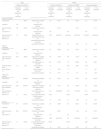
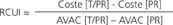En España, con una prevalencia del 2,5%, la hepatitis C (VHC) se asocia a una elevada morbi-mortalidad. El tratamiento combinado de telaprevir y peginterferon/ribavirina ([T/PR]) es eficaz en pacientes con VHC-G1. El objetivo primario de este estudio fue evaluar la relación coste-utilidad (RCUI) de [T/PR] versus peginterferon alfa 2a/ribavirina ([PR]) en pacientes naïve VHC-G1, según el grado de fibrosis y bajo la perspectiva del sistema sanitario español.
MetodologíaLa eficacia y la incidencia de efectos adversos (EAs) se obtuvieron de los estudios ADVANCE y OPTIMIZE. La estimación de los costes de monitorización, de manejo de EAs y de la enfermedad por estados de salud (€, 2014) fueron proporcionados por el panel de expertos, según bases de costes nacionales, excepto el coste de trasplante y post-trasplante obtenido de publicaciones. Se aplicó la deducción obligatoria a los costes farmacológicos (precio de venta del laboratorio). La tasa de descuento considerada para los costes y beneficios fue 3% anual.
Resultados[T/PR] proporcionó mejores resultados en salud (0,96 Años de Vida Ajustados por Calidad, AVAC) y mayor coste (17.495€) comparado con [PR], resultando una RCUI de [T/PR] versus [PR] de 18.288€/AVAC para toda la cohorte, 14.152€/AVAC para fibrosis moderada, 11.364€/AVAC para fibrosis en puentes y 15.929€/AVAC para cirrosis. Considerando toda la vida del paciente, [T/PR] podría evitar 12 cirrosis y 4 trasplantes cada 1.000 pacientes. Con una RCUI inferior a 30.000€/AVAC en el 69% de las simulaciones del análisis probabilístico [T/PR] sería eficiente versus [PR] en pacientes naïve, independientemente del grado de fibrosis.
The prevalence of Hepatitis C (HCV) in Spain is 2,5%, with a high morbimortality rate. Triple therapy based on telaprevir plus peginterferon/ribavirin ([T/PR]) has demonstrated to be an effective approach in treatment-naïve G1-HCV patients. This analysis evaluated, through a Markov model, the incremental cost-effectiveness ratio of triple therapy compared to peginterferon/ribavirin ([PR]) alone in naïve patients depending on fibrosis stage, from the Spanish Healthcare Authorities perspective.
MethodsEfficacy results and adverse events incidence were based on the combined results of ADVANCE and OPTIMIZE studies. Adverse events and disease-related costs (€, 2014) were built up from panel expert opinion except from transplant and post-transplant costs, taken from published data. Drug costs were obtained from national databases and adjusted for the mandatory deduction. Outcomes and costs were both discounted at 3%/year.
ResultsThe analysis shows higher costs and improved outcomes associated with [TR/PR] relative to [PR] alone, resulting in an incremental cost-effectiveness ratio (ICER) of €18,288/QALY for all the cohort, €14,152QALY for moderate fibrosis, €11,364QALY for bridging fibrosis, €15,929/QALY for cirrhosis. Over a lifetime period, the use of [T/PR] could avoid 12 cirrhosis and 4 liver transplants per 1,000 patients compared to [PR] alone. The probabilistic analysis, following 10,000 Montecarlo simulations, demonstrated the probability of an ICER below a €30,000/QALY gained threshold of 69%. At a willingness-to-pay of €30,000/QALY, [T/PR] could be considered as an efficient option compared with [PR] alone for treatment-naïve genotype 1 HCV patients, over a lifetime horizon.
La prevalencia de la hepatitis C (VHC) en España se sitúa en un 2,5%, una de las más altas en los países de nuestro entorno1.
A pesar de que la infección aguda es autolimitada, la tasa de cronicidad alcanza el 75-85%2, desarrollando cirrosis el 16% de los pacientes a los 20 años del inicio de la enfermedad3. La incidencia de carcinoma hepatocelular en estos pacientes es del 1,1% a un año, 1,9% en tres años y 5,0% en cinco años4.
El número de fallecimientos atribuibles a VHC en España se estimó en el año 2010 en 4.342, sobre un total de 360.391 muertes producidas ese año5.
Por otro lado, el coste asociado a la progresión y las complicaciones derivadas de la patología hepática también tienen un impacto relevante. Según un estudio naturalístico multicéntrico retrospectivo llevado a cabo en Europa, la enfermedad hepática supuso un coste promedio mensual de 644,77€ por paciente, siendo el 50,6% costes derivados de la hospitalización6.
El objetivo de la terapia en pacientes con VHC es alcanzar Respuesta Viral Sostenida (RVS), que se define como la ausencia de ARN-VHC en el suero, a los seis meses de finalizar el tratamiento. Un estudio prospectivo en 1.000 pacientes con VHC demostró que aquellos pacientes que lograban alcanzar una RVS tuvieron una tasa de trasplante (2,2% versus 21,3%) y muerte (2,7% versus 27,2%) diez veces menor que aquellos en los que el tratamiento no fue efectivo7,8.
Hasta la aparición de los nuevos inhibidores de proteasa (telaprevir y boceprevir), el tratamiento de elección en los pacientes con VHC genotipo 1 consistía en la administración de biterapia con peginterferon y ribavirina ([PR]). La incorporación de estos inhibidores a la biterapia se conoce como triple terapia.
El tratamiento con telaprevir asociado a [PR] ([T/PR]) ha demostrado una eficacia superior frente a [PR] en términos de RVS en ensayos fase III en pacientes pre-tratados (REALIZE)9 y sin tratamiento previo (ADVANCE)10 (OPTIMIZE)11.
El estudio pivotal fase III ADVANCE10, demostró una diferencia en RVS en los pacientes con [T/PR] frente a los pacientes tratados con [PR] del 31% (IC95% (24 - 38), p<0.001). Posteriormente se llevó a cabo el estudio OPTIMIZE11 que demostró resultados similares de eficacia para la administración de telaprevir en combinación con [PR] cada 8 o cada 12 horas.
Dadas las diferencias en RVS de [T/PR] frente a [PR] cabría esperar por lo tanto una importante reducción de la mortalidad y de la tasa de trasplante en estos pacientes, sin embargo [T/PR] presenta una mayor incidencia de efectos secundarios y un mayor coste de tratamiento.
El objetivo de este estudio fue evaluar la eficiencia de la triple terapia con telaprevir en comparación con la biterapia en tres subgrupos de pacientes sin tratamiento previo (naïve), en función del grado de fibrosis hepática (fibrosis moderada, fibrosis en puentes y cirrosis), en España. El estudio incluyó también el análisis de una cohorte conjunta de los 3 subgrupos para dimensionar los resultados obtenidos en cada subpoblación.
MétodosDiseño del modeloPara estimar los costes y los beneficios en salud del tratamiento de una cohorte de pacientes con VHC en España, se utilizó un modelo de Markov diseñado en Excel que consideraba 13 estados de salud, definidos a partir de la historia natural de la enfermedad. El presente análisis es una adaptación al entorno español del modelo presentado al National Institute for health and Care Excellence (NICE). En la Figura 1 aparece el diagra ma en el que se representan dichos estados de salud junto con las posibles transiciones entre ellos, descritas mediante flechas. Las probabilidades de transición, reflejo de la evolución natural de la enfermedad, se obtuvieron de la literatura12,13, ajustándose según la medida de eficacia en RVS observada en los ensayos clínicos10,11 para cada una de las alternativas evaluadas12,13 (Tabla 1). Se consideró la tasa de mortalidad por cualquier causa por franjas de edad14 y en el caso de hepatocarcinoma, trasplante hepático y postrasplante se ajustó esta tasa según datos publicados12.
Parámetros clínicos
| Estados de salud | Probabilidad de transición | |
|---|---|---|
| Fibrosis leve - Fibrosis moderada | 0,03513 | |
| Fibrosis moderada - Fibrosis en puentes | 0,04813 | |
| Fibrosis en puentes - Cirrosis Compensada | 0,04813 | |
| Cirrosis Compensada - Cirrosis Descompensada | 0,03912 | |
| Cirrosis Compensada - Carcinoma Hepatocelular | 0,01412 | |
| Cirrosis Compensada RVS- Carcinoma Hepatocelular | 0,007* | |
| Carcinoma Hepatocelular - Trasplante Hepático | 0,04012 | |
| Carcinoma Hepatocelular - Muerte | 0,43012 | |
| Trasplante Hepático - Muerte | 0,21012 | |
| Post Trasplante Hepático - Muerte | 0,05712 | |
| Estados de salud | Utilidad16 | |
| Fibrosis leve | 0,77 | |
| Fibrosis moderada | 0,66 | |
| Fibrosis en puentes | 0,55 | |
| Cirrosis compensada | 0,55 | |
| Cirrosis descompensada | 0,45 | |
| Carcinoma Hepatocelular | 0,45 | |
| Trasplante Hepático | 0,45 | |
| Post trasplante | 0,67 | |
| Cohortes | Tasa de RVS (%) | |
| [PR] | [T/PR] | |
| Cohorte completa** | 42,52 | 69,14 |
| Fibrosis moderada10,11 | 47,52 | 77,38 |
| Fibrosis en puentes10,11 | 32,69 | 64,15 |
| Cirrosis compensada10,11 | 33,33 | 53,23 |
| Efectos adversos | Incidencia (%)** | |
| [PR] | [T/PR] | |
| Anemia | 24,76 | 47,66 |
| Diarrea | 19,16 | 24,72 |
| Exantema | 47,20 | 59,94 |
| Náuseas | 33,18 | 42,00 |
| Prurito | 40,19 | 52,02 |
[T/PR]: triple terapia basada en peginterferon alfa, ribavirina y telaprevir, [PR]: biterapia basada en peginterferon alfa y ribavirina. *Dato facilitado por el panel de expertos
**Datos agregados para toda la cohorte de pacientes, ponderados en función del grado de fibrosis (fibrosis moderada, fibrosis en puentes, cirrosis) del estudio ADVANCE10 y OPTIMIZE11
Las 3 subpoblaciones según grado de fibrosis hepática (fibrosis moderada, fibrosis en puentes y cirrosis), analizadas en el modelo consistieron en cohortes hipotéticas de 1.000 pacientes con VHC genotipo 1, con una edad media de 49 años10.
La cohorte conjunta de los 3 subgrupos, presentó una distribución según grados de fibrosis representativa de los pacientes analizados en los estudios ADVANCE10 y OPTIMIZE11, ponderada según la población incluida en cada uno de ellos: 41,1% con fibrosis leve, 35,5% con fibrosis moderada, 14,2% con fibrosis en puentes y un 9,2% cirrosis. Los pacientes comenzaron la simulación en el estado de salud determinado por esta distribución.
Alternativas terapéuticasLas dos alternativas en estudio fueron la biterapia basada en peginterferon alfa 2a (Pegasys®) combinado con ribavirina frente a la triple terapia que incorpora telaprevir (Incivo®).
Las dosis y pautas de tratamiento de los fármacos en estudio se obtuvieron de ficha técnica15. Las posologías consideradas fueron 180µg semanales para peginterferón alfa 2a, 1.200mg y 2.250mg diarios para la ribavirina y telaprevir respectivamente.
La duración total del tratamiento prevista en ambas ramas, se estableció en 48 semanas. La pauta de [T/PR], incluía la administración de telaprevir combinado con peginterferón alfa (2a o 2b) y ribavirina durante 12 semanas, seguidas de 36 semanas de tratamiento únicamente con [PR] hasta completar las 48 semanas. En el caso de los pacientes con respuesta virológica rápida o respuesta rápida viral extendida (ARN-VHC indetectable en las semanas 4 y 12 del tratamiento) la duración del tratamiento se acortó a 24 semanas15.
La duración del tratamiento contempló las reglas de discontinuación recogidas en ficha técnica, según controles de carga viral y situación clínica del paciente15.
Los datos ponderados de eficacia según la duración del tratamiento (Tabla 3) y la incidencia de efectos adversos (Tabla 2) se obtuvieron a partir de los estudios ADVANCE10, y OPTIMIZE11 en función de la población incluida en cada uno de ellos.
Distribución de pacientes en función de la duración del tratamiento según las reglas de discontinuación
| [PR] | [T/PR] | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Estudio ADVANCE | Estudio ADVANCE | Estudio OPTIMIZE | Datos ponderados | ||||||
| Duración estimada del tratamiento, en semanas | % de pacientes | Duración estimada del tratamiento en semanas | % de pacientes | Duración estimada del tratamiento, en semanas | % de pacientes | Duración estimada del tratamiento, en semanas | % de pacientes | ||
| Cohorte completa | |||||||||
| Tratamiento | 56,00 | Tratamiento completo 24 | 24 | 53,70 | 24 | 55,27 | 24 | 54,34 | |
| completo | 48 | semanas (RVS positiva) | |||||||
| Discontinuación tras | 28 | 25,20 | Tratamiento completo 48 | 20,10 | 12,70 | 17,11 | |||
| la semana 12 | semanas (RVS negativa) | 48 | 48 | 48 | |||||
| Discontinuación antes o a la semana 12 | 12 | 18,80 | Discontinuación no asociadaa las pautas de paradaDiscontinuación asociada a | 7184 | 22,601,70 | 8,619,54 | 28,512,97 | 7,618,64 | 24,992,22 |
| las pautas de parada | 12 | 1,90 | 12 | 0,55 | 12 | 1,34 | |||
| Fibrosis moderada | |||||||||
| Tratamiento | 58,87 | Tratamiento completo 24 | 24 | 53,85 | 24 | 57,22 | 24 | 55,12 | |
| completo | 48 | semanas (RVS positiva) | |||||||
| Discontinuación tras la semana 12 | 23,6 | 36,88 | Tratamiento completo 48 semanas (RVS negativa) | 48 | 15,38 | 48 | 13,33 | 48 | 14,61 |
| Discontinuación no asociada | 8,9 | 27,56 | 7,2 | 25,56 | 8,3 | 26,81 | |||
| Discontinuación antes | 12 | 4,25 | a las pautas de parada | 19 | 18,8 | 3,89 | 18,9 | ||
| o a la semana 12 | Discontinuación asociada a | 4 | 0,64 | 4 | 4 | 1,87 | |||
| las pautas de parada | 12 | 2,57 | 12 | 0,0 | 12 | 1,59 | |||
| Fibrosis en puentes | |||||||||
| Tratamiento | 48,08% | Tratamiento completo 24 | 24 | 44,23 | 24 | 46,73 | 24 | 45,50 | |
| completo | 48 | semanas (RVS positiva) | |||||||
| Discontinuación tras la semana 12 | 22,3 | 48,08% | Tratamiento completo 48 semanas (RVS negativa) | 48 | 17,31 | 48 | 15,89 | 48 | 16,59 |
| Discontinuación antes o a la semana 12 | Discontinuación no asociada | 8,2 | 32,693,85 | 10,2 | 31,783,74 | 9,2 | 32,233,78 | ||
| 12 | 3,84% | a las pautas de parada Discontinuación asociada a | 13,34 | 23,34 | 18,44 | ||||
| las pautas de parada | 12 | 1,92 | 12 | 1,86 | 12 | 1,90 | |||
| Cirrosis | |||||||||
| Tratamiento | 48 | 33,33% | Tratamiento completo 24 | 24 | 42,86 | 24 | 39,81 | 24 | 40,69 |
| completo | semanas (RVS positiva) | ||||||||
| Discontinuación tras | 22,4 | 66,67% | Tratamiento completo 48 | 23,81 | 17,48 | 48 | 19,31 | ||
| la semana 12 | semanas (RVS negativa) | 84 | 48 | ||||||
| Discontinuación no asociada | 10,58 | 23,814,76 | 9,3 | 40,780,97 | 10 | 35,862,07 | |||
| Discontinuación antes o a la semana 12 | 12 | 0,00% | a las pautas de parada Discontinuación asociada a | 25,64 | 20,64 | 224 | |||
| las pautas de parada | 12 | 4,76 | 12 | 0,96 | 12 | 2,07 | |||
[T/PR]: triple terapia basada en peginterferon alfa, ribavirina y telaprevir, [PR]: biterapia basada en peginterferon alfa y ribavirina.
Costes unitarios (€, 2014)
| Coste farmacológico | Dosis | Coste por semana18(€) |
|---|---|---|
| Peginterferon α2a (Pegasys®) | 180 µg/semana | 177,7 |
| Ribavirina | 1.200 mg/día | 73,58 |
| Telaprevir (Incivo®) | 2.250 mg/día | 2.051,28 |
| Estados de salud | Coste de estado de salud (por ciclo) (€) | |
| Fibrosis leve | 268,61* | |
| Fibrosis moderada | 310,78* | |
| Fibrosis en puentes | 310,78* | |
| Cirrosis compensada | 565,41* | |
| Cirrosis descompensada | 2.302,45* | |
| Carcinoma Hepatocelular | 8.770,01* | |
| Trasplante Hepático | 123.686,2322 | |
| Post trasplante | ||
| Seguimiento primer año | 36.152,9622 | |
| Seguimiento segundo año | 18.076,4722 | |
| Efectos adversos | Coste de manejo de efectos adversos (por evento) (€)* | |
| Exantema | 984,09 | |
| Prurito | 179,32 | |
| Náuseas | 0 | |
| Diarrea | 0 | |
| Anemia | 876,70 | |
| Monitorización | Costes de monitorización (por ciclo) (€)* | |
| Diagnóstico | 1.409,62 | |
| 4 semanas | 798,51 | |
| 12 semanas | 1.104,90 | |
| 18 semanas | 1.273,75 | |
| 24 semanas | 1.934,71 | |
| 28 semanas | 2.040,24 | |
| 48 semanas | 2.885,19 |
Los datos sobre calidad de vida se extrajeron de un estudio en el que se estableció la utilidad asociada en estos pacientes según su gravedad16 (Tabla 1). Este estudio evidenció además que la posible aparición de efectos secundarios durante el tratamiento con interferón se asoció con una reducción de la calidad de vida percibida por los pacientes del 12,3% tras el tratamiento con [PR] y 11,4% con [T/PR]16.
Medida de los resultados obtenidosLa eficacia de las alternativas evaluadas, condicionó la progresión de la enfermedad y consecuentemente la supervivencia final de la cohorte analizada. El análisis de la eficiencia, consideró los resultados en salud en términos de supervivencia media por paciente, medida como Años de Vida ganados (AVG) al final de la simulación, que posteriormente se ajustaron con los valores de utilidades correspondientes, para expresarse como Años de Vida Ajustados por Calidad de vida (AVAC).
La estimación de la relación coste-utilidad incremental (RCUI) entre las dos alternativas en estudio para cada una de las subpoblaciones según el grado de fibrosis: fibrosis moderada, fibrosis en puentes y cirrosis se realizó mediante la siguiente fórmula:
Además, se estimó la RCUI para la cohorte conjunta de las 3 subpoblaciones de pacientes.
Perspectiva, tasa de descuento y horizonte temporalEn el análisis se consideró la perspectiva del Sistema Nacional de Salud, aplicándose una tasa de descuento anual del 3% a los costes y a los efectos en salud17 durante un horizonte temporal (70 años) que abarca toda la vida del paciente.
Recursos y costesEn línea con la perspectiva del análisis, únicamente se incluyeron costes directos: costes farmacológicos, costes de monitorización, costes de manejo de la enfermedad en cada estado de salud y coste de manejo de efectos adversos.
Los costes farmacológicos se calcularon a partir del precio de venta al laboratorio (PVL)18, aplicando la correspondiente deducción19,20. Para el coste de ribavirina se consideró el coste del genérico de menor precio.
La identificación y estimación del número de recursos necesarios (número de consultas médicas necesarias, pruebas diagnósticas, medicación, etc) para la monitorización del tratamiento y el manejo de la enfermedad y de los efectos adversos que se produjeron, fue llevada a cabo por el panel de expertos de este estudio. Según la recomendación de este panel, no se consideró ningún coste asociado al manejo de la diarrea y las náuseas.Los costes unitarios de cada recurso se obtuvieron a partir de bases de datos de costes sanitarios nacionales21 excepto el coste derivado del trasplante hepático y el seguimiento de estos pacientes que provino de la literatura científica22, aplicándose en los casos necesarios la variación del IPC correspondiente desde el año de origen de los costes localizados al año del presente análisis.
Todos los costes incluidos en el modelo se expresaron en euros (€, año 2014) y aparecen recogidos en la Tabla 2.
Análisis de sensibilidadCon el objetivo de evaluar la influencia de la variación de una serie de parámetros en los resultados del modelo y confirmar su robustez, se llevaron a cabo análisis de sensibilidad determinísticos univariantes (ASD) y probabilístico (ASP). En el ASD se modificó la tasa de descuento (0%-5%), el horizonte temporal del estudio (20 años) y los costes asociados a los diferentes estados de salud (+/-50%) y al manejo de efectos adversos (+/-50%). Por último, se llevó a cabo un análisis de sensibilidad considerando las utilidades descritas para población española en enfermos con Hepatitis Viral B23.
El ASP se realizó mediante 10.000 simulaciones de Montecarlo, variándose la tasa de RVS, las probabilidades de transición entre estados de salud (distribución beta), las utilidades asociadas a los mismos (distribución beta) y el porcentaje de RVS alcanzado para [PR] y [T/PR] (distribución gamma)
ResultadosEl porcentaje de pacientes que alcanzó una RVS con [T/PR] fue de 69,14% frente a 42,54% de pacientes en [PR], con una diferencia del 26,60% a favor de [T/PR]. Este porcentaje varió en el análisis por subgrupos siendo 29,86% en los pacientes con fibrosis moderada, 31,46% en los pacientes con fibrosis en puentes y 19,92% en los pacientes cirróticos.
Por otro lado, [T/PR] consiguió evitar 12 casos de cirrosis y 4 trasplantes hepáticos.
Al final de la simulación, la terapia con [T/PR] aportó 0,18 AVG adicionales por paciente que la terapia con [PR]. Esta diferencia varió entre las cohortes según el grado de fibrosis desde 0,11 en fibrosis moderada, 0,43 en fibrosis en puentes y 0,69 en la población cirrótica.
En términos de supervivencia ajustada por calidad de vida, el tratamiento con [T/PR] aportó 13,87 AVAC frente a 12,91 AVAC con [PR], con una diferencia favorable a [T/PR] de 0,96 AVAC por paciente. Según el análisis por subgrupos de pacientes, [T/PR] versus [PR] aportó 1,22 AVAC más en pacientes con fibrosis moderada, 1,57 AVAC en pacientes con fibrosis en puentes y 1,19 AVAC en pacientes cirróticos.
El tratamiento con la combinación de [T/PR] conllevó un coste asociado de 36.843€ (29.662€ coste farmacológico)
por paciente respecto al tratamiento con [PR] que supuso 22.229€ por paciente (9.825€ coste farmacológico), con una diferencia de 17.495€ asociado a [T/PR]. En función del grado de fibrosis, la diferencia de costes entre [T/PR] y [PR] fue de 17.390€ (fibrosis moderada), 17.935€ (fibrosis en puentes) y 18.873€ (cirrosis).
Los costes y los resultados en salud obtenidos tras el tratamiento con [T/PR] y [PR] aparecen recogidos en la Tabla 4. Por lo tanto, la RCUI de [T/PR] frente a [PR] resultó ser 18.288€/AVAC. Al realizar el análisis por cohorte de población según el grado de fibrosis se obtuvieron unas RCUI de 14.152€/AVAC para fibrosis moderada, 11.364€/AVAC para fibrosis en puentes y 15.929€/AVAC para la población cirrótica.
Resultados del caso base.
| [T/PR] | [PR] | Incremental | |
|---|---|---|---|
| Costes totales | |||
| Cohorte completa | 36.843€ | 19.348€ | 17.495€ |
| Fibrosis moderada | 34.921€ | 17.530€ | 17.390€ |
| Fibrosis en puentes | 40,826€ | 22,890€ | 17,935€ |
| Cirrosis | 49.223€ | 30.350€ | 18.873€ |
| Coste farmacológico | |||
| Cohorte completa | 29.662€ | 9.825€ | 19.837€ |
| Fibrosis moderada | 29.706€ | 9.794€ | 19.912€ |
| Fibrosis en puentes | 29.659€ | 9.317€ | 20.342€ |
| Cirrosis | 30.502€ | 8.566€ | 21.396€ |
| Resultados en salud | |||
| RVS | |||
| Cohorte completa | 69,14% | 42,54% | 26,60% |
| Fibrosis moderada | 77,38% | 47,52% | 29,86% |
| Fibrosis en puentes | 64,15% | 32,69% | 31,46% |
| Cirrosis | 53,23% | 33,33% | 19,92% |
| Casos de cirrosis | |||
| Cohorte completa | 60 | 72 | -12 |
| Casos de trasplante | |||
| Cohorte completa | 6 | 10 | -4 |
| AVG | |||
| Cohorte completa | 17,95 | 17,77 | 0,18 |
| Fibrosis moderada | 18,19 | 18,08 | 0,11 |
| Fibrosis en puentes | 17,78 | 17,35 | 0,43 |
| Cirrosis | 15,61 | 14,92 | 0,69 |
| AVAC | |||
| Cohorte completa | 13,87 | 12,91 | 0,96 |
| Fibrosis moderada | 14,31 | 13,09 | 1,22 |
| Fibrosis en puentes | 12,44 | 10,87 | 1,57 |
| Cirrosis | 10,56 | 9,37 | 1,19 |
| RCEI (€/AVG) [TPR] vs [PR] | |||
| Cohorte completa | 99.312€/AVG | ||
| Fibrosis moderada | 166.778€/AVG | ||
| Fibrosis en puentes | 41.859€/AVG | ||
| Cirrosis | 27.231€/AVG | ||
| RCUI (€/AVAC) | |||
| Cohorte completa | 18.288€/AVAC | ||
| Fibrosis moderada | 14.152€/AVAC | ||
| Fibrosis en puentes | 11.364€/AVAC | ||
| Cirrosis | 15.929€/AVAC | ||
AVAC: Años de Vida Ajustados por Calidad; AVG: Años de Vida Ganados; RCEI: Ratio Coste-Efectividad Incremental; RCUI: Ratio Coste-Utilidad Incremental; RVS: Respuesta Viral Sostenida, [T/PR]: triple terapia basada en peginterferon alfa, ribavirina y telaprevir, [PR]: biterapia basada en peginterferon alfa y ribavirina.
La ausencia de umbral de eficiencia oficial en España, dificulta la interpretación de los resultados obtenidos. En el caso de considerar aceptable un umbral de 30.000€/AVAC24, que es empleado como valor de referencia en la mayoría de las evaluaciones económicas publicadas para el entorno español25, la combinación de [T/PR] podría considerarse una estrategia eficiente frente a [PR] en el tratamiento de la VHC, independientemente del grado de fibrosis de los pacientes, España, ya que los RCUI obtenidos, fueron inferiores al mencionado umbral.
Análisis de sensibilidadLos resultados de los análisis de sensibilidad realizados confirmaron la robustez del modelo.
El empleo de los valores de utilidad alternativos se asoció a las mayores diferencias respecto al caso base, aumentándose en un 50% la RCUI en la población global, un 76% en fibrosis leve, un 150% en fibrosis moderada y un 49% en cirrosis (Tabla 5).
Análisis de sensibilidad determinístico
| Análisis de sensibilidad realizados | Cohorte completa | Fibrosis moderada | Fibrosis en puentes | Cirrosis | |||||
|---|---|---|---|---|---|---|---|---|---|
| CASO BASE RCUI (C/AVAC) [T/PR] vs [PR] | 18.288€ | % variación respecto a caso base | 14.152€ | % variación respecto a caso base | 11.364€ | % variación respecto a caso base | 15.929C | % variación respecto a caso base | |
| AS1 | Tasa de descuento=0 | 10.505€ | -42,56 | 8.075€ | 42,94 | 6,302€ | -44,55 | 8.836€ | -44,53 |
| AS2 | Tasa de descuento=5 | 24.693€ | 35,02 | 19.072€ | 34,77 | 15,359€ | 35,15 | 21.825€ | 37,01 |
| AS3 | Horizonte temporal 20 a€os | 26.596€ | 45,43 | 20.406€ | 44,19 | 16,707€ | 47,02 | 23.223€ | 45,79 |
| AS4 | Costes EA+50% | 18.482€ | 1,06 | 14.411€ | 1,84 | 11,460€ | 0,84 | 16.034€ | 0,66 |
| AS5 | Costes EA-50% | 18.119€ | -0,93 | 13.892€ | -1,64 | 11,165€ | -1,75 | 15.825€ | -0,65 |
| AS6 | Costes manejo enfermedad+50% | 17.305€ | -5,37 | 13.269€ | -6,23 | 10,672€ | -6,09 | 14.624€ | -8,19 |
| AS7 | Costes manejo enfermedad-50% | 19.270€ | 5,37 | 15.034€ | 6,23 | 12,056€ | 6,09 | 17.234€ | 8,19 |
| AS8 | Utilidades art€culo Herdman26 | 27.402€ | 49,84 | 24.947€ | 76,28 | 28,407€ | 149,97 | 23.675€ | 48,63 |
AS: Análisis de sensibilidad; AVAC: Años de Vida Ajustados por Calidad; EA: Efectos Adversos; RCUI: Relación Coste-Utilidad Incremental; T/PR]: triple terapia basada en peginterferon alfa, ribavirina y telaprevir, [PR]: biterapia basada en peginterferon alfa y ribavirina.
En todos los casos, los valores de los RCUI obtenidos fueron inferiores a 30.000€/AVAC24, pudiendo considerarse la combinación de [TPR] una estrategia eficiente, si se aceptara este valor como umbral de aceptabilidad.
El coste asociado al manejo de efectos adversos fue el parámetro que tuvo un menor impacto en los resultados, independientemente del grado de fibrosis.
Los resultados en términos de ganancia de AVG, AVAC y costes asociados a cada uno de los tratamientos al final del ASP aparecen recogidos en la Tabla 6. En la Figura 2 aparecen representadas las curvas de aceptabilidad correspondientes a este análisis. En las simulaciones de Montecarlo realizadas resultaron inferiores al valor de 30.000€/AVAC24, el 61% de resultados en la cohorte de fibrosis moderada, el 97% en fibrosis en puentes, el 22% en cirrosis, y el 68,6% para la cohorte conjunta de pacientes.
Resultados ASP (promedio e IC 95%)
| [T/PR] | [PR] | |||
|---|---|---|---|---|
| Promedio | IC 95% | Promedio | IC 95% | |
| AVG | ||||
| Cohorte completa | 17,908 | (17,903-17,913) | 17,760 | (17,754-17,767) |
| Fibrosis moderada | 18,192 | (18,191-18,194) | 18,078 | (18,073-18,083) |
| Fibrosis en puentes | 17,802 | (17,793-17,810) | 17,802 | (17,793-17,81 1) |
| Cirrosis | 15,196 | (15,148-15,243) | 14,932 | (14,887-14,977) |
| AVAC | ||||
| Cohorte completa | 13,163 | (13,143-13,183) | 12,500 | (12,483-12,5171) |
| Fibrosis moderada | 12,662 | (12,621-12,702) | 11,992 | (11,964-12,0201) |
| Fibrosis en puentes | 12,455 | (12,417-12,493) | 17,802 | (17,793-17,8105) |
| Cirrosis | 10,175 | (10,126-10,223) | 9,636 | (9,590-9,681 1) |
| Costes (€, 2014) | ||||
| Cohorte completa | 36.970,13€ | (36.930,10-37.010,16) | 19.364,65€ | (19.305,38-19,423,92) |
| Fibrosis moderada | 34.881,33€ | (34.845,85-34.916,81) | 17.807,10€ | (17.743,70-17.870,50) |
| Fibrosis en puentes | 40.71 5,32€ | (40.619,50-40.811,14) | 21.980,40€ | (21.853,25-22.107,56) |
| Cirrosis | 50.578,27€ | (50.377,55-50.778,99) | 29.908,85€ | (29.699,23-30.1 18,46) |
AVG: Años de vida ganados; AVAC: Años de Vida Ajustados por Calidad; EA; T/PR]: triple terapia basada en peginterferon alfa, ribavirina y telaprevir, [PR]: biterapia basada en peginterferon alfa y ribavirina.
Para los análisis por subgrupos de pacientes, el 61% de resultados estuvo por debajo de los 30.000€/AVAC fue en fibrosis moderada, el 97% en fibrosis en puentes y el 22% en cirrosis.
DiscusiónLa principal aportación de este estudio radica en ser el primer análisis coste-utilidad realizado en España, que incluye resultados de la eficiencia de la triple terapia frente a la biterapia por subgrupos de pacientes en función del grado de fibrosis. Dada la heterogeneidad en términos de impacto clínico y económico de estos pacientes según su gravedad y la progresión de la enfermedad hepática, el análisis por subgrupos permite reflejar de manera pormenorizada la eficiencia del tratamiento en estos pacientes a lo largo de su evolución.
En este sentido, el programa de Vigilancia Epidemiológica26 establecido en julio de 2013 está permitiendo eva- luar de forma precisa el impacto de esta enfermedad en la población española26 en términos clínicos a lo largo de los diferentes estadíos de la enfermedad.
La gravedad de esta enfermedad radica no sólo en la elevada morbimortalidad asociada, sino que al no producir síntomas evidentes, se dificulta el diagnóstico y el acceso precoz de los pacientes a los tratamientos27, aumentando los costes sanitarios asociados por la progresión de la enfermedad hepática en estos pacientes28.
En este sentido, a pesar de que la prevalencia de la VHC está disminuyendo con el tiempo, se prevé que la carga futura de la enfermedad se incrementará, aumentando también el coste económico asociado28.
En las evaluaciones económicas llevadas a cabo por Agencias Evaluadoras independientes como el Scottish Medical Consortium (SMC) o el NICE la terapia con telaprevir en pacientes naïve también resultó ser eficiente con una RCUI de 14.230£/AVAC (£, 2011)29 y 13.553£/AVAC (£, 2010)30. En concreto, el presente análisis es una adaptación al entorno español del modelo presentado al NICE.
Por otro lado, existen cuatro estudios coste-utilidad de [T/PR] frente a [PR] en pacientes naïve publicados hasta el momento de la realización de este análisis, uno de ellos realizado en el entorno español.
Las comparaciones directas con evaluaciones económicas llevadas a cabo en un entorno nacional diferente deben realizarse con cautela, debido a las posibles diferencias en la metodología empleada, los años de referencia de los costes y la variabilidad asociada al manejo de los pacientes y la organización sanitaria que son específicos de cada país.
Dos de las tres evaluaciones económicas identificadas realizadas en otros países, utilizaron el mismo modelo que el empleado en el presente análisis. En ambos casos, los estudios se llevaron a cabo bajo la perspectiva del sistema sanitario inglés, obteniéndose una RCUI de 13.553£/AVAC (£, 2010)31 y 12.733£/AVAC (valores del año no especificado)32 respectivamente. El tercer estudio se realizó en el entorno estadounidense, obteniéndose una RCUI de 16.778$/AVAC (valores del año no especificado)33. En todos los casos, [T/PR] resultó una estrategia eficiente versus [PR], situándose todos las RCUI por debajo del umbral de aceptabilidad comúnmente aceptado en estos países (30.000£/AVAC en Reino Unido, y 30.000$/AVAC en Estados Unidos).
En España, ha sido publicado recientemente un artículo en el que se comparaba la eficiencia del tratamiento con [T/PR] frente a [PR] en una cohorte de pacientes naïve con VHC, situándose la RCUI 33.751€ (€, 2012)34.
El presente análisis posee una serie de fortalezas respecto a esta publicación entre las que cabe destacar la distribución inicial de la población en estudio según el grado de fibrosis obtenida de los estudios ADVANCE y OPTIMIZE, lo que en opinión del panel de expertos refleja en mayor medida la realidad de la práctica clínica.
La estimación de RCUI de una cohorte completa de pacientes con VHC englobando pacientes sin fibrosis o con fibrosis leve, no refleja adecuadamente la eficiencia del tratamiento en el marco asistencial actual, de acuerdo a las recomendaciones de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)35.
Asimismo los datos de eficacia en este caso incorporan los resultados del estudio OPTIMIZE, a los datos del ADVANCE, lo que permite ajustar los resultados obtenidos en pacientes con grados de fibrosis más avanzada (fibrosis en puentes y cirrosis), dado el mayor número de pacientes de este perfil incluidos en el estudio OPTIMIZE.
La ausencia de umbral de eficiencia oficial en España imposibilita extraer conclusiones definitivas. Una revisión reciente25 de publicaciones de las evaluaciones económicas de tecnologías sanitarias en España desde el año 2003, revela que el 66% de las mismas emplea como umbral de eficiencia orientativo el valor de 30.000€/AVAC. En línea con esta tendencia, los datos obtenidos del presente análisis permitirían concluir que [T/PR] es una estrategia eficiente frente a la [PR] en el tratamiento de pacientes naïve en España, de acuerdo a las recomendaciones de uso establecidas por la AEMPS.
El tratamiento con [TPR] en fases menos avanzadas de la enfermedad, representados en el presente análisis por la cohorte de pacientes con fibrosis moderada aportó mayores beneficios en salud que [PR], y con el razonamiento anteriormente explicado, podría entenderse como una estrategia eficiente. Los resultados de los análisis de sensibilidad realizados corroboran la robustez de estas conclusiones.
El presente análisis no está exento de limitaciones, entre las que cabe destacar la utilización de estudios llevados a cabo en otros países como fuentes de datos, debido a la falta de publicaciones disponibles en España. Sin embargo, las características de la población considerada para estos estudios se ajustan a los datos epidemiológicos en este tipo de pacientes en España36 y, por lo tanto, el panel de expertos consultado consideró que los datos epidemiológicos incluidos en el modelo son representativos de población española.
La calidad de vida reflejada en las utilidades está fuertemente relacionada con aspectos socioculturales. En ausencia de datos de utilidades en población española en el caso base del presente análisis fue necesario el empleo de valores de población en UK. Para evaluar la influencia de este parámetro se realizó un análisis de sensibilidad determinístico con utilidades obtenidas específicamente en población española, pero referidos a hepatitis B, en lugar de C. Resulta difícil, concluir si las diferencias observadas, se deben a diferencias en la patología o a diferencias en el perfil de la población. En este sentido sería recomendable la realización de estudios de calidad de vida en pacientes españoles con VHC que permitiesen incluir datos de utilidad en este tipo de pacientes en futuras evaluaciones económicas.
El presente análisis se realizó con la perspectiva del Sistema Nacional de Salud, aportando información útil para las Autoridades Sanitarias. La dificultad de disponer de datos sobre el impacto de la enfermedad en la productividad laboral imposibilitó la incorporación de costes indirectos que se requiere para aplicar la perspectiva social, a pesar del interés que estos resultados hubieran podido suscitar.
A pesar de que [T/PR] está indicada para el tratamiento de pacientes adultos con VHC genotipo 1 con enfermedad hepática compensada (incluyendo cirrosis)15, la AEMPS recomienda en el Informe de Utilidad Terapéutica la administración de la triple terapia basada en [PR] y un inhibidor de la proteasa (telaprevir o boceprevir) únicamente en pacientes con un grado de fibrosis moderada y genotipo de la IL28B no favorables (TT o CT) o bien pacientes con fibrosis avanzada en la biopsia hepática o una elastografia hepática >9,5 kilopascales35.
Ademas, la eficacia de la triple terapia con telaprevir ha sido contrastada en la práctica clínica habitual34, y por lo tanto debe considerarse una alternativa terapéutica mientras no se disponga de fármacos orales con mayor eficacia y menos efectos adversos. Los resultados de este análisis son útiles para maximizar los beneficios en salud favoreciendo el acceso de los pacientes a los tratamientos que existen actualmente, reduciendo el impacto económico asociado a la progresión de la enfermedad hepática.
Conflicto de interesesBG, IO y MAC son empleados de PORIB, una consultora especializada en Evaluación Económica de Intervenciones Sanitarias que ha recibido financiación no condicionada por parte de Janssen para el desarrollo del análisis. MB, RJA, MAS y JT declaran haber recibido financiación no condicionada de Janssen, por su participación como panel de expertos para validación de la práctica clínica en España.
AgradecimientosLos autores agradecen a los revisores de Farmacia Hospitalaria, los comentarios aportados durante la revisión del manuscrito.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas