Analizar la mejoría clínica de los pacientes sometidos a cambio de opioide y describir el protocolo utilizado para el cambio.
MétodoEstudio observacional retrospectivo. Se seleccionaron pacientes sometidos a cambio de opioide en el periodo de estudio (18 meses). Fueron criterios para cambio de opioide: tratamiento con fármacos escalón 3 de la escalera de la OMS junto a coadyuvantes durante más de 6 meses y presentar una escala análogo visual del dolor de al menos 5, con o sin efectos adversos asociados.
Se definieron las variables: mejoría clínica, como una disminución superior o igual a 3 de escala análogo-visual, o la supresión de dos o más efectos adversos; y reducción de dosis equianalgésica, que se calculó mediante comparación de dosis equianalgésicas del opioide inicial y final.
ResultadosSe estudiaron 9 pacientes de los que la variable mejoría clínica resultó positiva en 7 de ellos (77%). La reducción de dosis media fue del 37% (-72% +18%) con respecto a la dosis equianalgésica. Cinco pacientes (55%) presentaban reacciones adversas antes del cambio de opioide; mientras que sólo uno (11%) tras la intervención.
ConclusionesEl cambio de opioide fue ventajoso en el manejo de pacientes con dolor crónico no oncológico y baja respuesta al tratamiento opioide y/o con efectos adversos. Para realizar un cambio de opioide con seguridad se debe reducir dosis inicialmente del nuevo opioide. Estudios prospectivos bien diseñados permitirían alcanzar mayor consenso para la aplicación del cambio de opioide en el manejo del dolor crónico no oncológico.
The implementation of opioid switch (OS) as a strategy in non-malignant chronic pain has been scarcely proved. This article aims to evaluate the results of OS in a Pain Treatment Unit.
MethodsThis is an observational retrospective study in which all patients who had been subjeted to OS for a period of 18 months were selected. All of them had been treated with opiods plus adyuvants for more than 6 months and had a visual analog scale (VAS) of at least 5, either with or without adverse effects.
Two variables were definedclinical improvement, as a reduction equal or superior to 3 in VAS or the elimination of two or more adverse effects; equianalgesic dose reduction is the difference between initial and final opioid dose.
Results7 out of 9 (77%) patients showed clinical improvement. Median equianalgesic dose reduction was 37% (-72% +18%). Five patients (55%) presented adverse effects to opioids before the OS but only one (11%) after OS.
ConclusionsOS was beneficial for the management of non-malignant chronic pain patients who have poor response to opioid treatment and/or with adverse effects. A secure OS should include a reduction in equianalgesic opioid dose. Prospective studys would achieve a mayor consensus for the applicance of OS in non-malignant chronic pain treatment.
El dolor es el síntoma principal de muchos procesos patológicos que habitualmente demandan atención sanitaria. La prevalencia del dolor aumenta de forma paralela con el envejecimiento de la población y la cronificación de enfermedades1,2,3 y constituye una patología de importancia creciente a nivel mundial. En España se estima una prevalencia del 30% para la población mayor de 55 años4. Cuando se aborda el tratamiento es importante diferenciar el tipo de dolor. Según su causa, puede ser nociceptivo, neuropático o mixto; mientras que dependiendo de su evolución, el dolor puede ser agudo o crónico5. El dolor crónico a su vez puede ser oncológico o no oncológico en función de si se asocia o no a un proceso tumoral.
El manejo del dolor crónico no oncológico (DCNO) supone un reto debido a su complejidad e imprevisibilidad de respuesta al tratamiento. Las causas por las que se produce la cronificación del dolor en estos pacientes no están claras, pero sí se conocen algunos factores fisiopatológicos, psicológicos y conductuales que la favorecen3. El uso de programas de tratamiento multidisciplinar, comparado con programas de tratamiento convencionales, muestran mayor efectividad en la reducción de la intensidad del dolor6. Dentro de esta estrategia multidisciplinar, el tratamiento farmacológico constituye la herramienta central.
Existe amplia experiencia en el uso de fármacos opioides para el tratamiento del DCNO, principalmente en dolores nociceptivos5,6. En el caso del dolor crónico neuropático, aunque la bibliografía más actual recomienda su uso, la experiencia clínica es menor y poco homogénea debido a la variabilidad de tipos de dolor neuropático3,5,6,7.
Tras una adecuada titulación de dosis, la efectividad inicial puede desaparecer gradualmente5. Los pacientes experimentan ataques de dolor a pesar de una adecuada adherencia al tratamiento, lo que justifica el aumento de dosis. Teóricamente, los opioides no tienen techo de dosis; en la práctica, dosis progresivamente altas originan efectos adversos con escaso beneficio clínico5. Las guías clínicas sobre utilización de opioides tienen como objetivo la protección de los pacientes frente a los efectos adversos de estos fármacos3. A pesar de ello, la razón más frecuente de fracaso terapéutico con opioides es la aparición de efectos adversos intolerables como consecuencia del incremento de la dosis necesaria para controlar el dolor7. En la Tabla 1 se recogen diferentes opciones para el manejo del dolor cuando aparecen efectos secundarios intolerables al aumentar la de dosis de opioide.
| Retirada de fármaco: Existirán pocos casos en los que la retirada esté indicada. A pesar de que los motivos para la interrupción de la terapia con opioides están consensuados, no existe ninguna estrategia validada para la retirada del tratamiento opioide. |
| Reducción de dosis: Cuando existe reducción de calidad de vida debido a efectos adversos relacionados con opioides, la reducción de dosis es el primer paso para el control de la analgesia. |
| Uso de coadyuvantes y tratamiento multidisciplinar: Se deben integrar terapias cognitivo-conductuales y de rehabilitación funcional que contribuyan o se vean afectadas por el DCNO. Es más probable que la terapia sea más efectiva como parte de un tratamiento multidisciplinar. |
| Cambio de vía: Cuando cambiamos de morfina oral o hidromorfona a infusión intratecal, la dosis diaria se puede reducir en un factor del 300%. Aunque estudios de eficacia y seguridad demuestran una mejora del tratamiento del DCNO, hay pocos estudios sobre la reducción de los efectos adversos cuando se realiza este cambio. |
La rotación o cambio de opioides (CO) es una opción más dentro del esfuerzo por mejorar la respuesta a la terapia analgésica. La estrategia del CO surge ante la expectativa de que la modificación farmacológica aumente la probabilidad de mejorar la analgesia y reducir efectos adversos9. Aunque no existen guías clínicas consensuadas para la práctica del CO7,9,10,11, éste constituye una alternativa para mejorar la respuesta al tratamiento en pacientes con tratamiento opioide de larga evolución. El mecanismo teórico por el que el CO mejora la respuesta al tratamiento, se basa en los siguientes aspectos: 1) la gran variación individual que caracteriza la respuesta terapéutica a los diferentes agonistas µ; 2) la variación en los coeficientes de unión a los subtipos de receptor µ del fármaco; 3) el fenómeno de crostolerancia incompleta a los efectos analgésicos y no analgésicos7,9,11. La rotación de opioides se beneficia de diferencias individuales en la presencia y patrones de expresión de subtipos de receptores opioides, para los que cada opioide tiene distinta preferencia y actividad intrínseca. Aunque el mecanismo de variación individual y crostolerancia apenas se conoce, empíricamente la rotación de opioides ha demostrado mejoras en el control del dolor y/o reducción de efectos adversos3. Las situaciones en las que el CO se considera una opción se exponen en la Tabla 2.
Se considera el CO9
| Cuando el aumento de dosis ha ocasionado efectos adversos intolerables.Cuando el paciente tiene dolor severo, que continúa a pesar de aumentos de dosis.Cuando el paciente puede beneficiarse de un cambio en vía de administración o de formulación.Cuando hay un cambio en el estado clínico.Cuando hay consideraciones económicas. |
El objetivo general de este estudio fue analizar la variable mejora clínica en los pacientes que se sometieron a CO. Además se describe el protocolo de CO utilizado.
MétodoSe realizó un estudio observacional retrospectivo en una unidad de dolor de un hospital de segundo nivel, durante un período de 18 meses (Abril 2012-Septiembre 2013). Esta unidad recibe pacientes derivados de atención primaria, de servicios hospitalarios propios y de hospitales terciarios. Está formada por un equipo multidisciplinar de 3 anestesistas, un médico de familia, un farmacéutico, un psicólogo y un enfermero. El estudio se plantea desde la consulta de farmacia donde se participa activamente en el manejo farmacológico del paciente con dolor de larga evolución.
La recogida de datos se realizó mediante revisión sistemática de historias clínicas de pacientes. Estos pacientes cumplían tres características: 1) estar en tratamiento analgésico escalón 3 de la escalera analgésica de la OMS asociado a coadyuvantes; 2) duración del tratamiento superior a 6 meses; 3) Escala Análogo-Visual (EVA) del dolor mantenida superior o igual a 5 con presencia o no de efectos adversos. Todos los pacientes a los que se sometió a CO en el periodo seleccionado forman parte del estudio. El periodo de tiempo quedó determinado por la disponibilidad de datos. Todos los registros demográficos, clínicos y de las variables determinadas se obtuvieron de la historia clínica. No se recogieron datos de seguimiento de estos pacientes una vez alcanzaron dosis estables del nuevo opioide.
De entre la información recogida en la historia clínica se consideraron los siguientes datos:
- -
Datos demográficos: edad y sexo
- -
Datos clínicos: patología base, intervenciones quirúrgicas previas, diagnóstico psiquiátrico, causas del CO y evaluación del dolor (EVA).
- -
Datos terapéuticos: polifarmacia, tiempo de tratamiento con opioides antes del CO, opioides basales/finales, número de efectos adversos y de rotaciones incompletas.
Se definieron las siguientes variables:
- a
mejoría clínica, variable principal del estudio. Variable dicotómica que se considera positiva cuando hay una reducción superior o igual a 3 puntos de la escala análogo-visual del dolor, o cuando se suprimen dos o más efectos adversos.
- b
reducción de dosis equianalgésica, se expresó en porcentaje y se calculó mediante comparación de dosis de opioide, inicial y final, convertidas a dosis de morfina IV.
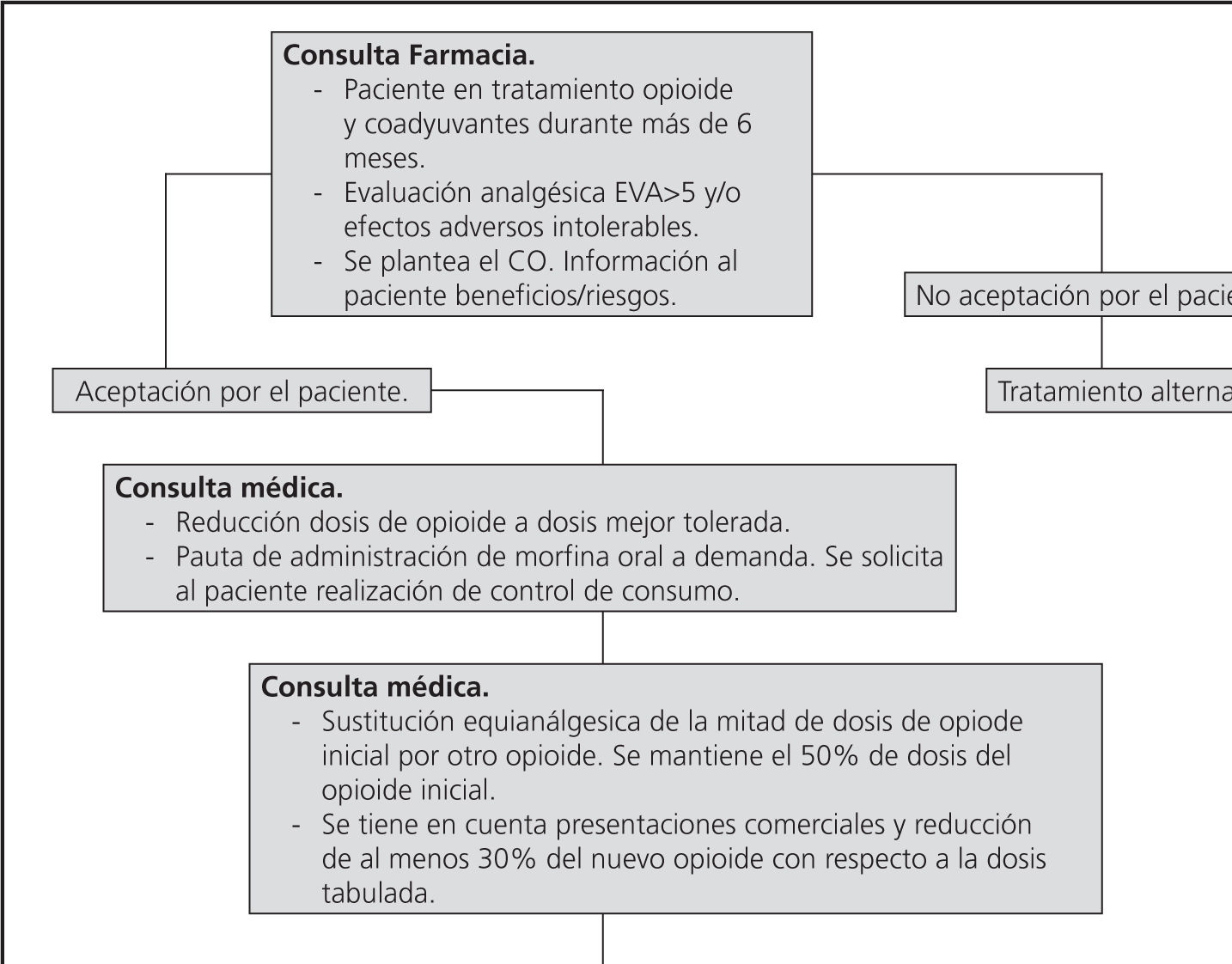
Se empleó el siguiente procedimiento para el CO: (Figura 1) El CO se inició en todos los casos previo acuerdo consensuado con el paciente. Una vez seleccionado el paciente, y antes de iniciar el CO, se informó al paciente de los riesgos y beneficios esperados y de las alternativas terapéuticas disponibles.
El CO se inicia reduciendo la dosis de opioide de partida, de esta forma se consigue mayor seguridad y predisposición del paciente para la realización del CO. Esto supuso volver a dosis anteriores al último ascenso, o a dosis a las que los efectos adversos eran tolerables. Se incluyó la prescripción de morfina oral para controlar posibles ataques de dolor y se solicitó al paciente la realización de un control de su consumo. En la siguiente cita, el médico tras la entrevista, sustituía aproximadamente el 50% la dosis del opioide inicial por la dosis equianalgésica del nuevo fármaco. En este cambio se consideraron las presentaciones comerciales disponibles, las características clínicas del paciente y una reducción del al menos el 30% respecto a la dosis tabulada.
A los 15 días aproximadamente, se realizó la evaluación del dolor y efectos adversos: en los casos en los que los pacientes manifestaban falta de respuesta terapéutica o aumento de efectos adversos a pesar del CO, se planteaba un nuevo CO. Si los pacientes presentaban buena tolerancia al CO, se procedía a la retirada del opioide inicial y a su sustitución por la dosis equianalgésica del nuevo fármaco. La reducción final con respecto al opioide inicial se mantuvo al menos en un 30%. Se respetó el opioide de corta acción para el dolor irruptivo. En las próximas entrevistas se reevaluó el dolor para ajuste y seguimiento de los efectos adversos. A través del seguimiento del consumo de la morfina oral se realizó la titulación de dosis del nuevo fármaco.
La actividad de la consulta de farmacia de la unidad del dolor consistió en identificar a los pacientes susceptibles de CO durante visitas rutinarias de control de tratamiento. Una vez seleccionados y siempre que el paciente aceptaba la intervención se les derivó al médico para realizar la estrategia de CO. Además, el farmacéutico realizó consejo farmacéutico, llevó el seguimiento y registro de los pacientes, el control de efectos adversos y la evaluación del dolor. Esta evaluación se llevó a cabo en dos momentos fundamentales, después de la introducción del nuevo opioide y tras la sustitución completa del opioide basal.
Según el registro de EVA inicial/final y del número de efectos adversos se identificaron a los pacientes con mejoría clínica. Se obtuvo el porcentaje de reducción de dosis para cada paciente sometido a CO de la comparación de dosis opioides anteriores y posteriores a la intervención, previamente convertidas a dosis equianalgésicas de morfina IV, según referencia de Trescot et al.8 (Tabla 3). También se clasificaron a los pacientes según el tiempo de tratamiento con opioides, según el opioide de partida, según el opioide final y según la causa del cambio.
Tabla equianalgésica modificada de Trescot et al8
| Opioide | Dosis | Dosis equianalgésica morfina IV |
|---|---|---|
| Fentanilo transdérmico | 25mcg/h | 15mg |
| Oxicodona oral | 1,5mg | 1mg |
| Morfina oral | 3mg | 1mg |
| Tapentadol oral | 7,5mg | 1mg |
IV: intravenoso; mcg: microgramo; h: hora; mg: miligramo
Se realizaron distribuciones de frecuencias de todas las variables y se calcularon medias y medianas de las variables de interés.
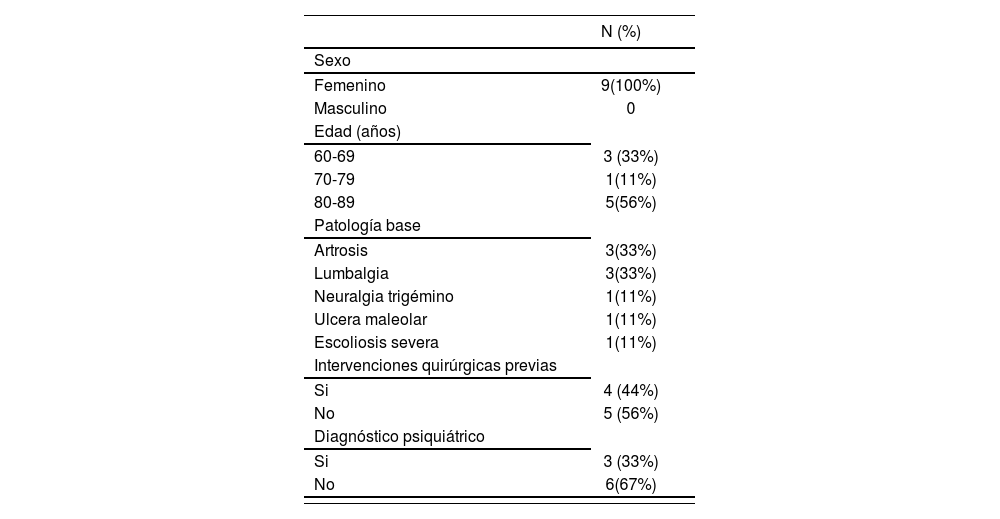
ResultadosSe encontraron 9 pacientes, todas ellas mujeres, a las que se sometió a CO en el periodo establecido. Las características demográficas y clínicas se detallan en la tabla 4. La mediana de edad de las pacientes fue 82 años (62-85), y todas ellas estaban en tratamiento crónico con más de 4 fármacos. Las patologías más frecuentes fueron artrosis y lumbalgia. Cuatro de las pacientes se habían sometido a intervenciones quirúrgicas previas y tres estaban en tratamiento psiquiátrico.
Características demográficas y clínicas
| N (%) | |
|---|---|
| Sexo | |
| Femenino | 9(100%) |
| Masculino | 0 |
| Edad (años) | |
| 60-69 | 3 (33%) |
| 70-79 | 1(11%) |
| 80-89 | 5(56%) |
| Patología base | |
| Artrosis | 3(33%) |
| Lumbalgia | 3(33%) |
| Neuralgia trigémino | 1(11%) |
| Ulcera maleolar | 1(11%) |
| Escoliosis severa | 1(11%) |
| Intervenciones quirúrgicas previas | |
| Si | 4 (44%) |
| No | 5 (56%) |
| Diagnóstico psiquiátrico | |
| Si | 3 (33%) |
| No | 6(67%) |
N: número de pacientes
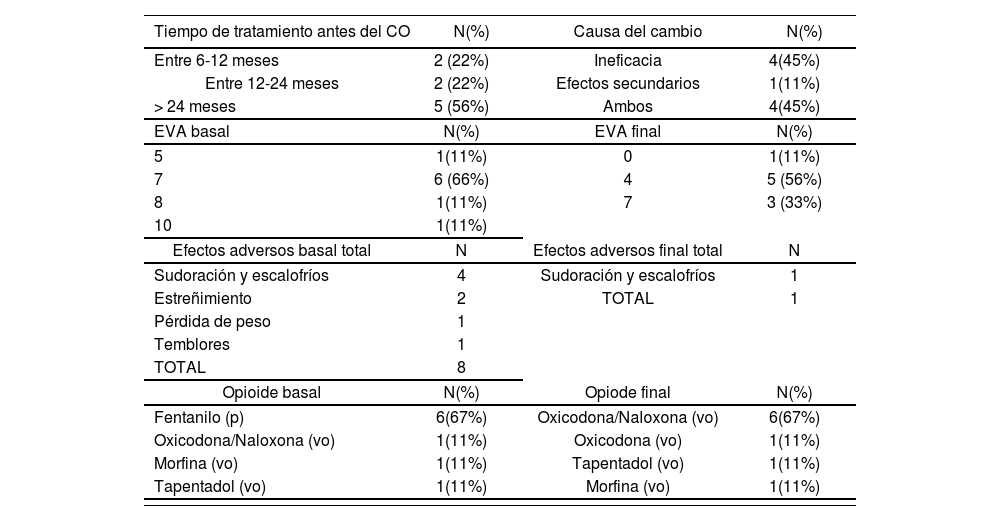
La tabla 5 resume datos terapéuticos de los pacientes en el estudio. La mediana de duración de tratamiento opioide previa al CO fue 60 meses (8-120). Mediana EVA inicial 7 (4-10). Las causas más frecuentes del CO fueron ineficacia o la combinación de ineficacia junto a efectos adversos. En seis de los pacientes el opioide inicial era fentanilo transdérmico, en dosis de entre 75-150mcg/h; también en seis de los pacientes se decidió el CO a oxicodona/naloxona, en dosis de entre 30-80mg/día. El tiempo de CO medio fue de 55 días, desde el inicio hasta que se alcanza la titulación estable del nuevo fármaco. La mediana EVA final fue de 4 (0-7), donde ningún paciente demostró empeoramiento.
Características del tratamiento.
| Tiempo de tratamiento antes del CO | N(%) | Causa del cambio | N(%) |
|---|---|---|---|
| Entre 6-12 meses | 2 (22%) | Ineficacia | 4(45%) |
| Entre 12-24 meses | 2 (22%) | Efectos secundarios | 1(11%) |
| > 24 meses | 5 (56%) | Ambos | 4(45%) |
| EVA basal | N(%) | EVA final | N(%) |
| 5 | 1(11%) | 0 | 1(11%) |
| 7 | 6 (66%) | 4 | 5 (56%) |
| 8 | 1(11%) | 7 | 3 (33%) |
| 10 | 1(11%) | ||
| Efectos adversos basal total | N | Efectos adversos final total | N |
| Sudoración y escalofríos | 4 | Sudoración y escalofríos | 1 |
| Estreñimiento | 2 | TOTAL | 1 |
| Pérdida de peso | 1 | ||
| Temblores | 1 | ||
| TOTAL | 8 | ||
| Opioide basal | N(%) | Opiode final | N(%) |
| Fentanilo (p) | 6(67%) | Oxicodona/Naloxona (vo) | 6(67%) |
| Oxicodona/Naloxona (vo) | 1(11%) | Oxicodona (vo) | 1(11%) |
| Morfina (vo) | 1(11%) | Tapentadol (vo) | 1(11%) |
| Tapentadol (vo) | 1(11%) | Morfina (vo) | 1(11%) |
CO: cambio de opioide; N: número de pacientes; (p) parche; (vo) vía oral
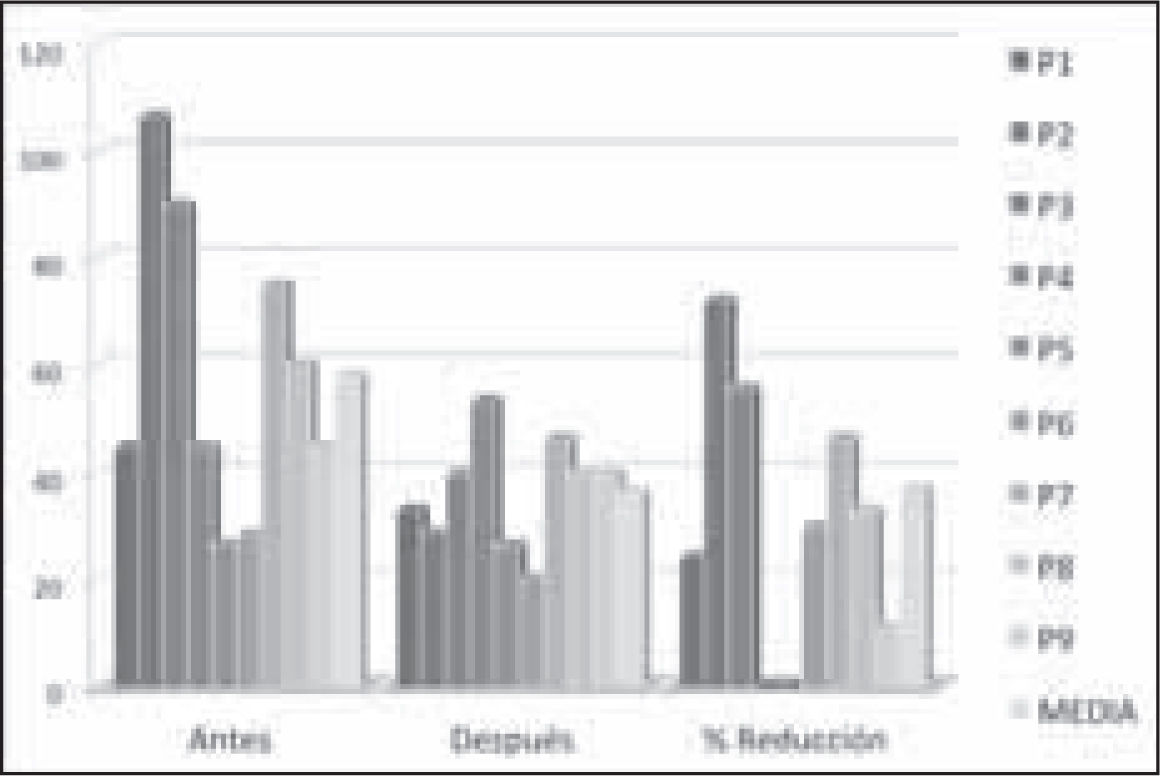
El análisis de mejora clínica mostró resultado positivo para 7 de los 9 pacientes (77%), cinco pacientes por mejora EVA y dos por reducción de efectos adversos. Cuatro pacientes no mostraron mejora en escala EVA. La reducción de dosis media fue de un 37% (Figura 2). Un paciente (P4) aumento la dosis según tabla equianalgési- ca un 18%; la máxima reducción fue de un paciente (P2) que redujo dosis un 72%. Antes del CO, el 55% de los pacientes (n=5) tenían registro en la historia clínica de efectos adversos asociados al tratamiento opioide; mientras que una vez realizada la intervención, sólo un 11% (n=1) de los pacientes mantuvo presencia de efectos adversos. Los pacientes que mostraron mejora clínica por reducción de efectos adversos fueron, un paciente (P5) que se suprimió estreñimiento, sudoración/escalofríos y pérdida de peso; y en el otro (P9), que redujo sudoración/escalofríos y estreñimiento. El 44% de los pacientes (n=4) presentaron cambios en la regulación térmica que se manifestaban con presencia de sudor y escalofríos (ésta fue la reacción adversa basal más frecuente). Un paciente presentó una rotación incompleta y otro dos, principalmente por intolerancia al nuevo opioide. En ningún caso el CO fue fallido, dado que ningún paciente volvió al opioide inicial. Todos los pacientes que presentaban ineficacia o presencia de efectos adversos into lerables (n=5) alcanzaron mejoría clínica. Sin embargo, sólo el 50% de los pacientes alcanzaron mejoría cuando coexistían ineficacia y efectos adversos (n=4).
DiscusiónSiete pacientes mostraron mejoría clínica tras la intervención, en ningún caso hubo EVAf > EVAi ni aumento de los efectos adversos. Este resultado muestra que el CO fue ventajoso para el alivio del dolor y en el control de los efectos adversos de pacientes con dolor crónico no oncológico de larga evolución cuando aparece ineficacia o efectos adversos intolerables. La bibliografía existente relativa a CO en pacientes con dolor crónico no oncológico es limitada, sin embargo existen estudios3,7,9,12 que han empleado CO con buenos resultados. En cuanto a publicaciones relativas a la rotación de opioides en pacientes con dolor oncológico, McNicol et al.13 en una revisión sistemática de 67 publicaciones concluyeron que el CO originaba un mejor control del dolor y una reducción de los efectos adversos. De la misma manera, algunos ensayos clínicos demuestran que la rotación opioide produce un alivio del dolor efectivo con menos efectos adversos7. Se trata de tres ensayos clínicos prospectivos en los que se cambia altas dosis de morfina, a fentanilo trasdérmico o parenteral (n=20) en pacientes oncológicos13; oxicodona oral (n=27)14 y a buprenorfina trasdérmica (n=42)15. La razón de la rotación fue analgesia inadecuada con efectos adversos intolerables que impedían el aumento de dosis. Se sustituyó la morfina y se ajustó la dosis del nuevo opioide, el resultado fue un mejor control del dolor, sin incrementar efectos adversos. Existen estrategias documentadas de CO en función del tiempo de duración de la transición, de las dosis previas de opioide o de la causa del cambio10. El CO puede ser inmediato o paulatino. En este último caso se optará por la coexistencia ambos compuestos durante un periodo de tiempo o por la intercalación de morfina antes de introducir el nuevo opioide. También existen recomendaciones relativas a la realización del CO en función del opioide de partida y del opioide final7,8,9.
La reducción equianalgésica alcanzada en este estudio es acorde con estudios anteriores7,8,12. Hubo gran variación en las reducciones de dosis con respecto a tablas equianalgésicas debido a la variabilidad de características clínicas de los pacientes. La primera tabla de dosis equianalgésicas se publicó hace más de 40 años16,17, codificando los resultados de estudios relativos a potencia de fármacos opioides. Sin embargo actualmente muchos autores cuestionan la rigidez de las conversiones7,9,12,15. Las tablas equianalgésicas sirven de orientación al prescriptor para estimar la dosis óptima del nuevo opioide pero tienden a dar la dosis más alta para alcanzar efectos analgésicos comparables. La conversión debe tener en cuenta las particularidades de los fármacos que se intercambian y las características individuales de los pacientes, como edad, función renal o efectos adversos referidos9. La insuficien-cia renal puede cambiar la potencia de algunos fármacos que dependen del aclaramiento renal9. Pacientes con insuficiencia adrenal e hipotiroidismo pueden mostrar alta respuesta a opioides7,9.
La etiología subyacente también es un factor determinante en el CO7,12. Además de las características poblacionales, los ratios de conversión pueden ser diferentes según la sensibilidad de la etiología subyacente. Diferentes síndromes dolorosos pueden tener una respuesta clínica variable y altamente impredecible, lo que resta importancia a las tablas equianalgésicas7. Una adecuada titulación de dosis inicial y apropiada adherencia es fundamental7,12; si la dosis de opioide no es adecuada como inicio, es menos probable que la dosis de conversión sea efectiva. La falta de adherencia puede restar efectividad al tratamiento y facilitan la aparición de ataques de dolor o de efectos adversos.
Este estudio presenta las limitaciones propias de un estudio retrospectivo con bajo tamaño muestral y además con ausencia de hombres, lo que resta relevancia. El escaso número de pacientes se debió al limitado número de pacientes candidatos y a la falta de accesibilidad a datos previos a la fecha de inicio. La valoración de los efectos adversos no se pudo graduar por tratarse de un estudio retrospectivo. No existía ninguna escala previa de valoración establecida, de forma que solo se registró la presencia o ausencia de efectos adversos. No hubo anotaciones en la historia clínica del consumo de morfina oral a demanda ni se pudo establecer una cronología estándar para realizar el seguimiento de todos los pacientes a lo largo del CO.
El análisis realizado permitió destacar la importancia de realizar una reducción del opioide basal, antes de iniciar el CO, que mejora la tolerancia y predispone al paciente al nuevo opioide. Esta reducción es la responsable del descenso medio superior al 30% en potencia relativa según las tablas equianalgésicas. Estas tablas deben ser consideradas como una primera aproximación para obtener la nueva dosificación del nuevo opioide, a las que se deben aplicar otros criterios (poblacionales, personales, etiológicos,…) para tratar de individualizar la dosificación del nuevo opioide7,9. La ausencia de estudios prospectivos y la falta de consenso de guías clínicas limitan la aplicación del CO para el manejo del dolor crónico no oncológico. A pesar de la publicación de algunas guías clínicas18 y de libros específicos sobre conversión de opioides19, organizaciones como la American Academy of Pain Medicine (AAPM) se abstienen de hacer recomendaciones sobre rotación de opioides11. La realización de estudios prospectivos arrojaría luz sobre una intervención que puede mejorar la calidad de vida de pacientes con dolor.
El tratamiento del dolor no oncológico con opioides es un asunto controvertido en el ámbito sanitario. Actualmente existe cierta reticencia a tratar este tipo de dolor con opioides, probablemente debido a una sobreestimación de los riesgos, lo que a su vez, hace más probable el fracaso en la terapia analgésica. Esto se refleja en múltiples estudios, como el publicado por la AAPM20, donde se estimó que más de 4 de cada 10 pacientes con dolor moderado-severo de tipo crónico no obtienen un alivio adecuado del dolor. La percepción de infra-dosificación en el tratamiento analgésico lleva a uno de cada cuatro pacientes a cambiar de profesional sanitario 3 o más veces20. La atención farmacéutica como parte del tratamiento multidisciplinar del dolor, permite potenciar la adherencia al tratamiento y controlar los aumentos de dosis y efectos adversos. Además permite detectar y corregir carencias que puedan incidir o distorsionar el beneficio terapéutico perseguido21. Desde nuestra experiencia, consideramos que la intervención del farmacéutico en el tratamiento del paciente con dolor crónico genera un vínculo entre el profesional sanitario y el paciente que permite mejorar las expectativas de éxito terapéutico. De la misma forma, reduce la carga asistencial médica y contribuye a la calidad y seguridad del tratamiento opioide.