ARTICULO ESPECIAL
ANALISIS DE LAS NOTIFICACIONES RECIBIDAS EN LA UNIDAD DE FARMACOVIGILANCIA DE LA SOCIEDAD ESPAÑOLA DE FARMACIA HOSPITALARIA 1990-1998
Molina Castiella, M. J., Becaria del Servicio de Farmacia. Hospital de Navarra (Pamplona).Napal Lecumberri, V., Presidente de la Sociedad Española de Farmacia Hospitalaria
Correspondencia: M. J. Molina Castiella. Hospital de Navarra. Irunlarrea, 3. 31008Pamplona.
Fecha de recepción: 5-4-1999
INTRODUCCION
El objetivo de la farmacovigilancia es promover la mayor seguridad en la utilización de los medicamentos. Para ello se requiere el trabajo conjunto de los profesionales sanitarios sin excepción.
En España los primeros pasos para organizar un programa de farmacovigilancia se dan en 1973 con la publicación de una orden ministerial (1). En dicha orden se establecían las finalidades del programa, el origen de las notificaciones de reacciones adversas, el tipo de reacciones adversas que debían comunicarse y el procedimiento de notificación, de forma que se asegurase la confidencialidad de los datos, la recogida de comunicaciones se hacía a través de las Jefaturas Provinciales de Sanidad y el Centro Nacional de Farmacobiología era el organismo encargado de las funciones de farmacovigilancia.
Esta orden sentaba las bases para un sistema de farmacovigilancia organizado. Sin embargo, los resultados fueron muy pobres: alrededor de 200 notificaciones en doce años.
En el año 1988 se puso en funcionamiento en nuestro país un programa de farmacovigilancia basado en la notificación voluntaria de sospecha de reacciones adversas a medicamentos (RAM). Se optó por un modelo descentralizado, se crearon centros especializados en farmacovigilancia en cada comunidad autónoma (2).
Aunque los servicios de farmacia de hospital (SFH) han llevado a cabo tradicionalmente tareas relacionadas con la farmacovigilancia, reflejadas en la OM de febrero de 1977 (3), la incorporación de la Sociedad Española de Farmacia Hospitalaria (SEFH) en el Sistema Español de Farmacovigilancia tiene lugar en 1989 con la aprobación en la Asamblea General de la SEFH del documento «Análisis de la incorporación de la SEFH al Sistema Español de Farmacovigilancia» (4), que tiene como objetivo canalizar, a su través, la incorporación oficial de los servicios farmacéuticos de la red hospitalaria estatal en el referido Programa Nacional de Farmacovigilancia.
La Ley del Medicamento publicada a finales de 1990 recoge el deber de comunicar los efectos inesperados o tóxicos para las personas o la salud pública que pudieran haber sido causadas por los medicamentos para todos los profesionales de la salud (5).
Los SFH dentro del hospital se encuentran en una situación óptima para la detección y seguimiento de RAM (distribucción de medicamentos en dosis unitarias, información de medicamentos, etc.).
Esta incorporación de los SFH al Sistema Español de Farmacovigilancia se pone en marcha en abril de 1990. Se impulsa en todos los centros sanitarios la notificación voluntaria a reacciones adversas mediante la implantación de la tarjeta amarilla, especialmente modificada y adaptada al medio hospitalario por la propia SEFH, con carácter común para toda la red de hospitales. Se recomienda que sea el propio servicio farmacéutico el que cumplimente en todos sus extremos el contenido de la tarjeta amarilla, con la ayuda de los profesionales clínicos responsables del paciente.
RESULTADOS
Se han recogido los siguientes datos:
-- Número de tarjetas amarillas recibidas.
-- Número de reacciones adversas.
-- Demanda asistencial.
-- Órganos y sistemas implicados en las RAM.
-- Reacciones adversas más frecuentes.
-- Exploraciones complementarias realizadas para confirmar la sospecha de RAM.
-- Gravedad y desenlace de las RAM.
-- Tratamiento de la reacciones adversas.
-- Sexo, edad y peso del paciente.
-- Procedencia de las notificaciones.
-- Imputabilidad de las RAM mediante la aplicación de algoritmos.
-- Grupo de fármacos sospechosos de haber producido las reacciones adversas.
Para los cálculos estadísticos se ha empleado la hoja de cálculo Corel Word Perfect.
Número de notificaciones
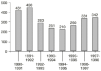
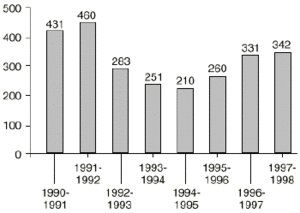
Desde la puesta en marcha del sistema (abril de 1990) hasta la fecha se ha recibido en la Unidad de Farmacovigilancia de la SEFH un total de 2.550 tarjetas amarillas, de las que se ha estudiado 2.150. En la figura 1 aparece el número de tarjetas recibidas por año.
Figura 1.--Número de tarjetas recibidas en la SEFH.
De las 400 tarjetas restantes, la mayoría no se ha podido estudiar por carecer de algún dato o no ser RAM a pesar de su notificación. Se está procediendo a una nueva revisión de las mismas.
La mayoría de las 2.150 tarjetas amarillas estaban totalmente cumplimentadas, tanto con la información obligatoria como con la información adicional para la SEFH.
Número de reacciones adversas
Las 3.523 reacciones adversas a medicamentos notificadas suponen 1,63 reacciones por tarjeta.
Demanda asistencial
En 1.290 pacientes la demanda asistencial, como consecuencia de la RAM, fue desconocida o no necesitaron ingreso hospitalario. Doscientos treinta y tres pacientes fueron atendidos en urgencias, no necesitando ingreso, y 627 pacientes sí lo necesitaron.
Afección por órgano o sistema
En la tabla 1 se observa que el porcentaje mayor de reacciones adversas afectan a la piel y anejos cutáneos, así como al aparato digestivo.
Tabla 1. Afección por órgano o sistema | ||
| Órgano | RAM | % |
| Piel y anejos cutáneos | 958 | 27,19 |
| Aparato digestivo | 722 | 20,49 |
| Generales | 343 | 9,74 |
| Sistema nervioso central, periférico | 325 | 9,23 |
| Hepáticas | 151 | 4,30 |
| Cardiovasculares, alteraciones del ritmo | 149 | 4,23 |
| Respiratorias | 138 | 3,92 |
| Hematológicas, serie blanca | 109 | 3,09 |
| Aparato urinario | 81 | 2,30 |
| Psiquiátricas | 69 | 1,96 |
| Metabólicas y nutricionales | 65 | 1,84 |
| Cardiovasculares, alteraciones vascula res extracardíacas | 65 | 1,84 |
| Hematológicas, plaquetas y coagulación | 57 | 1,62 |
| Cardiovasculares general | 54 | 1,53 |
| Visión | 48 | 1,36 |
| Sistema nervioso autónomo | 39 | 1,11 |
| Hematológicas, serie roja | 37 | 1,05 |
| Musculoesqueléticos | 33 | 0,94 |
| Endocrinas | 22 | 0,62 |
| Audición y sistema vestibular | 18 | 0,51 |
| Lesiones en el punto de aplicación | 15 | 0,42 |
| Otros | 25 | 0,71 |
| Total | 3.523 | 10 0 |
La relación de RAM comunicadas presenta una gran diversidad dentro de cada órgano o sistema; en la tabla 2 aparecen las RAM comunicadas que afectan a la piel.
Tabla 2. Recuento de RAM: piel y anejos cutáneos |
| -- Acné: 5. |
| -- Alopecia: 6. |
| -- Alteración de la piel: 1. |
| -- Angioedema: 12. |
| -- Cabello, descoloración: 1. |
| -- Dermatitis: 6. |
| -- Dermatitis exfoliativa: 1. |
| -- Dermatitis liquenoide: 1. |
| -- Dermografismo: 1. |
| -- Descamación piel: 1. |
| -- Eczema: 3. |
| -- Eritema exudativo: 2. |
| -- Eritema indurado: 1. |
| -- Eritema multiforme: 13. |
| -- Eritema nodoso: 4. |
| -- Erupción cutánea: 140. |
| -- Erupción eritematosa: 213. |
| -- Erupción maculopapular: 89. |
| -- Erupción purpúrica: 2. |
| -- Erupción psoriasiforme: 1. |
| -- Erupción pustular: 1. |
| -- Exfoliación de la piel: 1. |
| -- Fotosensibilidad: 1. |
| -- Fotosensibilidad alérgica: 2. |
| -- Hiperpigmentación piel: 2. |
| -- Hipertricosis: 1. |
| -- Hipopigmentación cutánea: 1. |
| -- Necrólisis epidérmica: 4. |
| -- Piel, alteración: 1. |
| -- Piel, exfoliación: 3. |
| -- Prurito: 224. |
| -- Exantema: 24. |
| -- Rubefacción: 1. |
| -- Síndrome de Stevens Johnson: 15. |
| -- Síndrome de Lyell: 6. |
| -- Sudoración, aumento: 24. |
| -- Toxicodermia: 2. |
| -- Urticaria: 96. |
Reacciones adversas más frecuentes
Las reacciones adversas que han aparecido con más frecuencia son prurito, erupción eritematosa y hemorragia gastrointestinal (tabla 3).
Tabla 3. Tipos de reacciones adversas más frecuentes | |
| Reacción adversa | Número |
| Prurito | 229 |
| Erupción eritematosa | 222 |
| Hemorragia GI | 181 |
| Erupción cutánea | 144 |
| Vómitos | 119 |
| Náuseas | 114 |
| Urticaria | 101 |
Exploraciones complementarias
En la tabla 4 se indican las exploraciones complementarias realizadas para confirmar la sospecha de RAM y concluir si hay o no relación causal con el fármaco sospechoso.
| Tabla 4. Tipos de exploración complementaria para confirmar la sospecha de RAM | |
| Tipo de exploración complementaria | N.° de exploraciones |
| Pruebas bioquímicas y hematológicas | 784 |
| Pruebas anatomopatológicas | 26 |
| Pruebas radiológicas | 16 |
| Pruebas de alergia | 23 |
| Endoscopia | 84 |
| Otros | 153 |
Gravedad y desenlace de las RAM
Gravedad
El mayor número de reacciones adversas corresponde a reacciones leves que han necesitado tratamiento (tabla 5).
Tabla 5. Gravedad de las RAM | ||
| Gravedad | N.° reacciones | % |
| Leve | 986 | 28,00 |
| Leve con tratamiento | 1.189 | 33,75 |
| Moderada | 1.057 | 30,00 |
| Grave | 233 | 6,62 |
| Mortal | 58 | 1,64 |
| Total | 3.523 | 100 |
Desenlace
El 74% de las reacciones tuvieron una recuperación total (tabla 6).
Tabla 6. Desenlaces de las RAM | ||
| Desenlace | N.° reacciones | % |
| Desconocido | 618 | 17,54 |
| Recuperación sin secuelas | 2.622 | 74,42 |
| Recuperado con secuelas | 57 | 1,62 |
| Todavía no recuperado | 151 | 4,29 |
| Muerte (por causa de la RA) | 24 | 0,68 |
| Muerte (el fármaco puede ha ber contribuido) | 46 | 1,30 |
| Muerte (no relacionada con el fármaco) | 5 | 0,14 |
| Total | 3.523 | 100 |
Tratamiento de las reacciones adversas
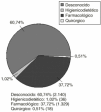
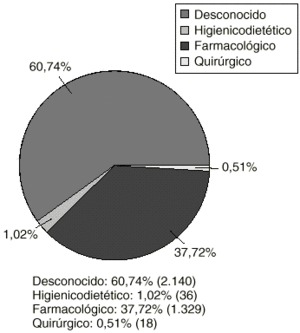
El 39% de las RAM notificadas precisaron ser tratadas, a pesar de la interrupción del tratamiento con el fármaco sospechoso. En la figura 2 aparece la proporción de los tratamientos recibidos.
Figura 2.--Reacciones adversas tratadas.
Sexo, edad y peso del paciente
Sexo
De las 2.150 tarjetas recibidas, la proporción de hombres y mujeres es la que muestra la tabla 7.
Tabla 7. Distribución del sexo | ||
| Sexo | N.° tarjetas amarillas | % |
| Hombres | 1.146 | 45,42 |
| Mujeres | 990 | 39,24 |
| Sin notificar | 387 | 15,33 |
Edad
De las 2.150 tarjetas estudiadas, 241 no han informado sobre la edad de los pacientes. Las 1.295 restantes indican que el grupo más afectado es el de mayores de setenta años (tabla 8).
Tabla 8. Distribución de edades | ||
Edad | Número | % |
| 0-10 años | 53 | 2,47 |
| 11-12 años | 121 | 5,63 |
| 21-30 años | 206 | 9,58 |
| 31-40 años | 259 | 12,05 |
| 41-50 años | 208 | 9,67 |
| 51-60 años | 262 | 12,19 |
| 61-70 años | 372 | 17,30 |
| Mayores de 71 años | 428 | 19,91 |
| Desconocida | 241 | 11,21 |
| Total | 2.150 | 100 |
Peso
De 2.150 tarjetas estudiadas, 1.347 no informaron del peso de los pacientes, del resto de tarjetas estudiadas el grupo de 61 a 70 kg de peso son los que con mayor frecuencia presentan reacciones adversas. La distribución de los pesos se indica en la tabla 9.
Tabla 9. Distribución de peso | ||
| Peso | Número | % |
| 0-10 kg | 23 | 2,86 |
| 11-20 kg | 25 | 3,11 |
| 21-30 kg | 16 | 1,99 |
| 31-40 kg | 31 | 3,86 |
| 41-50 kg | 65 | 8,09 |
| 51-60 kg | 176 | 21,92 |
| 61-70 kg | 229 | 28,52 |
| 71-80 kg | 141 | 17,56 |
| Más de 81 kg | 97 | 12,08 |
| Total | 803 | 100 |
Procedencia de las notificaciones
En la tabla 10 se indica el número de tarjetas amarillas recibidas según la comunidad autónoma de procedencia y revisadas hasta la fecha.
Tabla 10. RAM/comunidades autónomas | |||
| Comunidad autónoma | N.° de tarjetas amarillas | % | N.° de hospitales |
| Andalucía | 527 | 24,51 | 22 |
| Aragón | 2 | 0,09 | 1 |
| Asturias | 52 | 2,42 | 5 |
| Canarias | 20 | 0,93 | 2 |
| Castilla-La Mancha | 22 | 1,02 | 4 |
| Castilla y León | 136 | 6,32 | 6 |
| Cataluña | 366 | 17,02 | 38 |
| Galicia | 44 | 2,05 | 4 |
| La Rioja | 131 | 6,09 | 1 |
| Madrid | 75 | 3,49 | 8 |
| Murcia | 433 | 20,14 | 5 |
| Navarra | 148 | 6,88 | 5 |
| País Vasco | 37 | 1,72 | 3 |
| Valencia | 91 | 4,23 | 10 |
| Baleares | 8 | 0,37 | 3 |
| Extremadura | 3 | 0,14 | 1 |
| Desconocidas | 55 | 2,56 | -- |
| Total | 2.150 | 100 | 118 |
Imputabilidad de las RAM
Las tarjetas se han codificado mediante la aplicación del algoritmo de Karch-Lasagna modificado por Laporte, por ser dicho algoritmo el que se aplica a nivel nacional (6). También se han aplicado los algoritmos de Naranjo y Kramer (7, 8). El resultado es el que muestra la tabla 11.
Tabla 11. Imputabilidad de las RAM | |||
| Imputabilidad de la reacción al fármaco | Naranjo | Kramer | Karch-Lasagna |
| Desconocida | 7 | 8 | 22 |
| Definitivo | 47 | 65 | 110 |
| Probable | 2.780 | 2.524 | 2.623 |
| Posible | 676 | 903 | 528 |
| Improbable | 13 | 33 | 240 |
Grupo de fármacos sospechosos de haber producido las reacciones adversas
La tabla 12 presenta la distribución de los medicamentos implicados según su grupo farmacológico. Ocupan el primer lugar los antibióticos y las vacunas, seguidos de los medicamentos que actúan sobre el aparato cardiovascular y en tercer lugar los analgésicos no narcóticos y antimigrañosos.
Tabla 12. Fármacos sospechosos de producir RAM | ||
Fármacos | N.° | % |
| Antibióticos y vacunas | 576 | 26,80 |
| Aparato cardiovascular | 296 | 13,76 |
| Analgésicos no narcóticos y antimigrañosos | 269 | 12,51 |
| Antiinflamatorios y antirreumáticos | 186 | 8,65 |
| Aparato digestivo y metabolismo | 172 | 8,00 |
| Psicofármacos | 99 | 4,60 |
| Sangre y órganos hematopoyéticos | 98 | 4,56 |
| Antiepilépticos y antiparkinsonianos | 73 | 3,39 |
| Antigripales, antitusígenos y antiasmá ticos | 57 | 2,65 |
| Antineoplásicos | 56 | 2,60 |
| Hormones no sexuales | 48 | 2,23 |
| Aparato genitourinario y hormonas se xuales | 28 | 1,30 |
| Antiparasitarios | 21 | 0,98 |
| Otros | 171 | 7,95 |
| Total | 2.150 | 100 |
DISCUSION
En los dos primeros años de implantación del sistema de notificación de RAM a la SEFH (1990-1991) el número de notificaciones fue muy alto. En su mayoría se trataba de reacciones adversas leves y que ya estaban descritas. En los cuatro años sucesivos (1992, 1993, 1994 y 1995) disminuyó el número de notificaciones, pero se comunicaron reacciones adversas de mayor gravedad, y muchas de ellas no se habían descrito previamente. En los tres últimos años (1996, 1997 y 1998) creció de nuevo el número de notificaciones, debido lo más probable a la consolidación del sistema de farmacovigilancia en los SFH.
No se encontró una asociación estadísticamente significativa entre sexo y RAM (45% hombres respecto a 39% mujeres).
Es conocido que las RAM son más frecuentes en personas de mayor edad (9, 10). En el presente estudio fueron más frecuentes en personas mayores de sesenta años; esto se debe a los cambios fisiológicos que acompañan al proceso de envejecimiento, así como a la patología propia de esta etapa y a la polimedicación que la acompaña.
En los pacientes que necesitaron ingreso las RAM afectaron en una importante proporción al aparato digestivo (hemorragias digestivas altas). También destacaron por su importancia las RAM de tipo neurológico, hepático, hematológico, cardiovascular y respiratorias.
Los pacientes que tuvieron RAM y no precisaron ingreso hospitalario (60%), las RAM más frecuentes fueron las de tipo cutáneo (en su mayoría de naturaleza presuntamente alérgica).
Los dos órganos más afectados han sido piel y aparato digestivo, no habiendo diferencia significativa entre los dos (27 vs 20%). Otros autores (9, 10) citan al sistema gastrointestinal como el que más frecuentemente se ve afectado.
En cuanto a la gravedad, el 62% de las reacciones han sido de gravedad leve y el 38% de gravedad moderada, grave y mortal. Esta última cifra es más elevada y alcanza hasta el 50% cuando en las notificaciones participan activamente los servicios de urgencias.
Además de la gravedad de las RAM, es importante considerar la recuperación de las mismas, de las que un 74% tuvieron una recuperación total, hubo 618 reacciones en las que la recuperación no se conoció en el momento de la notificación.
Los fármacos sospechosos más frecuentemente implicados en las RAM notificadas fueron los antibióticos, seguidos por los fármacos que actúan sobre el aparato circulatorio y en tercer lugar aparecen los analgésicos, estos datos coinciden con ligeras variaciones con otros estudios (11, 12).
CONCLUSIONES
Se observa que la aparición de RAM es más frecuente en personas de mayor edad y en pacientes que toman más de un fármaco.
Los fármacos más implicados en las RAM han sido los antibióticos, seguidos de los fármacos que actúan sobre el aparato circulatorio y en tercer lugar los analgésicos.
Los órganos más afectados como consecuencia de las RAM han sido piel y aparato digestivo. La RAM que se ha encontrado con mayor proporción ha sido prurito, erupción eritematosa y hemorragia GI en tercer lugar.
En pocas notificaciones se ha obtenido una relación fármaco-efecto definida, ya que para que ésta sea así es necesario volver a administrar el fármaco sospechoso por segunda vez.
El número de tarjetas amarillas notificadas a lo largo de estos años indica que los servicios de farmacia de hospital han asumido la notificación de sospecha de RAM dentro de las tareas de farmacovigilancia que tradicionalmente venían llevando a cabo.
Hospitales y centros de atención primaria que han participado en las notificaciones de RAM
Andalucía
-- Centro de Atención Primaria. Melilla.
-- Centro Fremap.
-- Hospital Carlos Haya.
-- Hospital Comarcal de la Axarquía.
-- Hospital Comarcal San Agustín. Linares.
-- Hospital de la Merced de Osuna.
-- Hospital del S. A. S. El Tomillar (Complejo Hospitalario de Valme).
-- Hospital General de Especialidades Ciudad de Jaén.
-- Hospital General de Huelva.
-- Hospital Infanta Elena.
-- Hospital Juan Ramón Jiménez.
-- Hospital Municipal Línea de la Concepción.
-- Hospital Psiquiátrico Nuestra Señora del Sagrado Corazón.
-- Hospital Psiquiátrico San Francisco de Asís.
-- Hospital Río Tinto.
-- Hospital San Juan de Dios.
-- Hospital Universitario Reina Sofía.
-- Hospital Universitario de Valme.
-- Hospital Virgen del Rocío.
-- Hospital Victoria Eugenia-Cruz Roja Española.
-- Patronato Municipal. Hospital de San Sebastián.
Aragón
-- Hospital Miguel Servet.
Asturias
-- Complejo Hospitalario de Oviedo.
-- Hospital de Cabueñes.
-- Hospital Narcea Carmen y Severo Ochoa.
-- Hospital Nuestra Señora de Covadonga.
-- Hospital Valle del Nalón.
Baleares
-- Clínica Mare Nostrum.
-- Hospital Psiquiátrico.
-- Hospital Son Dureta.
Canarias
-- Hospital Nuestra Señora de Candelaria.
-- Hospital Nuestra Señora del Pino.
Cataluña
-- Centro Médico Teknon, S. L.
-- Clínica de Lleida l''Alianza.
-- Clínica Nuestra Señora del Pilar.
-- Clínica Nuestra Señora del Perpetuo Socorro.
-- Clínica Plato. Fundacio Privada.
-- Clínica Sagrada Familia.
-- Clínica Tres Torres.
-- Consorcio Hospitales Mataró.
-- Consorci Hospitalario de Parc Taulí.
-- Clínica Girona.
-- Fundacio Hospital de Sant Pau i Santa Tecla.
-- Hospital Bellvit Princeps d''Espanya.
-- Hospital Clínico y Provincial de Barcelona.
-- Hospital Comarcal de Sant Antoni Abat.
-- Hospital Comarcal de Mora d''Ebre.
-- Hospital Cruz Roja. Hospitalet.
-- Hospitals de Barcelon (Hospital L''Aliança y Hospital Sagrat Cor).
-- Hospital de la Creu Roja de Barcelona.
-- Hospital de Lleida Arnau de Villanova.
-- Hospital de Sant Jaume de Olot.
-- Hospital de San Juan de Dios.
-- Hospital de San Rafael.
-- Hospital de la Santa Creu y Sant Pau.
-- Hospital General de Granollers.
-- Hospital General Vall d''Hebron.
-- Hospital Infantil C. Sanitaria V. Hebron.
-- Hospital Materno-Infantil.
-- Hospital Mutua de Tarrasa.
-- Hospital Provincial Santa Caterina.
-- Hospital San Cam.
-- Hospital Universitari Joan XXII.
-- Hospital Universitario de Girona Doctor Josep Trueta.
-- Instituto Dexeus, S. A.
-- Instituto Guttmann.
-- La Alianza Mataronense.
-- Quinta de Salut L''Aliança.
-- San. y Clin., S. A. Clínica Quirón.
Castilla y León
-- Complejo Hospitalario S. S. de Segovia.
-- Hospital de Soria del Insalud.
-- Hospital del Río Hortega.
-- Hospital General de Segovia.
-- Hospital General Yagüe.
-- Hospital Provincial San Telmo. Palencia.
Castilla-La Mancha
-- Hospital Gutiérrez Ortega.
-- Hospital Nuestra Señora de Sonsoles.
-- Hospital Provincial de La Misericordia.
-- Hospital Virgen de la Altagracia.
País Vasco
-- Hospital de Basurto-Osakidetza.
-- Hospital de Cruces.
-- Hospital Nuestra Señora de la Antigua.
Extremadura
-- Hospital de Llerena del Insalud.
Galicia
-- Complejo Hospitalario Xeral-Calde.
-- Cristal Piñor Hospitais.
-- Hospital Comarcal Valdeorras.
-- Sanatorio Psiquiátrico de Conjo.
Madrid
-- Centro de Salud Monovar.
-- Centro de Salud Las Rozas.
-- Clínica Nuestra Señora de Loreto, S. A.
-- Clínica Puerta de Hierro.
-- Hospital de Móstoles.
-- Hospital 12 de Octubre.
-- Hospital Militar Central Gómez Ulla.
-- Hospital Severo Ochoa.
Murcia
-- Centro Sanitario Virgen de Arrixaca.
-- Hospital Comarcal del Noroeste. Caravaca de C.
-- Hospital General Universitario de Murcia.
-- Hospital Naval del Mediterráneo.
-- Hospital Santa María del Rosell.
Navarra
-- Clínica San Miguel.
-- Hospital Comarcal García Orcoyen.
-- Hospital de Navarra.
-- Hospital Reina Sofía.
-- Hospital Virgen del Camino.
La Rioja
-- Complejo Hospitalario San Millán-San Pedro.
Comunidad Valenciana
-- Hospital Dr. Moliner.
-- Hospital Francisco de Borja.
-- Hospital General de Elche.
-- Hospital General Universitario de Alicante del S. V. S.
-- Hospital General Universitario de Denia Marina Alta.
-- Hospital General de Valencia.
-- Hospital General Universitario.
-- Hospital La Fe.
-- Hospital Marina Baixa de Villajoyosa.
-- Hospital S. V. S. Orihuela.
BIBLIOGRAFIA
1.OM de 12 de noviembre de 1973. BOE 287 (30 de noviembre de 1973).
2. La farmacovigilancia en España. Madrid: Instituto Carlos III; 1992.
3. Orden de 1 de febrero de 1977 por la que se regulan los Servicios Farmacéuticos de Hospitales. BOE (19 de febrero de 1977).
4. Marcotegui F, Mas P, Napal V, Planells C. Análisis de la incorporación de la SEFH al Sistema Español de Farmacovigilancia. Comité Técnico de Farmacovigilancia; l989.
5.Ley 25/1990, de 20 de diciembre, del Medicamento. BOE (22 de diciembre de 1990).
6.Karch FE, Lassagna L. Toward the operational identification of adverse drug reactions. Clin Pharmacol Ther 1977;21:247-54.
7.Naranjo CA, Busto V, Sellers EM, Sandor P et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30:239-45.
8.Kramer MS, Hutchinson TA, Rudnick SA, Leventhal JM, Feinstein AR. Operational criteria for adverse drug reactions in evaluating suspected toxicity of a popular scabicide. Clin Pharmacolol Ther 1980;27:149-55.
9. Planells Herrero C, Rodríguez Sasiain JM, Jiménez Torres NV. Reacciones adversas a medicamentos que motivan la admisión hospitalaria detectadas mediante el diagnóstico de ingreso. Farm Hosp 1993;17:133-43.
10. Viñuales A, Napal V, Iruin A et al. Monitorización intensiva de reacciones adversas medicamentosas en el medio hospitalario: estudio previo. Farm Clin 1987;4:693-710.
11. Gómez Germá P, Beltrán García M, Martín Muñoz R, Bejarano Rojas D, Miguel del Corral M. Evaluación de la inclusión del Servicio de Documentación Clínica en la detección de reacciones adversas de medicamentos. Farm Hosp 1995;19 (Esp Congr):29.
12. García Fernández ML, Rubio Barbón S, Blanco Zorroza B. Reacciones adversas a fármacos detectadas a través del sistema de notificación voluntaria durante el período 1993-1995. Farm Hosp 1995;19:362-3.