Analizar la efectividad de un protocolo antiemético en pacientes que reciben quimioterapia.
MétodoEstudio prospectivo en pacientes con tumores sólidos con quimioterapia en el hospital de día de Oncología entre enero 2006–2007.
Se realizó una revisión bibliográfica analizando las recomendaciones de guías de práctica clínica. Se calculó el potencial emetógeno según nivel Hesketh (NH), estableciendo la premedicación antiemética de cada esquema. Se evaluó la efectividad de un protocolo antiemético mediante una encuesta como método de medida de episodios eméticos y náuseas en fase aguda y retardada.
ResultadosCiento setenta y dos pacientes cumplimentaron la encuesta, 13,4% vomitaron en fase aguda y 16,9% en retardada, mediana número de veces 2 (1–8) y 1 (1–5) respectivamente. Con esquemas NH 4–5 18,5% experimentaron vómitos en fase aguda y 20,2% en retardada; náuseas en fase aguda 46% y 38,4% en retardada. El control de vómitos en pacientes con esquemas NH=1–3 fue del 100% en fase aguda y de 91,7% en retardada; notificaron náuseas un 27% en fase aguda y 31% en retardada. Los factores que más contribuyeron a la presencia de vómitos y náuseas fueron potencial emetógeno (p<0,05), vómitos en ciclo anterior (p<0,05) y edad<50 (p<0,002).
DiscusiónLa pauta propuesta es eficaz en el control de vómitos para esquemas NH=–3. En esquemas altamente emetógenos, el protocolo antiemético es también eficaz aunque la protección no es completa. Este protocolo parece no ser tan efectivo en el control de náuseas, aunque este es un síntoma subjetivo de valoración compleja que no se mide de forma sistemática en ensayos clínicos.
To analyse the effectiveness of an antiemetic protocol in patients receiving chemotherapy treatment.
MethodProspective study in patients with solid tumours receiving chemotherapy in an oncology day hospital between January 2006 and 2007. We conducted a literature review and an evaluation of the recommendations of different clinical practice guidelines. The emetogenic potential was calculated according to the Hesketh level (HL), and the antiemetic premedication was determined for each regimen. We evaluated the effectiveness of an antiemetic protocol by using a survey as a method for measuring emetic episodes and nausea in the acute and delayed phases.
Results172 patients completed the survey. 13.4% vomited in the acute phase and 16.9% in the delayed phase; the median number of times was 2 (1–8) and 1 (1–5) for each respective phase. With treatment regimens classed as HL 4-5, 18.5% experienced vomiting in the acute phase and 20.2% in the delayed phase, with 46% experiencing nausea in the acute phase and 38.4% in the delayed phase. Control of vomiting in patients with treatment regimens classed as HL 1-3 was 100% in acute phase and 91.7% in the delayed phase; nausea was reported by 27% in the acute phase and 31% in the delayed phase. The factors that contributed the most to the presence of vomiting and nausea were the emetogenic potential of the treatment regimen (p<0.05), vomiting in the previous cycle (p<0.05) and age younger than 50 years (p<0.002).
DiscussionThe proposed antiemetic protocol is effective for controlling vomiting in chemotherapy regimens with an HL of 1-3. For highly emetogenic regimens, the antiemetic protocol is also effective, but protection is not complete. This protocol seems less effective for controlling nausea, although this is a subjective symptom which is difficult to assess and not routinely measured in clinical trials.
Las náuseas y vómitos provocados por el tratamiento quimioterápico son 2 de los efectos secundarios que más preocupan y más malestar provocan en el paciente con cáncer. Se producen hasta en un 70–80% de los pacientes que reciben tratamiento de quimioterapia, teniendo una gran repercusión sobre la calidad de vida y obligando en algunos casos a posponer, cambiar o suspender los tratamientos, debido a la aparición de complicaciones como deshidratación, desequilibrio electrolítico, etc.1
Aunque las náuseas y vómitos con frecuencia se presentan al mismo tiempo, no siempre van asociadas. Las náuseas hacen referencia a una sensación desagradable en la parte posterior de la garganta y en el estómago que pueden ocasionar vómitos. Los vómitos son contracciones fuertes de los músculos del estómago que hacen que el contenido del estómago ascienda y salga por la boca, pudiendo estar las náuseas o no presentes.
De manera convencional se distinguen varios tipos de emesis inducida por quimioterapia: emesis aguda (EA), náuseas y vómitos aparecidos en las primeras 24h tras ser administrada la quimioterapia; emesis retardada (ER), náuseas y vómitos acaecidos tras ese periodo de tiempo, en los siguientes 6–7 días tras la administración del tratamiento; emesis anticipatoria, náuseas y vómitos antes de recibir la quimioterapia en pacientes que ya han recibido, al menos, un ciclo previo de tratamiento2.
No todos los citostáticos poseen el mismo potencial emetógeno. Tanto es así que en ausencia de profilaxis antiemética, más del 90% de los pacientes que reciben cisplatino desarrollarán náuseas y vómitos 1 o 2h después de recibir quimioterapia, con la aparición de un segundo pico de 48 a 72h después. Otros agentes diferentes al cisplatino, como ciclofosfamida, carboplatino y antraciclinas también pueden causar ER3–5.
El riesgo de desarrollar náuseas y vómitos tras quimioterapia depende de varios factores. Entre ellos, se encuentran el sexo, edad, dosis de citostáticos, número de ciclos recibidos o historial de consumo de alcohol. Pero de todos los factores predictivos conocidos es el potencial emetógeno del esquema de quimioterapia a administrar el que debería considerarse como el factor principal de riesgo a la hora de instaurar tratamiento antiemético6.
El objetivo del tratamiento de las náuseas y vómitos inducidos por la quimioterapia es, sin duda, la eliminación completa de estos, siendo a menudo difícil de conseguir. El objetivo final es lograr la mayor mejora posible de la calidad de vida del paciente7.
Para valorar los episodios eméticos se utilizan diferentes criterios de respuesta. Los últimos ensayos clínicos realizados utilizan el término respuesta completa para la ausencia de episodios eméticos y la no utilización de tratamiento de rescate, protección completa cuando además no existen náuseas significativas y control total cuando no hay episodios eméticos ni náuseas y además no se utiliza medicación de rescate8.
La mejor estrategia para el tratamiento de los vómitos es su prevención. Esta debe comenzar con el primer ciclo de quimioterapia, ya que, una vez que aparece el vómito, resulta más difícil de controlar. Su tratamiento eficaz reduce no solo la morbilidad para el paciente, sino también las posibles complicaciones médicas que se puedan derivar de los vómitos repetidos. También se puede evitar un abandono prematuro del tratamiento.
Aunque la incorporación de nuevos fármacos en la última década ha modificado de forma radical la prevención de náuseas y vómitos, en muchos casos sigue siendo un problema sin resolver e incluso subestimado por los distintos profesionales que tratan a estos pacientes. No obstante, suelen ser las náuseas y vómitos por quimioterapia, junto con la muerte, lo que causa más preocupación a los pacientes, no habiéndose producido cambios en la percepción de estos eventos pese a la incorporación de fármacos altamente efectivos9,10.
Hay que tener en cuenta que aproximadamente 1 de cada 3 pacientes sometidos a quimioterapia sigue presentando vómitos en algún momento del tratamiento a pesar de los avances producidos en la última década11. Diversos autores han demostrado el efecto sinérgico de la asociación de los antagonistas 5-HT3 y los corticoides, tanto frente a vómitos como a náuseas en fase aguda inducidos por quimioterapia tanto alta como moderadamente emetógena. La protección completa obtenida con esta pauta se sitúa en torno al 70–90%. Los resultados obtenidos frente a la fase retardada son sensiblemente peores, demostrándose el escaso valor de los 5-HT3 en quimioterapia altamente emetógena (20–22%). Con esquemas de quimioterapia moderadamente emetógena y utilizando como tratamiento corticoide más metoclopramida o antiserotoninérgico, se consigue una protección en fase retardada de alrededor del 50%12,13.
La finalidad de este trabajo es analizar de forma prospectiva la efectividad de un protocolo antiemético implantado en pacientes que reciben quimioterapia.
MétodoSe realizó una revisión bibliográfica y se analizaron las recomendaciones de diferentes guías de práctica clínica disponibles en ese momento: Sociedad Americana de Oncología Clínica (ASCO)3, National Comprehensive Cancer Network (NCCN)4 y Sociedad Norteamericana de Farmacia Hospitalaria (ASHP)5.
Se calculó el potencial emetógeno de todos los esquemas de quimioterapia utilizando la clasificación propuesta por Hesketh14,15, que estima la frecuencia de emesis expresada en porcentaje cuando no se aplica profilaxis y categoriza los citostáticos en 5 grupos según su potencial emetógeno. Para combinaciones de fármacos establece que aquellos de nivel Hesketh (NH) 1 no contribuyen a la emetogenicidad de un régimen, la adición de uno o más fármacos de NH 2 incrementan la emetogenicidad de la combinación en un grado superior al fármaco más emetógeno de la combinación y la adición de fármacos de NH 3 o 4 incrementan la emetogenicidad de la combinación en un nivel por cada fármaco.
Como se recoge en las guías de práctica clínica consultadas, el esquema que se siguió para la decisión del tratamiento antiemético fue el siguiente:
- •
NH 1: no necesita prevención ni en la fase aguda ni en la retardada. Si no se controla pasaría a tratarse con el tratamiento propuesto para NH 2 en fase aguda y retardada respectivamente.
- •
NH 2: dexametasona 8–20mg intravenoso (i.v.) en la fase aguda y nada en la retardada. Si no se controla pasaría a tratarse con el tratamiento propuesto para NH 3 en fase aguda y retardada respectivamente.
- •
NH 3: dexametasona 8–20mg i.v. y ondansetron 8mg i.v. en la fase aguda y dexametasona 4–8mg cada 12h vía oral (v.o.) durante 2 días. Si no se controla pasaría a tratarse con el tratamiento propuesto para NH 4 en fase aguda y retardada respectivamente.
- •
NH 4/5: dexametasona 8–20mg i.v. y ondansetron 8mg i.v. en la fase aguda y dexametasona 4–8mg cada 12h v.o. durante 3–4 días. En regímenes altamente emetógenos basados en platino se adicionará también ondansetron 8mg cada 12h v.o. durante 3 días para controlar la fase retardada.
Como tratamiento de rescate tras fracaso terapéutico se propuso metoclopramida 10–20mg cada 6h v.o. o i.v. y, si no remitían, haloperidol 0,5–2mg cada 8–12h v.o. o subcutánea. Para el control de la emesis anticipatoria se propuso tratamiento con una benzodiazepina de acción corta como lorazepam.
En las tablas 1–3 se presenta la propuesta de optimización realizada según la localización anatómica del tumor, aceptada por parte de los clínicos en el 100% de los protocolos.
Propuesta de optimización del tratamiento antiemético en cáncer gastrointestinal
| Cáncer gastrointestinal | |||||
| Esquema TTO | Nivel Hesketh | TTO emesis aguda | TTO emesis retardada | ||
| Actual | Propuesta | Actual | Propuesta | ||
| Gemcitabina 1.250mg/m2d 1 y 8 cada 21d | |||||
| 5-FU 225mg/m2/d inf. continua 6 sem | 2 | No precisa | |||
| 5-FU 425mg/m2d 1-5 cada 21d (Clínica Mayo) | |||||
| Capecitabina 1.250mg/m2/12h×14d | |||||
| Irinotecan 150mg/m2+5-FU 400mg/m2d 1 seguido de 5-FU 2.400mg/m2 inf. 48h cada 14d (FOLFIRI modificado) | 4 | DXM 10–20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./12–8h×2 d | DXM 4–8mg v.o./12h×3–4 d comenzando tras 24h de la QT | |
| Cetuximab 400mg/m21.a dosis y seguir con 250mg/m2 semanal+FOLFIRI modificado | |||||
| Oxaliplatino 85mg/m2+5-FU 400mg/m2d 1 seguido de 5-FU 2400mg/m2 inf. 48h cada 14d (FOLFOX 4 modificado) | 5 | DXM 10–20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3 d | DXM 4–8mg v.o./12h×3–4 d comenzando tras 24h de la QT | |
| Oxaliplatino 85mg/m2d 1+capecitabina 850mg/m2/12h×14d cada 21d (xelox) | |||||
| Cisplatino 75mg/m2d 1+5-FU 1.000mg/m2/d inf. continua 96h cada 28 d (esquema Al Sarraf) | DXM 20mg i.v.+ondansetron 8mg i.v. | ||||
| Epirubicina 50mg/m2+cisplatino 60mg/m2+5-FU 200mg/m2/d inf. continua 21d, cada 21d | DXM 4–8mg v.o./12h×3–4d+ondansetron 8mg/12h×3d v.o. | ||||
DXM: dexametasona; inf.: infusión; QT: quimioterapia; TTO: tratamiento
Propuesta de optimización del tratamiento antiemético en cáncer de mama
| Cáncer de mama | |||||
| Esquema TTO | Nivel Hesketh | TTO emesis aguda | TTO emesis retardada | ||
| Actual | Propuesta | Actual | Propuesta | ||
| Trastuzumab 8mg/kg (dosis carga) y seguir con 6mg/kg cada 21d | 1 | No precisa | No precisa | ||
| Trastuzumab 4mg/kg (dosis carga) y seguir con 2mg/kg/semana | |||||
| Vinorelbina 30mg/m2d 1 y 8 cada 21d | |||||
| Vinorelbina 30mg/m2d 1 y 8 cada 21d+Trastuzumab 4mg/kg (dosis carga) y seguir con 2mg/kg/semana | |||||
| Gemcitabina 1.000mg/m2d 1 y 8 cada 21d | 2 | No precisa | |||
| Docetaxel 35mg/m2d 1 cada semana | Ondansetron 8mg i.v. | DXM 10–20mg i.v. | No precisa | ||
| Docetaxel 100mg/m2d 1 cada 21d | DXM 8mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o./12h×2 días | No precisa | ||
| Paclitaxel 80mg/m2d 1 cada semana | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o./12h×2 días | No precisa | ||
| Paclitaxel 175mg/m2d 1 cada 21d | Ondansetron 8mg i.v. | No precisa | |||
| Trastuzumab 8mg/kg (dosis carga) y seguir con 6mg/kg+docetaxel 100mg/m2d 1 cada 21d | DXM 8mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./12h×2 días | |||
| Trastuzumab 4mg/kg (dosis carga) y seguir con 2mg/kg+Paclitaxel 80mg/m2d 1 cada semana | Ondansetron 8mg i.v. | No precisa | |||
| Doxorubicina liposom 50mg/m2 cada 28d | |||||
| Epirubicina 100mg/m2 cada 21d×3 ciclos seguido de paclitaxel 225mg/m2 cada 21d×3 (NH 3 los 3 primeros ciclos) | |||||
| Doxorubicina liposomal 50mg/m2d 1 cada 21d | 3 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3 días | DXM 4–8mg v.o./12h×2 días comenzando tras 24h de la QT | |
| Docetaxel 75mg/m2d 1+ capecitabina 1250mg/m2/12h×14d cada 21d | |||||
| Doxorubicina 60mg/m2d 1+ciclofosfamida 600mg/m2d 1 cada 21d×4 ciclos seguido de paclitaxel 175mg/m2 cada 21d×4 (NH 4 los 4 primeros ciclos) | |||||
| Epirubicina 100mg/m2d 1+ciclofosfamida 600mg/m2d 1 cada 21d | 4 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT | |
| Ciclofosfamida 600mg/m2d 1+metotrexato 40mg/m2d 1 y 8+5-FU 600mg/m2d 1 y 8 cada 28d | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | DXM 4–8mg v.o./12h×3–4d comenzando tras 24h de la QT | |||
| Doxorubicina 60mg/m2d 1+docetaxel 60mg/m2d 1 cada 21d | 4 | DXM 20mg i.v.+ondansetron 8 mg.i.v. | |||
| Epirubicina 75mg/m2d 1+docetaxel 75mg/m2d 1 cada 21d | |||||
| Doxorubicina 60mg/m2+paclitaxel 175mg/m2 cada 21d | Ondansetron 8mg v.o./12h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT | |||
| Epirubicina 90mg/m2+paclitaxel 175mg/m2 cada 21d | |||||
| 5-FU 500mg/m2+doxorubicina 50mg/m2+ciclofosfamida 500mg/m2 cada 21d | 5 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT | |
| 5-FU 600mg/m2+epirubicina 90mg/m2+ciclofosfamida 600mg/m2 cada 21d | Ondansetron 8mg i.v. | DXM 10mg i.v.+ondansetron 8mg i.v. | |||
| Trastuzumab 4mg/kg (dosis carga) y seguir con 2mg/kg semanal+paclitaxel 80mg/m2d 1, 8 y 15+carboplatino AUC 2d 1, 8 y 15 cada 21d | |||||
Propuesta de optimización del tratamiento antiemético en cáncer de pulmón
| Cáncer de pulmón | |||||
| Esquema TTO | Nivel Hesketh | TTO emesis aguda | TTO emesis retardada | ||
| Actual | Propuesta | Actual | Propuesta | ||
| Gemcitabina 1.000mg/m2d 1 y 8+vinorelbina 25mg/m2d 1 y 8 cada 21d | 2 | DXM 8mg i.v.+ondansetron 8mg i.v. | DXM10–20mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×2d | No precisa |
| Gemcitabina 2.500mg/m2+irinotecan 150mg/m2 cada 15d | 5 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT | |
| Docetaxel 75mg/m2+carboplatino AUC=5 cada 21d | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg i.v.+DXM 8mg/12h día anterior | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | |
| Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | |||||
| Docetaxel 75mg/m2+cisplatino 75mg/m2 cada 21d | |||||
| Paclitaxel 175mg/m2+carboplatino AUC=5 cada 21d | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3 días | ||
| Paclitaxel 80mg/m2+carboplatino AUC=2 cada 7d | DXM 10 MG i.v. en 1.a adm y después 4mg | DXM 10mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | |
| Paclitaxel 175mg/m2+cisplatino 80mg/m2 cada 21d | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | ||
| Carboplatino AUC=6d 1+etoposido 100mg/m2d 1–3 cada 21d | 2 días 2 y 3 | DXM 4mg i.v.+ondansetron 8mg i.v. | DXM 20mg i.v. | No precisa | |
| 5 día 1 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./12h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3 días | ||
| Cisplatino 80mg/m2d 1+etoposido 100mg/m2d 1–3 cada 21d | 2 días 2 y 3 | DXM 4mg i.v.+ondansetron 8mg i.v. | DXM 20mg i.v. | No precisa | |
| 5 día 1 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./12h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | ||
| Gemcitabina 1.000mg/m2d 1 y 8+carboplatino AUC=5 cada 21d | 2 día 8 | Ondansetron 8mg i.v. | DXM 20mg i.v. | No precisa | |
| 5 día 1 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./12h×2d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | ||
| Gemcitabina 1.250mg/m2d 1 y 8+cisplatino 100mg/m2 cada 21d | 2 día 8 | Ondansetron 8mg i.v. | DXM 20mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | no precisa |
| 5 día 1 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | ||
| Cisplatino 100mg/m2d 1+vinorelbina 30mg/m2d 1, 8 y 15 cada 21d | 1 días 8 y 15 | Ondansetron 8mg i.v. | No precisa | No precisa | |
| 5 día 1 | DXM 20mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | ||
| Vinorelbina 25mg/m2d 1 y 8+carboplatino AUC=5 cada 21d | 1 día 8 | Ondansetron 8mg i.v. | No precisa | No precisa | |
| 5 día 1 | DXM 8mg i.v.+ondansetron 8mg i.v. | Ondansetron 8mg v.o. a las 4 y 8h de la QT y después 8mg v.o./8h×3d | DXM 4–8mg v.o./12h×3–4 días comenzando tras 24h de la QT+ondansetron 8mg/12h×3d | ||
DXM: dexametasona; QT: quimioterapia; TTO: tratamiento
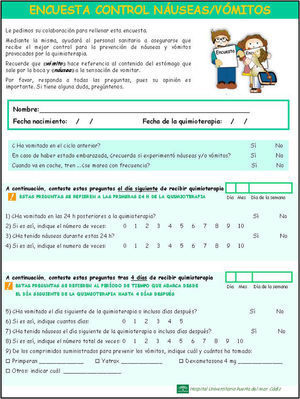
Una vez puesto en marcha el protocolo antiemético, el servicio de farmacia diseñó una encuesta, previamente aprobada en la comisión de farmacia y terapéutica, para evaluar la efectividad del mismo (fig. 1).
Se realizó un estudio prospectivo donde se incluyeron pacientes con tumores sólidos que recibían tratamiento quimioterápico en Hospital de Día de Oncología durante el período comprendido entre enero de 2006 y enero de 2007. Los criterios de inclusión fueron pacientes con diagnóstico histopatológico de cáncer en cualquier estadío, en tratamiento quimioterápico i.v., que hubieran recibido al menos un ciclo y capacitados para otorgar su consentimiento informado para participar en este estudio. Se excluyeron pacientes menores de 18 años o que recibieran como tratamiento i.v. concomitante otra terapia no antineoplásica.
Las variables independientes recogidas de la historia clínica y de la encuesta, fueron las siguientes: datos demográficos, predisposición a sufrir vómitos y/o náuseas (vómitos en ciclo anterior, historial de vómitos en embarazo y cinetosis), localización anatómica tumoral, esquemas de tratamiento quimioterápicos recibidos, cumplimiento del protocolo antiemético y potencial emetógeno del esquema de tratamiento recibido. Como variables dependientes se recogieron la presencia de vómitos y náuseas en fase aguda y retardada.
El personal de hospital de día de Oncología fue el encargado de incluir a los pacientes en este estudio, de forma aleatoria, explicándoles el motivo de la encuesta así como las instrucciones necesarias para su cumplimentación. El paciente rellenaba la encuesta en su domicilio y la devolvía en el siguiente ciclo. En ella, el paciente debía señalar diariamente para los días 1–5 si había tenido vómitos y/o naúseas y el número de veces o días que persistió, así como la necesidad de medicación de rescate.
El análisis estadístico de los datos se realizó con el programa SPSS® versión 14.0. Para la estadística descriptiva se realizó una distribución de frecuencias de las variables categóricas del estudio, así como de medidas de tendencia central y de dispersión para las variables cuantitativas. En el análisis bivariante, para cada variable categórica de interés se determinó la existencia de asociación entre la respectiva variable independiente y las 4 variables dependientes de estudio, mediante la prueba de significación estadística chi-cuadrado de Mantel-Haenszel. La magnitud de la asociación se calculó a través de la odds ratio (OR), valorándose la precisión de la estimación mediante IC del 95%. En el análisis multivariante, para investigar el efecto simultáneo de las variables independientes, así como comparar diferentes grupos, se utilizó la técnica de regresión logística. El criterio estadístico de aceptación de variables en el modelo fue el de significación estadística p<0,05 y el de salida p>0,10. Para la selección de las variables predictoras se utilizó el método Forward-Wald.
ResultadosEn el periodo del estudio se administró quimioterapia intravenosa a 554 pacientes. Fueron cumplimentadas un total de 172 encuestas, no contabilizándose el número total de encuestas entregadas. La distribución por sexo fue de 139 mujeres y 33 hombres con una mediana de edad de 55 años (rango 49, 31–80). En la tabla 4 se muestran las características de los pacientes.
Características de los pacientes
| Pacientes (%) | N.° pacientes (n=172) | |
| Sexo | ||
| Mujeres | 80,8 | 139 |
| Hombres | 19,2 | 33 |
| Edad | ||
| ≤50 años | 34,9 | 60 |
| >50 años | 65,1 | 112 |
| Factores predisponentes | ||
| Cinetosis | 14 | 24 |
| Emesis gravídica | 25 | 43 |
| Emesis ciclo anterior | 22,7 | 39 |
| Diagnóstico | 129 | |
| Cáncer mama | 75 | 14 |
| Cáncer gastrointestinal | 8,1 | 9 |
| Cáncer pulmón | 5,2 | 20 |
| Otros | 11,6 | |
| Nivel Hesketh | ||
| 1 | 3,5 | 6 |
| 2 | 17,4 | 30 |
| 3 | 7 | 12 |
| 4 | 43,6 | 75 |
| 5 | 28,5 | 49 |
| Cumplimiento del protocolo | ||
| Sí | 84,9 | 146 |
| No | 15,1 | 26 |
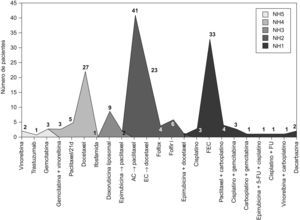
El 72% de los esquemas quimioterápicos administrados fueron altamente emetógenos (NH 4–5) mientras que el 28% restante fueron clasificados como bajo-moderadamente emetógeno (NH 1–3). En la figura 2 se muestran los esquemas utilizados y el NH asignado a cada uno de ellos.
En las tablas 5–7 se reflejan los resultados obtenidos para vómitos y náuseas en la fase aguda y retardada así como el grado de significación estadística alcanzado para cada variable independiente (análisis bivariante).
Episodios eméticos en fase aguda y retardada por subgrupos de pacientes
| Fase aguda | Fase retardada | |||
| % (n) | % (n) | |||
| Vómitos | Náuseas | Vómitos | Náuseas | |
| Sexo | ||||
| Mujeres | 15,1% (21) | 45,3% (63) | 18% (25) | 54% (75) |
| Hombres | 6,1% (2) | 21,2% (7) | 12,1% (4) | 18,2% (6) |
| Edad | ||||
| ≤50 años | 10% (6) | 56,7% (34) | 21,7% (13) | 60% (36) |
| >50 años | 15,2% (17) | 32,1% (36) | 14,3% (16) | 42,2% (45) |
| Factores predisponentes | ||||
| Cinetosis | 29,2% (7) | 62,5% (15) | 25% (6) | 58,3% (14) |
| Emesis gravídica | 23,3% (10) | 55,8% (24) | 23,3% (10) | 67,4% (29) |
| Emesis ciclo anterior | 46,2% (18) | 66,7% (26) | 53,8% (21) | 76,9% (30) |
| Nivel Hesketh | ||||
| 1 | – | – | – | – |
| 2 | – | 30% (9) | 6,7% (2) | 36,7% (11) |
| 3 | – | 33,3% (4) | 16,7% (2) | 33,3% (4) |
| 4 | 18,7% (14) | 49,3% (37) | 20% (15) | 54,7% (41) |
| 5 | 18,4% (9) | 40,8% (20) | 20,4% (10) | 51% (25) |
| Cumplimiento del protocolo | ||||
| Sí | 0,7% (1) | 41,8% (61) | 17,1% (25) | 48,6% (71) |
| No | 19,2% (5) | 34,6% (9) | 15,4% (4) | 38,5% (10) |
Emesis en fase aguda. Análisis bivariante
| Vómitos | Náuseas | |||
| OR (IC95%) | p | OR (IC95%) | p | |
| Sexo | ||||
| Hombres/Mujeres | 2,7 (0,6–12,4) | 0,17 | 3,1(1,2–7,6) | 0,011 |
| Edad | ||||
| ≤50/>50 | 1,6 (0,6–4,3) | 0,342 | 0,4 (0,2–0,7) | 0,002 |
| Factores predisponentes | ||||
| Cinetosis | 3,4 (1,2–9,4) | 0,014 | 2,8 (1,2–6,9) | 0,019 |
| Emesis gravídica | 2,7 (1,1–6,7) | 0,028 | 2,3 (1,1–4,6) | 0,02 |
| Emesis ciclo anterior | 21,9 (7,3–65,5) | 0,000 | 4 (1,9–8,6) | 0,000 |
| Nivel Hesketh | ||||
| 1-3/4-5 | 10,4 (1,4–79,9) | 0,006 | 2,3 (1,1–4,7) | 0,024 |
| Cumplimiento del protocolo | ||||
| No/Sí | 0,6 (0,2–1,7) | 0,341 | 1,4 (0,6–3,2) | 0,493 |
Emesis en fase retardada. Análisis bivariante
| Vómitos | Náuseas | |||
| OR (IC95%) | p | OR (IC95%) | p | |
| Sexo | ||||
| Hombres/Mujeres | 1,6 (0,5–4,9) | 0,4 | 5,3 (2–13,6) | 0,000 |
| Edad | ||||
| ≤50/>50 | 0,6 (0,3–1,3) | 0,2 | 0,4 (0,2–0,8) | 0,01 |
| Factores predisponentes | ||||
| Cinetosis | 1,8 (0,6–5) | 0,2 | 1,7 (0,7–4) | 0,2 |
| Emesis gravídica | 1,7 (0,7–4,1) | 0,2 | 3,1 (1,5–6,3) | 0,002 |
| Emesis ciclo anterior | 18,2 (7–47,2) | 0,000 | 5,3 (2,3–12,2) | 0,000 |
| Nivel Hesketh | ||||
| 1−3/4−5 | 2,8 (0,9–8,4) | 0,06 | 2,5 (1,2–5) | 0,01 |
| Cumplimiento del protocolo | ||||
| No/Sí | 1,1 (0,4–3,6) | 0,8 | 1,5 (0,6–3,5) | 0,3 |
De forma global podemos decir que con el protocolo antiemético implantado, un 13,4% vomitaron en la fase aguda y 16,9% en la retardada, con una mediana en el número de veces de 2 (1–8) y 1 (1–5) respectivamente. La incidencia de náuseas fue de 40,7% en fase aguda y 47,1% en la retardada, con una mediana en el número de veces de 4 (1–10). Asimismo, de los pacientes que vomitaron en la fase retardada, 17 habían sufrido vómitos también en la fase aguda (89,5%).
Observamos relación entre potencial emetógeno del esquema quimioterápico y probabilidad de emesis tanto en fase aguda como en retardada. La probabilidad de EA en esquemas altamente emetógenos es 10,4 veces mayor (Intervalo de confianza [IC]95%, 1,4–79,9, p=0,006) que en bajo-moderadamente emetógenos. En la fase retardada también existe asociación entre nivel emetógeno del esquema de quimioterapia y presencia de vómitos y náuseas, OR 2,8 (IC95%, 0,9–8,4, p=0,06) y 2,5 (IC95%, 1,2–5, p=0,01) respectivamente.
El 15% de los pacientes no cumplieron el protocolo antiemético prescrito, vomitando un 26,9% (7/26) de ellos, dos pacientes tanto en la fase aguda como en la retardada, 3 solo en la aguda y 2 solo en la retardada, aunque no alcanzó significación estadística en el análisis bivariante.
Setenta y cuatro pacientes habían tenido uno o varios de los factores predisponentes para presentar emesis posquimioterapia (vómitos en ciclo anterior, historial de cinetosis o gravídica). El haber vomitado en el ciclo anterior constituyó el factor predictivo más importante, y el único que alcanzó significación estadística, ya que el 78% de los pacientes que vomitaron en la fase aguda y el 72,4% en la fase retardada lo habían hecho también en el ciclo anterior. En el resto de pacientes (98/172), una baja proporción presentaron vómitos (5/98), casi todas mujeres jóvenes y con esquemas de tratamiento altamente emetógenos.
En la tabla 8 se presentan los resultados obtenidos en el análisis multivariante donde se observa que el potencial emetógeno del esquema de quimioterapia a administrar, junto con haber vomitado en el ciclo anterior, son los dos factores que más contribuyen a la presencia de vómitos y náuseas en fase aguda (p<0,05). También la edad de los pacientes, el ser menor de 50 años, constituyó un factor predictivo negativo para la presencia de náuseas en fase aguda con una OR 3,1 (IC95% 1,5–6,2, p=0,002). En la fase retardada, el haber vomitado en el ciclo anterior estuvo asociado con significación estadística tanto para la presencia de vómitos como de náuseas, y el potencial emetógeno del esquema sólo para las náuseas.
Modelo de regresión logística (análisis multivariante)
| Coeficiente | p | OR (IC95%) | |
| Vómitos en fase aguda | |||
| Emesis en ciclo anterior | 2,992 | 0,000 | 19,9 (6,5–60,7) |
| Nivel Hesketh | |||
| 1−3/4−5 | 2,102 | 0,052 | 8,2 (1–68,4) |
| Náuseas en fase aguda | |||
| Edad | |||
| ≤50/>50 | 1,121 | 0,002 | 3,1 (1,5–6,2) |
| Nivel Hesketh | |||
| 1-3/4-5 | 0,812 | 0,043 | 2,3 (1–5) |
| Emesis en ciclo anterior | 1,269 | 0,002 | 3,6 (1,6–7,9) |
| Vómitos en fase retardada | |||
| Emesis en ciclo anterior | 2,903 | 0,000 | 18,2 (7–47,3) |
| Náuseas en fase retardada | |||
| Nivel Hesketh | |||
| 1−3/4−5 | 0,759 | 0,049 | 2,1 (1–4,6) |
| Emesis en ciclo anterior | 1,698 | 0,000 | 5,5 (2,3–13,1) |
Por otro lado, aproximadamente la mitad de pacientes que recibieron esquemas de quimioterapia altamente emetógenos, NH 4–5, presentaron náuseas tanto en la fase aguda como en la retardada.
El control de los vómitos en pacientes con esquemas de tratamiento bajo-moderadamente emetógenos fue total en la fase aguda y de un 91,7% en la retardada, mientras que un 27% tuvieron náuseas en la fase aguda y 31% en la retardada.
DiscusiónLa elección del régimen antiemético más apropiado se basa fundamentalmente en el potencial emetógeno del esquema que se va a administrar, aunque los factores de riesgo individuales de cada paciente pueden dar lugar a variaciones en las dosis o incluso en la elección del fármaco. Entre estos factores se encuentran: edad, sexo, estrés, depresión y consumo de alcohol. En especial, los pacientes más jóvenes (<50 años), de sexo femenino, con bajo consumo de alcohol (<100g/día) y que presentan un historial de vómitos en el embarazo o por movimiento (cinetosis) tienen más tendencia a presentar vómitos16. Pero el factor pronóstico más importante es el haber presentado náuseas y vómitos en ciclos anteriores17. Esto mismo hemos constatado en nuestro estudio, excepto en pacientes jóvenes (<50 años) donde observamos menor incidencia de vómitos en fase aguda. Aunque la incidencia de EA y retardada fue mayor en mujeres que en hombres, esta diferencia no fue estadísticamente significativa. Probablemente esto sea debido a la falta de homogeneidad que existe con respecto a la proporción de pacientes mayores de 50 años y de sexo femenino, limitación que asumimos.
Existen publicados numerosos estudios que analizan los episodios eméticos postquimioterapia y son menos los que evalúan las náuseas, pero no todos presentan los resultados utilizando los criterios de respuesta estandarizados (respuesta completa, protección total y control total) que evalúan las náuseas mediante una escala visual analógica (EVA) o una escala descriptiva, dificultando todo esto la comparabilidad de los resultados8. Aunque la mayoría de los ensayos clínicos realizados suelen utilizar el término de respuesta completa que hace referencia a episodios eméticos y a necesidad de terapia de rescate, sin valorar la incidencia de náuseas, otros estudios definen criterios de respuesta propios como incidencia de episodios eméticos, respuesta mayor o respuesta menor. En estudios de ámbito nacional similares al nuestro, como el realizado en pacientes con tumores ginecológicos18 tratadas con quimioterapia se obtiene protección completa (ausencia de vómitos y náuseas) en fase aguda en el 87,3% de las pacientes con quimioterapia moderadamente emetógena sin cisplatino, descendiendo a 78,4% en aquellos regímenes que incluyen cisplatino como parte del esquema. Sin embargo, y como cabe esperar, los resultados alcanzados en fase retardada son algo menores ya que se obtiene protección completa en el 69,3% de los pacientes con quimioterapia moderadamente emetógena y en el 26,1% de los que reciben cisplatino. La comparabilidad de estos resultados con los nuestros es difícil, primero porque analizan datos globales de ciclos, y no respuestas individuales de pacientes, y segundo por la utilización de variables de respuesta diferentes a las nuestras. En nuestro estudio, ante la falta de valoración de la aparición de náuseas mediante la escala validada EVA u otra descriptiva, y el valor subjetivo de las mismas, hemos realizado un seguimiento por separado de los episodios eméticos y nauseosos tanto en fase aguda como en retardada, justificando así la ausencia de utilización de los criterios de respuesta estandarizados.
Otros estudios actuales muestran que la incidencia de náuseas y vómitos postquimioterapia en pacientes que reciben tratamiento antiemético considerado eficaz, es aún significativa en las primeras 24h, tanto en estudios observacionales basados en la vida real10,19 como en ensayos clínicos controlados20,21. Entre 13–32% de los pacientes experimentan emesis o necesidad de tratamiento de rescate durante la fase aguda y más del 35% presentan náuseas. La incidencia de náuseas y vómitos en la fase retardada en la práctica habitual en pacientes tratados con quimioterapia de emetogenicidad moderada a alta y profilaxis antiemética apropiada es del 52–60% para náuseas y del 28–50% para vómitos10,22. Estos datos no difieren mucho de los encontrados en nuestro estudio en la fase aguda, con el protocolo antiemético implantado, la incidencia de vómitos fue del 86,6% de los pacientes. Sin embargo, el control de los vómitos en la fase retardada fue mucho mejor en nuestro caso ya que sólo en el 17% de los pacientes hizo falta un tratamiento de rescate. Quizás esta diferencia radica en el bajo número de pacientes tratados con cisplatino, considerado como el fármaco patrón de mayor emetogenicidad, que cumplimentaron la encuesta, infravalorándose los vómitos en la fase retardada.
En el estudio observacional publicado por Grunberg et al10, con 298 pacientes incluidos, se pone de manifiesto que del 32% de los pacientes que sufren vómitos en la fase retardada y del 54% que sufren náuseas, el 23% y el 24% respectivamente ocurren en ausencia de náuseas y vómitos en la fase aguda. En nuestro estudio, de los 29 pacientes (16,9%) que vomitaron en la fase retardada, casi la mitad ocurrían en ausencia de vómitos en la fase aguda (12/29).
Otro estudio prospectivo observacional23 publicado en el año 2008 en el que se incluyen 102 pacientes que reciben tratamiento antiemético considerado eficaz, determinó la incidencia de náuseas y vómitos por quimioterapia en la práctica habitual. El 15,7% de los pacientes vomitan en la fase aguda del primer ciclo y el 14,7% lo hacen en la fase retardada. Sin embargo, la incidencia de náuseas es mayor, 37,3 y 47,1% respectivamente, incrementándose en ciclos posteriores. Estos resultados demuestran que mientras los vómitos son bien controlados, no ocurre lo mismo con las náuseas. De nuevo hemos de insistir en la similitud de nuestros datos con los publicados en este estudio, ya que en el 40,7% y el 47,1% de los pacientes, fase aguda y retardada respectivamente, no logramos controlar las náuseas.
El cisplatino es el fármaco considerado de mayor emetogenicidad por todas las guías de práctica clínica y es capaz de originar un cuadro emético bifásico, compuesto por una fase de EA y otra de ER. Cuando se utiliza en dosis bajas (40–60mg/m2), la ER inducida por cisplatino es poco frecuente, al contrario de lo que ocurre cuando las dosis superan los 100–120mg/m2. En dos ensayos clínicos multicéntricos que suman más de 1.000 pacientes que reciben cisplatino (dosis ≥70mg/m2) y profilaxis basada en antagonistas de los receptores de 5-HT3 y dexametasona, entre 44–53% de los pacientes experimentan emesis o necesidad de tratamiento de rescate durante la fase retardada20,21. En nuestro estudio, 3 pacientes recibieron cisplatino en monoterapia, 40mg/m2 uno y 100mg/m2 los dos restantes. No vomitaron ni en la fase aguda ni en la retardada, aunque sí presentaron náuseas, que se hicieron más patentes en la fase retardada. Por otro lado, 5 pacientes recibieron cisplatino combinado con otros agentes citotóxicos. De ellos, 2 vomitaron tanto en la fase aguda como en la retardada coincidiendo con los esquemas que contenían cisplatino a dosis más altas (100mg/m2). Debido al bajo número de pacientes tratados con cisplatino que cumplimentaron la encuesta (8/172), es difícil sacar conclusiones con respecto a la incidencia real de vómitos en estos pacientes o efectividad de nuestro protocolo, ni podemos establecer comparaciones con los encontrados en la literatura.
Los receptores de serotonina del tipo S-3 (5-HT3) son considerados como los mediadores más importantes de la emesis posquimioterapia. No obstante, otros receptores, como los dopaminérgicos D-2, los endorfinérgicos, los muscarínico-colinérgicos y otros, también podrían jugar un papel en la transmisión de los estímulos aferentes nerviosos del arco reflejo emético. Recientemente, se ha implicado también a la sustancia P/neurokinina 1 en la trasmisión de señales eméticas24. En guías de práctica clínica posteriores a nuestro estudio17, ya se establece como recomendación para la profilaxis antiemética de esquemas de quimioterapia altamente emetógenos que contengan cisplatino un nuevo fármaco, Aprepitant, con un mecanismo diferente, ya que actúa como antagonista de los receptores de neurokinina 1. En la fecha en la que se realizó este estudio todavía no se había solicitado este fármaco a la comisión de farmacia y terapéutica de nuestro hospital. En la actualidad se ha incluido como profilaxis antiemética en aquellos pacientes que reciben quimioterapia altamente emetógena con cisplatino o antraciclinas y que son refractarios al protocolo implantado en el hospital.
Si bien ya existen estudios sobre eficacia y seguridad de aprepitant13,21, no contamos en la actualidad con información concluyente acerca de cuáles deben ser las normas a seguir en pacientes con esquemas de quimioterapia basados en platino varios días o esquemas de quimioterapia más radioterapia.
Actualmente existe controversia sobre el papel de los antagonistas 5-HT3 en la prevención de la ER25. Los resultados de un metanálisis26 muestran una ligera disminución (4.6%) en la proporción absoluta de pacientes en los que se controla la ER con estos fármacos, con independencia del tratamiento antiemético recibido en los distintos ensayos clínicos que se analizan. De hecho, la Sociedad Americana de Oncología Clínica en su última guía de práctica clínica27 no recomienda la combinación de un antagonista 5-HT3 con dexametasona para la prevención de la ER tras quimioterapia altamente emetógena.
Sin embargo en nuestro hospital, se sigue utilizando la combinación de ambos fármacos para prevenir la ER en esquemas que contienen platino, posiblemente debido a que este tipo de emesis sigue siendo un problema que queda lejos de estar resuelto en la actualidad o incluso quizás por las restricciones de uso de aprepitant en la guía farmacoterapéutica, que condiciona su uso a aquellos pacientes en los que no existe control de la emesis con el protocolo antiemético propuesto.
Las náuseas y vómitos inducidos por la quimioterapia son efectos adversos que hoy día deberían controlarse completamente en la mayoría de los pacientes con cáncer. El objetivo debe ser prevenir su aparición más que tratar, con el fin de mejorar la calidad de vida, evitar complicaciones y facilitar el cumplimiento del tratamiento quimioterápico. A pesar de los importantes avances realizados en el control de la emesis inducida por la quimioterapia, los tratamientos antieméticos actuales no protegen a todos los pacientes de uno de los efectos adversos tradicionalmente más temido por el paciente oncológico, y es necesario optimizar al máximo los recursos disponibles para conseguir que ningún paciente en tratamiento quimioterápico presente náuseas ni vómitos.
Los resultados de nuestro estudio no son extrapolables por el bajo número de pacientes incluidos, pero demuestran la necesidad de seguir trabajando en la actualización de un protocolo antiemético para aumentar el control de náuseas y vómitos en todos los pacientes que reciben quimioterapia y preservar así la calidad de vida de estos pacientes.
FinanciaciónFinanciado por una beca del Fondo de Investigación Sanitaria del Instituto de Salud Carlos III (PI070797).
Este trabajo ha sido presentado parcialmente como comunicación breve (póster) al 51 Congreso de la Sociedad Española de Farmacéuticos de Hospitales (SEFH). Málaga, 28 de septiembre de 2006.