la optimización del tratamiento antirretroviral y, a medida que las personas que viven con el VIH envejecen, comprender las causas de la interrupción del tratamiento se vuelve fundamental. El objetivo del estudio fue determinar el cambio en las razones de la interrupción del tratamiento antirretroviral durante 12 años. Secundariamente, comparar la tasa anual de la interrupción del régimen antirretroviral y factores asociados.
Métodose realizó un análisis con datos de personas con infección VIH que recibían terapia antirretroviral y la interrumpieron por cualquier motivo. El estudio incluyó a personas con VIH que visitaron la consulta de atención farmacéutica desde enero de 2010 hasta diciembre de 2021. Se diferenciaron 2 periodos para el análisis: 2010–2015 y 2016–2021. Las razones para la interrupción siguieron la clasificación descrita por la cohorte suiza. En este estudio el término «interrupción» se empleó para cambios del tratamiento e interrupciones definitivas. Para analizar los factores asociados a la interrupción, se utilizaron métodos de Kaplan–Meier y modelos proporcionales de Cox.
ResultadosSe incluyeron 789 personas con infección por VIH, mayoritariamente hombres (81,5%). La principal razón de la interrupción fue decisión clínica (50,2%), seguida de efectos adversos (37,9%). Centrándonos en la decisión clínica, observamos un cambio de tendencia que pasó de la simplificación del régimen (56,1%) en la primera parte del periodo analizado a la optimización terapéutica (53,6%) en la segunda mitad. Además, los factores estadísticamente significativos asociados con la interrupción fueron: la edad mayor de50 años (HR 1,60; IC del 95% 1,25–2,04), régimen de un único comprimido/día posinterrupción (HR 1,49; IC del 95% 1,06–2,11) y clases de medicamentos antirretrovirales.
Conclusiónesen los últimos 12 años, ha habido un cambio en la principal causa de interrupción del tratamiento antirretroviral, siendo la optimización terapéutica la razón principal. Los regímenes basados en inhibidores de integrasa y las estrategias de regímenes de un único comprimido/día tenían menos probabilidad de ser interrumpidos que otras clases de medicamentos antirretrovirales, lo que permite un mejor manejo clínico debido al perfil de eficacia, especialmente en las personas que viven con VIH mayores de50 años con comorbilidades.
In the context of the advancement of antiretroviral therapy and, as the characteristics of people living with HIV progress toward an aging population, understanding the causes of treatment interruption becomes crucial. The aim of the study was to determine the change in reasons for antiretroviral treatment discontinuation for 12 years. Secondarily, compare annual antiretroviral regimen discontinuation rate and factors associated.
MethodsWe conducted an analysis using data from people living with HIV who were receiving antiretroviral therapy and discontinued it for any reason. The study included people with HIV infection who visited an outpatient hospital pharmacy clinic from January 2010 to December 2021. Two periods were differentiated for the analysis: 2010–2015 and 2016–2021. The reasons for antiretroviral treatment discontinuation followed classification described by Swiss cohort. In the context of this study, it is pertinent to note that the term ‘interruption’ will be consistently used in this article to refer to the act of switching or stopping antiretroviral treatment. To examine factors associated with antiretroviral therapy discontinuation, we utilized Kaplan–Meier methods and Cox proportional models.
ResultsWe included 789 people living with HIV, predominantly male (81,5%). The main reason for discontinuation was clinical decision (50.2%) followed by adverse effects (37.9%). Focusing on clinical decision, we observed a trend change that went from antiretroviral treatment simplification regimen (56.1%) in the first part of the period analyzed to the therapeutic optimization (53.6%) in the second half. Furthermore, factors that were statistically significantly associated with antiretroviral treatment discontinuation were people with HIV ≥50 years (HR 1.60; 95%CI 1.25–2.04), post-discontinuation single-tablet regimen (HR 1.49; 95%CI 1.06–2.11) and antiretroviral drug classes.
ConclusionsOver the 12 years there has been a change in the main cause of antiretroviral treatment discontinuation, currently therapeutic optimization being the main reason. Integrase inhibitors-based regimens and singletablet regimen strategies were less likely to be discontinued than others antiretroviral drug classes, allowing for better clinical management due to the efficacy profile, especially in people living with HIV ≥50 years with comorbidities.
El tratamiento antirretroviral (TAR) ha mejorado significativamente la esperanza de vida de las personas que viven con el VIH/sida (PVVS) al reducir las tasas de morbimortalidad1. El envejecimiento progresivo de las PVVS se traduce en un aumento de la polifarmacia, lo que posteriormente incrementa el riesgo de efectos adversos (EA), interacciones farmacológicas y prescripciones potencialmente inadecuadas2.
En la última década, han aparecido nuevos fármacos que ofrecen más eficacia, mejores perfiles de tolerabilidad y toxicidad, y con pautas posológicas y formulaciones más cómodas que los medicamentos tradicionales. Como resultado, las tasas de fracaso virológico observados con los TAR iniciales han disminuido significativamente en cohortes observacionales3,4. El principal motivo de la interrupción del tratamiento en el pasado fue la intolerancia y la toxicidad asociadas a los fármacos utilizados en los TAR5; sin embargo, la optimización del perfil de seguridad de nuevos fármacos ha permitido reducir los EA asociados.
Varios estudios han identificado como factores que contribuyen a la interrupción, los tratamientos complejos, varias tomas diarias, el tratamiento con un inhibidor de la proteasa (IP) o una carga vírica basal elevada6,7. Más allá de estos factores, se han producido avances y cambios significativos tanto en el ámbito clínico como en la atención farmacéutica. Por tanto, podemos decir que se ha producido un cambio hacia nuevas causas de interrupción derivadas de la optimización farmacoterapéutica. El concepto de farmacoterapia optimizada se centra en asegurar que cada persona reciba las alternativas farmacoterapéuticas más adecuadas para su situación clínica. La optimización farmacoterapéutica implica la simplificación de los tratamientos, como reemplazar la triterapia por la terapia dual o el cambio de tratamiento para evitar posibles interacciones con otros fármacos esenciales en la farmacoterapia del paciente8.
Sin embargo, la mayoría de los estudios que investigan las causas de la interrupción del tratamiento se realizaron antes de o durante la adopción generalizada de los tratamientos con inhibidores de la transferencia de la cadena de la integrasa (INSTI). Los ensayos controlados y aleatorizados que involucran tratamientos innovadores, compuestos principalmente por varios INSTI, han demostrado sistemáticamente una eficacia, tolerabilidad y facilidad de administración favorables9. Estos atributos impulsan la interrupción de un tratamiento en aras de una optimización farmacoterapéutica. Sin embargo, existen pocos estudios que comparen los regímenes de tratamiento más antiguos con los más modernos (basados predominantemente en INSTI), especialmente en lo que respecta a su durabilidad y a los motivos de interrupción del tratamiento10,11.
El objetivo principal de este estudio fue determinar los cambios en las razones por las que se produce interrupción de los TAR a lo largo de 12 años. En segundo lugar, comparamos la tasa anual de interrupción en los TAR y los factores asociados.
MétodosDiseño del estudio y participantesSe trata de un estudio observacional, prospectivo y unicéntrico. El análisis incluye a PVVS mayores de 18 años y tratadas con TAR que acudieron al servicio ambulatorio de farmacia del hospital desde enero de 2010 hasta diciembre de 2021. Aquellos pacientes que suspendieron el TAR por cualquier motivo fueron elegibles para el análisis.
La recogida de datos se realizó durante las visitas ambulatorias al servicio de farmacia hospitalaria en el momento en que el paciente interrumpía el TAR, tanto en la primera ocasión como en las posteriores. Se analizaron las siguientes variables: demográficas (edad, sexo); datos analíticos, carga vírica plasmática (copias/ml), recuento de células CD4 (células/μl); y variables clínicas relacionadas con comorbilidades y farmacoterapia, como tipo de TAR (antes/después de la interrupción), número de fármacos del régimen TAR, motivo de la interrupción, medicación concomitante, polifarmacia, patrones de polifarmacia, comorbilidades, patrones de polimorbilidad y puntuación en el índice de complejidad del tratamiento farmacéutico (ICTF). Solo se incluyeron en el análisis aquellos pacientes con un conjunto de datos completo.
Definición del criterio de valoraciónEl criterio de valoración se definió como la duración hasta la interrupción (ya sea por cambio o abandono) del TAR. En este estudio, es importante destacar que el término «interrupción» se utilizará sistemáticamente para referirse al acto de cambiar o de abandonar el tratamiento antirretroviral. Se caracterizó la modificación del tratamiento como cualquier alteración en al menos un fármaco antirretroviral dentro del régimen terapéutico, excluidos los ajustes de dosis. Se consideró abandono cuando se interrumpieron todos los fármacos del tratamiento durante un periodo mínimo de 30 días.
Los motivos de interrupción se clasificaron utilizando la clasificación descrita por la cohorte suiza, que contempla la interrupción por EA, fracaso virológico, decisión clínica (incluidas las interacciones o la optimización de la farmacoterapia), decisión del paciente (incluido el abandono voluntario o la falta de adherencia) y otros (incluido el embarazo)12.
Para averiguar si la causa de interrupción estaba asociada a la optimización del tratamiento, se realizó una subclasificación de la causa de interrupción asociada a la decisión clínica con las siguientes categorías: simplificación, optimización y cambio debido a la presencia de interacciones farmacológicas. La simplificación de los TAR se define como la reducción del número de fármacos que componen el régimen de tratamiento o el cambio a una combinación que ofrece la posibilidad de administrar un tratamiento completo en un solo comprimido y una toma diaria. La optimización de los TAR puede entenderse como un proceso dirigido a mejorar la eficacia a largo plazo, la adherencia, la tolerabilidad, la seguridad, la comodidad y la asequibilidad de TAR combinados.
El periodo de interrupción del TAR se clasificó en periodo corto plazo (menor de3 meses), medio plazo (entre 3 meses y un año) y largo plazo (mayor deun año), en función de la duración del TAR prescrito hasta la interrupción. Además, se llevó a cabo una comparación entre 2 periodos de tiempo distintos: un periodo inicial que abarcaba de 2010 a 2015, y otro posterior que abarcaba de 2016 a 2021. Para facilitar la comparación de los intervalos en el análisis temporal se realizó un corte temporal dividiendo el periodo de seguimiento en 2 intervalos de 6 años. Además, el segundo periodo (2016–2021) corresponde específicamente al marco temporal durante el que se incorporaron regímenes más recientes con INSTI y las pautas de comprimido único (PCU).
DefinicionesSe consideró como comorbilidad a toda enfermedad crónica que estuviera presente en el paciente al inicio o que apareciera durante el estudio. Junto con la presencia o ausencia de comorbilidades, se incluyó una variable sobre el tipo de comorbilidad. También se clasificaron los patrones de comorbilidad según el estudio publicado por De Francesco et al.13.
La polifarmacia se definió como el uso de 6 o más fármacos diferentes, incluida la medicación antirretroviral; la definición de polifarmacia mayor se restringió al uso mínimo de 11 fármacos diferentes. Para describir los patrones de polifarmacia, empleamos la categorización propuesta por Calderón-Larrañaga et al.14 que clasifica los patrones en función del tratamiento previsto para enfermedades específicas. Un paciente se clasificó bajo un patrón de polifarmacia concreto si tenía prescritos al menos 3 fármacos incluidos en dicho patrón.
El ICTF es una herramienta validada de 65 ítems que evalúa la complejidad del tratamiento, teniendo en cuenta factores como el número de medicamentos, la presentación de los mismos, las pautas posológicas y las instrucciones adicionales. La puntuación del índice oscila entre 1,5 (para personas que toman un solo comprimido o cápsula una vez al día) y un máximo indefinido, ya que la puntuación aumenta según aumenta el número de medicamentos. A mayor puntuación, mayor complejidad del tratamiento15. Además, siguiendo a Morillo-Verdugo et al.16, se utilizó un valor de corte de 11,25 para la puntuación del índice ICTF del paciente complejo.
Los TAR se clasificaron en función de sus clases de la siguiente manera: una combinación de 2 inhibidores de la transcriptasa inversa análogos de nucleósido (ITIAN) junto con un tercer agente, que podría ser un inhibidor de la transcriptasa inversa no análogo de nucleósidos (ITINN), un inhibidor de la proteasa (IP) o un INSTI. Los TAR que incorporan enfoques alternativos y no siguen los esquemas de triterapia mencionados anteriormente se incluyeron en una categoría más amplia denominada «otros». Los regímenes de TAR también se clasificaron en función del número de fármacos que componen cada pauta de tratamiento: triterapia, biterapia o monoterapia.
Análisis estadísticosLas características basales de los pacientes incluidos se expresaron, bien como números absolutos con porcentaje, o bien como mediana con amplitud intercuartílica (IQR). Se compararon los pacientes entre los periodos de 2010–2015 y 2016–2021, empleando la prueba de X2 o la prueba U de Mann–Whitney, dependiendo de lo que se considerara más apropiado.
En primer lugar, se evaluó la durabilidad del régimen TAR, que se definió como la interrupción (cambio o abandono) de la clase de fármaco antirretroviral. La durabilidad del TAR se analizó mediante el método de Kaplan–Meier para identificar los factores independientes asociados. Las diferencias entre subgrupos se evaluaron mediante la prueba de log-rank. Para identificar los factores asociados con la durabilidad del régimen TAR, se empleó un modelo multivariable de regresión de Cox. Se incluyeron en dicho análisis todas las variables asociadas a la interrupción en el análisis bivariante del modelo de Cox (p < 0,20). Se utilizó la estrategia «hacia atrás» (backward) para eliminar variables hasta llegar al modelo de Cox definitivo. Se notificaron los cocientes de riesgos (HR) con intervalos de confianza (IC) del 95% para evaluar la potencia y la asociación entre las variables, y se consideraron estadísticamente significativos valores de p < 0,05.
El análisis de datos se realizó con SPSS para MacOS versión 28,0 (SPSS, Chicago, IL, EE. UU.).
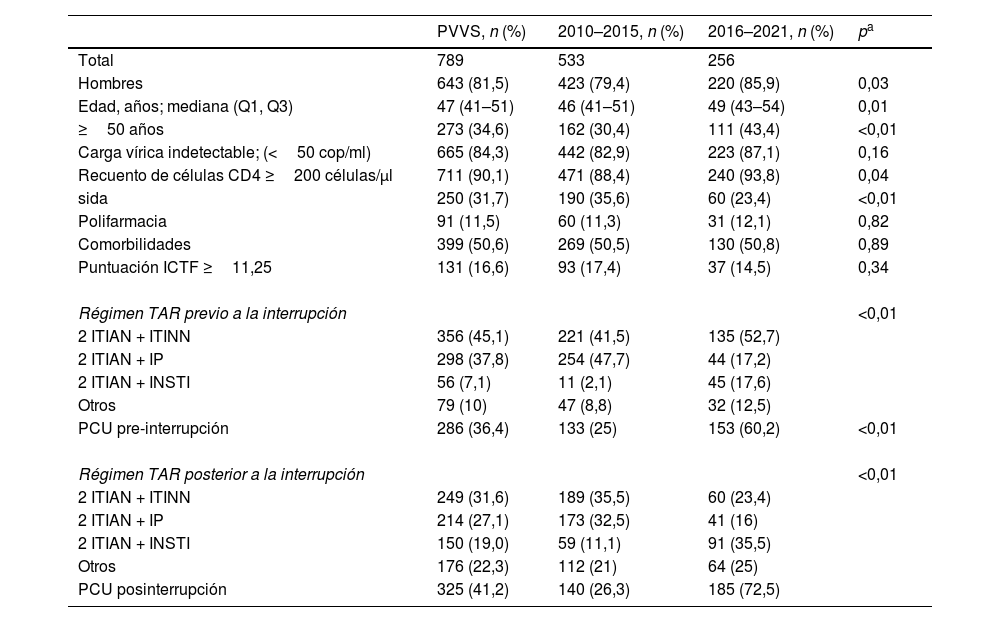
ResultadosUn total de 789 PVVS cumplieron los criterios de inclusión y fueron elegibles para los análisis en el periodo comprendido entre enero de 2010 y diciembre de 2021. Los pacientes eran predominantemente varones (88,2%) y la mediana de edad en el momento de la interrupción del régimen TAR fue de 47 años (IQR, 40–52 años). En el momento de la interrupción del TAR, el 84,3% de las PVVS estaban virológicamente suprimidas y el 90,1% tenían un recuento de células CD4 ≥ 200 células/μl. En la tabla 1, se muestran las características basales de los pacientes en la primera interrupción. Las características basales de los pacientes en las discontinuaciones sucesivas se presentan en el material suplementario (tabla 1, segunda interrupción; tabla 2, tercera interrupción).
Características basales en la primera interrupción
| PVVS, n (%) | 2010–2015, n (%) | 2016–2021, n (%) | pa | |
|---|---|---|---|---|
| Total | 789 | 533 | 256 | |
| Hombres | 643 (81,5) | 423 (79,4) | 220 (85,9) | 0,03 |
| Edad, años; mediana (Q1, Q3) | 47 (41–51) | 46 (41–51) | 49 (43–54) | 0,01 |
| ≥50 años | 273 (34,6) | 162 (30,4) | 111 (43,4) | <0,01 |
| Carga vírica indetectable; (<50 cop/ml) | 665 (84,3) | 442 (82,9) | 223 (87,1) | 0,16 |
| Recuento de células CD4 ≥200 células/μl | 711 (90,1) | 471 (88,4) | 240 (93,8) | 0,04 |
| sida | 250 (31,7) | 190 (35,6) | 60 (23,4) | <0,01 |
| Polifarmacia | 91 (11,5) | 60 (11,3) | 31 (12,1) | 0,82 |
| Comorbilidades | 399 (50,6) | 269 (50,5) | 130 (50,8) | 0,89 |
| Puntuación ICTF ≥11,25 | 131 (16,6) | 93 (17,4) | 37 (14,5) | 0,34 |
| Régimen TAR previo a la interrupción | <0,01 | |||
| 2 ITIAN + ITINN | 356 (45,1) | 221 (41,5) | 135 (52,7) | |
| 2 ITIAN + IP | 298 (37,8) | 254 (47,7) | 44 (17,2) | |
| 2 ITIAN + INSTI | 56 (7,1) | 11 (2,1) | 45 (17,6) | |
| Otros | 79 (10) | 47 (8,8) | 32 (12,5) | |
| PCU pre-interrupción | 286 (36,4) | 133 (25) | 153 (60,2) | <0,01 |
| Régimen TAR posterior a la interrupción | <0,01 | |||
| 2 ITIAN + ITINN | 249 (31,6) | 189 (35,5) | 60 (23,4) | |
| 2 ITIAN + IP | 214 (27,1) | 173 (32,5) | 41 (16) | |
| 2 ITIAN + INSTI | 150 (19,0) | 59 (11,1) | 91 (35,5) | |
| Otros | 176 (22,3) | 112 (21) | 64 (25) | |
| PCU posinterrupción | 325 (41,2) | 140 (26,3) | 185 (72,5) | |
ICTF: índice de complejidad del tratamiento farmacéutico; IP: inhibidor de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósido; ITNN: inhibidor de la transcriptasa inversa no análogo de nucleósidos; PCU: pautas de comprimido único; PVVS: personas que viven con el VIH/sida; TAR: tratamiento antirretroviral.
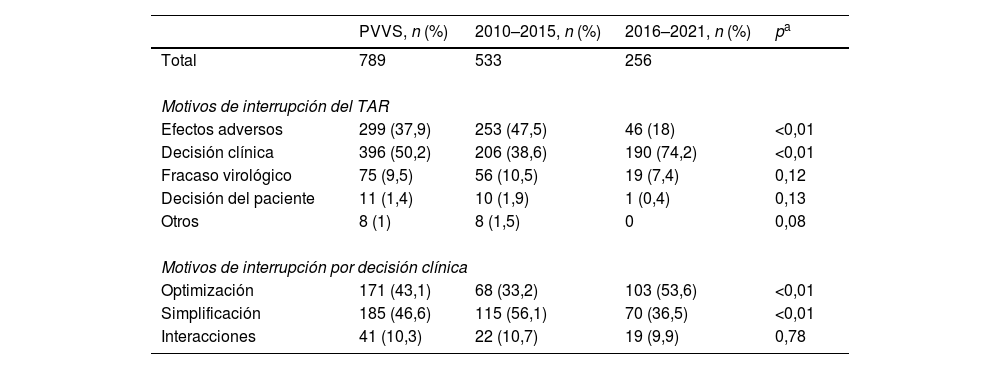
Razones para la interrupción del tratamiento antirretroviral
| PVVS, n (%) | 2010–2015, n (%) | 2016–2021, n (%) | pa | |
|---|---|---|---|---|
| Total | 789 | 533 | 256 | |
| Motivos de interrupción del TAR | ||||
| Efectos adversos | 299 (37,9) | 253 (47,5) | 46 (18) | <0,01 |
| Decisión clínica | 396 (50,2) | 206 (38,6) | 190 (74,2) | <0,01 |
| Fracaso virológico | 75 (9,5) | 56 (10,5) | 19 (7,4) | 0,12 |
| Decisión del paciente | 11 (1,4) | 10 (1,9) | 1 (0,4) | 0,13 |
| Otros | 8 (1) | 8 (1,5) | 0 | 0,08 |
| Motivos de interrupción por decisión clínica | ||||
| Optimización | 171 (43,1) | 68 (33,2) | 103 (53,6) | <0,01 |
| Simplificación | 185 (46,6) | 115 (56,1) | 70 (36,5) | <0,01 |
| Interacciones | 41 (10,3) | 22 (10,7) | 19 (9,9) | 0,78 |
PVVS: personas que viven con el VIH/sida; TAR: tratamiento antirretroviral.
A lo largo del tiempo, se han producido cambios significativos en la composición de los regímenes de los TAR, impulsados principalmente por la introducción de nuevos fármacos como los INSTI o los medicamentos coformulados que facilitan la prescripción PCU. Durante el periodo inicial de 2010 a 2015, el régimen de TAR más prescrito antes de la interrupción consistía en 2 ITIAN y un IP (47,7%), seguido de una pauta basada en ITINN (41,5%). En el periodo posterior, se hicieron más frecuentes los regímenes de TAR compuestos por 2 ITIAN y un ITINN (52,7%).
Por otro lado, los regímenes de TAR retomados tras una interrupción en el primer periodo se asemejaron a los tratamientos previos a dicha interrupción, con una mayor prevalencia de combinaciones basadas en ITINN (35,5%) y combinaciones basadas en IP (32,5%). Por el contrario, durante el periodo 2016–2021 comenzaron a predominar los regímenes TAR basados en INSTI (35,5%). De las 789 PVVS que interrumpieron el TAR, el 41,2% cambió a un TAR de PCU. El porcentaje de PCU experimentó un aumento significativo, pasando del 26,3% durante el periodo 2010–2015 a un remarcable 72,5% entre 2016 y 2021 (p < 0,01).
Atendiendo a los periodos de duración de la prescripción de TAR definidos hasta la interrupción, se observa que 103 de los 789 pacientes (13,1%) interrumpieron el tratamiento en el corto plazo, el 12,1% en el medio plazo y el 74,8% en el largo plazo. De todas las PVVS que suspendieron el tratamiento de TAR, 485 tuvieron una segunda interrupción (69,4% en el largo plazo) y 243 una tercera interrupción (71,8% en el largo plazo). La mediana de duración del TAR hasta la interrupción fue de 45 meses (IQR: 13–69). La mediana de duración hasta la interrupción fue mayor en el periodo 2016–2021 (77 meses; IQR: 22–111) que en el periodo anterior (38 meses; IQR: 13–69).
El principal motivo de interrupción del régimen TAR fue la decisión clínica (50,2%), seguido de los EA (37,9%), el fracaso virológico (9,5%), la decisión del paciente (1,4%) y otros (1%). Centrándonos en los motivos asociados a la decisión clínica, predomina la simplificación del tratamiento (46,6%), seguida de la optimización (43,1%) y la evitación de interacciones farmacológicas (10,3%). La descripción completa de los motivos asociados a la interrupción del TAR por periodo estudiado se muestra en la tabla 2.
La tasa de interrupción por EA disminuyó con el tiempo (47,5% para 2010–2015 y 18% para 2016–2021), mientras que la interrupción por modificación de la decisión clínica mostró una tendencia creciente (38,6 y 74,2% durante 2010–2015 y 2016–2021, respectivamente). No se informó a menudo el fracaso virológico como motivo de interrupción del TAR, y su porcentaje no varió significativamente entre los periodos estudiados. En el periodo 2016–2021, el cambio de régimen por decisión clínica asociada a la optimización terapéutica aumentó significativamente respecto al periodo 2010–2015 (53,6% frente a 33,2%). Sin embargo, la decisión clínica asociada a la simplificación del tratamiento se redujo y la prevención de interacciones se mantuvo constante durante todo el periodo de estudio.
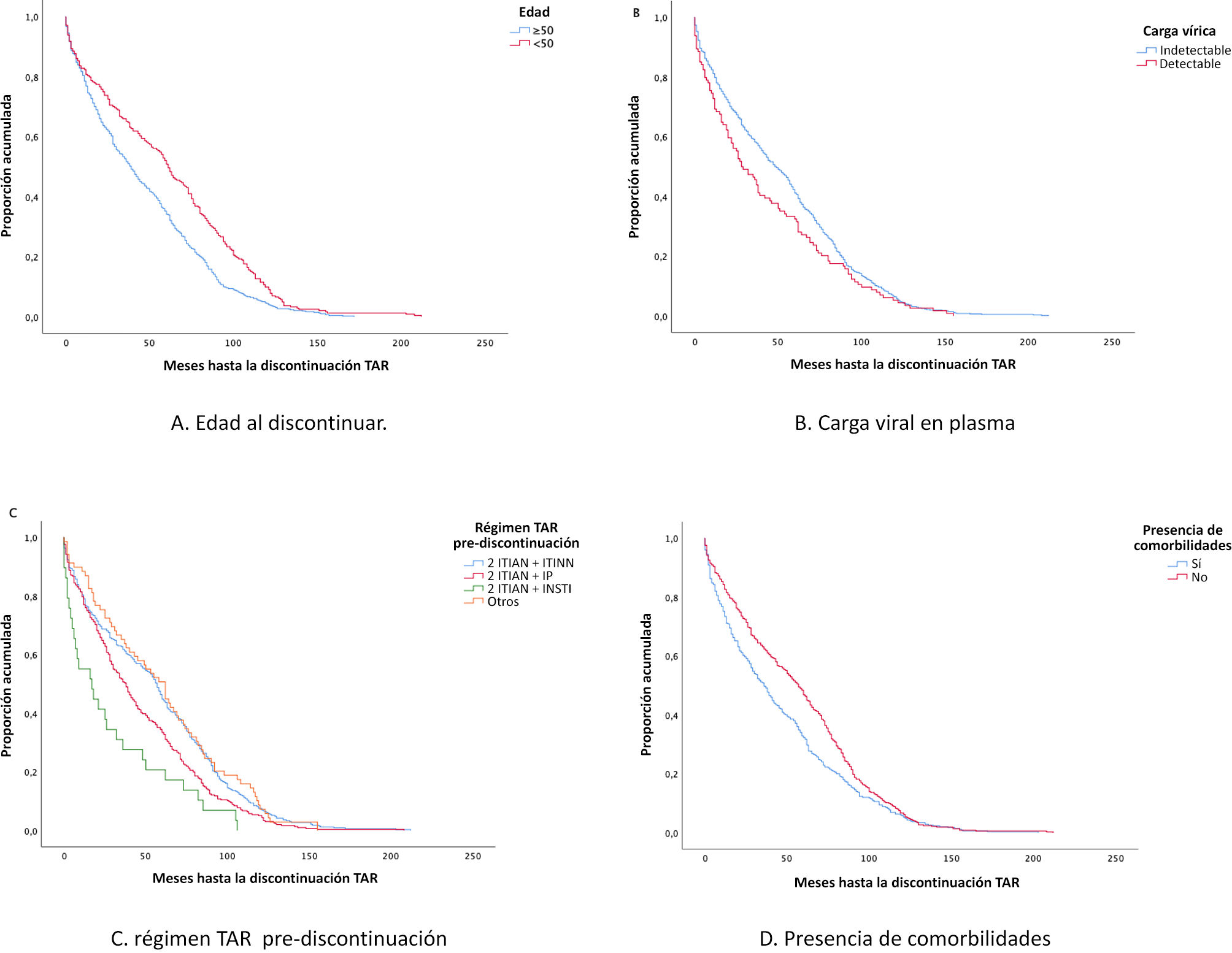
Centrándonos en los factores asociados a la interrupción del TAR, mediante la prueba de log-rank se identificaron asociaciones estadísticamente significativas entre la edad de la PVVS en el momento de la interrupción (p < 0,01), la carga vírica plasmática detectable (p = 0,04), el régimen TAR previo a la interrupción (p < 0,01), la comorbilidad (p < 0,01) y el año de inicio del TAR (p < 0,01). Se realizaron análisis temporales para identificar los factores pronósticos asociados a la interrupción del TAR. Estos factores, con la excepción del año de inicio del TAR, se muestran en los gráficos de Kaplan–Meier de la figura 1: A) edad en el momento de la interrupción; B) carga vírica en plasma; C) régimen TAR antes de la interrupción; D) presencia de comorbilidades. Una figura suplementaria incluida ilustra la proporción acumulada de durabilidad de los TAR antes de la interrupción, basada en el régimen TAR antes de la interrupción (fig. 1) durante los 2 periodos analizados: A) 2010–2015; B) 2016–2021, para diferenciar los patrones farmacológicos a lo largo de los marcos temporales estudiados.
Las PVVS mayores de 50 años fueron más propensas a interrumpir el TAR que las menores de 50 años (HR 1,45; IC 95% 1,24-1,69). La presencia de comorbilidades fue significativamente más propensa a provocar la interrupción del régimen TAR (HR 1,25; IC 95% 1,08-1,45). Además, los pacientes que tenían algún tratamiento concomitante al TAR tenían mayor riesgo de interrupción (HR 1,17; IC 95% 1,01-1,37). Sin embargo, no se encontraron diferencias con respecto a la polifarmacia. Considerando los regímenes TAR previos a la interrupción, observamos que un régimen basado en IP (HR 1,37; IC 95% 1,06-1,78) o uno basado en INSTI (HR 2,22; IC 95% 1,44-3,34) antes de la interrupción se asocia con mayores tasas de modificación, en comparación con otras combinaciones. La interrupción del TAR es mayor en el periodo 2010–2015 que en el 2016–2021 (HR 2,31; IC 95% 1,92-2,76).
Se realizaron 3 modelos multivariantes para identificar las diferencias existentes entre los periodos de tiempo definidos para el estudio. En la tabla 3 se presentan los resultados de los modelos multivariantes de riesgos proporcionales de Cox de los factores asociados a la interrupción del TAR.
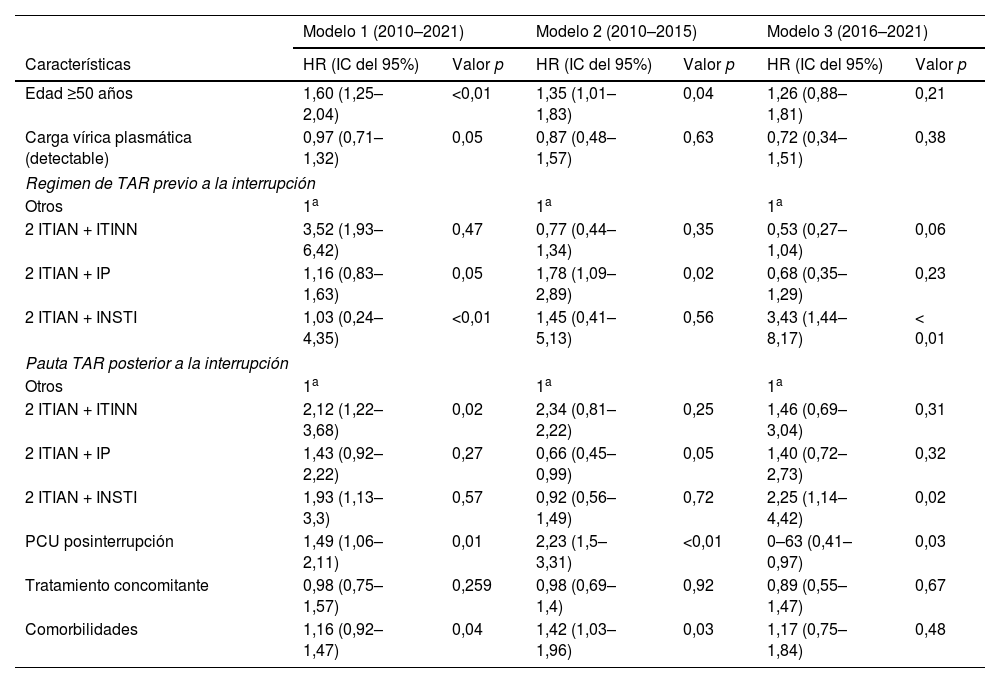
Resultados de los modelos multivariantes de riesgos proporcionales de Cox
| Modelo 1 (2010–2021) | Modelo 2 (2010–2015) | Modelo 3 (2016–2021) | ||||
|---|---|---|---|---|---|---|
| Características | HR (IC del 95%) | Valor p | HR (IC del 95%) | Valor p | HR (IC del 95%) | Valor p |
| Edad ≥50 años | 1,60 (1,25–2,04) | <0,01 | 1,35 (1,01–1,83) | 0,04 | 1,26 (0,88–1,81) | 0,21 |
| Carga vírica plasmática (detectable) | 0,97 (0,71–1,32) | 0,05 | 0,87 (0,48–1,57) | 0,63 | 0,72 (0,34–1,51) | 0,38 |
| Regimen de TAR previo a la interrupción | ||||||
| Otros | 1a | 1a | 1a | |||
| 2 ITIAN + ITINN | 3,52 (1,93–6,42) | 0,47 | 0,77 (0,44–1,34) | 0,35 | 0,53 (0,27–1,04) | 0,06 |
| 2 ITIAN + IP | 1,16 (0,83–1,63) | 0,05 | 1,78 (1,09–2,89) | 0,02 | 0,68 (0,35–1,29) | 0,23 |
| 2 ITIAN + INSTI | 1,03 (0,24–4,35) | <0,01 | 1,45 (0,41–5,13) | 0,56 | 3,43 (1,44–8,17) | < 0,01 |
| Pauta TAR posterior a la interrupción | ||||||
| Otros | 1a | 1a | 1a | |||
| 2 ITIAN + ITINN | 2,12 (1,22–3,68) | 0,02 | 2,34 (0,81–2,22) | 0,25 | 1,46 (0,69–3,04) | 0,31 |
| 2 ITIAN + IP | 1,43 (0,92–2,22) | 0,27 | 0,66 (0,45–0,99) | 0,05 | 1,40 (0,72–2,73) | 0,32 |
| 2 ITIAN + INSTI | 1,93 (1,13–3,3) | 0,57 | 0,92 (0,56–1,49) | 0,72 | 2,25 (1,14–4,42) | 0,02 |
| PCU posinterrupción | 1,49 (1,06–2,11) | 0,01 | 2,23 (1,5–3,31) | <0,01 | 0–63 (0,41–0,97) | 0,03 |
| Tratamiento concomitante | 0,98 (0,75–1,57) | 0,259 | 0,98 (0,69–1,4) | 0,92 | 0,89 (0,55–1,47) | 0,67 |
| Comorbilidades | 1,16 (0,92–1,47) | 0,04 | 1,42 (1,03–1,96) | 0,03 | 1,17 (0,75–1,84) | 0,48 |
ITIAN: inhibidores de la transcriptasa inversa análogos de los nucleósidos; ITINN: inhibidores de la transcriptasa inversa no análogos de los nucleósidos; IP: inhibidor de la proteasa; INSTI: inhibidor de la transferencia de la cadena de la integrasa; PCU: pauta de comprimido único.
Nuestro análisis de cohorte examinó la tendencia y los factores asociados a la interrupción de regímenes TAR durante el periodo comprendido entre 2010 y 2021 en condiciones de la práctica clínica habitual. Los resultados describen la evolución de la principal causa de interrupción del TAR a lo largo de los años, destacando la importancia que ha adquirido en los últimos años la decisión clínica de optimizar la farmacoterapéutica. Por otro lado, observamos una reducción en la interrupción del tratamiento por EA durante el periodo de estudio.
En línea con lo publicado por otros estudios, en los últimos años se ha observado una tendencia hacia una mayor duración del tratamiento con TAR antes de la interrupción11,17. En nuestra cohorte, las razones principales para modificar el régimen se atribuyen principalmente a los EA asociados al TAR y a decisiones clínicas encaminadas a la simplificación del régimen terapéutico y la optimización de la terapia.
En consecuencia, hipotetizamos que a lo largo del periodo estudiado se produciría un cambio en el motivo principal de la interrupción a favor de la optimización terapéutica, debido al desarrollo de nuevos fármacos tan importantes como los INSTI con un perfil buen de eficacia y seguridad, así como al aumento de regímenes TAR con la alternativa de estrategias PCU18,19. Nuestros hallazgos confirman que, en el periodo 2016–2021, la optimización farmacoterapéutica por parte de médicos fue significativamente más prevalente como factor impulsor de la modificación del tratamiento.
En el periodo 2010–2015, la principal causa de interrupción fueron los EA relacionados con TAR, lo que está en consonancia con estudios anteriores20,21. En el periodo 2016–2021, se produjo un cambio notable en los patrones de prescripción, marcado por la rápida adopción de tratamientos basados en INSTI y la sustitución de los tratamientos basados en IP e ITINN. Además, hubo una ligera disminución en la interrupción debida al fracaso virológico (10,5% en 2010–2015 y 7,4% en 2016–2021), lo que indica que la introducción de tratamientos bien tolerados y eficaces, incluyendo las PCU, han llevado a una mejor adherencia y menores tasas de fracaso virológico.
Los regímenes de una toma diaria, especialmente las PCU, muestran una mayor durabilidad del tratamiento, algo demostrado en otros estudios22,23. Este efecto se debió probablemente a la mejor adherencia observada con estas pautas de tratamiento y que permiten la optimización farmacoterapéutica en los pacientes polimedicados24. Nuestros datos confirmaron dicha tendencia, ya que observamos un mayor número de tratamientos PCU posteriores a la interrupción, principalmente en 2016–2021.
Varios estudios de cohortes europeos que examinan la interrupción de los regímenes TAR iniciales con seguimiento de un año, particularmente en los pacientes sin tratamiento previo, indican que los tratamientos que incorporan INSTI y estrategias de PCU exhiben menores tasas de interrupción25,26. Nuestra diferencia respecto a este estudio radicó en la inclusión de pacientes con y sin tratamiento previo. Sin embargo, los resultados siguieron la tendencia de otros estudios publicados.
Debido a las comorbilidades relacionadas con la edad, la población de PVVS de edad avanzada requiere a menudo un tratamiento concomitante al del régimen de TAR27,28. Los pacientes de mayor edad presentan tasas superiores de interrupción, posiblemente relacionadas con las comorbilidades y los tratamientos concomitantes29. En el análisis multivariante general de nuestro estudio, ser una PVVS mayor de 50 años y con comorbilidades se asoció a la interrupción del régimen TAR. Aunque el análisis bivariante indicó una mayor probabilidad de interrupción del TAR cuando existía un tratamiento concomitante, la diferencia no alcanzó significación estadística en el análisis multivariante.
El cambio, como principal causa de interrupción, pone de manifiesto tanto la mejora de los fármacos incluidos en los esquemas de medicación antirretroviral como un mejor manejo terapéutico de las PVVS de más edad y presentan más comorbilidades. Sin embargo, no debemos limitarnos a la evaluación clínica y es necesario incorporar una evaluación multidimensional que incluya a los pacientes y considere otros aspectos como los resultados notificados por los pacientes.
A pesar de estos resultados, una de las principales limitaciones del estudio fue su carácter unicéntrico, y por lo tanto, existe la posibilidad de que se hayan favorecido ciertas guías en detrimento de otras y que se haya creado un sesgo de selección. Sin embargo, las consultas de enfermedades infecciosas en nuestro centro siguieron guías de práctica clínica nacionales e internacionales, lo que estandarizó la práctica asistencial con los diferentes centros nacionales que siguen las mismas directrices de trabajo, reduciendo así el sesgo.
En conclusión, nuestra cohorte muestra características similares en la interrupción de TAR que las notificadas en otros países europeos. Los resultados de este estudio indican una disminución de la interrupción debida a EA a lo largo del tiempo. Esta tendencia se atribuye probablemente a la mejora de la efectividad y el perfil de seguridad, así como a pautas posológicas más simples con nuevos regímenes que emplean estrategias de PCU, y los tratamientos basados en INSTI. Se identificaron varios factores que mostraron una asociación significativa con la interrupción del TAR, como PVVS mayores de50 años y la presencia de comorbilidades. Además, en el periodo 2016–2021, se encontró una mayor tasa de interrupción por decisión clínica asociada a la optimización farmacoterapéutica, que supuso el uso de regímenes con INSTI y PCU.
Consideraciones éticasEl estudio cumple todos los requisitos éticos y fue aprobado por el Comité Ético de Investigación Clínica de Sevilla-Sur (C.I. 0174-N-20). Este estudio se realizó de acuerdo con las directrices de la Declaración de Helsinki para la investigación biomédica
FinanciaciónNinguna a declarar.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Declaración de contribución de autoría CRediTEnrique Contreras Macías: Conceptualization, Data curation, Formal analysis, Investigation, Methodology, Writing – original draft, Writing – review & editing, Project administration, Validation, Visualization. Antonio Gutiérrez-Pizarraya: Data curation, Methodology, Project administration, Validation, Writing – review & editing. Juan Antonio Pineda Vergara: Conceptualization, Formal analysis, Investigation, Methodology, Supervision, Validation, Visualization. Ramón Morillo Verdugo: Conceptualization, Investigation, Methodology, Supervision, Validation, Writing – original draft, Writing – review & editing.