Diversos estudios han demostrado similar efectividad y seguridad de epoetina alfa (r-HuEpo) y darbepoetina alfa (NESP) en el mantenimiento de los niveles de hemoglobina, en pacientes con insuficiencia renal crónica (IRC). Sin embargo, existe controversia en cuanto a su eficiencia. El objetivo de este estudio es la realización de un análisis de minimización de costes (AMC), y como parte del mismo se comparan los costes que supone para el hospital el tratamiento con r-HuEpo frente a NESP.
MétodosEstudio observacional prospectivo. Se incluyeron pacientes con IRC sometidos a hemodiálisis, sin déficit de hierro, vitamina B12 o folato, tratados con r-HuEpo IV a dosis estables. El seguimiento se realizó en 3 periodos: el primero durante 6 meses, manteniendo la terapia previa con r-HuEPO, el segundo, de 8 meses, tras cambiar a NESP y el tercero, los últimos 8 meses tras nuevo cambio a r-HuEPO. Para la conversión de ambos tratamientos se utilizó el factor de conversión establecido en ficha técnica 1:200.
Resultados51 pacientes completaron el estudio y fueron válidos para el análisis, con una media de edad de 68,3 años, de los cuales 18 fueron mujeres (35,3%). Las dosis medias semanales al final de cada periodo fueron de 8.058,8 (SD 3.911,1) UI para el periodo EPO1, 39,4 (SD 21,6)μg para el NESP y 7.882,4 (SD 4.594,1)UI para el EPO2. Los costes semanales de cada tratamiento muestran diferencias significativas entre NESP y r-HuEpo, siendo el coste de NESP superior.
ConclusiónEn nuestro estudio encontramos una eficacia similar de r-HuEpo y NESP en pacientes con IRC sometidos a hemodiálisis, y un incremento significativo de los costes asociado al tratamiento con NESP.
Multiple studies have shown that epoetin alpha (r-HuEpo) and darbepoetin alpha (NESP) are similarly effective and safe for maintaining haemoglobin levels in patients with chronic kidney disease (CKD). Nevertheless, there is some debate over their cost-effectiveness. The purpose of this study is to carry out a cost-minimisation analysis including a comparison of the costs to the hospital arising from treatment with r-HuEpo vs. NESP.
MethodsProspective observational study. We included CRF patients on haemodialysis with no iron, vitamin B12 or folate deficiencies, treated with stable doses of IV r-HuEpo. Follow-up was performed over three periods: the first during six months, maintaining prior treatment with r-HuEpo; the second for eight months, after changing to NESP, and the third, during the final eight months, following resuming r-HuEpo treatment. For converting both treatments, the conversion factor established on technical sheet 1:200 was used.
Results51 patients completed the study and were valid for analysis. Their mean age was 68.3 years, and 18 were women (35.3%). The mean weekly doses at the end of each period were 8,058.8 (SD 3,911.1)IU for the EPO1 period, 39.4 (SD 21.6)μg for NESP and 7,882.4 (SD 4,594.1)IU for EPO2. The weekly costs for each treatment showed significant differences between NESP and r-HuEpo: the cost of NESP was higher.
ConclusionIn our study, we found that r-HuEpo and NESP were similarly effective in patients with CRF on haemodialysis, but that there was a significant cost increase associated with NESP treatment.
La eritropoyetina es una glucoproteína que estimula la proliferación de progenitores eritroides en la médula ósea. Se produce mayoritariamente a nivel de las células intersticiales peritubulares renales, en respuesta a la hipoxia, por lo que su secreción se ve comprometida en los pacientes con insuficiencia renal crónica (IRC). La mayoría de estos pacientes desarrollan anemia cuando su aclaramiento de creatinina es inferior a 30ml/min. Además, otros factores contribuyen a disminuir la vida media de los hematíes, como son el déficit de hierro, hemorragias gastrointestinales, inflamación aguda o crónica, infecciones asociadas, deficiencias nutricionales y toxicidad por aluminio1,2.
La comercialización en España en 1990 de la primera eritropoyetina humana recombinante (r-HuEpo/epoetina alfa), permitió el tratamiento eficaz de la anemia en la IRC, mejorando la calidad de vida y la supervivencia de estos pacientes, con una disminución paralela de los ingresos hospitalarios. Darbepoetina alfa (NESP), comercializada en 2001, difiere de la r-HuEpo original en su secuencia de aminoácidos. La mutación de 5 de ellos le confiere un mayor contenido en ácido siálico, ya que tiene 5 centros de N-glucosilación en lugar de 3, lo que le proporciona una mayor semivida3,4. Sin embargo, la afinidad de NESP por los receptores específicos en los precursores eritroides es menor5.
El tratamiento con ambos factores estimulantes consta de una fase de corrección y una fase de mantenimiento. En la fase de corrección la hemoglobina (Hb) debe monitorizarse cada 2 o 4 semanas, en el caso de r-HuEpo, y cada 1 o 2 semanas en el caso de NESP, ajustando la dosis cada 4 semanas como mínimo, en ambos casos. En la fase de mantenimiento, una vez alcanzado el nivel de Hb objetivo, y las dosis de factor estimulante son estables, la Hb debe monitorizarse periódicamente4,6,7. Las European Best Practice Guidelines recomiendan mantener niveles de Hb >11g/dl para todos los pacientes con IRC, ya que existen evidencias de menor mortalidad e ingresos hospitalarios, dejando el objetivo de Hb superior a criterio clínico en función de la individualidad de cada paciente8. Para asegurar la eficacia de los factores estimulantes, son necesarios unos depósitos adecuados de hierro, medidos por la ferritina en el caso del hierro tisular, y el índice de saturación de transferrina (TSAT), en el caso del hierro funcional. Por esta razón, prácticamente todos los pacientes requieren suplementos de hierro, excepto aquellos que presenten ferritina superior a 800μg/l o TSAT superior a 50%6,9.
Diversos estudios han demostrado similar efectividad y seguridad de NESP en el mantenimiento de los niveles de Hb, en pacientes estables tratados previamente con r-HuEpo10,11. En estos estudios de conversión, la dosis de NESP se calculó dividiendo la dosis semanal total de r-HuEpo (UI/semana) por 200, factor de conversión (FC) que se basa en la equivalencia en masa peptídica de 200UI de r-HuEpo alfa y 1μg de NESP12. Los pacientes tratados con r-HuEpo 2 o 3 veces a la semana pasaron a NESP 1 vez por semana, mientras que los pacientes tratados con r-HuEpo 1 vez por semana pasaron a NESP una vez cada 2 semanas.
Por otro lado, existe una controversia en cuanto a la eficiencia de ambos fármacos. Los estudios publicados muestran una variedad de resultados en cuanto a las dosis de NESP necesarias para mantener los niveles de Hb estables. El FC recomendado para el cambio de dosis de r-HuEpo a NESP, 200:1, se ve modificado a lo largo de los meses de evolución de los diferentes estudios, de manera que pueden encontrar en la bibliografía científica resultados entorno a 150:1 hasta más de 250:113–16. Los requerimientos de dosis de NESP varían de un estudio a otro, de forma que al final del periodo pueden resultar ser mayores, en el primer caso, o menores, en el segundo.
El objetivo de este estudio es la realización de un análisis de minimización de costes, y como parte del mismo se comparan los costes que supone para el hospital el tratamiento con r-HuEpo frente a NESP.
MétodosEstudio observacional multicéntrico, en el que se incluyeron pacientes con IRC sometidos a hemodiálisis, pertenecientes a 2 centros de diálisis dependientes del Hospital Universitario La Fe, en el periodo comprendido entre julio de 2003 y diciembre de 2005.
El estudio se realizó en 3 periodos: EPO 1, NESP y EPO 2. El primer periodo, EPO1, fue de 6 meses de duración (mes -6 a 0). Los datos de los pacientes correspondientes a este periodo fueron recogidos de forma retrospectiva en el cuaderno de recogida de datos. En el mes 0 o basal, los pacientes pasaron a recibir NESP como factor eritropoyético, y aquellos que cumplieron los criterios de inclusión fueron seleccionados para su seguimiento. La política del hospital marcó el cambio de r-HuEpo a NESP, pues se decidió la inclusión de NESP en la guía farmacoterapéutica, sustituyendo a r-HuEpo. Todos los pacientes pasaron a recibir NESP como factor estimulante de la eritropoyesis.
Para el cálculo de dosis de NESP se utilizó el FC 200:1 (dosis semanal total r-HuEpo, en UI/semana dividida por 200), según ficha técnica de NESP, y la frecuencia de administración de dosis fue de 1 vez por semana para pacientes que recibían r-HuEpo de 2 a 3 veces a la semana, y quincenal para pacientes que lo hacían 1 vez a la semana.
En el periodo NESP, de 8 meses de duración (mes 0 a +8), la dosis de NESP se ajustó de la siguiente forma: para aumentos de Hb inferiores a 1g/dl en 4 semanas, la dosis se aumentó en aproximadamente un 25%; para aumentos de Hb superiores a 2,5g/dl en 4 semanas, la dosis se redujo entre un 25–50%, dependiendo de la velocidad de aumento de la Hb; en los casos en que la Hb rebasó los 14g/dl, se interrumpió el tratamiento hasta que disminuyo por debajo de 13g/dl, instaurándose de nuevo a una dosis 25% inferior a la dosis previa. Para el cambio de tratamiento de NESP a r-HuEpo, en el mes +8, se utilizó la dosis correspondiente a la dosis semanal total de NESP (μg/semana) multiplicada por 200 y la frecuencia de administración la inversa a la empleada en el cambio r-HuEpo a NESP en el mes basal.
Por último, el tercer periodo, r-HuEpo 2 (mes +8 a +16), fue de 8 meses de duración, y las dosis de r-HuEpo se fueron modificando para conseguir el nivel objetivo de Hb.
Los pacientes fueron seleccionados en base a unos criterios que asegurasen la no influencia de otros factores externos a la terapia eritropoyética.
Los criterios de inclusión fueron: 1) pacientes mayores de 18 años en hemodiálisis sin déficit de hierro (ferritina >100mcg/l, TSAT >20%), vitamina B12 o folato, tratados con HuEpo por vía intravenosa a dosis estables (cambios de dosis semanal ≤25% en las 8 semanas previas a la inclusión) con niveles Hb estables en el intervalo objetivo (Hb=10–13,5g/dl); 2) pacientes incluidos en programa de hemodiálisis al menos durante los 6 meses anteriores a la fecha de inclusión; 3) pacientes que no tengan programada una salida de su unidad de hemodiálisis habitual durante la duración del estudio.
Los criterios de exclusión fueron: 1) pacientes con alteraciones hematológicas; 2) pacientes con signos de inflamación o infección; 3) pacientes con HTA no controlada, medida por: presión diastólica (PAD)>110mmHg, presión sistólica (PAS) >150mmHg); 4) pacientes con patología maligna, excepto carcinoma de células basales o de células escamosas de la piel o neoplasma intraepitelial de cuello uterino; 5) pacientes con hiperparatiroidismo no controlado (PTH >1.500pg/ml); 6) pacientes con signo de sangrado activo; 7) pacientes transfundidos en los 3 meses previos a la inclusión.
La fecha de inicio de reclutamiento de pacientes es posterior a la comunicación de la Agencia Española del Medicamento, por lo que todos los pacientes reciben r-HuEpo por vía intravenosa, vía que mantenienen tras el cambio a NESP. Además, se administró hierro intravenoso a todos los pacientes en los que fue necesario, para mantener el TSAT >20% y los niveles de ferritina >100μg/l.
– Eficacia y seguridad: Los datos basales recogidos para cada paciente fueron los correspondientes a las variables: edad, sexo, peso, talla, índice de masa corporal (IMC), etiología de la IRC, PAS, PAD, Hb, hematocrito (Hto), volumen corpuscular medio (VCM), TSAT, ferritina sérica, PTH, PRC y aluminio en sangre.
Durante el estudio, se realizan controles cada 2 meses. En cada control se recogió el nivel de Hb, así como la dosis de factor estimulante y la frecuencia de administración del mismo. Además, se recogieron los datos correspondientes a las variables: Hb, Hto, tipo de hierro y dosis del mismo, TSAT, ferritina sérica, aluminio en sangre y Kt/v total.
Para la evaluación de la eficacia se analizó las Hb de cada fármaco al principio y final de cada periodo de estudio.
Los estadísticos descriptivos utilizados para cada variable fueron: la media y la mediana como parámetros de posición, la desviación típica, rango y percentiles 25% y 75% como parámetros de dispersión. Para las comparaciones de las medias de Hb y coste del tratamiento en cada periodo de estudio, se han aplicado pruebas no paramétricas basadas en el test de Wilcoxon. Se consideró significativo un valor de p<0,05.
– Costes asociados a cada tratamiento: La perspectiva del estudio es la de los gestores del hospital. Para el cálculo de los costes asociados al tratamiento con cada fármaco se tuvo en cuenta el precio de adquisición del medicamento, PVF, correspondiente al último concurso de la central de compras. No se tuvieron en cuenta más costes pues en todos los casos el fármaco se administró vía iv, a través del sistema de hemofiltración, utilizando las jeringas precargadas del medicamento.
Para el cálculo de los costes semanales, en primer lugar se obtuvo el precio medio ponderado por unidad de fármaco de una UI de HuEpo y un μg de NESP a partir del gasto real del hospital. Es decir, se asume que la distribución porcentual del número de unidades de consumo de las presentaciones de cada medicamento es representativa del consumo global del hospital.
De esta forma se obtiene que el precio medio de una UI de HuEpo es de 0,005584, y el de un μg de NESP es de 1,317987.
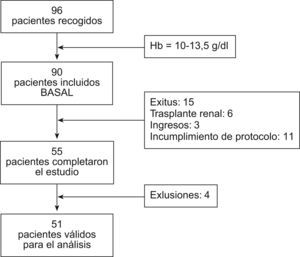
ResultadosSe recogieron un total de 96 pacientes de los cuales 90 cumplían los criterios de inclusión (fig. 1). De estos 90 pacientes, que comenzaron el tratamiento con NESP, completaron el estudio 55 pacientes (61,1%). Las pérdidas fueron por diversas causas: 15 pacientes murieron (13,3% de los pacientes incluidos), 6 fueron receptores de trasplante renal (6,7%), 3 fueron ingresados durante el estudio (3,3%) y en 11 pacientes se incumplió el protocolo. De los 55 pacientes que completaron el estudio se excluyeron 4 por las siguientes causas: 1 caso por no disponer de los valores de dosis a partir del mes 8 y 3 casos por posible resistencia a NESP o r-HuEpo al registrar incrementos superiores a 10.000UI en un periodo de 6 meses con incremento de dosis crecientes en todo el periodo del estudio. De esta forma, el total de pacientes válidos para el análisis es de 51, como muestra la figura 1.
Las características demográficas de los pacientes válidos se muestran en la tabla 1. Los valores de las medias (SD) de ferritina sérica y TSAT en el mes basal fueron: 493,8 (178,2)μg/l y 36,87 (14,4), respectivamente. El 62,7% de los pacientes recibían aportes de hierro, siendo la dosis media mensual de 139,5 (66,9)mg.
Características demográficas de los pacientes (n=51)
| Edad, años | |
| Media (SD) | 68,3 (11,1) |
| Mediana (rango) | 70,5 (40,9–83,2) |
| Sexo, n (%) | |
| Mujeres | 18 (35,3%) |
| Hombres | 33 (64,7%) |
| Peso, kg | |
| Media (SD) | 68,0 (13,2) |
| Mediana (rango) | 66,0 (44,5–104) |
| Etiología de la IRC, n (%) | |
| Glomerular | 5 (9,8) |
| Intersticial | 7 (13,7) |
| Poliquística | 3 (5,9) |
| Vascular | 8 (15,7) |
| Diabetes | 7 (12,7) |
| Tipo I | 4 (7,8) |
| Tipo II | 3 (5,9) |
| Otras | 1 (2,0) |
| Desconocida | 20 (39,2) |
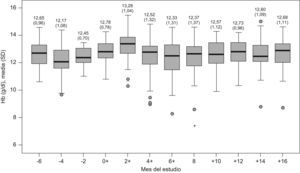
– Eficacia y seguridad: Las Hb correspondientes a cada mes del estudio se muestran en la figura 2. No existe diferencia estadísticamente significativa entre la Hb media del inicio del periodo EPO 1 y las Hb medias del periodo basal (fin EPO 1 e inicio NESP; p=0,790), del mes 8 (fin periodo NESP e inicio EPO 2; p=0,318) o del mes 16 (fin periodo EPO 2; p=0,945). Tampoco existen diferencias estadísticamente significativas entre las medias del inicio y final del periodo NESP (p=0,196) o entre las medias del inicio y final del periodo EPO 2 (p=0,389).
No se detectaron diferencias estadísticamente significativas en las dosis de hierro (p=0,363) en el periodo NESP respecto al periodo EPO 1 (p=0,084), ni en la ferritina del periodo NESP frente al periodo EPO 1 (p=0,261) ni en el TSAT (p=0,127).
Así mismo, no se detectaron diferencias estadísticamente significativas en las dosis de hierro (p=0,428) en el periodo EPO 2 respecto al periodo EPO 1, ni en los niveles de ferritina y TSAT (p=0,553; p=0,666, respectivamente).
En cuanto a las dosis de factor estimulante empleadas, la tabla 2 muestra las dosis en los siguientes momentos temporales: mes -6 (inicio retrospectivo del periodo EPO 1), mes 0 basal (fin del periodo retrospectivo EPO 1 e inicio del periodo NESP), mes +8 (fin del periodo NESP e inicio del periodo EPO 2) y mes +16 (fin periodo EPO 2). El cambio de r-HuEPO a NESP en el momento basal o de NESP a r-HuEPO en el mes +8 se hace con un FC de 1:200. No existen diferencias significativas en la dosis entre ningún periodo (test de Friedman de comparaciones múltiples, p=0,970).
Dosis de r-HuEpo y NESP semanales
| Periodo | EPO 1 (UI) | NESP (μg) | EPO 2 (UI) | |||
| Mes | -6 | 0 | 0 | +8 | +8 | +16 |
| Media | 7.784,3 | 8.058,8 | 40,3 | 39,4 | 7.882,4 | 7.882,4 |
| SD | 4.234,7 | 3.911,1 | 19,6 | 21,6 | 4.311,1 | 4.594,1 |
| Mediana | 6.000 | 6.000 | 30 | 30 | 6.000 | 6.000 |
| Mín | 0 | 2.000 | 10 | 0 | 0 | 0 |
| Máx | 24.000 | 20.000 | 100 | 105 | 21.000 | 18.000 |
| Suma dosis | 39.700 | 411.000 | 2.055 | 2.010 | 402.000 | 402.000 |
| Perc 25% | 6.000 | 6.000 | 30 | 25 | 5.000 | 4.000 |
| Perc 75% | 9.000 | 12.000 | 60 | 45 | 9.000 | 12.000 |
Cuarenta y siete pacientes del total (92,2%) pasaron de una frecuencia de administración de r-HuEpo 2–3 veces por semana a 1 vez por semana con NESP. De ellos, 45 mantuvieron esta frecuencia al final del periodo NESP y 2 disminuyeron a 1 vez por quincena. Los 4 pacientes restantes (7,8%), pasaron de una frecuencia de rHuEpo de 1 vez por semana a 1 vez por quincena, aumentando esta frecuencia de nuevo al final del periodo NESP en 3 casos.
En el periodo EPO 2, 45 pacientes (88,2%) pasaron de una frecuencia de administración de NESP de 1 vez por semana a 2–3 veces por semana con r-HuEpo. De ellos, 34 se mantuvieron al final del periodo EPO 2, 7 disminuyeron la frecuencia y 4 la aumentaron. Tres pacientes (5,9%) pasaron de NESP 1 vez por quincena a 1 vez semanal, aumentando la frecuencia 2 de ellos. Dos pacientes (3,9%) mantuvieron la frecuencia al pasar de un periodo de evaluación a otro, siendo de 1 vez por semana, aumentando 1 de ellos la frecuencia al final del periodo EPO 2. El paciente restante (2%) inició el periodo EPO 2 con la dosis suspendida, reinstaurándose durante el periodo EPO 2.
–Costes asociados a cada tratamiento: Los costes semanales para cada factor estimulante se muestran en la siguiente tabla (tabla 3). Para el coste de una unidad de fármaco se ha utilizado la transformación 1:200 y el precio medio por unidad de fármaco.
Costes semanales asociados a cada tratamiento, €
| Periodo | EPO 1 | NESP | EPO 2 | |||
| Valor de una unidad de fármaco, € | 0,005584 | 0,005584 | 1,317987 | 1,317987 | 0,005584 | 0,005584 |
| Mes | −6 | 0 | 0 | +8 | +8 | +16 |
| Media | 43,47 | 45,00 | 53,11 | 51,94 | 44,02 | 44,02 |
| SD | 23,65 | 21,84 | 25,77 | 39,54 | 24,07 | 25,65 |
| Mediana | 33,51 | 33,51 | 39,54 | 28,41 | 33,51 | 33,51 |
| Mín | 0 | 11.17 | 13.18 | 0 | 0 | 0 |
| Máx | 134,02 | 111,68 | 131,80 | 138,39 | 117,26 | 100,51 |
| Suma costes | 2.216,85 | 2.295,02 | 2.708,46 | 2.649,15 | 2.244,77 | 2.244,77 |
| Perc 25% | 33,50 | 33,51 | 39,54 | 32,95 | 27,92 | 22,34 |
| Perc 75% | 50,26 | 67,01 | 79,08 | 59,31 | 50,26 | 67,01 |
Existen diferencias significativas en los costes semanales entre NESP y r-HuEpo tanto para el periodo 1 como para el periodo 2 (Test de Friedman de comparaciones múltiples, p<0,001).
El análisis de sensibilidad obtenido al variar el FC de 1:150 a 1:250, mínimo y máximo aproximadamente encontrados en la literatura científica, se muestra en las tablas 4 y 5. Así mismo, se muestra el FC de corte obtenido al igualar los costes de r-HuEpo y NESP.
Análisis de sensibilidad periodos NESP-EPO2
| Dosis media NESP (μg) | Dosis media EPO (UI) | Coste semanal medio NESP, € (mes +8) | Coste semanal medio EPO, € (mes +16) | |
| FC 1:200 | 39,4 | 7.882,4 | 51,94 | 44,02 |
| FC 1:150 | 39,4 | 5.910,0 | 51,94 | 33,00 |
| FC 1:250 | 39,4 | 9.850,0 | 51,94 | 55,00 |
| FC 1:236 | 39,4 | 9.301,6 | 51,94 | 51,94 |
Los resultados obtenidos en este estudio muestran una eficacia similar de r-HuEpo y NESP. La mayoría de pacientes se mantienen, durante los dos periodos del estudio posteriores a la inclusión, con concentraciones de Hb dentro del nivel objetivo. Estos resultados están en consonancia con los publicados por otros autores, como el multicéntrico realizado en EEUU y Canadá con 507 pacientes con IRC en hemodiálisis10, y el realizado en Europa y Australia con 522 pacientes con IRC en hemodiálisis o diálisis peritoneal11.
El FC que se obtiene en nuestro estudio se mantiene en torno a 1:200 con ligeras oscilaciones en función del periodo que se compara. Así, se obtiene un FC de 1:205 si se compara las dosis finales del periodo EPO1 con las finales del periodo NESP, y de 1:200 si se compara las dosis finales del periodo NESP con las finales del periodo EPO2. En cuanto a los costes, encontramos que el tratamiento con r-HuEpo se asocia a un menor coste en comparación con NESP (51,94€ semanales al final del tratamiento con NESP frente a 45€ semanales al final del periodo EPO1 y frente a 44,02€ semanales al final del periodo EPO2), cuando los precios empleados en el estudio son los de adquisición. De esta forma, el precio de NESP para que se iguale al de r-HuEpo debería disminuir de 1,317987€ por μg a 1,142132€ por μg si se tiene en cuenta el periodo EPO1, y a 1,117259€, si se tiene en cuenta el periodo EPO2.
El análisis de sensibilidad muestra que, según los datos de nuestro estudio, existe un FC de corte (FC 1:236), en el cual se igualan los costes de ambos factores eritropoyéticos. Por encima de este FC de corte es previsible que los resultados relativos a costes sean favorables a NESP.
Sin embargo, en algunos trabajos se ha obtenido un FC superior a 200:1. Los estudios de Martinez Castelao et al17 y Molina et al16 plantean dosis menores de darbepoetina alfa, siendo los FC de 238:1 y 260:1, respectivamente. De Roger et al15 encuentran una disminución de dosis de NESP (FC de 275,9:1) al pasar de r-HuEpo a NESP, de forma que el coste disminuye tras el cambio. Este estudio consta de 2 fases, en la primera se evalúa el paso de EPO 1, 2 o 3 veces por semana a NESP 1 vez semanal, y en la segunda los pacientes pasan a NESP quincenal. La disminución del coste se refiere a la primera fase, con lo cual parece que la reducción de dosis es esperada ya que los pacientes que pasan de r-HuEpo semanal a NESP semanal estarían sobredosificados. Además, el estudio tan solo contempla 4 meses de seguimiento en la primera fase. Por otro lado, Brophy et al18 en un trabajo en el que evalúan los costes de cada tratamiento tras la implementación de un programa de intercambio para sustituir r-HuEpo por NESP, observan una disminución de los costes, pero atribuyen parte de esa reducción al propio programa, ya que estandariza la dosificación del factor estimulante en la fase NESP, no habiendo protocolo de dosificación en la fase r-HuEpo. Así, en esta línea, está descrita la influencia que tiene en las dosis semanales de r-HuEpo la implementación de un protocolo de dosificación, sin que suponga una variación en el control de la Hb9.
En contraposición, se encuentran en la literatura científica resultados de FC por debajo de 200:1, como el publicado por Jacobs et al13, que con una muestra de más de 8.000 pacientes en hemodiálisis de diferentes países europeos, concluyen que 1μg de NESP equivale sólo a 176UI de r-HuEpo. En otro estudio presentado en el marco de la Sociedad Europea de Diálisis y Transplante en 2005, en el que se realiza un análisis de coste-eficacia de los diferentes factores eritropoyéticos en 138 pacientes en hemodiálisis, observaron un aumento significativo de dosis al pasar de r-HuEpo alfa a NESP que se tradujo también en un aumento significativo de los costes19.
Una de las limitaciones de este estudio es la no inclusión de los costes de tiempo de personal de enfermería referentes a la administración, pues los autores hemos considerado que no supondrían un impacto significativo en el coste total. Así mismo, los costes obtenidos solo permiten su generalización a hospitales del a Comunidad Valenciana, ya que los precios empleados son los que marca la Central de Compras.
En cuanto a la frecuencia de administración, la mayoría de pacientes de nuestro estudio que pasan de r-HuEpo 2–3 veces por semana a 1 vez por semana de NESP, mantienen esta frecuencia de administración al final del periodo NESP. Sin embargo, de los 4 pacientes que pasan de una frecuencia de administración de 1 vez por semana de r-HuEpo a 1 vez por quincena de NESP, 3 de ellos vuelven a aumentar la frecuencia durante el periodo NESP. La eficacia de NESP con una frecuencia de administración de 1 vez cada 2 semanas ha sido demostrada en varios estudios, tanto por vía iv como sc11,20. Los beneficios que puede suponer para los pacientes la reducción en el número de inyecciones, se hace patente cuando la administración es a través de la vía sc. En nuestro estudio, la administración se realiza a través del sistema de hemodiálisis, con lo que no procede tener en cuenta esta disminución en la frecuencia.
Por otro lado, para asegurar la eficacia del tratamiento, son necesarios unos depósitos adecuados de hierro. La deficiencia absoluta o funcional de hierro es la causa más común de una mala respuesta al tratamiento de la anemia en la IRC. Las guías europeas recomiendan8 un nivel de ferritina entre 200–500 y un TSAT entre 30–40% para el mantenimiento de unos depósitos adecuados de hierro, evitando la sobrecarga. En nuestro trabajo, los niveles de ferritina y TSAT se mantienen en el margen recomendado tanto en el mes basal como en cada periodo de tratamiento, gracias a la administación de hierro por vía iv en todos los casos que fue necesario.
En cuanto a la seguridad del tratamiento, se asumió que ambos fármacos tienen el mismo perfil de seguridad, constatado por otros autores en diversos estudios10,11,14,21. No obstante, dicha asunción constituye una posible limitación del estudio que convendría tener en cuenta en futuros diseños.
En conclusión, en nuestro estudio encontramos una eficacia similar de r-HuEpo y NESP en pacientes con IRC sometidos a hemodiálisis, pero con un incremento significativo de los costes asociado al tratamiento con NESP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.