Describir la estructura de la Comisión de Farmacia y Terapéutica y el proceso de selección de nuevos medicamentos de un hospital terciario.
Material y métodosSe revisan todas las actas de la Comisión de Farmacia y Terapéutica y las Guías para la Incorporación de Nuevos Fármacos recibidas en el periodo 2004–2007 en el Hospital Universitario Virgen del Rocío. Se realiza un estudio descriptivo que recoge variables relacionadas con el fármaco (grupo terapéutico, vía de registro, vía de administración y categoría legal), con el solicitante (servicio al que pertenece, categoría profesional y tipo de petición) y con el resultado de la evaluación (decisión final adoptada y tiempo de retraso entre la petición y la decisión).
ResultadosDe los 72 medicamentos solicitados, se aprobaron 45 (62,5%), 6 como equivalentes terapéuticos, 36 (80%) con recomendaciones específicas y 3 (4,2%) sin ninguna restricción. De los fármacos no incluidos, en 12 (81,1%) fue por insuficiente evidencia de su eficacia comparada con el tratamiento actual. El grupo terapéutico solicitado con más frecuencia fue el de los antineoplásicos, destacando Oncología y Hematología entre los peticionarios. Destaca el alto porcentaje de solicitantes que aportaron ensayos clínicos (97,2%) y datos referentes al coste (84,7%).
ConclusionesExiste un alto grado cumplimentación de la Guía para la Incorporación de Nuevos Fármacos en nuestro centro que garantiza una decisión final por parte de la Comisión de Farmacia y Terapéutica basada en la evidencia científica.
The purpose of this study is to describe the structure of the CFyT, the Pharmacy and Therapeutics Committee, and a tertiary hospital's selection process for new drugs.
Material and methodsAll annals of the P&TC and the New Drug Incorporation Guides (GINF) to incorporate new drugs received at Hospital Virgen del Rocío between 2004 and 2007 were reviewed. We carried out a descriptive study which collected variables having to do with the drug (drug type, type of register, route of administration and legal category), the petitioner (responsible division, professional category and request type) and the result of the evaluation (final decision, elapsed time between the request and the decision).
ResultsOf the 72 requested drugs, 45 (62.5%) were approved: six as equivalent treatments, 36 (80%) with specific recommendations, and three (4.2%) with no restrictions. Twelve drugs (81.1%) were not included due to insufficient evidence of their effectiveness compared with the current treatment. The most frequently-requested drug type was the antineoplastics, most commonly requested by Oncology and Haematology divisions. We highlight the fact that many of the petitioners included clinical trials (97.2%) and data referring to costs (84.7%).
ConclusionsThere is a high level of compliance with the GINF guide in our centre, which guarantees that the P&TC's final decision is based on scientific evidence.
La política de registro de medicamentos en la Unión Europea no permite evaluar los nuevos medicamentos en el contexto del resto de las alternativas existentes, lo que obliga a los hospitales a la realización de evaluaciones propias1,2. Esta función corresponde a las Comisiones de Farmacia y Terapéutica (CFyT)3. La decisión final de incorporar un medicamento a un hospital y el establecimiento de las condiciones de uso, en caso de inclusión, debe someterse a procedimientos regulados y basarse en el análisis de las evidencias disponibles4.
Pese a la coincidencia entre distintas instituciones en los criterios que deben aplicarse para evaluar los medicamentos y las herramientas utilizadas se ha identificado un apreciable grado de variabilidad entre las decisiones adoptadas por las CFyT en diferentes hospitales5–7.
Esta variabilidad puede tener su origen en la disparidad entre las herramientas empleadas en el proceso de selección de medicamentos y en diferencias relacionadas con la práctica asistencial que pueden implicar diferencias de equidad y accesibilidad a determinadas terapias8. Por ello, es necesario utilizar herramientas de trabajo normalizadas como guías de solicitud, informes de evaluación y protocolos de trabajo. También, evaluar la validez de estas herramientas, su nivel de implantación y de cumplimentación, así como la calidad de sus productos.
En una publicación previa de nuestro grupo se evaluó la actividad de la CFyT de nuestro hospital, así como la implantación de la Guía para la Incorporación de Nuevos Fármacos (GINF) durante el periodo 2002-039. Otros trabajos han evaluado la implantación de otras herramientas10, como el modelo de informe establecido en 2005 por el grupo GENESIS11.
El objetivo de este estudio ha sido describir la estructura de la CFyT y el proceso de selección de nuevos medicamentos de un hospital terciario en el periodo 2004-07.
Material y métodosSe realizó un análisis descriptivo de las características del proceso de solicitud y toma de decisiones de la CFyT del Hospital Universitario Virgen del Rocío, tomando como base un artículo previo publicado por nuestro grupo9.
La muestra del estudio estuvo constituida por todas las solicitudes de incorporación de nuevos medicamentos recibidas en la CFyT durante el periodo 2004–07. Dicha comisión revisa todos los medicamentos disponibles en el hospital, incluyendo extranjeros y usos compasivos relevantes, trabaja conforme a un protocolo normalizado que cumple los principales estándares12,13 y se sustenta fundamentalmente en dos instrumentos: la guía de solicitud GINF14 y el informe de evaluación GENESIS.
Se identificaron todos los medicamentos solicitados para evaluación en este periodo a través de las actas de la CFyT. Para cada uno de ellos se recogieron variables relacionadas con el fármaco (grupo terapéutico, vía de registro, vía de administración y categoría legal), con la persona solicitante (servicio al que pertenece, categoría profesional, sexo y tipo de petición) y con la solicitud GINF (una variable para cada una de las preguntas del cuestionario no contempladas en las anteriores).
Nuestras variables de estudio fueron las mismas que aparecen en el cuestionario para ser cumplimentadas por el solicitante. Así, para cada medicamento las variables recogidas fueron: grupo terapéutico según el primer dígito del código ATC o Sistema de Clasificación Anatómica, Terapéutica, Química oficial en España; la modalidad de registro según la situación existente en el momento de su evaluación como «centralizado o reconocimiento mutuo (agencia EMEA)», «nacional», «uso compasivo» o «medicamento extranjero»; la vía de administración según fuese «parenteral», «oral» u «otras»; la categoría legal del medicamento como «uso hospitalario», «diagnóstico hospitalario», «fórmula magistral», «medicamento extranjero», «receta» u «otros» según la situación finalmente adoptada en nuestro país para cada uno de ellos.
La categoría profesional del solicitante se recogió como «jefe de servicio»; «jefe de sección», «facultativo especialista de área (FEA)» o «médico interno residente» y el tipo de petición según fuese «a título individual», «consensuado con el resto de compañeros» o ««consensuado con los compañeros y con el jefe de servicio».
Las variables relacionadas con el cuestionario GINF se definieron tal como aparecen en el mismo en el caso de preguntas cerradas, y como dicotómicas, en el caso de preguntas abiertas, consignándose como «sí» cuando estuvieran cumplimentadas y como «no» cuando no se hubieran rellenado.
Además, se recogieron variables relacionadas con el proceso y resultado de la evaluación de la CFyT para cada medicamento (decisión final adoptada y tiempo de retraso entre la petición y la decisión), así como relacionadas con la labor de la comisión estratificada por años (número de reuniones, asistentes, invitados, puntos del orden del díay medicamentos evaluados). La decisión finalmente adoptada por la CFyT se clasificó según la decisión real tomada, sobre la base de las opciones que propone la propia GINF.
Todos los datos fueron recogidos y codificados por dos investigadoras que han trabajado de forma conjunta, siguiendo los mismos criterios y consensuando las posibles discrepancias. Para cada una de las variables se realizó una estadística descriptiva simple de distribución central mediante el programa informático SPSS versión 15.
Se estableció como resultado principal del estudio la tasa de aprobación de fármacos, analizándose su distribución según diversos estratos considerados como relevantes: categoría y servicio clínico del solicitante, grupo terapéutico y modalidad de registro del fármaco.
Respecto a la evaluación de la calidad de cumplimentación de la GINF, se consideraron cinco resultados diferentes: 1) la coincidencia de la indicación solicitada con la oficialmente aprobada en España como índice de las solicitudes «off label»; 2) la indicación o no del tratamiento actual alternativo como clave diferenciadora de la evaluación de las CFyT de los hospitales frente a la evaluación de las agencias reguladoras; 3) la inclusión de ensayos clínicos como elemento básico de calidad; 4) la inclusión de costes como evaluación del grado de implicación del clínico en el análisis económico15, y 5) la inclusión del número previsto de pacientes a tratar como elemento de calidad para el análisis del impacto asistencial y presupuestario. El grado de cumplimiento de estos apartados de la GINF se analizó por los mismos estratos de interés definidos anteriormente.
Se realizó un análisis comparativo con un trabajo similar realizado en el periodo 2002–03 con objeto de estudiar la evolución temporal de las variables principales9.
ResultadosA lo largo del periodo se evaluaron 72 solicitudes de incorporación de nuevos fármacos. Las características de los medicamentos, solicitudes y solicitantes se muestran en las tablas 1 y 2. El número de solicitudes aumentó progresivamente a lo largo de los años, pasando de 9 en 2004 a 26 en 2007.
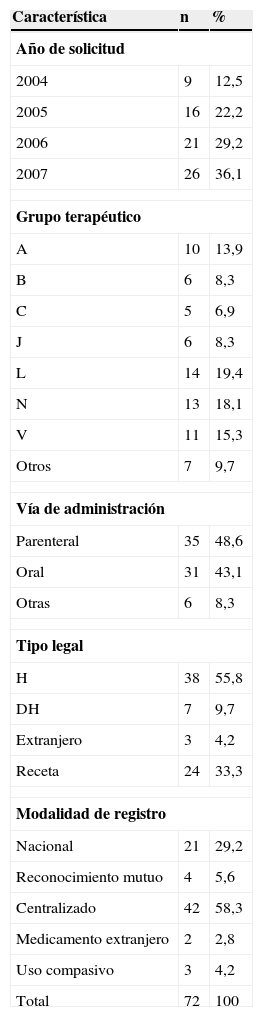
Características de los fármacos solicitados para evaluación en el Hospital Universitario Virgen del Rocío entre los años 2004 y 2007
| Característica | n | % |
| Año de solicitud | ||
| 2004 | 9 | 12,5 |
| 2005 | 16 | 22,2 |
| 2006 | 21 | 29,2 |
| 2007 | 26 | 36,1 |
| Grupo terapéutico | ||
| A | 10 | 13,9 |
| B | 6 | 8,3 |
| C | 5 | 6,9 |
| J | 6 | 8,3 |
| L | 14 | 19,4 |
| N | 13 | 18,1 |
| V | 11 | 15,3 |
| Otros | 7 | 9,7 |
| Vía de administración | ||
| Parenteral | 35 | 48,6 |
| Oral | 31 | 43,1 |
| Otras | 6 | 8,3 |
| Tipo legal | ||
| H | 38 | 55,8 |
| DH | 7 | 9,7 |
| Extranjero | 3 | 4,2 |
| Receta | 24 | 33,3 |
| Modalidad de registro | ||
| Nacional | 21 | 29,2 |
| Reconocimiento mutuo | 4 | 5,6 |
| Centralizado | 42 | 58,3 |
| Medicamento extranjero | 2 | 2,8 |
| Uso compasivo | 3 | 4,2 |
| Total | 72 | 100 |
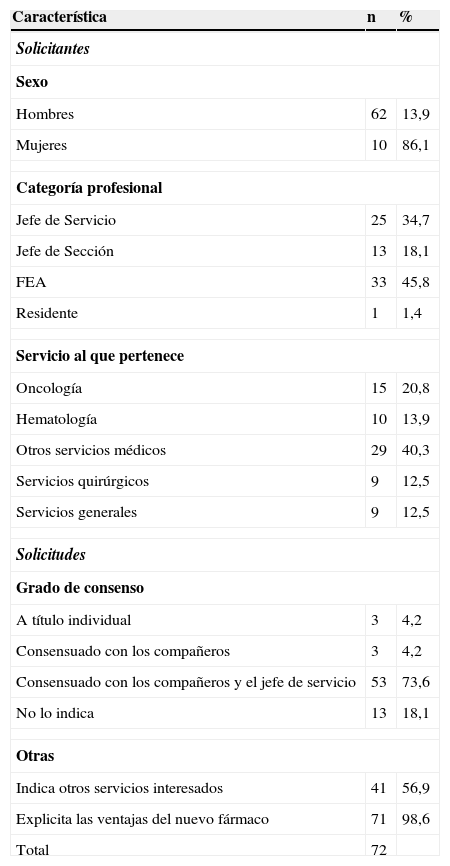
Características de las solicitudes y de los solicitantes de nuevos medicamentos en el Hospital Universitario Virgen del Rocío (2004-07). Grado de cumplimentación/adecuación del formato de la guía GINF
| Característica | n | % |
| Solicitantes | ||
| Sexo | ||
| Hombres | 62 | 13,9 |
| Mujeres | 10 | 86,1 |
| Categoría profesional | ||
| Jefe de Servicio | 25 | 34,7 |
| Jefe de Sección | 13 | 18,1 |
| FEA | 33 | 45,8 |
| Residente | 1 | 1,4 |
| Servicio al que pertenece | ||
| Oncología | 15 | 20,8 |
| Hematología | 10 | 13,9 |
| Otros servicios médicos | 29 | 40,3 |
| Servicios quirúrgicos | 9 | 12,5 |
| Servicios generales | 9 | 12,5 |
| Solicitudes | ||
| Grado de consenso | ||
| A título individual | 3 | 4,2 |
| Consensuado con los compañeros | 3 | 4,2 |
| Consensuado con los compañeros y el jefe de servicio | 53 | 73,6 |
| No lo indica | 13 | 18,1 |
| Otras | ||
| Indica otros servicios interesados | 41 | 56,9 |
| Explicita las ventajas del nuevo fármaco | 71 | 98,6 |
| Total | 72 | |
Los grupos terapéuticos para los que se recibieron más solicitudes fueron los de digestivo (A), antineoplásicos (L), sistema nervioso central (N), y varios (V). Al ser un estudio de ámbito hospitalario, los medicamentos de administración parenteral y de uso o diagnóstico hospitalario fueron mayoría. Más de la mitad de las solicitudes correspondían a medicamentos registrados por procedimiento centralizado.
En la distribución por servicio solicitante, los del área médica representaron el 75% del total y, entre ellos, destacaron los servicios de Oncología y Hematología como principales peticionarios de nuevos fármacos, sumando entre ambos el 34% de las mismos. La mayoría de las solicitudes estaban avaladas y consensuadas con el jefe del servicio. La mayoría de solicitantes fueron varones (86,1%).
De los 72 fármacos evaluados, 45 se aceptaron para su inclusión en la guía farmacoterapéutica del hospital (62,5%) y se desestimó el resto. De los medicamentos incluidos, 6 (13%) fueron considerados como equivalentes terapéuticos y 36 (80%) aprobados con restricciones o recomendaciones específicas para su uso. La clasificación final adoptada para cada uno de los fármacos individuales se recoge en la tabla 3.
Clasificación final adoptada por la CFyT sobre los fármacos evaluados
| Clase GINF | Fármaco | n (%) | |
| No incluidos (37,5%) | |||
| A2 | Ezetimiba | 1 (1,4) | |
| B1 | Ác. carglúmico | Olanzapina i.m. | 13 (18,1) |
| Citicolina | Pegaptanib | ||
| Duloxetina | Pregabalina en dolor neuropático | ||
| Ectainiscidina | Rifaximina | ||
| Fondaparinux | Ziconotide | ||
| Gadobutrol | Ziprasidona i.m. | ||
| B2 | Fotemustina | Nevibolol | 2 (2,8) |
| C1 | Bevacizumab en cáncer de mama | Micofenolato sódico | 11 (15,3) |
| Nimotuzumab | |||
| Buprenorfina | Oxicodona | ||
| Eplerenona | Paricalcitol | ||
| Erlotinib | Sunitinib | ||
| Macrogol/bicarbonato sódico/NaCl/KCl | Vinorelbina oral | ||
| Sí incluidos (62,5%) | |||
| C2 | Adalimumab | Insulina detemir | 6 (8,3) |
| Emtricitabina | Levo-bupivacaina | ||
| Infliximab | Peg-filgastrim | ||
| D | Aminolevulinato-hexilo | Fulvestrant | 36 (50) |
| Aprepitant | Gadofosveset | ||
| Aripiprazol | Laronidasa | ||
| Atazanavir | Lenalidomida | ||
| Atorvastatina | Levodopa/carbidopa | ||
| Azacitidina | Miglustat | ||
| Bivalirudina | Oxibato sódico | ||
| Bortezomib | Óxido nítrico | ||
| Candesartán | Óxido nitroso/oxígeno | ||
| Cetuximab | Parecoxib | ||
| Cinacalcet | Pemetrexed | ||
| Cisatracurio | Ranibizumab | ||
| Citarabina liposomal | Sitaxentan | ||
| Darunavir | Tacrolimus liberación sotenida | ||
| Entecavir | Tetrahidrobiopterina | ||
| Ertapenem | Tigeciclina | ||
| Etanercept | Valsartán | ||
| Fibrinógeno/trombina | Verde de indocianina | ||
| E | Ácido gadobénico | Hierro superparamagnético | 3 (4,2) |
| Cisteamina | |||
A2: no se incluye en la GFT por estar indicado en una patología que no requiere ser atendida desde la hospitalización o las unidades de pacientes externos; B1: no se incluye en la GFT por insuficiente evidencia de que exista una mejor relación eficacia-seguridad comparada con el tratamiento actual que se realiza en el hospital; B2: no se incluye en la GFT porque la evidencia existente indica un peor perfil de eficacia-seguridad respecto al tratamiento actual que se realiza en el hospital; C1: el medicamento es de una eficacia y seguridad comparables a las alternativas existentes para las indicaciones propuestas. Además, no aporta ninguna mejora en el perfil de coste-efectividad, ni en la organización o gestión de los servicios, por tanto, no se incluye en la GFT; C2: el medicamento es de una eficacia y seguridad comparables a las alternativas existentes para las indicaciones propuestas. Además, no aporta ninguna mejora en la relación coste-efectividad. Sin embargo, se estima que su incorporación a los procedimientos de compra podría suponer ventajas en la gestión. Por tanto, se incluye en la guía como equivalente terapéutico a las opciones existentes, por lo que el fármaco concreto que existirá en cada momento será el que resulte del procedimiento público de adquisiciones; D: se incluye en la GFT con recomendaciones específicas; E: se incluye en la GFT sin recomendaciones específicas.
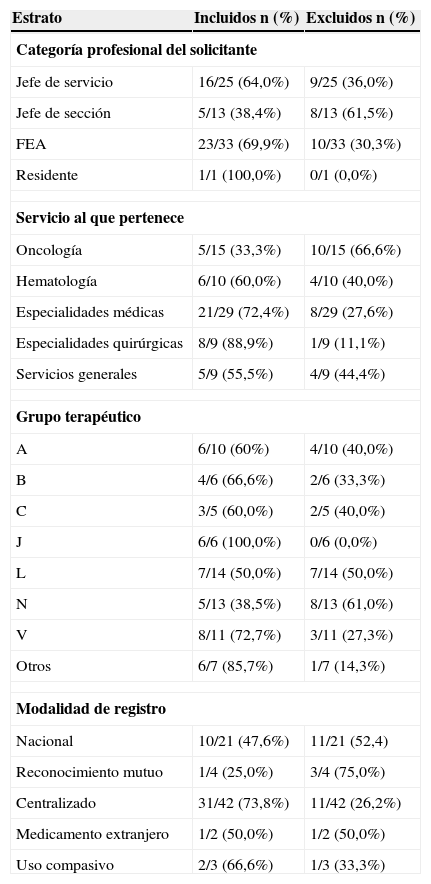
La distribución de medicamentos aprobados respecto a los no aprobados fue distinta según las principales características de las solicitudes, solicitantes y propios fármacos. En la tabla 4 se muestra que en todos los servicios fue mayor el porcentaje de fármacos incluidos que excluidos, salvo en Oncología, donde hubo un mayor porcentaje de fármacos no aprobados (66,6%). Por grupos terapéuticos, la mayor proporción de incorporados estuvo entre los antimicrobianos (fueron incluidos todos los solicitados) y la menor entre los medicamentos del grupo N (analgésicos y medicamentos para salud mental), donde solo se aprueba el 38,5% de las solicitudes. Salvo en dicho grupo, en todos los restantes fue mayor el porcentaje de fármacos incluidos respecto a los excluidos. De los antineoplásicos solicitados, la mitad se incluyeron y la otra mitad no.
Distribución del porcentaje de fármacos incluidos según diversas características de las solicitudes y los fármacos
| Estrato | Incluidos n (%) | Excluidos n (%) |
| Categoría profesional del solicitante | ||
| Jefe de servicio | 16/25 (64,0%) | 9/25 (36,0%) |
| Jefe de sección | 5/13 (38,4%) | 8/13 (61,5%) |
| FEA | 23/33 (69,9%) | 10/33 (30,3%) |
| Residente | 1/1 (100,0%) | 0/1 (0,0%) |
| Servicio al que pertenece | ||
| Oncología | 5/15 (33,3%) | 10/15 (66,6%) |
| Hematología | 6/10 (60,0%) | 4/10 (40,0%) |
| Especialidades médicas | 21/29 (72,4%) | 8/29 (27,6%) |
| Especialidades quirúrgicas | 8/9 (88,9%) | 1/9 (11,1%) |
| Servicios generales | 5/9 (55,5%) | 4/9 (44,4%) |
| Grupo terapéutico | ||
| A | 6/10 (60%) | 4/10 (40,0%) |
| B | 4/6 (66,6%) | 2/6 (33,3%) |
| C | 3/5 (60,0%) | 2/5 (40,0%) |
| J | 6/6 (100,0%) | 0/6 (0,0%) |
| L | 7/14 (50,0%) | 7/14 (50,0%) |
| N | 5/13 (38,5%) | 8/13 (61,0%) |
| V | 8/11 (72,7%) | 3/11 (27,3%) |
| Otros | 6/7 (85,7%) | 1/7 (14,3%) |
| Modalidad de registro | ||
| Nacional | 10/21 (47,6%) | 11/21 (52,4) |
| Reconocimiento mutuo | 1/4 (25,0%) | 3/4 (75,0%) |
| Centralizado | 31/42 (73,8%) | 11/42 (26,2%) |
| Medicamento extranjero | 1/2 (50,0%) | 1/2 (50,0%) |
| Uso compasivo | 2/3 (66,6%) | 1/3 (33,3%) |
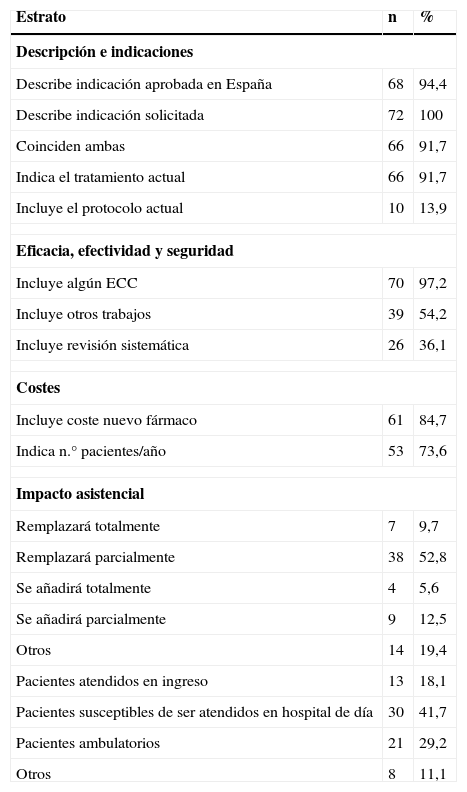
Los resultados referentes a la calidad de la cumplimentación de la GINF están recogidos en la tabla 5. Los apartados más cumplimentados fueron los relacionados con la descripción del fármaco y sus indicaciones, disponibles en más del 90% de las solicitudes, aunque la inclusión de protocolo de uso terapéutico solo se realizó en el 14% de ellas. El 97,2% de las solicitudes incluían al menos un ensayo clínico pivotal. Sin embargo, destaca como en dos de ellas (ácido gadobénico y gadobutrol) no se incluyó ninguno. La mayoría de las solicitudes (52,8%) estimaron que el nuevo medicamento reemplazaría parcialmente a la alternativa terapéutica anterior.
Características de cumplimentación de la GINF para el conjunto de todas las solicitudes
| Estrato | n | % |
| Descripción e indicaciones | ||
| Describe indicación aprobada en España | 68 | 94,4 |
| Describe indicación solicitada | 72 | 100 |
| Coinciden ambas | 66 | 91,7 |
| Indica el tratamiento actual | 66 | 91,7 |
| Incluye el protocolo actual | 10 | 13,9 |
| Eficacia, efectividad y seguridad | ||
| Incluye algún ECC | 70 | 97,2 |
| Incluye otros trabajos | 39 | 54,2 |
| Incluye revisión sistemática | 26 | 36,1 |
| Costes | ||
| Incluye coste nuevo fármaco | 61 | 84,7 |
| Indica n.° pacientes/año | 53 | 73,6 |
| Impacto asistencial | ||
| Remplazará totalmente | 7 | 9,7 |
| Remplazará parcialmente | 38 | 52,8 |
| Se añadirá totalmente | 4 | 5,6 |
| Se añadirá parcialmente | 9 | 12,5 |
| Otros | 14 | 19,4 |
| Pacientes atendidos en ingreso | 13 | 18,1 |
| Pacientes susceptibles de ser atendidos en hospital de día | 30 | 41,7 |
| Pacientes ambulatorios | 21 | 29,2 |
| Otros | 8 | 11,1 |
Respecto a la calidad del procedimiento de trabajo de la CFyT, la característica más relevante fue que el tiempo medio transcurrido entre la fecha de entrega de la GINF por el solicitante y la decisión tomada por la CFyT fue de 118±78 días, es decir, casi cuatro meses de media. Sin embargo, la mediana tiene un valor de 92 días, lo cual pone de manifiesto el peso de valores extremos. Tal fue el caso de ertapenem (306 días) (valor máximo), mientras que para otros medicamentos evaluados, como nimotuzumab, la decisión fue resuelta en el mismo mes en que se solicitaron.
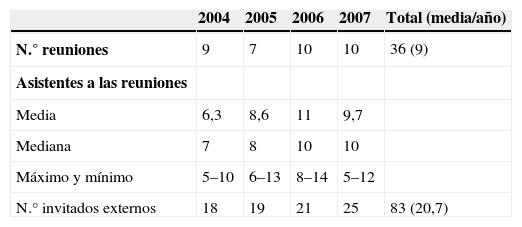
En la tabla 6 se muestran otras características del funcionamiento de la CFyT no vinculadas a variables relacionadas con el fármaco o la solicitud.
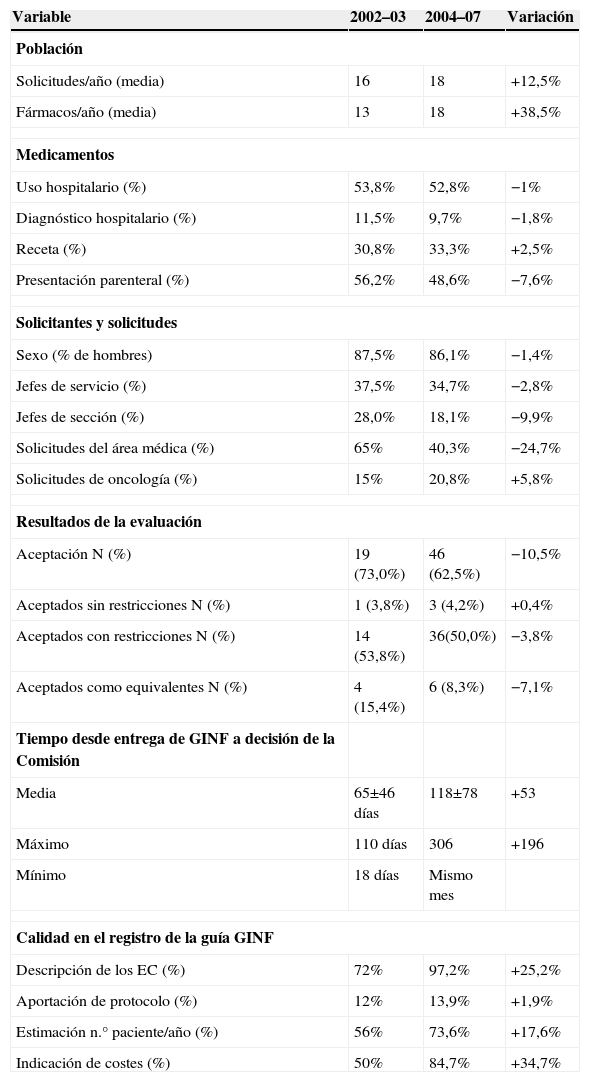
En la tabla 7 se muestra la variación experimentada por los principales indicadores del presente trabajo respecto a un estudio similar de nuestro grupo en el periodo 2002–03. Destaca como a pesar de un importante aumento en el número de fármacos evaluados anualmente entre ambos periodos, las características de los mismos y de los solicitantes se mantienen prácticamente constantes a excepción de una caída del 25% en las solicitudes provenientes del área médica. Es relevante también el descenso del porcentaje de medicamentos aceptados respecto al total de solicitados así como una ligera disminución en la tasa de los declarados equivalentes terapéuticos. Entre las variables que indicarían calidad en el registro de la GINF, destaca el aumento sustancial de todas las que presentaban bajo porcentaje de cumplimentación en la primera etapa, excepto el hecho de que el solicitante sigue sin aportar un protocolo.
Variación temporal de los principales indicadores del estudio actual respecto al trabajo previo del mismo grupo
| Variable | 2002–03 | 2004–07 | Variación |
| Población | |||
| Solicitudes/año (media) | 16 | 18 | +12,5% |
| Fármacos/año (media) | 13 | 18 | +38,5% |
| Medicamentos | |||
| Uso hospitalario (%) | 53,8% | 52,8% | −1% |
| Diagnóstico hospitalario (%) | 11,5% | 9,7% | −1,8% |
| Receta (%) | 30,8% | 33,3% | +2,5% |
| Presentación parenteral (%) | 56,2% | 48,6% | −7,6% |
| Solicitantes y solicitudes | |||
| Sexo (% de hombres) | 87,5% | 86,1% | −1,4% |
| Jefes de servicio (%) | 37,5% | 34,7% | −2,8% |
| Jefes de sección (%) | 28,0% | 18,1% | −9,9% |
| Solicitudes del área médica (%) | 65% | 40,3% | −24,7% |
| Solicitudes de oncología (%) | 15% | 20,8% | +5,8% |
| Resultados de la evaluación | |||
| Aceptación N (%) | 19 (73,0%) | 46 (62,5%) | −10,5% |
| Aceptados sin restricciones N (%) | 1 (3,8%) | 3 (4,2%) | +0,4% |
| Aceptados con restricciones N (%) | 14 (53,8%) | 36(50,0%) | −3,8% |
| Aceptados como equivalentes N (%) | 4 (15,4%) | 6 (8,3%) | −7,1% |
| Tiempo desde entrega de GINF a decisión de la Comisión | |||
| Media | 65±46 días | 118±78 | +53 |
| Máximo | 110 días | 306 | +196 |
| Mínimo | 18 días | Mismo mes | |
| Calidad en el registro de la guía GINF | |||
| Descripción de los EC (%) | 72% | 97,2% | +25,2% |
| Aportación de protocolo (%) | 12% | 13,9% | +1,9% |
| Estimación n.° paciente/año (%) | 56% | 73,6% | +17,6% |
| Indicación de costes (%) | 50% | 84,7% | +34,7% |
Este trabajo ha evaluado la actividad de la CFyT de un importante hospital por su tamaño y complejidad. Respecto a la descripción de las solicitudes recibidas destaca que el número de medicamentos evaluados ha crecido a lo largo de los años lo cual no se debe al incremento en el número de medicamentos comercializados en nuestro país en este periodo que se ha mantenido estable16, sino quizás, a la mayor proporción de medicamentos de uso hospitalario comercializados en este periodo o a razones relacionadas con la implementación de la guía GINF. Esta guía se hizo obligatoria al principio del periodo evaluado. La mayor familiaridad de los clínicos con dicha herramienta ha podido influir en el aumento de las solicitudes, así como el hecho de que los laboratorios fabricantes reaccionaron ofreciendo a los hospitales guías posiblemente redactadas en sus departamentos de información como ha sido publicado en otra parte17. De la misma manera, estos factores han podido propiciar la mejora en los índices de cumplimentación a lo largo de los años. Las características de los medicamentos evaluados están dentro de lo esperable y prácticamente no han variado a lo largo de los años. Los medicamentos de prescripción o uso exclusivamente hospitalario, los grupos terapéuticos donde estos predominan (con la excepción de la alta frecuencia de solicitud de medicamentos de acción en SNC donde predominan los no hospitalarios), los medicamentos con administración parenteral y aquellos con registro centralizado dominan las solicitudes. Dichos medicamentos son, de hecho, los que alcanzan mayores porcentajes de aceptación, aunque hay que destacar que nuestro hospital se ha caracterizado en estos años por no incluir en su guía farmacoterapéutica (por motivos de efectividad comparada y coste-efectividad) algunos medicamentos de uso hospitalario con lo que, de facto no podrán ser utilizados en el área de salud.
Igualmente destaca como nuestra CFyT trabaja fundamentalmente para evaluar las solicitudes de los servicios médicos y en especial de Oncología y Hematología. Esta situación hace imprescindible una formación específica de los miembros de la CFyT y de los responsables de la elaboración de los informes en aspectos diferenciales de la farmacoterapia del cáncer, por ejemplo en el diseño de ensayos clínicos, en el establecimiento de la significación clínica o en las medidas del coste efectividad, etc.
El perfil del solicitante habitual es un hombre con o sin responsabilidades de gestión, fundamentalmente del área médica y que realiza la solicitud después de un proceso de consenso en su servicio. Desde un punto de vista de gestión, parecería importante que las solicitudes de nuevos medicamentos se realizaran por el responsable de la unidad. Sin embargo, dada la necesaria implicación del clínico en la cumplimentación de la guía GINF en la comparecencia en la CFyT es mejor que se responsabilice de la solicitud el clínico que atiende directamente a esos pacientes.
La variación del porcentaje de solicitudes aceptadas respecto a las distintas categorías analizadas, tampoco depara resultados inesperados. Destacan la alta tasa de aceptación general, probablemente derivada de que los medicamentos solicitados son ya de por sí una selección de los comercializados, el relativamente alto porcentaje de medicamentos incluidos como equivalentes terapéuticos derivado de la mayor experiencia y documentación sobre cómo abordar este criterio y la aceptación generalizada con condiciones de uso, probablemente derivada del pequeño beneficio marginal y alto coste de los nuevos medicamentos.
Para algunos grupos como los antimicrobianos o los medicamentos del grupo terapéutico V la tasa de aceptación fue mayor. En el primer caso, quizás debido a la larga tradición en nuestro hospital de circunscribir la solicitud de antimicrobianos a pocos servicios clínicos con claros criterios de evaluación como enfermedades infecciosas, hematología o cuidados críticos. En el segundo caso, los medicamentos incluidos en el grupo V, se refieren a contrastes radiológicos para resonancia nuclear magnética, inmunosupresores y anti-TNF, medicamentos de por sí valiosos para el hospital. Para los medicamentos con acción en SNC, muchos de ellos de aplicación en psiquiatría, para los medicamentos oncológicos y del sistema digestivo, la tasa de rechazo fue mayor. La razón del bajo porcentaje de inclusión de medicamentos anticancerosos, siendo el grupo de los más demandados, quizás se deba a que aportan pequeños beneficios marginales en términos de supervivencia o calidad de vida, mientras que su coste multiplica exponencialmente el de las alternativas disponibles, tal como ha sido identificado por otros autores para los nuevos anticancerosos aprobados por la EMEA18,19.
Los buenos resultados generales en la respuesta al instrumento GINF denotan que ha sido incorporado a la rutina asistencial con toda normalidad. Estos indicadores mejoran con los años y tienen diferencias significativas respecto al anterior trabajo de nuestro grupo realizado al inicio de su implantación. Tal como figura explícitamente en su diseño13, este instrumento mantiene una tensión entre solicitar información esencial para la toma de decisiones e información de excelencia, ya que la mayoría de los peticionarios cumplimentan las secciones esenciales mientras que existen algunas escasamente cumplimentadas.
Respecto a otras características de funcionamiento de la CFyT, se pueden considerar aceptables y estables en el tiempo. Respecto al número de invitados, este dato está en relación con el número de medicamentos evaluados, (puesto que se invita al menos a un clínico por medicamento), que aumentaron a lo largo del periodo, pero sobre todo con otras actividades que se han incrementado como la revisión sistemática del cumplimiento de las recomendaciones de uso, la elaboración de protocolos y otras.
El presente trabajo supone una de las pocas evaluaciones de la actividad de una comisión de farmacia detectadas en la literatura de los últimos años. Pensamos que puede suponer un punto de partida para definir indicadores, variables de medida y estándares de evaluación de la CFyT. De hecho, podría ser un referente para trabajos posteriores, al menos en España. En nuestro país, Martínez-López et al publicaron un trabajo que, aunque se centraba en los informes de evaluación, presentaba algunos datos sobre actividad de la CfyT10, similares a los nuestros en cuanto a número de medicamentos evaluados y tasa de aceptación (algo mayor). Weekes et al propusieron en 1998 una batería de indicadores que ellos entendían de utilidad para evaluar las CFyT de los hospitales australianos. Se trata de 35 indicadores, la mayoría de ellos dicotómicos y de evaluación cualitativa que distan mucho del objetivo y metodología del presente estudio20.
Diversas encuestas han analizado indicadores de actividad de las CFyT en ámbitos tan distintos como Bélgica, Inglaterra o USA21–23. En general, utilizan indicadores cuantitativos de composición y actividad de las CFyT, por demás muy diferentes entre unas y otras y escasos indicadores de resultado.
Es posible que la principal limitación de este trabajo es el hecho de que se refiere a un solo hospital y por lo tanto los resultados están muy influenciados por las dimensiones, características y cultura de este centro. Será necesario esperar los resultados de un amplio trabajo realizado por el grupo GENESIS de la Sociedad Española de Farmacia Hospitalaria que pretende analizar la estructura, funcionamiento y resultados de una amplia muestra de CFyT a nivel nacional y cuyos resultados preliminares han sido presentados en otra parte24.
Otra importante limitación es que la evaluación se ha basado exclusivamente en ciertos elementos de la estructura de la comisión y, sobre todo, de sus procedimientos (proceso). Sería necesario en el futuro dar un paso más y poder evaluar la adecuación de la toma de decisiones a la evidencia disponible. Es decir, determinar la validez de las decisiones de una comisión de este tipo, analizando la calidad de los estudios que las sustentan.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Emilia Barrot-Cortés, Ana Bernáldez López, José Manuel Blanco Hidalgo, Ana Casas Fernández de Tejerina, Francisco Javier Dapena Fernández, Francisco Domínguez Abascal, Juan Carlos Domínguez Camacho, Elena Hevia Alonso, Francisco Javier Jiménez Jiménez, María Ángeles Martínez Maestre, Rafael Medina López, Ramiro José Núñez Vázquez, Diego José Rangel Sousa y Federico Relimpio Astolfi, como miembros de la CFyT del Hospital Universitario Virgen del Rocío por su trabajo y colaboración.