Optimizar el método bioanalítico HPLC-UV empleado hasta el momento en el Hospital Clínico Universitario de Salamanca, para la determinación de los niveles plasmáticos de la lamotrigina (LTG).
Material y métodosLa técnica analítica de HPLC-UV desarrollada y utilizada hasta el momento demostró ser lineal, exacta y precisa, siendo apta para su empleo en la monitorización rutinaria de la LTG. Sin embargo, presentaba un prolongado tiempo para el análisis de las muestras, por lo que se optó por una mejora en la misma. Dicha mejora consistió en el empleo de una columna cromatográfica alternativa a la usada hasta el momento. Para ello se sustituyó la habitualmente empleada (Kromasil-100C18–5μm–15*0,4cm por la LiChroCART-RP18e–3μm–5,5*0,4cm) realizando en ambos casos una extracción líquido-líquido y siguiendo el mismo protocolo de extracción de muestra.
ResultadosAmbas validaciones demostraron que los dos tipos de columnas son válidos para la monitorización rutinaria de la LTG.
ConclusiónLa disminución en el tiempo de retención, junto con el menor límite de cuantificación y los mejores parámetros de precisión y exactitud obtenidos con la columna LiChorCART, sugieren a esta como una candidata ideal para la práctica clínica debido al gran número de determinaciones que pueden realizarse en un menor tiempo y la mayor precisión en la cuantificación de la LTG.
The purpose of this study was to optimise the HPLC-UV bio-analytical method currently used by the Salamanca University Clinical Hospital for determining lamotrigine plasma levels.
Material and methodsThe developed HPLC-UV analytic technique currently in use was shown to be linear, exact and precise, and suitable for use in routine monitoring of lamotrigine levels. The drawback of this method has always been the time required for analysing samples, so our aim was to improve on that elapsed time. That improvement involved using a different chromatographic column from the one used up until now. We replaced the column that was normally used (Kromasil-100C18–5μm-15*0.4cm with a LiChroCART-RP18e–3μm-5.5*0.4cm); in both cases, a liquid-liquid extraction was performed and the same sample extraction protocol was followed.
ResultsBoth validation methods showed that the two column types are valid for routine lamotrigine monitoring.
ConclusionThe decrease in retention time, in addition to a lower quantification limit and better precision and accuracy parameters obtained with the LiChorCART column, suggest that this unit is ideal for use in clinical practice because it enables a large number of determinations to be performed in less time and the greater precision of LTG measurements.
La lamotrigina (LTG) (3,5-diamino-(6[2,3-diclorofenil]-1,2,4-triazina) es un agente antiepiléptico cuya estructura química no está relacionada con otros antiepilépticos habitualmente utilizados.
Presenta una actividad farmacológica similar a la de otros fármacos antiepiléticos como la fenitoína o la carbamazepina1,2. Es un medicamento efectivo como coadyuvante para el tratamiento de crisis parciales simples y crisis tónico-clónicas, con generalizaciones secundarias resistentes a otros tratamientos farmacológicos3.
La monitorización rutinaria de los fármacos antiepilépticos es una práctica habitual en los servicios de farmacia hospitalaria debido a la gran ayuda que esto supone para los pacientes, ya que el óptimo control de las concentraciones plasmáticas es una herramienta clave para el buen control de las crisis, ayudándonos del mismo modo a ampliar el conocimiento de las diferentes interacciones que se producen cuando se administra junto con otros fármacos antiepilépticos, especialmente inductores e inhibidores enzimáticos4–7.
Desde el punto de vista farmacocinético es de gran utilidad, puesto que, si bien existe un margen terapéutico no muy bien definido8–10 ya que este es muy amplio, el mayor conocimiento del fármaco nos permitiría un mejor ajuste del mismo. Además, este tipo de determinaciones pueden ser aplicadas para estudios poblacionales11, siendo esta, junto con una optimización y reducción en el tiempo de las determinaciones plasmáticas de la LTG, algunas de las razones por las que en el presente trabajo hemos estudiado el efecto de la longitud de la columna y el tamaño de partícula en el tiempo de análisis, el límite de cuantificación y la exactitud y precisión de las dos técnicas de cromatografía líquida de alta eficacia con detector ultravioleta (HPLC-UV) utilizando el margen de concentraciones de 0,5–20,0μg/ml (margen de concentraciones plasmáticas habituales en humanos).
Materiales y métodosMaterialLa LTG BW430C78 (3,5-diamino-(6[2,3-diclorofenil]-1,2,4-triazina) y su estándar interno BW725C78 ([3,5-diamino-6-][2-metoxifenil])-1,2,4-triazina estándar interno (SI) fueron proporcionados por Wellcome Research Laboratories (Cardiff, Reino Unido).
Los reactivos usados (dihidrógeno fosfato potásico, hidróxido sódico, trietilamina) de grado analítico y metanol de grado HPLC fueron adquiridos a través de Merck (MerckKGaA, Darmstadt, Alemania). El agua purificada se obtuvo en el laboratorio con un sistema de purificación de agua Milli-Q. El plasma humano se obtuvo del banco de sangre del Hospital Clínico Universitario de Salamanca (HUSAL).
Preparación de estándaresEn primer lugar, se prepara una solución madre de LTG en metanol de concentración de 500μg/ml. Esta solución es diluida después en plasma para preparar la solución de trabajo, de concentración de 20,0μg/ml. A partir de esta solución de trabajo los estándares que se preparan son de concentraciones de 15,0; 10,0; 8,0; 6,0; 4,0; 2,0; 1,0; 0,5; 0,25; 0,15 y 0,1μg/ml de LTG.
En el caso del SI se prepara una solución madre de 500μg/ml en metanol, a partir de la cual se prepara la solución de trabajo de concentración de 20,0μg/ml.
CromatógrafoLa técnica analítica utilizada fue la HPLC. El sistema cromatográfico empleado fue el sistema HP1050 con inyector automático y dectector UV de Waters 486 y el software Clarity®.
La separación cromatográfica se realizó con dos tipos de columnas: Kromasil 100 C18 5μm 15*0,4 y LiChroCART RP18e 5,5* 0,4μcm (TeknoKroma).
Las condiciones cromatográficas fueron: la fase móvil consistió en una mezcla de 0,1M KH2PO4, trietielamina y metanol (62:3:35% v/v) con un pH=6,2. La fase móvil se preparaba diariamente, desgasificándola y filtrándola con un filtro de membrana de 0,45μm.
El proceso cromatográfico se llevaba a cabo a temperatura ambiente con un flujo de trabajo de 1ml/min y con luz UV a una longitud de onda de 206nm.
Procedimiento de extracción de LTG/SIEl proceso de extracción consistió en una extracción líquido- líquido. A 50μl de SI+50μL de 2M NaOH se añadían a 500μl de muestra; la mezcla se agitaba durante 30s y posteriormente se añadían 2ml de acetato de etilo como solvente orgánico. Tras 30s de agitación en vortex, se recogía la fase orgánica y se centrifugaba durante 10min a 3.500rpm. Después, y como paso final, se evaporaba en atmósfera de N2 y se reconstituía con 100μl de fase móvil inyectándose en el cromatógrafo un volumen de 50μl12.
Validación de la técnica bioanalíticaSe ha estudiado la selectividad, exactitud y precisión siguiendo las premisas de la FDA13.
Para estudiar la selectividad de la técnica se analizaron 6 blancos de plasma de orígenes distintos. El estudio de linealidad se realizó preparando 5 curvas de calibración con el margen de concentraciones comprendido entre 0,5 y 20,0μg/ml (0,5; 1,0; 2,0; 4,0; 6,0; 8,0; 10,0; 15,0 y 20,0μg/ml). Con los datos obtenidos calculamos el valor de r, el coeficiente de variación del factor relativo de respuesta y la desviación de la media del factor respuesta para cada concentración.
A partir de los datos del estudio de linealidad determinamos la exactitud de la técnica como porcentaje de recuperación de la cantidad de LTG añadida a cada muestra.
En cuanto a la precisión, se estudió tanto la repetibilidad como la reproducibilidad de ambos métodos. Para estudiar la repetibilidad, o precisión intradía, la misma persona preparó y analizó cinco réplicas de las concentraciones altas, medias y bajas, el mismo día y con los mismos reactivos. Para el estudio de reproducibilidad, o precisión interdía, el mismo analista preparó igualmente cinco replicas de las concentraciones altas, medias y bajas de la concentración de LTG, pero en este caso en diferentes días y con diferentes reactivos. En ambos casos se calcularon los CV del área (área LTG/área SI) en los 5 análisis.
Adicionalmente, determinamos los límites de cuantificación siguiendo el método de Lang and Bolton14. El margen de concentraciones entre 0,5 y 0,1μg/ml (0,5; 0,25; 0,15 y 0,1μg/ml) se prepararon por triplicado.
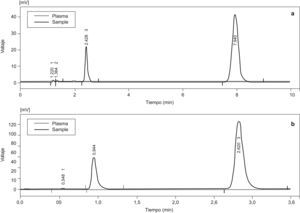
ResultadosPara estudiar la selectividad de la técnica se analizaron 6 blancos de plasma de orígenes distintos observándose que, tal y como se representa en la figura 1, a los tiempos de retención de la LTG y de su SI no aparecen picos fantasmas de componentes del plasma. De la misma manera se realizaron diferentes estudios con plasmas de pacientes en politerapia con distintos fármacos antiepilépticos observándose el mismo efecto, la no interferencia en ninguno de los casos. De la misma manera se encontró una excelente separación entre el pico de LTG y su SI, y entre este último y otros componentes de las muestras plasmáticas. Los tiempos de retención de la LTG fueron de 7,94 y 2,62 y para su SI 2,43 y 0,95min para las columnas Kromasil y LiChroCART, respectivamente.
Los resultados de los límites de cuantificación fueron 0,25 y 0,1μg/ml para las columnas Kromasil y LiChroCART, respectivamente.
La validación de ambas técnicas ha proporcionado unos resultados que pueden verse en las tablas 1 y 2 del presente documento.
Resultados del estudio de validación con la columna Kromasil para las concentraciones de margen estudiadas (0,5–20μg/ml)
| Media±SD | CV % | |
| r | 0,998 | |
| Fr (factor respuesta) | 0,55±0,03 | 6,07 |
| Exactitud (% recuperación) | 101,83±7,39 | 7,25 |
| Repetibilidad (área LTG/área SI) | ||
| 0,5μg/ml | 0.27±0,01 | 1,99 |
| 6,0μg/ml | 3,35±0,21 | 6,40 |
| 20,0μ/ml | 11,31±0,15 | 1,29 |
| Reproducibilidad (área LTG/área SI) | ||
| 0,5μg/ml | 0,29±0,01 | 4,55 |
| 6,0μg/ml | 3,55±0,27 | 7,68 |
| 20,0μ/ml | 11,49±0,27 | 2,31 |
| Límite de cuantificación | 0,25μg/ml | |
Resultados del estudio de validación realizados con la columna LiChroCART para el margen de concentraciones estudiadas (0,5–20μg/ml)
| Media±SD | CV % | |
| r | 0,999 | |
| fr (factor respuesta) | 0,55±0,03 | 6,07 |
| Exactitud (% recuperación) | 100,13±3,42 | 3,41 |
| Repetibilidad (área LTG/área SI) | ||
| 0,5μg/ml | 0,33±0,01 | 3,90 |
| 6,0μg/ml | 3,60±0,05 | 1,31 |
| 20,0μ/ml | 11,82±0,36 | 3,05 |
| Reproducibilidad (área LTG/área SI) | ||
| 0,5μg/ml | 0,32±0,02 | 6,64 |
| 6,0μg/ml | 3,49±0,14 | 4,12 |
| 20,0μ/ml | 11,56±0,37 | 3,20 |
| Límite de cuantificación | 0,1μg/ml | |
El estudio de la optimización de la técnica analítica de HPLC-UV para la determinación de las concentraciones plasmáticas de LTG ha demostrado que es un método adecuado para la monitorización farmacocinética, dentro de los límites del rango terapéutico de (3–14μg/ml), que es lo habitualmente encontrado en la práctica clínica.
La selección de ambas columnas se ha realizado en función de las similitudes en sus características físicoquímicas, siendo la principal diferencia entre ambas el menor tamaño de partícula y longitud. El hecho de realizar la comparativa de ambas columnas se ha debido al intento por mejorar la técnica bioanalítica, permitiendo de este modo aumentar, como ya se ha mencionado anteriormente, tanto el número como la precisión de las determinaciones realizadas.
El poder contar con un método bioanalítico exacto, preciso, repetible, reproducible y rápido permite establecer un sistema de monitorización rutinaria en la práctica clínica, así como la posibilidad de realizar estudios farmacocinéticos para determinar y estudiar de esta manera tanto el comportamiento del fármaco en sí como las posibles interacciones con otros fármacos.
A partir de los resultados obtenidos y teniendo en cuenta la complejidad del tratamiento de las muestras, una vez que el método ha sido validado, se ha tomado como criterio de un buen tratamiento de los datos una variabilidad máxima del área del SI del 15% respecto al valor de la media de los datos obtenidos en la validación. Todas las muestras que sobrepasen este valor deberán ser repetidas ya que es posible que se haya cometido algún error durante la preparación de las muestras. Tales errores se reflejan así en el área del SI.
Por lo tanto el estudio nos permite concluir que la columna LiChroCART sería la candidata mas adecuada para la monitorización rutinaria de la LTG en la práctica clínica debido a la disminución en el tiempo de análisis y la adecuabilidad de la técnica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.