el objetivo del presente trabajo fue realizar una comparación indirecta ajustada, según el perfil citogenético, en términos de eficacia, entre los distintos inhibidores de la tirosin cinasa de bruton empleados como monoterapia en primera línea para la leucemia linfocítica crónica. Asimismo, se evaluaron los resultados de seguridad considerados de interés para establecer si dichas opciones pueden ser consideras alternativas terapéuticas equivalentes.
Métodocon fecha 10 de noviembre del 2022, se llevó a cabo una búsqueda bibliográfica en las bases de datos de Pubmed y Embase de ensayos clínicos fase III que estudiaran los inhibidores de la tirosin cinasa de Bruton en monoterapia en contexto de primera línea para la leucemia linfocítica crónica. Se incluyeron ensayos en los que se empleara la combinación de bendamustina y rituximab como comparador y que presentaran poblaciones y tiempos de seguimiento semejantes. Se combinaron mediante metaanálisis los resultados de los subgrupos según las características mutacionales clasificando a los pacientes en alto y bajo riesgo citogenético. Se desarrolló una comparación indirecta ajustada utilizando el método de Bucher. Se determinó la posible equivalencia terapéutica aplicando para ello la guía de alternativas terapéuticas equivalentes.
Resultadode los 39 estudios obtenidos en la revisión, se seleccionaron 2 ensayos clínicos: uno para zanubrutinib y otro para ibrutinib. El resto de estudios no se incluyeron por incumplimiento de los criterios de inclusión. Los resultados obtenidos en la comparación indirecta ajustada para ambos subgrupos de riesgo citogenético no mostraron diferencias estadísticamente significativas. En cuanto a la seguridad, las diferencias más relevantes se encontraron en la incidencia de fibrilación auricular, hipertensión arterial y eventos cardiovasculares en los pacientes tratados con ibrutinib, y mayor incidencia de cánceres secundarios en los pacientes tratados con zanubrutinib. Aplicando los criterios de la guía ATE, ambos tratamientos no podrían ser considerados alternativas terapéuticas equivalentes.
Discusiónasumiendo la incertidumbre asociada a la comparación indirecta ajustada, zanubrutinib podría ser considerado de similar beneficio clínico en eficacia a ibrutinib, sin embargo, la presencia de características diferenciadoras en el perfil de seguridad impide asignar a ambas alternativas como alternativas terapéuticas equivalentes a todos los efectos.
The aim of this study was to perform an adjusted indirect treatment comparison, according to the cytogenetic profile, in terms of efficacy between different Bruton tyrosine kinase inhibitors used as first-line monotherapy for chronic lymphocytic leukemia. Safety outcomes considered of interest were also evaluated to establish whether these options can be considered equivalent therapeutic alternatives.
MethodA literature search was conducted in Pubmed and Embase on 10 November 2022 for phase III clinical trials studying Bruton's tyrosine kinase inhibitors in monotherapy in the first-line setting for CLL. Results were filtered according to whether the combination of bendamustine and rituximab was used as comparator and whether they had similar populations and follow-up times. Subgroup results were meta-analyzed according to mutational characteristics by classifying patients into high and low cytogenetic risk. An adjusted indirect comparison was developed using Bucher's method. Possible therapeutic equivalence was determined by applying the guide to equivalent therapeutic alternatives.
ResultOf the 39 studies obtained in the review, two clinical trials were selected: one for zanubrutinib and one for ibrutinib. The remaining studies were not included because they did not meet the inclusion criteria. The results obtained in the adjusted indirect treatment comparison for both cytogenetic risk subgroups showed no statistically significant differences. The most relevant safety differences were auricular fibrillation, hypertension and cardiovascular events in patients treated with ibrutinib and higher incidence of secondary cancers in patients treated with zanubrutinib. Applying the ATE guideline criteria, both treatments cannot be considered equivalent therapeutic alternatives.
ConclusionsAssuming the uncertainty associated with the adjusted indirect comparison, zanubrutinib could be considered equivalent in efficacy to ibrutinib, however, the presence of differentiating safety features precludes assigning the two alternatives as equivalent therapeutic alternatives.
La leucemia linfocítica crónica (LLC) es una enfermedad hematológica caracterizada por la proliferación y acumulación de células B maduras con funcionalidad comprometida en sangre y en distintos tejidos como médula ósea y tejidos linfoides, lo que conlleva a la aparición de los conocidos síntomas B, junto a adenopatías, síndromes anémicos e infecciones1. De manera predominante, afecta a pacientes de edad avanzada, siendo su frecuencia mayor en hombres, con una proporción de 2:12. Actualmente la LLC es la forma de leucemia más frecuente en países occidentales, representando alrededor del 30% de los casos3.
Según datos reportados por la Sociedad Americana Contra El Cáncer, se estima que 20.160 nuevos pacientes serán diagnosticados en total para el año 20224.
Actualmente, la elección del arsenal terapéutico empleado dependerá de los factores citogenéticos presentes al inicio del diagnóstico tales como la deleción 17p (del[17p]), mutación del gen TP53, deleción 11q (del[11q]) y el estado mutacional de las regiones variables de las cadenas pesadas de la inmunoglobulina (IgHV), además de la edad y el estado funcional del paciente. En el contexto de la primera línea de tratamiento, existen disponibles distintos esquemas de quimioterapia y de quimioinmunoterapia, junto con inhibidores de la tirosin cinasa de bruton (iBTK) y los inhibidores BCL-25,6.
Ibrutinib fue el primer iBTK aprobado por la European Medicine Agency (EMA), tras los resultados publicados por el estudio Resonate-2, donde se comparó su eficacia frente a clorambucilo. Dicho estudio presentó datos actualizados a 8 años de seguimiento, mostrando beneficio en supervivencia libre de progresión (SLP) frente a clorambucilo en monoterapia con un Hazard Ratio (HR) de 0,154 (IC95% 0,108–0,220)7. En 2020 se publicó el ensayo ELEVATE-TN, donde se mostró la eficacia y seguridad de acalabrutinib, primer iBTK de segunda generación, con y sin obinutuzumab, frente a clorambucilo-obinutuzumab, en primera línea de la LLC. Tanto acalabrutinib en combinación con obinutuzumab como en monoterapia mostraron beneficio en SLP frente al comparador, sin embargo, no se observó beneficio en términos de supervivencia global (SG)8.
Actualmente se ha publicado el ensayo fase III SEQUOIA, donde se muestran los resultados de eficacia y seguridad en pacientes tratados con zanubrutinib frente a bendamustina-rituximab (BR), mostrando un beneficio en SLP, pero no en SG9.
Tras la aparición de este nuevo iBTK existe la incertidumbre sobre si estos fármacos presentan diferencias relevantes en términos de eficacia, pudiendo posicionar uno sobre otro en el contexto de la primera línea de tratamiento. Las comparaciones indirectas ajustadas (CIA), a través de un comparador común, permiten mostrar la eficacia relativa de 2 o más alternativas que no disponen de comparaciones directas a través de ensayos clínicos aleatorizados. La interpretación de la relevancia clínica de la diferencia encontrada en la CIA (mediante un valor delta, Δ, máxima diferencia considerada clínicamente relevante) nos permite valorar si las distintas opciones pueden ser consideras alternativas terapéuticas equivalentes (ATE)10, es decir, alternativas de similar beneficio clínico.
El objetivo del presente trabajo es realizar una CIA, según el perfil citogenético, en términos de eficacia, entre los distintos iBTK empleados como monoterapia en primera línea para la LLC, utilizando BR como comparador común, y establecer si dichas alternativas pueden ser consideras ATE.
MetodologíaBúsqueda en la bibliografía y criterios de inclusiónSe realizó una búsqueda en las bases de datos Pubmed y Embase, para determinar los ensayos clínicos fase III que estudiaran los iBTK en monoterapia en primera línea de tratamiento para la LLC. Se aplicaron los siguientes filtros: clinical queries (preguntas clínicas), narrow (estrecho), Clinical Trial Phase III (ensayos clínicos fase III) para la base de datos Pubmed; y Publication types – article (tipo de publicación – artículo), Clinical Trial Phase III (ensayos clínicos fase III) para Embase. Los términos de búsqueda empleados fueron: (ibrutinib OR acalabrutinib OR zanubrutinib) AND chronic lymphocytic leukemia AND (untreated OR treatment-naive OR naive OR first-line OR first-line treatment). Asimismo, se realizó un análisis de referencias bibliográficas (rastreo de citas) y una búsqueda complementaria no sistemática de páginas web. Los estudios incluidos fueron aquellos que empleaban BR como comparador común y presentaran poblaciones y tiempos de seguimiento semejantes. La variable principal para la comparación fue la SLP, definida como el tiempo transcurrido desde la aleatorización hasta la progresión o la muerte (lo que ocurra primero). Se excluyeron los estudios que no presentaran datos de supervivencia.
Análisis de los datosPara determinar los pacientes según el perfil citogenético, se realizó un metaanálisis de los subgrupos, clasificando a los pacientes en alto riesgo (pacientes con del17p, mutación TP53, del11q y/o IgHV no mutadas) y bajo riesgo (sin del17p, mutación TP53, del11q y/o IgHV mutadas), mediante la calculadora de Joaquín Primo11. La heterogeneidad y la consistencia se analizaron mediante la prueba estadística Q.
Se empleó el método Bucher y la calculadora propuesta por la Agencia Canadiense de Medicamentos y Tecnologías en Salud para la realización de la CIA entre los distintos iBTK. Para evaluar la posibilidad de considerar los iBTK12,13 como alternativas de similar beneficio clínico, se utilizó la metodología empleada en la Guía ATE10. Esta metodología establece criterios para evaluar si 2 o más fármacos pueden ser considerados alternativas terapéuticas equivalentes en eficacia. Para la consideración de fármacos como ATE, según la citada Guía, es preciso partir de la mejor evidencia disponible, es decir, los estudios de la mejor calidad posible; emplear la variable de mayor relevancia clínica y valorar si ésta supone un perjuicio grave o irreversible para el paciente; y establecer un margen de relevancia clínica (valor Δ). El valor Δ se define como la máxima diferencia considerada clínicamente irrelevante entre las distintas alternativas evaluadas. En el presente estudio, se empleó el valor Δ establecido por paneles de expertos, empleando la Escala de Magnitud de Beneficio Clínico publicada por la Sociedad Europea de Oncología Médica (ESMO-MCBS) para la determinación de dicho valor14. La ESMO-MCBS es una aplicación estandarizada para determinar una puntuación del beneficio clínico para cada alternativa en un contexto oncológico, empleando un formulario donde se valora la intención curativa del tratamiento a estudiar, la variable principal empleada, y el tipo de ensayo clínico junto con resultados de calidad de vida, toxicidad y mejoría de la supervivencia frente al comparador15.
Al mismo tiempo, se realizó una evaluación gráfica de los resultados para determinar si el HR y el intervalo de confianza del 95% (IC95%) obtenido tras la CIA estaban dentro del margen Δ. Para determinar la probabilidad de que el resultado exceda el margen de equivalencia se empleó la calculadora de Shakespeare et al.16.
Del mismo modo, y siguiendo con lo dispuesto en la Guía ATE, para la declaración definitiva de fármacos como ATE, se debe valorar también la toxicidad de estos en sus respectivos estudios y detectar así si hubiera alguna diferencia sustancial que impidiera considerar los fármacos como alternativas. Para ello, se extrajeron los resultados en seguridad de los distintos iBTK incluidos para evaluar si podían ser declarados ATE en seguridad estableciéndose la frecuencia de las reacciones adversas (RAM) de interés de grado de 3 a 4.
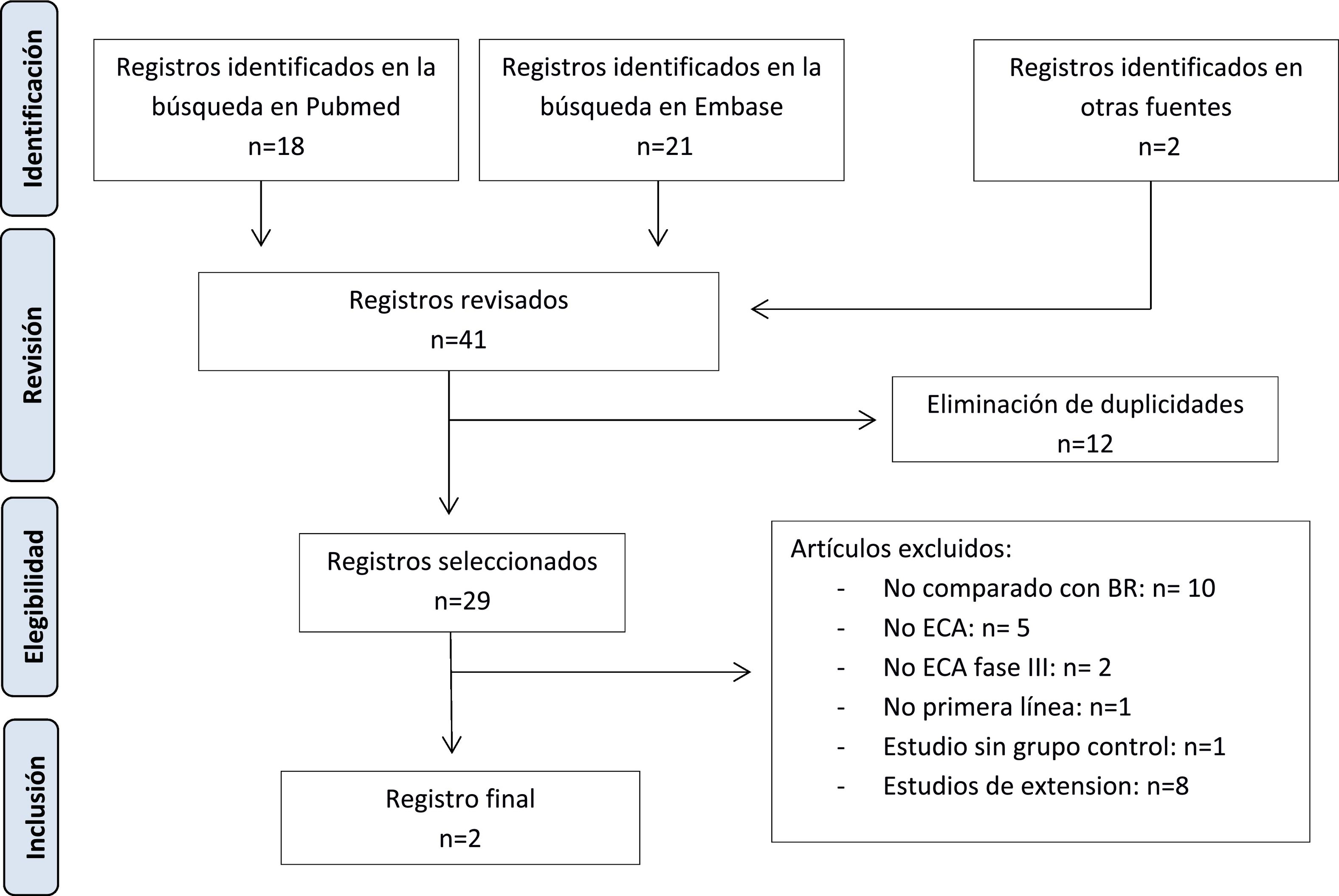
ResultadosBúsqueda en la bibliografíaLa búsqueda bibliográfica se realizó en Medline (Pubmed) y Embase a fecha del 10 de noviembre de 2022. Los detalles se muestran en la figura 1. Se identificaron un total de 39 estudios empleando los criterios de búsqueda propuestos. Para todos los resúmenes que no fueron excluidos en la revisión inicial, se revisó en detalle el artículo completo para comprobar la idoneidad de su inclusión. Se consideraron elegibles para la revisión del texto completo 2 estudios: uno para ibrutinib y otro para zanubrutinib.
Un análisis de referencias bibliográficas y búsqueda complementaria sobre el uso de los iBTK en pacientes naive con LLC, realizada el 11 de noviembre del 2022 detectaron 2 nuevos ensayos clínicos aleatorizados (ECA), no obstante, estos fueron excluidos por no cumplir las características definidas.
Finalmente se incluyeron los ensayos A041202 (ibrutinib) y SEQUOIA (zanubrutinib) para la realización de la CIA, mientras que acalabrutinib fue excluido por falta de estudios con el comparador común seleccionado. Ambos ECA incluyeron pacientes mayores de 65 años, sin embargo, en el ensayo SEQUOIA se incluyeron además pacientes mayores de 18 años con comorbilidades y no candidatos al esquema fludarabina, ciclofosfamida y rituximab al presentar un puntaje mayor de 6 en la escala de valoración acumulativa de enfermedades y con un aclaramiento de creatinina por debajo de 70 ml/min.
El ensayo A041202 (N = 547) fue un ECA fase III, doble ciego, que comparaba el uso de ibrutinib en monoterapia e ibrutinib asociado a rituximab frente a BR (en una proporción 1:1:1), en pacientes con LLC no tratada previamente. La mediana de población fue de 71 años, con un 97% de los pacientes con ECOG 0–1 y la presencia de la del17p, mutación TP53, del11q y IgHV no mutadas fue del 9, 19, 63 y 54% respectivamente en el brazo de ibrutinib en monoterapia. El estudio SEQUOIA (N = 590) fue un ECA fase III, doble ciego, donde se comparaba zanubrutinib frente a BR, en una proporción 1:1, en pacientes sin del17p con LLC. Hubo un tercer brazo en tratamiento con zanubrutinib donde se valoró los pacientes con del17p, sin comparación con el grupo control. La mediana de población fue de 70 años, con un ECOG 0–1 en el 94% de la muestra y la presencia de la del17p, mutación TP53, del11q y IgHV no mutadas fue del 6, 18, 53 y 29% respectivamente en el brazo de zanubrutinib en monoterapia.
Análisis de los datosTanto ibrutinib (HR 0,39 [IC95% 0,26 a 0,58]) como zanubrutinib (HR 0,42 [IC95% 0,28 a 0,63]) demostraron ser superiores estadísticamente frente a su comparador BR en términos de SLP. Con respecto a la variable SG, no hubo diferencias estadísticamente significativas entre ambos iBTK. En la tabla 1 se muestran los resultados publicados en los ECA de la SLP de ibrutinib y zanubrutinib, expresados como HR y su IC95%, de los subgrupos de pacientes según características citogenéticas.
Eficacia demostrada en cada subgrupo de tratamiento según características citogenéticas y metaanálisis final
| Pacientes bajo riesgo citogenético | Pacientes alto riesgo citogenético | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MetaanálisisHR (IC95%) | IgHV mutadasHR (IC95%) | Ausencia mutación TP53HR (IC95%) | Ausenciadel11qHR (IC95%) | Ausencia del17pHR (IC95%) | ECA | Presencia del17pHR (IC95%) | Presencia del11qHR (IC95%) | Presencia mutación TP53HR (IC95%) | IgHV no mutadasHR (IC95%) | MetaanálisisHR (IC95%) |
| 0,44 (0,27 a 0,72) | – | – | 0,44 (0,27 a 0,72) | A041202(Ibrutinib) | 0,26 (0,12 a 0,56) | – | – | 0,26 (0,12 a 0,56) | ||
| 0,47 (0,36 a 0,63)I2 = 13% | 0,67 (0,36 a 1,22) | 0,38 (0,25 a 0,59) | 0,50 (0,32 a 0,80) | – | SEQUOIA(zanubrutinib) | – | 0,21 (0,09 a 0,50) | 1,19 (0,28 a 4,99) | 0,24 (0,13 a 0,43) | 0,27 (0,17 a 0,43)I2 = 56% |
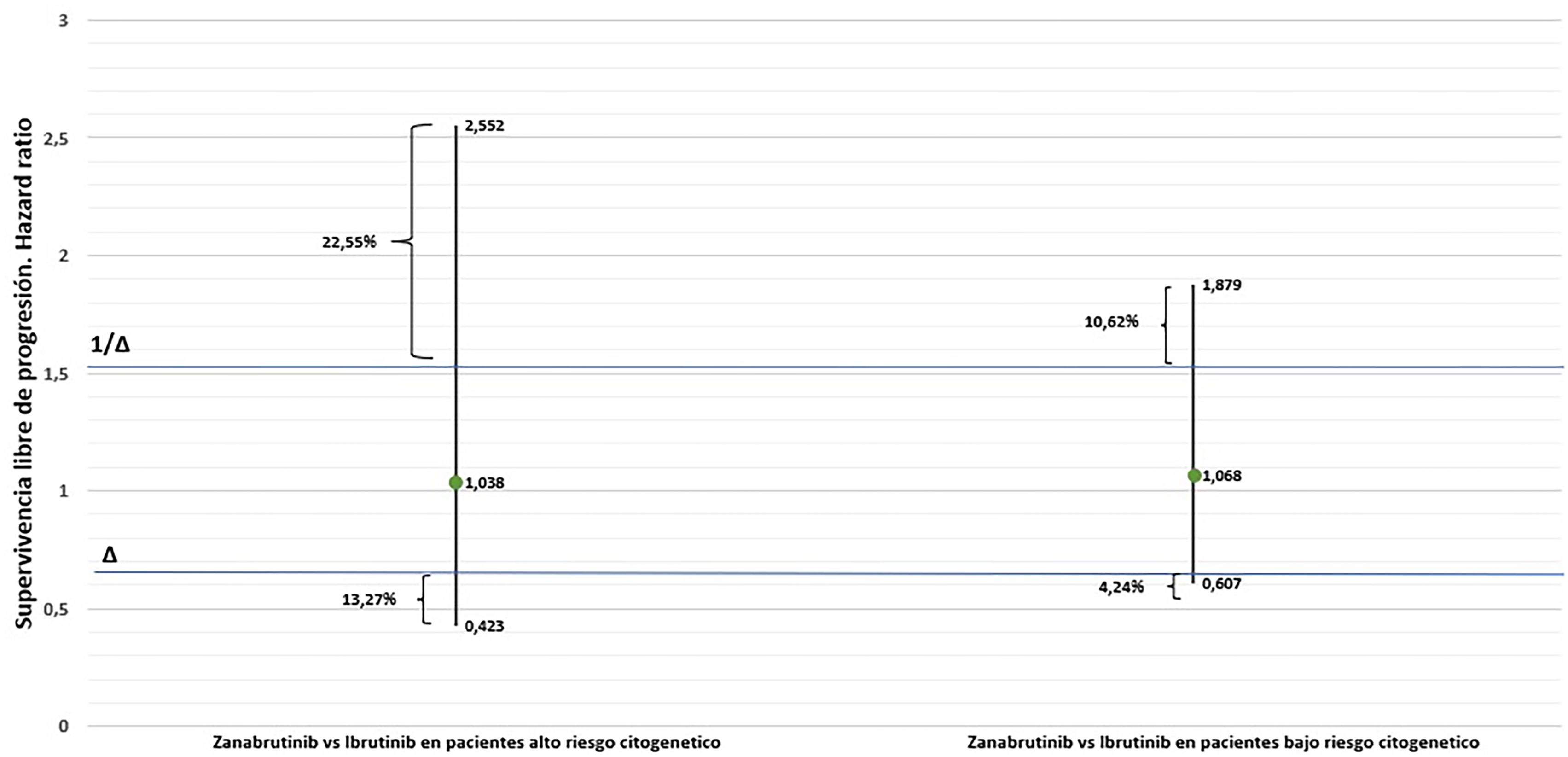
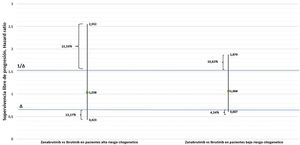
Para la determinación de la relevancia clínica, se tomó como valor Δ un HR 0,65 (y su inverso 1,54). La figura 2 muestra una representación gráfica del resultado de la CIA realizada. No se encontraron diferencias estadísticamente significativas entre ambos iBTK en los 2 subgrupos de pacientes y el valor del HR no excede el valor Δ establecido, encontrándose una probable equivalencia clínica entre estos fármacos en términos de eficacia, según la guía ATE. Los resultados obtenidos de la calculadora de Shakespeare et al. muestran que el IC95% de la CIA entre zanubrutinib e ibrutinib en pacientes con alto riesgo citogenético sobrepasa el margen de equivalencia por encima en un 22,55% y por debajo en un 13,27%, mientras que en los pacientes con bajo riesgo citogenético exceden dicho margen en un 10,62 y 4,24% respectivamente.
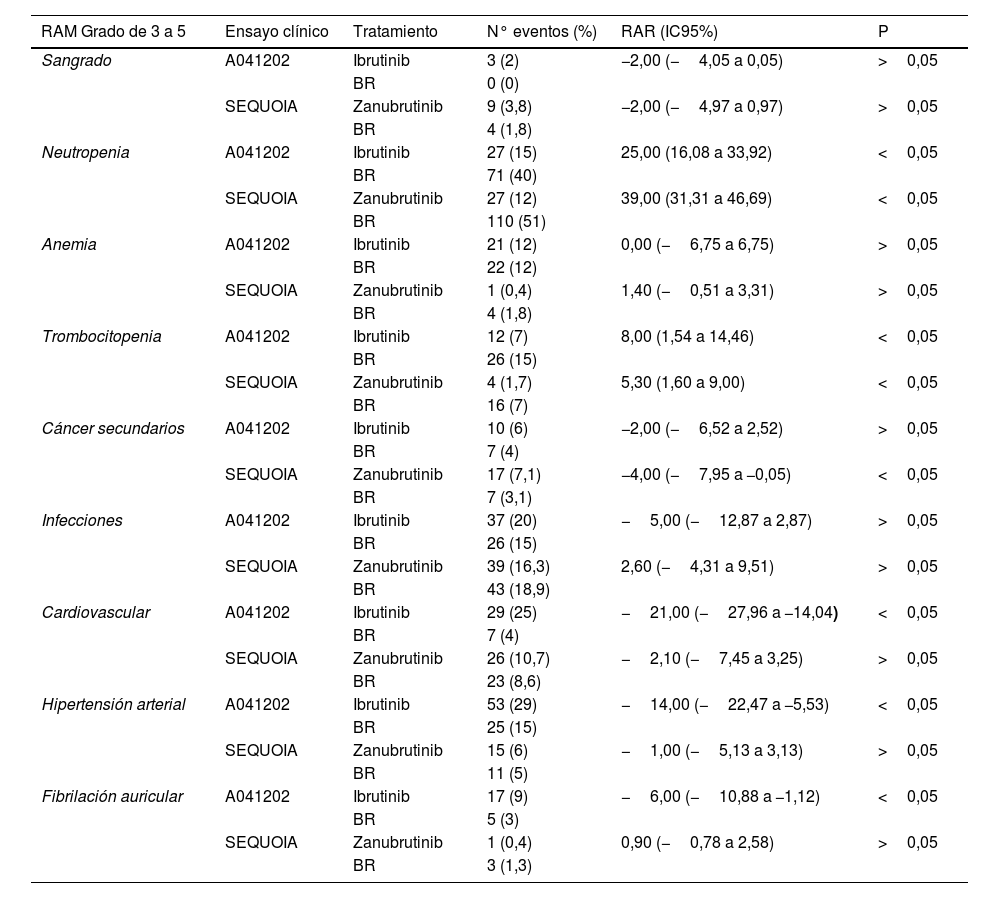
Con respecto a la seguridad, la falta de unanimidad a la hora de definir las RAM impidió el desarrollo de una CIA. En la tabla 2 se muestran los resultados de los eventos adversos de grado de 3 a 5 extraídos de los ECA analizados. En el estudio A041202, se observaron diferencias estadísticamente significativas en el porcentaje de pacientes que sufrieron fibrilación auricular, hipertensión arterial y eventos cardiovasculares entre ibrutinib y el grupo control BR. En el estudio SEQUOIA, la mayor incidencia de cánceres secundarios fue el evento de interés con resultados estadísticamente significativas entre el brazo zanubrutinib y el grupo control. Del mismo modo, la neutropenia y la trombocitopenia fueron las RAMS comunes y con significación estadística en ambos iBTK frente al comparador BR.
RAM de interés grado de 3 a 5 demostrada por cada brazo de tratamiento en los ensayos clínicos aleatorizados seleccionados
| RAM Grado de 3 a 5 | Ensayo clínico | Tratamiento | N° eventos (%) | RAR (IC95%) | P |
|---|---|---|---|---|---|
| Sangrado | A041202 | Ibrutinib | 3 (2) | −2,00 (−4,05 a 0,05) | >0,05 |
| BR | 0 (0) | ||||
| SEQUOIA | Zanubrutinib | 9 (3,8) | −2,00 (−4,97 a 0,97) | >0,05 | |
| BR | 4 (1,8) | ||||
| Neutropenia | A041202 | Ibrutinib | 27 (15) | 25,00 (16,08 a 33,92) | <0,05 |
| BR | 71 (40) | ||||
| SEQUOIA | Zanubrutinib | 27 (12) | 39,00 (31,31 a 46,69) | <0,05 | |
| BR | 110 (51) | ||||
| Anemia | A041202 | Ibrutinib | 21 (12) | 0,00 (−6,75 a 6,75) | >0,05 |
| BR | 22 (12) | ||||
| SEQUOIA | Zanubrutinib | 1 (0,4) | 1,40 (−0,51 a 3,31) | >0,05 | |
| BR | 4 (1,8) | ||||
| Trombocitopenia | A041202 | Ibrutinib | 12 (7) | 8,00 (1,54 a 14,46) | <0,05 |
| BR | 26 (15) | ||||
| SEQUOIA | Zanubrutinib | 4 (1,7) | 5,30 (1,60 a 9,00) | <0,05 | |
| BR | 16 (7) | ||||
| Cáncer secundarios | A041202 | Ibrutinib | 10 (6) | −2,00 (−6,52 a 2,52) | >0,05 |
| BR | 7 (4) | ||||
| SEQUOIA | Zanubrutinib | 17 (7,1) | −4,00 (−7,95 a −0,05) | <0,05 | |
| BR | 7 (3,1) | ||||
| Infecciones | A041202 | Ibrutinib | 37 (20) | −5,00 (−12,87 a 2,87) | >0,05 |
| BR | 26 (15) | ||||
| SEQUOIA | Zanubrutinib | 39 (16,3) | 2,60 (−4,31 a 9,51) | >0,05 | |
| BR | 43 (18,9) | ||||
| Cardiovascular | A041202 | Ibrutinib | 29 (25) | −21,00 (−27,96 a −14,04) | <0,05 |
| BR | 7 (4) | ||||
| SEQUOIA | Zanubrutinib | 26 (10,7) | −2,10 (−7,45 a 3,25) | >0,05 | |
| BR | 23 (8,6) | ||||
| Hipertensión arterial | A041202 | Ibrutinib | 53 (29) | −14,00 (−22,47 a −5,53) | <0,05 |
| BR | 25 (15) | ||||
| SEQUOIA | Zanubrutinib | 15 (6) | −1,00 (−5,13 a 3,13) | >0,05 | |
| BR | 11 (5) | ||||
| Fibrilación auricular | A041202 | Ibrutinib | 17 (9) | −6,00 (−10,88 a −1,12) | <0,05 |
| BR | 5 (3) | ||||
| SEQUOIA | Zanubrutinib | 1 (0,4) | 0,90 (−0,78 a 2,58) | >0,05 | |
| BR | 3 (1,3) |
Aplicando los criterios establecidos por la Guía ATE, y a partir de los resultados de la CIA en eficacia entre ibrutinib y zanubrutinib, junto con los resultados de seguridad de los ECA, ambos iBTK no pueden ser considerados alternativas terapéuticas equivalentes en pacientes en primera línea de LLC en mayores de 65 años.
DiscusiónLa aparición de nuevos iBTK para los pacientes naive con LLC supone un paradigma a la hora de elegir la opción terapéutica más apropiada. Ante la ausencia de comparaciones directas, las CIA, junto con los metaanálisis en red, suponen una herramienta óptima para determinar el arsenal más eficaz y seguro entre las alternativas disponibles.
La elección de los distintos tratamientos disponibles va a depender principalmente de las características citogenéticas de los pacientes. El modelo pronóstico que aporta la clasificación de los pacientes según el riesgo citogenético es un enfoque pragmático que se emplea diariamente en la práctica clínica, a la hora de seleccionar el tratamiento más idóneo17. En el Informe de Posicionamiento Terapéutico, publicado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en febrero del 2022 de venetoclax asociado a obinutuzumab en este contexto terapéutico, se posicionan las distintas alternativas según la presencia o no de riesgo citogenético6. Es por ello necesario valorar si existen diferencias en relación a las variables de eficacia estudiadas en los ECA que permita posicionar una alternativa terapéutica sobre otra en estos subgrupos de poblaciones.
La Guía ATE permite la evaluación, interpretación y posterior posicionamiento de 2 o más alternativas disponibles para una misma indicación, valorando la existencia de diferencias clínicamente relevantes entre las distintas alternativas, y permite agruparlas como similares o no, para la posterior competencia de precios en los procesos de adquisición que garantice la sostenibilidad de los sistemas sanitarios10. Para su aplicabilidad se requiere de la elección de un valor Δ apropiado, debido a que la validez del estudio dependerá de dicha elección. Debido a esta premisa, la ESMO-MCBS fue tomada como herramienta de referencia para la obtención de este valor por parte de nuestro estudio, al ser considerada una escala validada y de prestigio consolidado, que actualmente se está empleando como ayuda en la toma de decisiones a la hora de priorizar los tratamientos disponibles a nivel oncológico en los tumores sólidos14.
Los resultados de nuestro estudio concluyen que ambos iBTK, si bien no pueden ser considerados estrictamente como ATE, no existen criterios objetivos que muestren la superioridad de un fármaco sobre otro en los distintos subgrupos de riesgo citogenético, desde el punto de vista de eficacia. Dicha consideración está argumentada por 2 razones: la primera es la consecuencia de que el fallo del tratamiento supondría la progresión de la enfermedad, sin embargo, los resultados obtenidos en los ensayos clínicos muestran que no existe una traducción directa entre la progresión de la enfermedad y la pérdida de la supervivencia global a largo plazo; la segunda razón es que los resultados obtenidos en la calculadora de Shakespeare et al. nos muestra que la mayor proporción del IC95% no supera el margen de equivalencia establecido, destacando en el subgrupo de pacientes de bajo riesgo citogenético. Cabe destacar que en pacientes con alto riesgo citogenético esta proporción fuera del valor Δ es algo mayor, debido en parte a la alta incertidumbre asociada a la comparación indirecta.
No obstante, las diferencias descritas relacionadas con la seguridad cardiovascular, supone una consideración a tener en cuenta a la hora de definir ambos tratamientos con ATE. Estos resultados son consistentes con la nueva carta de seguridad publicada por parte del Ministerio de Sanidad sobre la mayor incidencia de efectos cardiovasculares asociadas a ibrutinib en pacientes mayores de 65 años y con alteraciones cardiacas previas18.
En diciembre del 2022, Brown J.R. et al. publicaron un ensayo donde comparaban zanabrutinib frente a ibrutinib en pacientes LLC en recidiva o resistente al tratamiento. En dicho estudio, el 21,3% de los pacientes en tratamiento con zanubrutinib presentaron algún evento cardiaco, frente al 29,6% en el brazo de ibrutinib (RAR: 8,30 [1,62 a 14,98])19.
Nuestro trabajo es el primer estudio que incluye a zanubrutinib dentro de una comparación frente a ibrutinib en contexto de primera línea en LLC. Existen publicaciones de distintos metaanálisis en red que comparan los iBTK solos o junto a la combinación de venetoclax asociado a obinutuzumab.
En el estudio de Molica et al., los resultados de acalabrutinib frente a los de ibrutinib junto a obinutuzumab no mostró resultados estadísticamente significativos entre los distintos riesgos citogenéticos con respecto a la variable SLP20. Algo similar ocurre con los resultados globales expuestos en el estudio de Davids et al., sin resultados significativos en términos de SLP y SG entre acalabrutinib e ibrutinib21. Estos resultados podrían confirmar nuestros hallazgos tras la realización de la CIA entre zanubrutinib e ibrutinib.
Entre las limitaciones de nuestro estudio se encuentra la falta de comparación con acalabrutinib, ya que se requerirían más comparaciones intermediarias para poder realizar una CIA con zanubrutinib; la imposibilidad de subdividir el subgrupo de pacientes con riesgo citogenético en muy alto y alto riesgo, debido a la falta de representación de los resultados por separado de los pacientes con las distintas deleciones en el ECA A041202 (del17p y del11q), además de la falta de resultados en los subgrupos de pacientes con mutación de TP53 y estado mutacional de IgHV (tabla 1). Del mismo modo, se debe de tener en cuenta que la escala ESMO-MCBS es una herramienta para tumores sólidos, debido a que aún se está desarrollando la escala ESMO para procesos onco-hematológicos.
En definitiva, tras la realización de la CIA y asumiendo la incertidumbre asociada, los resultados obtenidos muestran que zanubrutinib puede ser considerarada como una alternativa de similar beneficio clínico en eficacia a ibrutinib. Sin embargo, la presencia de características diferenciadoras a nivel de seguridad impide la consideración definitiva de ambos fármacos como ATE.
Responsabilidades éticasTodos los procesos se conducen bajo la estricta observancia de la normativa ética internacional sobre publicación de investigación e información biomédica.
FinanciaciónSin financiación.
Conflicto de interesesSin conflictos de intereses (anexo declaración por la «International Committee of Medical Journal Editors» de cada uno de los autores).