Lung cancer is the third most frequent neoplastic tumour in Spain, with around 27 000 new cases diagnosed per year; 80-95% of these are non-small-cell cancer (NSCLC), and the majority of cases are diagnosed in advanced stages of the disease, and for this reason it is one of the oncologic conditions with higher mortality rates (21.4% mean survival at 5 years).
The main treatment regimens used for first-line treatment of NSCLC are: cisplatin/pemetrexed (cis/pem), cisplatin/gemcita- bine/bevacizumab (cis/gem/bev), and carboplatin/paclitaxel/ bevacizumab (carb/pac/bev). The objective of this study was to evaluate the cost-effectiveness ratio of antineoplastic 1st line NSCLC treatment regimens, from the point of view of hospital management.
MethodologyA cost-efficacy mathematical model was prepared, based on a decision tree. The efficacy variable was Progression Free Survival, obtained from the PARAMOUNT, AVAIL and SAIL Phase III clinical trials. The study was conducted from the perspective of the hospital management, considering only the direct costs of drug acquisition. A deterministic sensitivity analysis was conducted to confirm the robustness of outcomes.
ResultsThe PFS obtained in clinical trials with cls/pem, cis/ gem/bev and carb/pac/bev was: 6.9, 6.7 and 6.2 months, respectively. Based on our model, the mean cost of treatment per patient for these regimens was: 19942€, 15594 € and 36095€, respectively. The incremental cost-effectiveness ratio per month of additional PFS between cls/pem and cls/gem/bev was 19303€. Estimating a 30% reduction in acquisition costs for pemetrexed (Alimta®Eli Lilly Nederland B.V.), due to the forthcoming launch of generic medications, the cis/pem treatment would become the predominant alternative for 1st line treatment of NSCLC patients, by offering the best health results at a lower cost.
El cáncer de pulmón es la tercera neoplasia tumoral más frecuente en España, con unos 27.000 nuevos casos/ año, de los que el 80-85% son de etiología no microcítica (NSCLC) y en la mayoría de los casos diagnosticados en estadios avanzados de la enfermedad, razón por la que es uno de los procesos oncológicos con mayores tasas de mortalidad (supervivencia media a los 5 años del 21,4%). Los principales esquemas de primera línea utilizados en el tratamiento del NSCLC son: cisplatino/pemetrexed (cis/pem), cisplatino/gemcitabina/ bevacizumab (cis/gem/bev)′y carboplatino/paclitaxel/bevacizu- mab (carbo/pac/Bev). El objetivo del presente trabajo consistirá en realizar un análisis para estimar el ratio coste-eficacia de los esquemas antineoplásicos de primera línea en el tratamiento del NSCLC, desde la perspectiva de la gerencia hospitalaria. Metodos: Se elaboró un modelo matemático de coste-eficacia basado en un árbol de decisiones. Como variable de eficacia se utilizó la supervivencia libre de progresión, obtenida de los ensayos clínicos fase III PARAMOUNT, AVAIL y SAIL. El estudio se efectuó desde la perspectiva de la gerencia hospitalaria considerando únicamente los costes directos de adquisición de los fármacos. Se realizó un análisis de sensibilidad determinístico para comprobar la robustez de los resultados.
ResultadosLa SLP obtenida en los ensayos clínicos de los tratamientos cis/pem, cis/gem/bev y carb/pac/bev fue de: 6,9, 6,7 y 6,2 meses, respectivamente. En base a nuestro modelo, el coste medio del tratamiento por paciente para estos esquemas fue de 19.942€, 15.594 € y 36.095€, respectivamente. La razón coste-eficacia incremenal por mes de SLP adicional entre cis/pem y cis/gem/bev fue de 19.303€. Estimando una reducción del 30% de los costes de adquisición de pemetrexed (Alimta®EI¡ Lilly Nederland B.V) ante su próxima Incorporación al mercado de medicamentos genéricos, el tratamiento cis/pem se convertiría en la alternativa dominante en el tratamiento de primera línea de los pacientes con NSCLC, al ofrecer los mejores resultados en salud a un menor coste.
This article evaluates the efficiency of using cisplatin/ pemetrexed, cisplatin/gemcitabine/bevacizumab or car- boplatin/paclitaxel/bevacizumab as first line treatment for patients with non-squamous non-small-cell lung cancer, from the perspective of the hospital management. The interest of this article lies in the fact that, as far as we know, no pharmacoeconomic evaluation has been conducted so far in order to evaluate the efficiency of using the main three first line treatment regimens for this condition, taking also into account the potential economic impact of the imminent launch of generic pemetrexed. Given our current economic situation, with limited healthcare resources, this type of studies appear as an additional tool to be considered at the time of making decisions, by complementing the information about efficacy and safety extracted from clinical trials.
IntroductionAfter colorectal cancer and prostate cancer, lung cancer is the most frequent tumour in Spain, with around 27,000 new cases /year (13% of the total number)1; 8085% of these are non-small-cell lung cancer (NSCLC) cases2. The majority of patients are diagnosed in advanced stages of the disease3, and for this reason it is one of the oncologic conditions with higher mortality rates (21.4% mean survival at 5 years)4.
The standard treatments for NSCLC are platinum-based antineoplastic regimens5, and in recent years, new agents have been incorporated for metastatic disease, such as pemetrexed and bevacizumab. Some regimens based only on chemotherapy doublets have also been described for the induction stage, followed by maintenance with pemetrexed; but guidelines currently recommend the incorporation of pemetrexed or bevacizumab since the induction stage6. Both drugs have demonstrated an improvement in the life expectancy of these patients, when used in treatment regimens including one platinum-based induction stage with pemetrexed or bevacizumab, followed by maintenance with any of these two drugs. These regimen are mostly: cisplatin/pe- metrexed (Pem/Cis)7, cisplatin/gemcitabine/bevacizumab (Gem/Cis/Bev)8 and carboplatin/paclitaxel/bevacizumab (Pac/Carb/Bev)9. The improvement in efficacy represented by incorporating these two new drugs has also entailed an increase in the cost of treatments9. And the fact that the efficacy outcomes shown by the three regimens are similar, together with the lack of clinical trials comparing them with one another, means that currently it is difficult to pick the most efficient regimen. Therefore, particularly in our current economic situation, with limited healthcare resources, it is necessary to conduct a cost-effectiveness analysis to be used as a tool for decision making at the time of optimizing those resources available.
Therefore, the objective of this study was to conduct an economic analysis to estimate the cost-effectiveness ratio of first line antineoplastic regimens for NSCLC treatment, from the perspective of the hospital management.
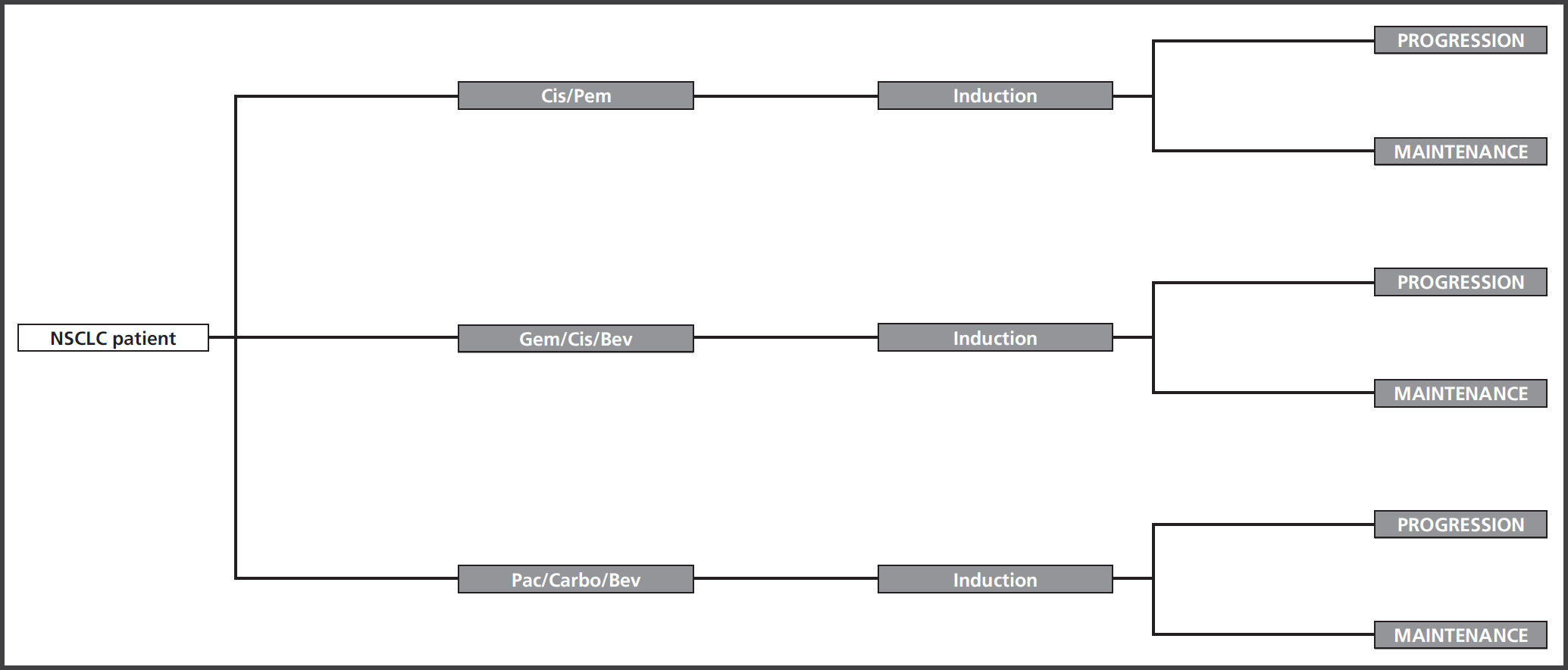
Material and methodsPharmacoeconomic modelA mathematical model for cost-effectiveness was prepared, based on a decision tree with three branches, each of them representing the cis/pem, cis/gem/bev and carb/pac/bev regimens (Figure 1). The probability values for each transition were obtained from these Phase III clinical trials: PARAMOUNT7 (cis/pem); AVAIL8 (cis/gem/ bev) and SAIL9 (carb/pac/bev).
These treatment regimens are based on an induction stage followed by a maintenance stage on monotherapy which is continued until disease progression (Progression Free Survival - PFS), or unacceptable toxicity.
- •
4 Cis (75 mg/m2)/Pem (500 mg/m2) courses, followed by pemetrexed (500 mg/m2) as maintenance every 3 weeks.
- •
6 Gem (1250 mg/m2)/Cis (80 mg/m2)/Bev (7.5 mg/ kg) courses, followed by bevacizumab (7.5 mg/kg) as maintenance every 3 weeks.
- •
6 Pac (200 mg/m2)/Carb (AUC = 6)/Bev (15 mg/kg) courses, followed by bevacizumab (15 mg/kg) as maintenance every 3 weeks.
A summary of the main characteristics of the PARAMOUNT, SAIL and AVAIL clinical trials appears in Table 1.
Outcomes and characteristics of the PARAMOUNT, AVAIL and SAIL clinical trials6,7,8
| Clinical trial | Study arm and its characteristics | % patients on maintenance | PFS (months) | 95% Cl |
|---|---|---|---|---|
| Paramount | Induction: 4 courses with Cis 75 mg/m2′ Pern 500 mg/m2Maintenance: Pem 500 mg/m2 Every 3 weeks | 57% | 6.9 | 3.2-4.6 |
| Avail | Induction: 6 courses with Cis 80 mg/m2/Gem 1250 mg/m2/ bev 7,5 mg/m2Maintenance: Bev 7.5 mg/kg m2 every 3 weeks | 42% | 6.7 | 0.56- 0.83 |
| Sail | Induction: 6 courses with Carb AUC=6, pac 200 mg/m2, bev 15 mg/kgMaintenance: Beva 15 mg/kg every 3 weeks | 53% | 6.2 | 0.57- 0.77 |
The economic model was validated by an expert panel of oncologists, with the objective to clarify any differences and/or contradictions described in scientific literature. The Microsoft Excel 2013® computer application was used for developing the model. Figure 1 shows a schematic diagram of the decision analysis.
Estimation of efficacy and costsThe efficacy variable used was Progression Free Survival (PFS) as described in the clinical trials for each treatment. Given that in the AVAIL study, those patients who survived the induction stage were randomized to receive bevacizumab as maintenance at a 7.5 mg/kg or 15 mg/ kg dose, and no statistically significant differences were found between both bevacizumab doses, the 7.5 mg/kg dosing was used for cost estimation.
The pharmacological cost was estimated according to the LSP (Laboratory Selling Price) of the medications studied, resulting from applying the profit margins established on the retail price-VAT of the Catalog by the General Council of Official Pharmaceutical Colleges, and with the relevant 7.5% deduction on the LSP established by Royal Decree 8/2010 and provided by the Ministry of Health, Social Services and Equality on October, 201210,11 (Table 2).
Costs per unit used in the pharmacoeconomic model for 1st line NSCLC treatment (at October, 2015 euros)
| Packaging | LSP (€2015) | |
|---|---|---|
| Cisplatin G.M.P. 50 mg/vial | 11.15 | Catalog by the General Council of Official Pharmaceutical Colleges |
| Bevacizumab 25 mg/ml vial 16 ml∗ | 1,177.42 | |
| Pemetrexed 500 mg/vlal∗ | 1,110 | |
| Carboplatin 450 mg/vlal 45 ml | 68.76 | |
| Gemcitabine vial 1 g | 43.70 | |
| Paclitaxel G.M.P. 6 mg/ml vial 50 mL | 443.58 |
G.M.P. Generic Medicinal Product
∗ 7.5% reduction on the LSP established by Royal Decree 8/201014
For dose calculation, we used the anthropometric characteristics of a standard patient representative of Spanish oncology patients12: weight of 70.15 kg, body surface of 1.78 m2, and serum creatinine of 0.6 mg/dL. The administration of carboplatin in order to obtain the desired area under the curve (AUG) was determined by the Glomerular filtration rate (GFR). Calvert Formula was used in this study to calculate the carboplatin milligrams needed for each administration13. The total pharmacological cost for each oncological regimen was estimated by assuming maximum use of vials. All costs included in the analysis were stated in 2015 euros (€).
Time horizon, analysis perspective, and discount rateThe time horizon considered was the time until progression to first line of treatment, which coincided approximately with 1 year of modelling based on clinical trial outcomes. The study was conducted from the perspective of the hospital management, taking into account only the direct costs for drug acquisition. Given the limited survival of patients (none of the oncology regimens went beyond one year of treatment), it was not adequate to apply a discount rate correction14,15.
Base case and Sensitivity AnalysisThe mean values of costs and efficacy were considered for the base case in the study.
In order to confirm the robustness of the base scenario outcomes and the consistency of the estimations, various univariate deterministic sensitivity analyses were conducted, considering the following factors:
- 1.
Improvement in efficacy (PFS). The PFS of patients who survive the induction stage is not specified in clinical trials; therefore, it was estimated with the following formula:
The model assumes that the PFS of patients with progression during the induction stage is equal to the duration of said stage. This assumption is based on the fact that, in clinical practice, imaging tests to confirm the status of the disease are usually conducted after completing the induction stage. Therefore, the estimated PFS for patients who presented disease progression during the induction stage was:
- -
2.8 months for the cis/pem regimen (4 induction courses every 3 weeks).
- -
4.2 months for the pac/carb/bev and cis/gem/bev regimens (6 induction courses every 3 weeks).
A sensitivity analysis was conducted, assuming a 20% improvement in the proportion of patients who survived the induction stage for each regimen (Table 3); by applying the previous formula in an overall PFS for each regimen, this would result in:
- -
cis/pem: 7.69 months
- -
cis/gem/bev: 7.18 months
- -
pac/carb/bev: 6.58 months
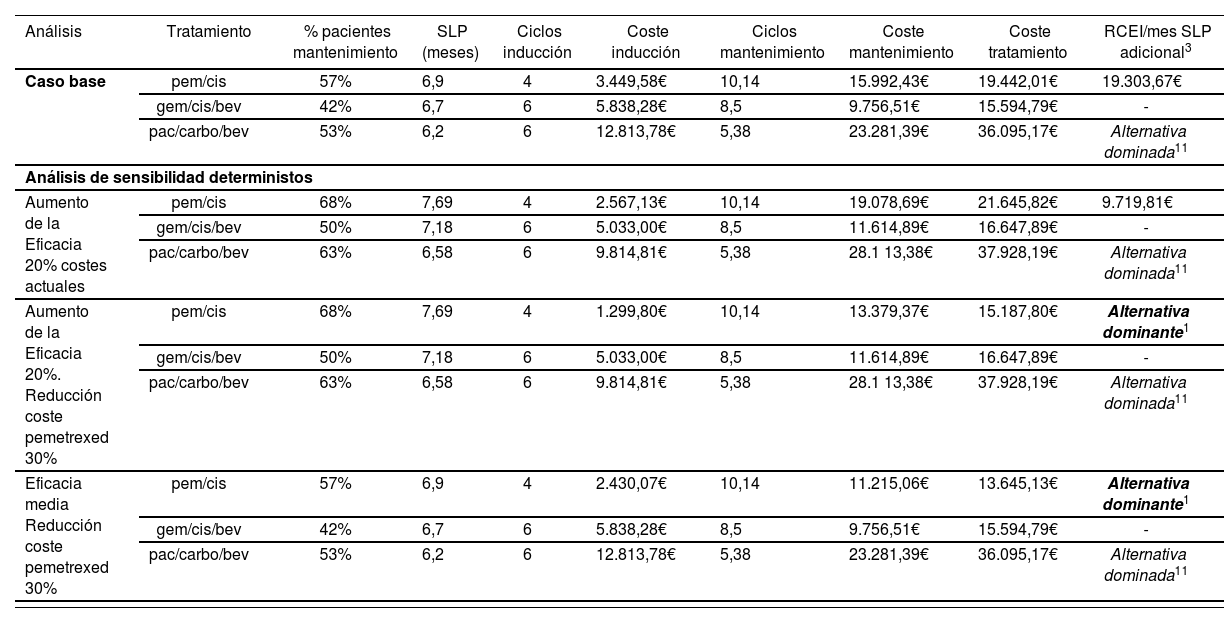
Table 3.Incremental cost-effectiveness ratio and sensitivity analysis for the cost-effectiveness analysis (at October, 2015€) of 1st line NSCLC treatment.
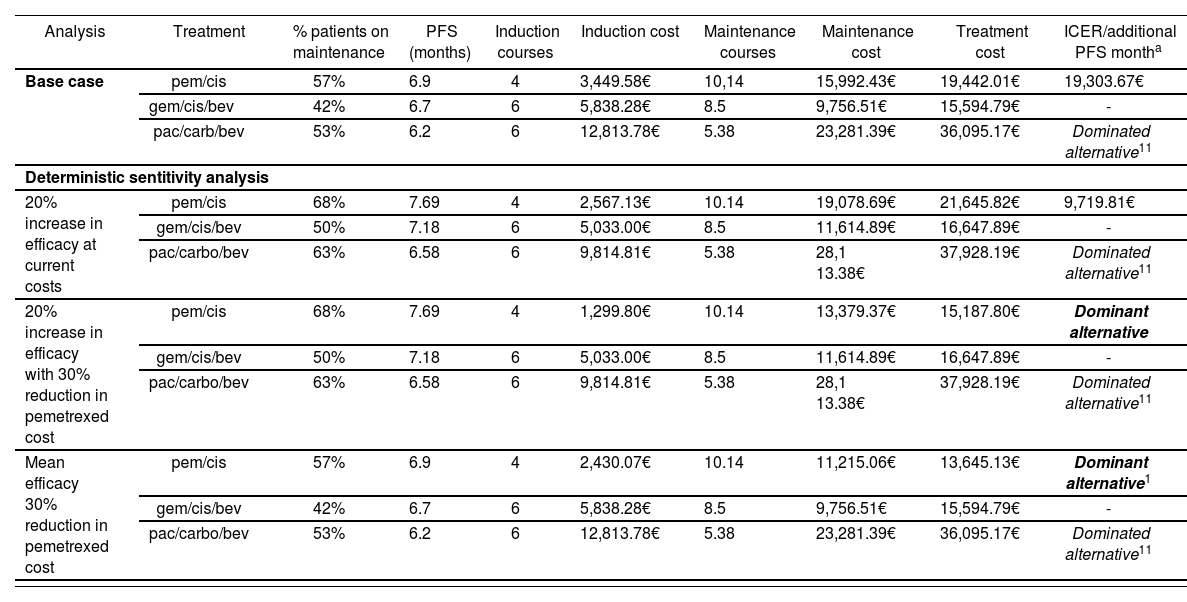
Analysis Treatment % patients on maintenance PFS (months) Induction courses Induction cost Maintenance courses Maintenance cost Treatment cost ICER/additional PFS montha Base case pem/cis 57% 6.9 4 3,449.58€ 10,14 15,992.43€ 19,442.01€ 19,303.67€ gem/cis/bev 42% 6.7 6 5,838.28€ 8.5 9,756.51€ 15,594.79€ - pac/carb/bev 53% 6.2 6 12,813.78€ 5.38 23,281.39€ 36,095.17€ Dominated alternative11 Deterministic sentitivity analysis 20% increase in efficacy at current costs pem/cis 68% 7.69 4 2,567.13€ 10.14 19,078.69€ 21,645.82€ 9,719.81€ gem/cis/bev 50% 7.18 6 5,033.00€ 8.5 11,614.89€ 16,647.89€ - pac/carbo/bev 63% 6.58 6 9,814.81€ 5.38 28,1 13.38€ 37,928.19€ Dominated alternative11 20% increase in efficacy with 30% reduction in pemetrexed cost pem/cis 68% 7.69 4 1,299.80€ 10.14 13,379.37€ 15,187.80€ Dominant alternative gem/cis/bev 50% 7.18 6 5,033.00€ 8.5 11,614.89€ 16,647.89€ - pac/carbo/bev 63% 6.58 6 9,814.81€ 5.38 28,1 13.38€ 37,928.19€ Dominated alternative11 Mean efficacy 30% reduction in pemetrexed cost pem/cis 57% 6.9 4 2,430.07€ 10.14 11,215.06€ 13,645.13€ Dominant alternative1 gem/cis/bev 42% 6.7 6 5,838.28€ 8.5 9,756.51€ 15,594.79€ - pac/carbo/bev 53% 6.2 6 12,813.78€ 5.38 23,281.39€ 36,095.17€ Dominated alternative11 aincremental cost-effectiveness ratio per additional month of Progression Free Survival
bAn alternative Is defined as dominated when there are options with higher efficacy and lower cost. cAn alternative Is defined as dominant when It presents the highest efficacy at the lowest cost.
- -
- 3.
Modification of the acquisition costs for pemetrexed, assuming a 30% cost reduction with the launch of generic drugs.
The proportion of patients who moved on to the maintenance stage during clinical trials was: 57% for the cis/ pern regimen, 42% for patients who received gem/cis/ bev, and 53% for the carb/pac/bev regimen. Based on our model, the mean cost of treatment per patient for the gem/cis/bev, cis/pem, and carb/pac/bev treatment regimens would be 15,594.74€, 19,442.01 € and 36,095.17€ respectively. The car/pac/bev regimen is the dominated alternative, because it is the most costly treatment regimen with the worst health outcomes. The difference in costs between the cis/pem and cis/gem/bev approaches is 3,847.21€, with an incremental cost-effectiveness ratio (ICER) per additional PFS month of 19,303€ (Table 3).
Sensitivity analysis in alternative scenariosThere was a robust outcome in the sensitivity analysis for all scenarios, considering the current drug acquisition costs; with an IC ER of 9,720€ per additional PFS month for the cis/pem regimen, when a 20% increase in efficacy is considered for all treatments. However, with a 30% reduction in the price of pemetrexed, the cis/pem alternative would become the dominant alternative, because it presents the best health outcomes at a lower cost. The best incremental cost-efficacy ratio for the cis/pem treatment occurred when a 30% discount was assumed for pemetrexed, as well as a 20% increase in efficacy (ICER = -3,974€/additional PFS month).
The carb/pac/bev regimen was the dominated alternative in all scenarios studied (Table 3).
DiscussionThe outcomes of our model show that, from the perspective of hospital management, the carb/pac/bev regimen is the dominated alternative in first line treatment for NSCLC, because there are current regimens with higher efficacy and lower cost; therefore, in our opinion, this option would be relegated only to patients who cannot tolerate cisplatin-based treatments; for example, those patients with underlying renal conditions. At the current acquisition cost for the drugs studied, the cis/ gemc/bev treatment is cheaper than the cis/pem treatment, with an incremental cost of between 8,217 and 19,303€ per additional PFS month. Typically, a therapy will be considered cost-effective if its ICER is below the predefined threshold of acceptability17. If no explicit thresholds of acceptability are available, a therapy can be considered cost-effective if its ICER is within the range of other therapies which healthcare managers have been willing to pay for16. In a study published in 2013 about the efficiency of oncologic treatments in Spain, Oyaguez et al. found that the ICER values per additional PFS month were within the range of 5,979.87 to 46,716€17 for first line therapies; therefore, according to these studies, the conclusion could be that the cis/pem treatment is a cost-effective strategy.
Besides what has been previously stated, the incorporation to the market of generic pemetrexed (Alimta®Eli Lilly Nederland B.V, date of authorization: September, 2004) can lead to a significant change in our current situation. With a 30% reduction in the current acquisition costs for pemetrexed, the cis/pem treatment would become the dominant alternative (the best health outcomes at a lower cost) for the 1st line treatment of NSCLC patients. These outcomes should be taken into account at the time of making decisions in order to optimize the resources available.
The interpretation of the outcomes of this analysis must be understood as an approach to the efficiency of oncologic regimens, and in any case it should be considered alongside a series of limitations. The main limitation is that only the pharmacological cost of treatment regimens has been considered, though some therapies could be associated with additional costs for the health system, such as those derived of their administration, monitoring, or management of adverse events experienced by patients and caused by medication. The approach chosen for this analysis, considering the pharmacological cost only, intends to equalize the outcomes for the different regimens evaluated. Therefore, the outcomes of this pharmacoeconomic analysis should be confirmed through effectiveness records, comparing the use of healthcare resources for the therapeutic options evaluated, in the setting of daily clinical practice. Besides, we must not forget that bevacizumab presents a series of important limitations that are usually frequent in this type of patients, because it is contraindicated in haemoptysis cases, or when the tumour is adjacent to a major thoracic vessel. Meanwhile, according to the outcomes of this model, the conclusion that can be reached is that the cis/pem treatment is cost-effective, and that the launch of generic pemetrexed could turn it into the dominant 1st line treatment option for NSCLC patients.
Conflict of interestsThe authors declare that there is no conflict of interests.
Aportación a la literatura científicaEn este trabajo se ha evaluado la eficiencia de usar cisplatino/pemetrexed, cisplatino/gemcitabina/bevacizu- mab o carboplatino/paclitaxel/bevacizumab como terapia de primera línea en pacientes con cáncer de pulmón no microcitico no escamoso desde la perspectiva de la gerencia hospitalaria. El interés de este trabajo radica en que, hasta donde conocemos, no se ha realizado ninguna evaluación farmacoeconómica que evalúe la eficiencia de usar los tres esquemas principales de tratamiento de primera línea en esta patología teniendo en cuenta además el impacto económica que podría suponer la inminente comercialización de pemetrexed genérico. En momentos como los actuales de coyuntura económica, donde los recursos sanitarios son limitados, este tipo de estudios, se muestran como una herramienta mas a tener en cuenta a la hora de tomar decisiones, al complementar la información de eficacia y seguridad extraída de los ensayos clínicos.
IntroducciónTras el cáncer colorrectal y el cáncer de próstata, el cáncer de pulmón es el más frecuente en España, con unos 27.000 nuevos casos/año (13% del total)1 y de estos, el 80-85% corresponden a cáncer de pulmón no microcítico (NSCLC)2 diagnosticados en su mayoría en estadios avanzados de la enfermedad3, razón por la que se trata de uno de los procesos oncológicos con mayores tasas de mortalidad mundial (supervivencia media a los 5 años del 21,4%)4.
El tratamiento estándar del NSCLC son esquemas an- tineoplásicos basados en platino5, y en los últimos años a estos tratamientos se han incorporado nuevos agentes en la enfermedad metastásica, como el pemetrexed y el bevacizumab. También han sido descritos algunos esquemas, basados únicamente en dobletes de quimioterapia para la fase de inducción, y luego el mantenimiento con pemetrexed, pero hoy en día las guías clínicas recomiendan el la incorporación del pemetrexed o bevacizumab desde la fase de inducción6. Ambos fármacos han mostrado mejorías en la esperanza de vida de estos pacientes cuando se utilizan en regímenes que se componen de una fase de inducción, constituidas de platinos junto con pemetrexed o bevacizumab, seguido de una fase de mantenimiento con alguno de estos dos fármacos. Estos esquemas fundamentalmente son: cisplatino/ pemetrexed (Pem/Cis)7, cisplatino/gemcitabina/bevaci- zumab (Gem/Cis/Bev)8 y carboplatino/paclitaxel/bevaci- zumab (Pac/Carbo/Bev)9. La mejora en la eficacia que ha supuesto la incorporación de estos dos nuevos fármacos, también ha significado un aumento en el coste de los tratamientos9. Y el hecho de que los resultados de eficacia mostrados por los tres esquemas resulten similares, junto con la ausencia de ensayos comparativos entre ellos, implica que en la actualidad sea difícil conocer cual es el esquema mas eficiente. Por tanto, resulta necesario, especialmente en momentos como los actuales de coyuntura económica, donde los recursos sanitarios son limitados, realizar un análisis de coste-eficacia que sirva de herramienta para la toma de decisiones a la hora de optimizar los recursos disponibles.
De tal forma que el objetivo del presente trabajo consistirá en realizar un análisis económico para calcular el ratio coste-eficacia de los esquemas antineoplásicos de primera línea en el tratamiento del NSCLC, desde la perspectiva de la gerencia hospitalaria.
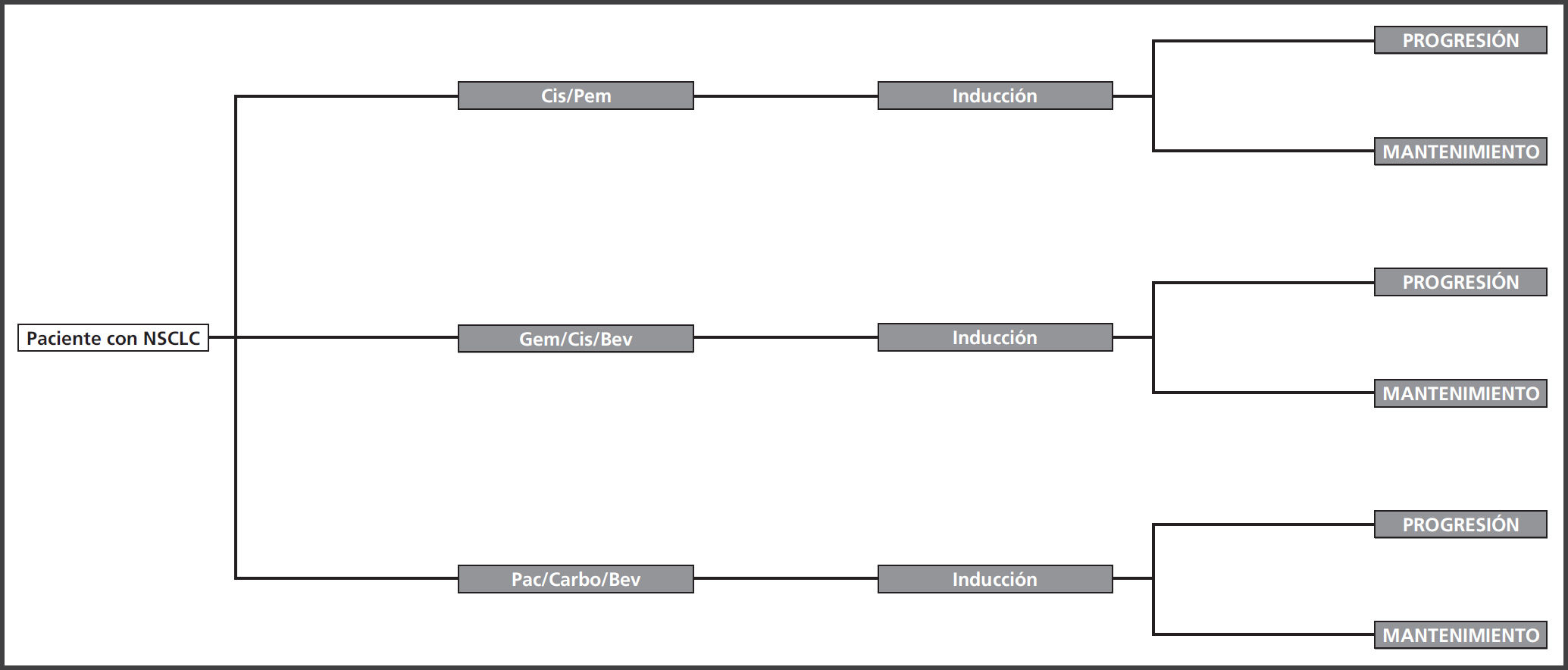
Material y métodosModelo farmacoeconómicoSe elaboró un modelo matemático de coste-eficacia basado en un árbol de decisiones de tres ramas, cada una de ellas correspondiente a los esquemas cis/pem, cis/gem/bev o carbo/pac/bev (Figura 1). Los valores pro- babilísticos de cada transición fueron obtenidos de los ensayos clínicos Fase III: PARAMOUNT7 (cis/pem); AVAIL8 (cis/gem/bev) y SAIL9 (carbo/pac/bev).
Estos esquemas de tratamiento se basan en una fase de inducción seguida de una fase de mantenimiento en monoterapia que se prolonga hasta progresión de la enfermedad (supervivencia libre de progresión (SLP)) o toxicidad intolerable.
- •
4 ciclos Cis (75 mg/m2)/Pem (500 mg/m2) seguido de pemetrexed (500 mg/m2) en mantenimiento cada 3 semanas.
- •
6 ciclos Gem (1250 mg/m2)/Cis (80 mg/m2)/ Bev (7,5 mg/kg) seguido de bevacizumab (7,5 mg/kg) en mantenimiento cada 3 semanas.
- •
6 ciclos Pac (200 mg/m2)/Carbo (AUC = 6)/Bev (1 5 mg/ kg) seguido de bevacizumab (15 mg/kg) en mantenimiento cada 3 semanas.
En la Tabla 1 se resumen las características principales de los ensayos PARAMOUNT, SAIL y AVAIL.
Resultados y características de los ensayos PARAMOUNT, AVAIL y SAIL6,7,8
| Ensayo clínico | Brazo del estudio y características del mismo | % pacientes mantenimiento | SLP (meses) | 95% Cl |
|---|---|---|---|---|
| Paramount | Inducción: 4 ciclos Cls 75 mg/m2, Pem 500 mg/m2 Mantenimiento: Pem 500 mg/m2 cada 3 semanas | 57% | 6,9 | 3,2-4,6 |
| Avail | Inducción: 6 ciclos Cls 80 mg/m2/Gem 1250 mg/m2/bev7,5 mg/m2Mantenimiento: Bev 7,5 mg/kg m2 cada 3 semanas | 42% | 6,7 | 0,56- 0,83 |
| Sail | Inducción: 6 ciclos Carb AUC=6, pac 200 mg/m2, bev 15 mg/kgMantenimiento: Beva 15 mg/kg cada 3 semanas | 53% | 6,2 | 0,57- 0,77 |
El modelo económico fue validado por un panel de expertos, constituidos por oncólogos, con el objetivo de aclarar diferencias y/o contradicciones descritas en la literatura. Para el desarrollo del modelo se utilizó el aplicativo informático Microsoft Excel 2013®. Un diagrama esquemático del análisis de decisión se ilustra en la Figura 1.
Estimación de la eficacia y costesComo variable de eficacia se utilizó la supervivencia libre de progresión (SLP) descrita en los ensayos clínicos de cada tratamiento. Dado que el estudio AVAIL, los pacientes que superaron la fase de inducción eran aleato- rizados a recibir bevacizumab en mantenimiento, a dosis de 7,5 mg/kg o 15 mg/kg y no se observaron diferencias estadísticamente significativas entre ambas dosis de bevacizumab, para la estimación de los costes se utilizó la dosificación de 7,5 mg/kg.
El coste farmacológico se calculó en función del PVL de los medicamentos considerados, resultante de la aplicación de los márgenes comerciales establecidos sobre el PVP-IVA del Catálogo del Consejo General de Colegios Oficiales de Farmacéuticos, y con la correspondiente deducción del 7,5% sobre el PVL establecida por el RD 8/2010 y proporcionada por el Ministerio de Sanidad, Servicios Sociales e Igualdad con fecha Octubre-201210-11 (Tabla 2).
Costes unitarios utilizados en el modelo farmacoeconómico del tratamiento del NSCLC en 1a linea (€de octubre de 2015)
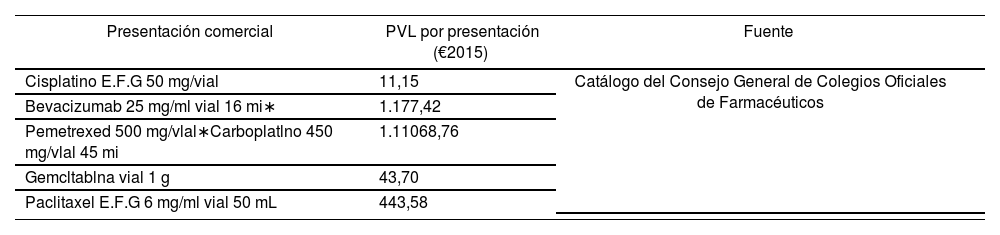
| Presentación comercial | PVL por presentación (€2015) | Fuente |
|---|---|---|
| Cisplatino E.F.G 50 mg/vial | 11,15 | Catálogo del Consejo General de Colegios Oficiales de Farmacéuticos |
| Bevacizumab 25 mg/ml vial 16 mi∗ | 1.177,42 | |
| Pemetrexed 500 mg/vlal∗Carboplatlno 450 mg/vlal 45 mi | 1.11068,76 | |
| Gemcltablna vial 1 g | 43,70 | |
| Paclitaxel E.F.G 6 mg/ml vial 50 mL | 443,58 |
E.F.G Especialidad farmacéutica genérica
∗ deducción 7,5% sobre el PVL establecida por el RD 8/201014
Para el cálculo de la dosis, se consideraron las características antropométricas de un paciente estándar representativo de pacientes oncológicos españoles12: 70,15 kg de peso, una superficie corporal de 1,78 m2, y una creatinina plasmática de 0,6 mg/dL. La administración de carboplatino, para obtener el área bajo la curva (ABC) deseada, viene determinada por la tasa de filtración glomerular (TFG). En el presente trabajo se utilizó la fórmula de Calvert para estimar los miligramos de carboplatino necesarios en cada administración13. El coste farmacológico total para cada esquema oncológico se estimó asumiendo un aprovechamiento máximo de los viales. Todos los costes incluidos en el análisis se expresaron en euros (€) del año 2015.
Horizonte temporal, perspectiva del análisis y tasa de descuentoEl horizonte temporal considerado fue el tiempo hasta progresión de la primera línea de tratamiento, que correspondió aproximadamente a 1 año de modelización en base a los resultados obtenidos los ensayos clínicos. El estudio se efectuó desde la perspectiva de la gerencia hospitalaria considerando únicamente los costes directos de adquisición de los fármacos. Dada la limitada supervivencia de los pacientes (ninguno de los esquemas oncológicos supero el año de tratamiento), no fue oportuna la aplicación correctora de la tasa de descuento14,15.
Caso base y análisis de sensibilidadEn el caso base del estudio, se consideraron los valores medios de los costes y de la eficacia.
Para comprobar la robustez de los resultados del escenario base y la consistencia de las estimaciones efectuadas, se realizaron varios análisis de sensibilidad determinísticos univariantes considerando los factores siguientes:
- 1.
Mejora de la eficacia (SLP). Dado que en los ensayos clínicos no se especifica la SLP de los pacientes que superan la fase de inducción, esta se estimo mediante la siguiente fórmula:
El modelo asume que la SLP de los pacientes que progresan durante la fase de inducción es igual a la duración de dicha fase. Esta suposición se basa en el hecho de que, en la práctica clínica, las pruebas de imagen para comprobar el estado de la enfermedad suelen realizarse finalizada la fase de inducción. Por tanto, la SLP estimada para los pacientes que presentaron progresión de la enfermedad durante la fase de inducción fue la siguiente:
- -
2,8 meses para el esquemas cis/pem (4 ciclos de inducción cada 3 semanas).
- -
4,2 meses para el esquema pac/carbo/bev y cis/ gem/bev (6 ciclos de inducción cada 3 semanas).
Se llevo a acabo un análisis de sensibilidad asumiendo una mejoría en el porcentaje de pacientes que superaban la fase de inducción del 20% para cada esquema (Tabla 3), lo que resultaría, aplicando la fórmula anterior en una SLP global para cada esquema de:
- -
cis/pem: 7,69 meses
- -
cis/gem/bev: 7,18 meses
- -
pac/carbo/bev: 6,58 meses
Tabla 3.Razón coste-eficacia incremental y análisis de sensibilidad del análisis de coste-eficacia (€de octubre de 2015) del tratamiento del NSCLC en 1a línea.
Análisis Tratamiento % pacientes mantenimiento SLP (meses) Ciclos inducción Coste inducción Ciclos mantenimiento Coste mantenimiento Coste tratamiento RCEI/mes SLP adicional3 Caso base pem/cis 57% 6,9 4 3.449,58€ 10,14 15.992,43€ 19.442,01€ 19.303,67€ gem/cis/bev 42% 6,7 6 5.838,28€ 8,5 9.756,51€ 15.594,79€ - pac/carbo/bev 53% 6,2 6 12.813,78€ 5,38 23.281,39€ 36.095,17€ Alternativa dominada11 Análisis de sensibilidad deterministos Aumento de la Eficacia 20% costes actuales pem/cis 68% 7,69 4 2.567,13€ 10,14 19.078,69€ 21.645,82€ 9.719,81€ gem/cis/bev 50% 7,18 6 5.033,00€ 8,5 11.614,89€ 16.647,89€ - pac/carbo/bev 63% 6,58 6 9.814,81€ 5,38 28.1 13,38€ 37.928,19€ Alternativa dominada11 Aumento de la Eficacia 20%. Reducción coste pemetrexed 30% pem/cis 68% 7,69 4 1.299,80€ 10,14 13.379,37€ 15.187,80€ Alternativa dominante1 gem/cis/bev 50% 7,18 6 5.033,00€ 8,5 11.614,89€ 16.647,89€ - pac/carbo/bev 63% 6,58 6 9.814,81€ 5,38 28.1 13,38€ 37.928,19€ Alternativa dominada11 Eficacia media Reducción coste pemetrexed 30% pem/cis 57% 6,9 4 2.430,07€ 10,14 11.215,06€ 13.645,13€ Alternativa dominante1 gem/cis/bev 42% 6,7 6 5.838,28€ 8,5 9.756,51€ 15.594,79€ - pac/carbo/bev 53% 6,2 6 12.813,78€ 5,38 23.281,39€ 36.095,17€ Alternativa dominada11 aRazón coste/eficacia ¡ncremental por mes de supervivencia libre de progresión adicional
bUna alternativa se dice que es dominada cuando existen opciones con mayor eficacia y menor coste cUna alternativa se dice que es dominante cuando es la que presenta mayor eficacia a menor coste
- -
- 3.
Modificación de los costes de adquisición de pemetrexed suponiendo una disminución del coste del 30% con la incorporación al mercado de genéricos.
El porcentaje de pacientes que pasaron a la fase de mantenimiento durante los ensayos clínicos fue: 57% en el caso del régimen cis/pem, 42% en el caso de los pacientes que recibieron gem/cis/bevy 53% en el esquema carbo/pac/bev. En base a nuestro modelo, el coste medio de tratamiento por paciente para los esquemas de tratamiento gem/cis/bev, cis/pem, y carb/pac/bev serían 15.594,74€, 19.442,01 € y 36.095,17€ respectivamente. El esquema car/pac/bev se trata de la alternativa dominada por tratarse de el esquema de tratamiento mas costoso y con peores resultados en salud. La diferencia de costes entre las estrategias cis/pem y cis/gem/bev es de 3.847,21€, con una razón coste-eficacia incremental (RCEI) por mes de SLP adicional de 19.303€ (Tabla 3).
Análisis de sensibilidad en escenarios alternativosEl resultado fue robusto en el análisis de sensibilidad en todos los escenarios considerando los costes de adquisición de los fármacos actuales. Con una RCEI por mes de SLP adicional de 9.720€ para el régimen cis/pem cuando se considera un aumento de la eficacia del 20% para todos los tratamientos. Sin embargo, con una bajada del precio de pemetrexed del 30%, la alternativa cis/ pem pasaría a convertirse en la alternativa dominante, por ser la que presenta mejores resultados en salud a un coste menor. La mejor razón coste-eficacia incremental para el tratamiento cis/pem se produjo cuando se considero un descuento del 30% para pemetrexed y un aumento de la eficacia del 20% (RCEI = -3.974€/mes de SLP adicional)
El esquema carb/pac/bev fue la alternativa dominada en todos los escenarios contemplados (Tabla 3).
DiscusiónDe los resultados de nuestro modelo, se deduce, que desde la perspectiva de la gerencia hospitalaria, el esquema carb/pac/bev es la alternativa dominada en el tratamiento de primera línea del NSCLC, al existir regímenes con una eficacia mayor y menor coste, por lo que esta opción quedaría relegada, a nuestro juicio, únicamente a los pacientes que no puedan tolerar los tratamientos que contengan cisplatino, como sucede, por ejemplo, en el caso de pacientes con nefropatías de base. Con el coste de adquisición actual de los fármacos analizados, el tratamiento cis/gemc/bev es más económico que el régimen cis/pem, con una coste incremental de entre 8.217 - 19.303C por mes de SLP adicional. Habitualmente una terapia se considera coste-efectiva si su RCEI es inferior al umbral de aceptabilidad definido17. En caso de no disponer de umbrales de aceptabilidad explícitos, una terapia puede considerarse coste-efectiva si su RCEI se encuentra en el rango de otras terapias para las que los gestores sanitarios han demostrado disponibilidad a pagar16. Oyagüez y colabores, en un estudio publicado en 2.013 sobre la eficiencia de los tratamientos oncológicos en España, encontraron que los valores de RCEI por mes de SLP adicional se incluyeron en el rango de 5.979,87 y 46.716€17 para las terapias de primera línea, por lo que, de acorde con estos estudios, podría concluirse que el tratamiento cis/pem es una estrategia coste-efectiva.
Además de lo citado con anterioridad, la incorporación al mercado de medicamentos genéricos de pemetrexed (Alimta® Eli Lilly Nederland B.V, fecha autorización septiembre 2004) puede cambiar considerablemente la situación actual. Con una rebaja de los costes de adquisición actuales de pemetrexed del 30%, el tratamiento cis/pem se convertiría en la alternativa dominante (mejores resultados en salud a menor coste) en el tratamiento de 1a línea de los pacientes con NSCLC. Estos resultados deberían ser tenidos en cuenta a la hora de la toma de decisiones para optimizar los recursos disponibles.
La interpretación de los resultados del presente análisis, debe entenderse como una aproximación a la eficiencia de los esquemas oncológicos y en cualquier caso debe ir acompañada de la consideración de una serie de limitaciones. La principal limitación debe entenderse derivada de la consideración únicamente del coste farmacológico de los esquemas oncológicos, aunque algunas terapias podrían asociarse con costes adicionales para el sistema sanitario como los derivados de su administración, monitorización o manejo de acontecimientos adversos sufridos por el paciente a consecuencia de la medicación. La aproximación elegida para el análisis, considerando solo el coste farmacológico, pretende igualar los resultados de los diferentes esquemas evaluados. Los resultados de este análisis farma- coeconómico deberían por tanto, confirmarse mediante registros de efectividad, en los que se comparase la utilización de recursos sanitarios de las opciones terapéuticas evaluadas en condiciones de práctica clínica habitual. Además, no hay que olvidar que el bevacizumab presenta una serie de limitaciones importantes que suelen ser frecuentes en este tipo de pacientes, ya que está contraindicado en situaciones de hemoptisis o bien si el tumor se encuentra adherido a un gran vaso torácico. Mientras tanto, de acuerdo con los resultados del modelo, puede concluirse que, el tratamiento cis/pem es un tratamiento coste-efectivo y la incorporación al mercado de genéricos de pemetrexed podría convertirla en la alternativa dominante en el tratamiento de 1a línea de pacientes con NSCLC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas