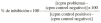ORIGINALES
EFECTO IN VITRO DE LAS INMUNOGLOBULINAS DE ADMINISTRACION INTRAVENOSA SOBRE LA PROLIFERACION LINFOCITARIA Y SOBRE LA PRODUCCION DE INTERLEUCINA-2
Casamiquela Badía, R.*; Montoro Ronsano, J. B.**; Millán López, O.***; Martorell, J.***; Jorquera Nieto, J. I.*
* Área de Investigación y Desarrollo. Instituto Grifols, S. A. Barcelona.
** Servicio de Farmacia. Hospital Vall d''Hebron. Barcelona.
*** Servicio de Inmunología. IDIBAPS. Hospital Clínic. Barcelona.
Correspondencia: J. B. Montoro Ronsano. Servicio de Farmacia. Hospital General Vall d''Hebron. P.° Vall d''Hebron, 119-129. 08035 Barcelona.
Fecha de recepción: 10-11-98
Palabras clave:
Inmunoglobulina. Linfocitos. Interleucina-2.
Resumen:
Fundamento: El presente estudio evalúa el efecto de diferentes preparaciones comerciales de inmunoglobulina humana para administración intravenosa (IgIV) sobre la respuesta proliferativa y de secreción de citocinas (IL-2) en cultivos in vitro de linfocitos humanos aislados de sujetos normales.
Método: Se han estudiado las siguientes preparaciones comerciales: Endobulin® (Immuno), Flebogamma Líquida® (Grifols), Gammagard S/D® (Baxter), Gammonativ® (Kabi), Polyglobin N® (Bayer) y Sandoglobulina® (Sandoz).
Las muestras de IgIV se ensayaron en cultivos de linfocitos a las dosis equivalentes a la utilización del producto in vivo. La respuesta proliferativa se midió por la incorporación de timidina tritiada al cultivo, expresándose en porcentaje de inhibición respecto a un control sin producto. La secreción de IL-2 se determinó por ELISA en los sobrenadantes de los cultivos a las cuarenta y ocho horas, expresándose en pg de IL-2 por ml. Se realizaron también ensayos de proliferación linfocitaria y determinación de IL-2 con la solución de excipientes de cada uno de los productos estudiados con el objeto de evaluar el efecto potencial de dichos excipientes respecto al producto.
Resultados: Las IgIV inhibieron la proliferación linfocitaria un valor medio del 44,6% (intervalo: 23-96%). La producción de IL-2 fue de 38,62 pg/ml (intervalo: 5,60-140,50 pg/ml), inferior significativamente al valor del control positivo (82,7 ± 4,0 pg/ml, p < 0,05). Las muestras correspondientes a la simulación de los excipientes ejercieron también un efecto inhibidor, con un valor medio del 17,9% (intervalo: 0-76%). La producción de IL-2 fue superior, con un valor medio de 116,9 pg/ml (intervalo: 5,6-749,5 pg/ml), superior al control positivo.
Discusión: Todas las preparaciones comerciales de IgIV ensayadas presentaron un efecto inhibidor de la proliferación linfocitaria. Sin embargo, la magnitud del efecto difiere significativamente según el preparado comercial tanto en los ensayos in vitro de proliferación linfocitaria (p = 0,009) como en la producción de IL-2 (p < 0,001). Es destacable también la importancia de los excipientes de las diferentes preparaciones comerciales en los resultados obtenidos en estos ensayos in vitro, que según nuestros resultados podrían representar del 0 al 100% del efecto de la preparación.
IN VITRO EFFECT OF INTRAVENOUS IMMUNOGLOBULIN ON LYMPHOCYTE PROLIFERATION AND PRODUCTION OF INTERLEUKIN-2
Key words:
Immunoglobulin. Lymphocyte. Interleukin-2.
Summary:
Background: Our study evaluated the effect of different commercial human immunoglobulin preparations administered intravenously (IgIV) on proliferative response and cytokine secretion (IL-2) in cultures in vitro of human lymphocytes isolated from healthy subjects.
Method: The following commercial preparations were studied: Endobulin® (Immuno), Flebogamma Líquida® (Grifols), Gammagard S/D® (Baxter), Gammonativ® (Kabi), Polyglobin N® (Bayer) and Sandoblogulina® (Sandoz).
IgIV samples were assayed in lymphocyte cultures at doses equivalent to those used in vivo. Proliferative response was measured by tritiated thymidine incorporation by the culture, expressed as the percentage of inhibition compared with an untreated control. IL-2 secretion was determined by ELISA in the supernatant of forty eight hour old cultures and expressed in pg IL-2 per mililiter. Assays were made of lymphocyte proliferation and IL-2 determination with the excipient solution of each product studied in order to evaluate the effect of excipients on the product.
Results: IgIV inhibited lymphocyte proliferation by a mean of 44.6% (range: 23-96%). IL-2 production was 38.62 pg/ml (range: 5.60-140.50 pg/ml), significantly less than that of the positive control (82.7 ± 4.0 pg/ml, p < 0,05). The samples corresponding to the excipient simulation had a mean inhibitory effect of 17.9% (range: 0-76%). Mean IL-2 production was 116.9 pg/ml (range: 5.6-749.5 pg/ml), which was greater than in the positive control.
Discussion: All the commercial IgIV preparations assayed had an inhibitory effect on lymphocyte proliferation. However, the magnitude of the effect differed significantly between commercial preparations in terms of lymphocyte proliferation in vivo (p = 0.009) and IL-2 production (p < 0,001). We emphasize the importance of the excipients of the commercial preparation on the results of assays in vitro, which our results show could be 0 to 100% of the effect of preparation.
INTRODUCCIÓN
La principal indicación terapéutica de la inmunoglobulina humana para administración intravenosa (IgIV) ha sido clásicamente el tratamiento sustitutivo de distintas formas de inmunodeficiencia (1, 2). Sin embargo, y cada vez en mayor proporción, las IgIV son utilizadas por su capacidad moduladora de la respuesta inmune en enfermedades autoinmunes y trasplantes (3-5).
El mecanismo por el cual las IgIV ejercen un efecto terapéutico en el tratamiento de disfunciones inmunológicas es controvertido (6), aunque se han propuesto distintos mecanismos de acción: bloqueo de los receptores Fc por un aumento de los monómeros de inmunoglobulina (Ig) circulantes (tras la administración de IgIV), que competirían con los autoanticuerpos por los receptores Fc de células reticuloendoteliales (7); interacciones idiotipo-antiidiotipo (8), o por modulación de la secreción de citoquinas proinflamatorias (IL-1, IL-2, IL-6, INF-* y TNF-*).
Estudios recientes sugieren que la administración de IgIV afecta directamente a la activación y proliferación celular. Así se ha demostrado una inhibición dosisdependiente de la proliferación de células mononucleares periféricas estimuladas con antígenos y/o mitógenos tras su incubación con concentraciones de IgIV equivalentes a las obtenidas en plasma tras la administración de dosis terapéuticas de IgIV (250-500 mg/kg) (10).
A la vista de esta amplia utilización de las IgIV, por su capacidad inmunomoduladora podría en principio suponerse que esta capacidad es inherente a la Ig independientemente de la preparación comercial utilizada.
El análisis de la literatura (10-17) revela que en ensayos in vitro que evalúan la capacidad inmunomoduladora las IgIV se comportan de forma distinta según la metodología del ensayo, siendo especialmente sensibles al tipo y dosis de mitógeno utilizado y a la dosis de IgIV. La falta de una metodología homogénea invalida la posibilidad de establecer comparaciones interestudio, por lo que en la práctica aún no se dispone de datos que permitan objetivar comportamientos selectivos por parte de las distintas preparaciones comerciales de IgIV en relación con la capacidad inmunomoduladora.
El presente estudio pretende aportar conocimiento en el campo del efecto inmunomodulador de las IgIV analizando el efecto in vitro de las distintas preparaciones comerciales sobre la proliferación linfocitaria y sobre la secreción de IL-2 con el propósito de objetivar (si las hubiere) diferencias entre las mismas. Asimismo se evalúa y controla el potencial efecto inmunomodulador causado por los excipientes (distintos) de cada preparado comercial de IgIV.
MÉTODO
Preparados comerciales
Las preparaciones comerciales estudiadas de IgIV han sido Endobulin® (Immuno), Flebogamma i.v. LP® (Grifols), Gammagard S/D® (Baxter) y Polyglobin N® (Bayer) (la totalidad de las registradas en nuestro país) y Gammonativ® (Pharmacia) y Sandoglobin® (Sandoz), especialidades extranjeras de amplia utilización. Para este estudio se ha empleado un lote comercial de cada preparado.
Preparación de las muestras
Los preparados comercializados en forma líquida se han utilizado tal como se presentan y los preparados liofilizados se han reconstituido siguiendo las instrucciones del fabricante con agua destilada.
Las concentraciones de IgIV de estudio han sido 7 y 14 mg/ml y se han obtenido al asumir que la concentración plasmática tras la administración de dosis usuales de IgIV (200-400 mg/kg durante cuatro-cinco días hasta 1 g/kg dos días) oscila entre estos valores si se considera un volumen de distribución en el estado estacionario de 75 ml/kg.
Las muestras de excipientes de los productos estudiados se han reproducido y preparado según la ficha técnica del producto. La concentración final de estudio en las muestras de excipientes se ha calculado de forma análoga a la de las IgIV.
Descriptiva analítica
En una primera etapa se ha procedido a la determinación de la citotoxicidad e interferencia de las muestras con los «kits» de determinación como medida para garantizar la coherencia de los resultados. Se ha comprobado que no existe linfocitotoxicidad de las muestras. Se comprueba también que no existe interferencia de las muestras en la determinación de IL-2 por ELISA.
Las diferentes muestras de IgIV se han ensayado en cultivos de linfocitos a las dosis equivalentes a la utilización del producto in vivo y a una concentración de mitógeno (PHA, Sigma) de 10 µg/ml. Los ensayos de proliferación linfocitaria y determinación de IL-2 se han realizado también con la solución de excipientes de cada uno de los productos estudiados con el objeto de evaluar el efecto de dichos excipientes respecto al producto.
La respuesta proliferativa se ha medido por la incorporación de timina tritiada al cultivo y se ha expresado en porcentaje medio de inhibición respecto al control (sin producto) de un mínimo de tres replicados por experiencia.
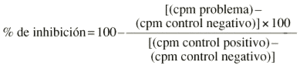
Los linfocitos, obtenidos a partir de sangre heparinizada de individuos sanos, se separaron por gradiente de Ficoll en flujo laminar y utilizando material estéril. Se ajustaron a un recuento de 106 linfocitos/ml · 50 µl de suspensión y se cultivaron en una placa estéril de 96 pocillos de fondo en «U» en presencia de PHA a 10 µg/ml de concentración final. La incubación se realizó en estufa húmeda con 5% de CO2 a 37° C durante setenta y dos horas. A las cuarenta y ocho horas de incubación se añadieron 50 µl de una solución de timidina tritiada de 1,0 mCi/ml (2,0 Ci/mmol) equivalente a 1,25 µCi/pocillo. Los cultivos se recogieron sobre filtro de nitrocelulosa y la timidina captada se evaluó mediante lector BetaPlate® (Pharmacia). Se calculó la media y el error estándar de los triplicados. La capacidad de inhibición de la mitogénesis de cada muestra se evaluó según la fórmula:
La IL-2 se midió por ELISA mediante «kit» de Immunotech (F) (número cat. 1116), siguiendo las instrucciones del fabricante de los cultivos de linfocitos activados por PHA a las cuarenta y ocho horas y se expresa en picogramos de IL-2 por ml de sobrenadante (media de dos replicados por experiencia). La concentración celular fue de 2 · 106 células/ml (100.000 células/pocillo).
Análisis estadístico
El análisis estadístico se realizó utilizando un paquete estadístico comercial (SPSS/PC+ versión 5.0 para Windows). La distribución de las variables se examinó mediante el test de Shapiro-Wilks para detectar desviaciones significativas de la normalidad. No obstante, y a efectos descriptivos, se emplearon la media y la desviación estándar independientemente del tipo de distribución.
La influencia del preparado comercial y de los excipientes en la inhibición de la proliferación linfocitaria y en la producción de IL-2 se evaluó mediante el análisis de la varianza, controlando la concentración de IgIV, y el test de Kruskal y Wallis.
Por otro lado, la influencia de la concentración de IgIV sobre la inhibición de la proliferación linfocitaria y en la producción de IL-2 se evaluó mediante regresión lineal.
Todos los valores de significación estadística se calcularon sobre hipótesis bilaterales. Un valor de p < 0,05 se considera que indica significación estadística.
RESULTADOS
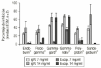
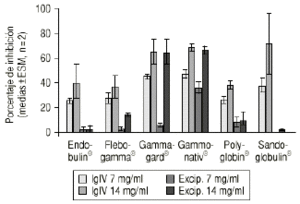
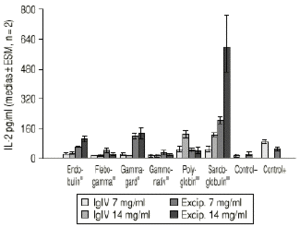
Las preparaciones comerciales de IgIV inhiben como era previsible la proliferación linfocitaria, con un valor medio del 44,6% (intervalo total: 23-96%). La producción de IL-X fue de 38,62 pg/ml (intervalo total: 5,60-140,50 pg/ml), inferior significativamente al valor del control positivo (82,7 ± 4,0 pg/ml, p < 0,05). Las muestras correspondientes a la simulación de los excipientes ejercen también un efecto inhibidor, con un valor medio del 17,9% (intervalo total: 0-76%). La producción de IL-2 es muy superior, con un valor medio de 116,9 pg/ml (intervalo total: 5,6-749,5 pg/ml), superior al control positivo. La tabla 1 recoge los valores medios de inhibición para cada preparado comercial y para su correspondiente solución de excipientes. De forma análoga, la tabla 2 muestra los valores medios de producción de IL-2 para cada especialidad y su correspondiente solución de excipientes. Las figuras 1 y 2 recogen gráficamente los valores de inhibición y formación de IL-2 para cada preparado y su excipiente.
Figura 1.--IgIV: proliferación linfocitaria.
Figura 2.--IgIV: producción de IL-2.
| Tabla 1. Resultados de inhibición (%) de la proliferación linfocitaria inducida por PHA producida por las muestras de IgIV y por sus excipientes | |||
| Preparadocomercial | Dosis exp.(mg/ml) | IgIV% inhibición(X ± ES, n = 2) | Excipientes % inhibición(X ± ES, n = 2) |
| Endobulin® | 7 | 26,5 ± 0,5 | 2,0 ± 2,0 |
| 14 | 41,0 ± 15,0 | 2,3 ± 2,3 | |
| Flebogamma® | 7 | 28,0 ± 4,0 | 3,0 ± 0,4 |
| 14 | 37,5 ± 8,5 | 13,9 ± 0,3 | |
| Gammagard® | 7 | 45,5 ± 1,5 | 5,9 ± 1,4 |
| 14 | 65,5 ± 10,5 | 65,5 ± 10,5 | |
| Gammonativ® | 7 | 48,0 ± 3,0 | 37,0 ± 4,0 |
| 14 | 70,0 ± 2,0 | 67,5 ± 2,5 | |
| Polyglobin® | 7 | 26,0 ± 3,0 | 7,7 ± 4,3 |
| 14 | 38,0 ± 4,0 | 9,5 ± 5,5 | |
| Sandoglobulin® | 7 | 37,5 ± 6,5 | 0 |
| 14 | 72,0 ± 24,0 | 1,0 ± 1,0 | |
| Tabla 2. Resultados de valoración de IL-2 en los cultivos de linfocitos estimulados por PHA con las muestras | |||
| Preparadocomercial | Dosis exp.(mg/ml) | IgIVIL-2 pg/ml(X ± ES, n = 2) | Excipientes IL-2 pg/ml(X ± ES, n = 2) |
| Endobulin® | 7 | 27,9 ± 0,4 | 64,2 ± 0,8 |
| 14 | 27,4 ± 3,9 | 101,8 ± 18,4 | |
| Flebogamma® | 7 | 6,1 ± 0,5 | 43,5 ± 11,9 |
| 14 | 12,1 ± 4,9 | 26,1 ± 5,4 | |
| Gammagard® | 7 | 14,7 ± 5,8 | 117,6 ± 15,2 |
| 14 | 6,8 ± 1,2 | 135,2 ± 30,1 | |
| Gammonativ® | 7 | 14,1 ± 1,2 | 18,9 ± 6,5 |
| 14 | 12,8 ± 1,8 | 11,6 ± 6,0 | |
| Polyglobin® | 7 | 48,8 ± 9,3 | 53,6 ± 0,3 |
| 14 | 122,5 ± 17,9 | 41,4 ± 10,4 | |
| Sandoglobulin® | 7 | 46,9 ± 11,7 | 202,8 ± 13,5 |
| 14 | 122,9 ± 3,7 | 586,3 ± 163,2 | |
| Control+ | -- | 82,7 ± 4,0 | 49,9 ± 5,7 |
| Control | -- | 6,8 ± 1,3 | 12,2 ± 6,6 |
El análisis de la varianza demuestra que existen diferencias con significación estadística en la inhibición de la proliferación linfocitaria (p = 0,009) y en la producción de IL-2 (p < 0,001), controlando la concentración de IgIV en función de la preparación comercial de IgIV. El test de Kruskal y Wallis indica (sin controlar la concentración de IgIV) igualmente diferencias significativas para el porcentaje de inhibición (p = 0,045) y para la producción de IL-2 (p = 0,0014). Curiosamente se observan igualmente diferencias tanto en la inhibición como en la producción de IL-2 cuando se valora el efecto de las distintas soluciones de excipientes (p = 0,0058 y p = 0,0007, respectivamente).
La magnitud de la respuesta se correlaciona con la concentración de IgIV en el caso de capacidad de inhibición (p = 0,0107, coeficiente de determinación del 26,1%). Sin embargo, la producción de IL-2 es independiente de la concentración de IgIV empleada.
DISCUSIÓN
La utilización de IgIV en el tratamiento de disfunciones inmunológicas por su capacidad moduladora inmune está avalada por el efecto terapéutico conseguido en la práctica clínica (4, 13, 17). El mecanismo por el cual las IgIV ejercen dicho efecto terapéutico es en la actualidad controvertido, aunque parece que podría ser debido a una afectación de la activación y proliferación celular (10).
Tal como se ha descrito ampliamente (10-17), todas las preparaciones comerciales de IgIV ensayadas muestran un efecto inhibidor de la proliferación linfocitaria in vitro. A la luz de los resultados obtenidos, sin embargo, se observa que las distintas preparaciones no se comportan de forma similar tanto en el ensayo de proliferación linfocitaria como en la formación de IL-2.
La especialidad Endobulin® muestra una actividad inhibitoria moderada de la proliferación linfocitaria y de la producción de IL-2, no atribuible a los excipientes. Asimismo, la especialidad Flegobamma® muestra también una actividad inhibidora moderada de la proliferación linfocitaria y de la producción de IL-2, no atribuible completamente a los excipientes. El preparado Gammagard® presenta una actividad inhibidora importante de la proliferación linfocitaria, atribuible a los excipientes, y un efecto inhibidor de la producción de IL-2, no atribuible en este caso a los excipientes. En el caso de la especialidad Gammonativ®, ésta muestra una actividad inhibidora importante de la proliferación linfocitaria, atribuible a los excipientes, y un efecto inhibidor de la producción de IL-2, claramente también atribuible a los excipientes. La especialidad Polyglobin® presenta una actividad inhibidora moderada, no atribuible a los excipientes, no mostrando efecto inhibidor sobre la producción de IL-2 e incluso aumentándola a concentraciones de 14 pg/ml. Los excipientes no modificarían el efecto. Finalmente, la especialidad Sandoglobulin® muestra una actividad inhibitoria importante, no atribuible a los excipientes. La producción de IL-2 se incrementa a dosis de 14 pg/ml. Los excipientes muestran un importante aumento en la producción de IL-2.
La evaluación de las diferencias encontradas entre las diferentes preparaciones comerciales viene dificultada por el escaso conocimiento acerca del mecanismo de acción de la IgIV e incluso a que el efecto inmunosupresor pueda ser debido a proteínas contaminantes como el TGFß (18), lo que implicaría que este efecto inmunosupresor pudiera estar relacionado con el origen de la materia prima plasmática y con el método de purificación seguido por cada fabricante. Otra posibilidad sería la presencia de mayor o menor cantidad de agregados de Ig (dímeros o polímeros) o fracciones de la misma, que, como ha apuntado algún autor (19), podrían influir de forma determinante en la capacidad de la preparación para afectar a la proliferación celular. Es decir, la magnitud del efecto inmunosupresor podría estar inversamente relacionada con la pureza y calidad del producto, al menos en pruebas in vitro.
Otro aspecto no menos importante, como ya han apuntado otros autores (20, 21), es la influencia de los excipientes y estabilizantes de las diferentes preparaciones en los resultados obtenidos en estos ensayos in vitro, que según nuestros datos pueden representar del 0 al 100% del efecto de la preparación en función del excipiente utilizado.
Si bien en el presente estudio se pretende sólo una aproximación al conocimiento del efecto in vitro de diferentes preparaciones comerciales, podemos destacar que en todas las preparaciones se observa un efecto dependiente de la dosis utilizada.
Respecto a la magnitud del efecto observamos un grupo de preparaciones que presentan un efecto esperado, es decir, inhibición moderada de la proliferación linfocitaria (la utilización de menores dosis de mitógeno u otro tipo de estimulación la podría convertir en una inhibición importante), no atribuible a los excipientes y asociada a una disminución en la determinación de IL-2 de los cultivos. En principio esto podría indicar su capacidad para inhibir el sistema inmunitario.
Otras preparaciones muestran un efecto inhibidor importante, claramente asociado a los excipientes en un caso y en el que además los excipientes reducen la detección de IL-2 en la misma magnitud que el producto. En otro caso el efecto de los excipientes es dependiente de la dosis y no parece afectar a la producción de IL-2.
Finalmente, tenemos una preparación que muestra una inhibición importante de la proliferación celular, no atribuible a los excipientes. En este caso no se detecta una afectación importante de la producción de IL-2 por la IgIV, pero, sorprendentemente, en el cultivo con sus excipientes se detecta un aumento muy importante de IL-2. Este hecho podría explicarse por una disminución del consumo de IL-2 debida a un efecto de los excipientes por bloqueo de los receptores para la IL-2 en el cultivo in vitro. La confirmación de este hecho podría cuestionar la validez de este tipo de ensayo para la comparación in vitro de diferentes preparaciones comerciales.
Por todo lo expuesto parece fuera de discusión que las IgIV modifican la respuesta linfocitaria de proliferación y alteran la formación de IL-2, lo cual puede estar directamente relacionado con la eficacia de las IgIV en el tratamiento de los procesos autoinmunes. El establecimiento de la correcta correlación entre los resultados in vitro y su correspondiente valor in vivo depende del esclarecimiento del mecanismo de acción de las IgIV sobre el sistema inmunitario (19, 22-24). Por otro lado, parece claro también que existen diferencias en el comportamiento de los diferentes preparados, con un efecto variable de sus correspondientes excipientes. Un análisis más completo de las diferencias de comportamiento observadas y del papel de los excipientes podría ofrecer más luz sobre el mecanismo de acción de las IgIV en este tipo de procesos y explicaría, por otro lado, la presencia de resultados clínicos en ciertos casos contradictorios sobre la eficacia de las IgIV en las enfermedades causadas por una disfunción inmunológica.
BIBLIOGRAFÍA
1.Bruton OC. Agammaglobulinemia. Pediatrics 1952; 9:722.
2.Cunningham-Randles C, Siegal FP, Smithwick EM. Efficacy of intravenous immuneglobulin in primary humoral immunodeficiency disease. Ann Intern Med 1984;101:435.
3.Schanz U, Hugle T, Gmur J. Additional inhibitory effects of intravenous immunoglobulins in combination with cyclosporine A on human T lymphocyte alloproliferative response in vitro. Transplantation 1996;61:1736.
4.Bussel JB, Szatrowski TP. Uses of intravenous gammaglobulin in immune hematologic disease. Immunol Invest 1995;24:451.
5.Klaesson S, Ringden O, Markling L, Remberger M, Lundkvist I. Immune modulatory effects of immunoglobulins on cell-mediated immune responses in vitro. Scand J Immunol 1993;477.
6.Mouthon L, Kaveri SV, Spalter SH, Lacroix-Desmazes S, Lefranc C, Desai R, Kazatchkine MD. Mechanisms of action of intravenous immune globulin in immunemediated diseases. Clin Exp Immunol 1996;104(Supl 1):3.
7.Gelfand E. Treatment of autoimmune diseases with intravenous immune globulin. Sem Haematol 1992; 29:127.
8.Dietrich G, Algiman M, Sultan Y, Nydegger UE, Kazatchkine MD. Origin of antiidiotypic activity against anti-factor VIII autoantibodies in pools of normal human immunoglobulina G (IgIV). Blood 1992;79:2946.
9.Andersson IP, Andersson UG. Human intravenous immunoglobulin modulates monokine production in vitro. Immunology 1990;71:372.
10.Van Schaik IN, Lundkvist I, Vermeulen M, Brand A. Polyvalent immunoglobulin for intravenous use interferences with cell proliferation in vitro. J Clin Immunol 1992;12:325.
11.Andersson UG, Björk L, Skansén-Saphir U, Andersson JP. Down-regulation of cytokine production and interleukin-2 receptor expression by pooled human IgG. Immunology 1993;79:211.
12. Van Schaik IN, Vermuelen M, Brand A. In vitro effects of polyvalent immunoglobulin for intravenous use. J Neurol Neurosurg Psychiatry 1994;57:15.
13.Klaesson S, Ringden O, Markling L, Tammik L. Intravenous immunoglobulin: immune modulatory effects in vitro and clinical effects in allogeneic bone marrow transplant recipients. Transplant Proc 1995;27:3536.
14.Kawada K, Terasaki PI. Evidence for immunosuppresion by high-dose gammaglobulin. Exp Hematol 1987;15:133.
15.Andersson JP, Skansén-Saphir U, Sparrelid E, Andersson UG. Intravenous immune globulin effects cytokine production in T lymphocites and monocytes/macrophagues. Clin Exp Immunol 1996;104:10.
16. Wolf HM, Eibl MM. Immunomodulatory effect of immunoglobulins. Clin Exp Rheumatol 1996;14 (Supl 15):S17.
17.Aukrust P, Muller F, Nordoy I, Haug CJ, Froland SS. Modulation of lymphocyte and monocyte activity after intravenous immunoglobulin administration in vivo. Clin Exp Immunol 1997;107:50.
18.Kekow J, Reinhold D, Pap T, Ansorge S. Intravenous immunoglobulins and transforming growth factor b. Lancet 1998;351:184.
19.Mannhalter JW, Eibl MM. Down regulation of Fc receptors by IVIgG. Int Rev Immunol 1989;5:173.
20.Alder LB, Morgan LA, Spickett GP. Contribution of stabilizing agents present in intravenous immunoglobulin preparations to modulation of mononuclear cell proliferation in vitro. Scand J Immunol 1996;44:585.
21.Muchmore AV, Decker JM, Blaese RM. Evidence that specific oligossacharides block early events necessary for the expressioin of antigen-specific proliferation by human lymphocytes. J Immunol 1980; 125:1306.
22.Mayer L, Stohl W, Cunningham-Rundles C. Feedback inhibition of B cell differentiation by monomeric immunoglobulin. Int Rev Immunol 1989;5:189.
23.Toungouz M, Denys C, Dupont E. Blockade of proliferation and tumor necrosis factor production occuring during mixed lymphocyte reaction by interferon-gamma-specific natural antibodies contained in intravenous immunoglobulins. Transplantation 1996; 62:1292.
24. Modiano JF, Amran D, Lack G, Bradley K, Ball C, Domenico J, Gelfand EW. Posttranscriptional regulation of T-cell IL-2 production by human pooled immunoglobin. Clin Immunol Immunopathol 1997;83:77.