Elaborar una relación de nombres de medicamentos similares con letras mayúsculas resaltadas, que facilite y estandarice la implantación de esta técnica en prácticas dirigidas a reducir errores por similitud de nombres.
Material y métodosSe realizaron dos encuestas estructuradas. La primera incluyó 46 pares, grupos o nombres de medicamentos similares con letras mayúsculas, procedentes de las listas establecidas por la FDA, ISMP y CAPCA/ISMP-Canadá, y 32 seleccionados de la base de datos del ISMP-España y Consejo de COF. La segunda incluyó 27 pares, grupos o nombres propuestos por los encuestados y 11 procedentes de la actualización del ISMP. Se formularon preguntas sobre la utilidad de la técnica y su implantación en los hospitales. Participaron en la primera encuesta 90 farmacéuticos de diferentes hospitales y 89 en la segunda.
ResultadosLa relación de nombres de medicamentos similares con letras mayúsculas resaltadas elaborada recoge 107 nombres agrupados en 44 pares o grupos. Un 93,3% de los encuestados opinó que esta técnica debería implantarse para denominar a los medicamentos, tanto en el etiquetado de la industria farmacéutica (91,1%) como en otros lugares donde aparecen los nombres, como en las pantallas de prescripción informatizada (90%), de farmacia (82,2%) o de los sistemas automatizados de dispensación (81,1%), en etiquetado de preparaciones y estantes, etc. Solo 9 (10%) de los hospitales utilizaban esta técnica.
ConclusionesLa disponibilidad de esta relación de nombres similares en los que se recomienda utilizar letras mayúsculas resaltadas podría facilitar su aplicación en prácticas de diferenciación de nombres, actualmente reducida en nuestro país.
To develop a list of look-alike drug names with tall man letters, which will facilitate and standardize the implementation of this technique in safety practices designed to reduce errors caused by look-alike names.
Material and methodsTwo structured surveys were carried out. The first survey included 46 pairs, groups, or individual look-alike drug names with tall man letters from the lists established by the FDA, ISMP and CAPCA/ISMP-Canada, and 32 selected from ISMP-Spain and the COF Council database. The second survey included 27 proposals made by those respondents who completed the first survey and 11 from the ISMP updated list. Participants were asked about the usefulness and current implementation of the technique. Ninety pharmacists from different hospitals participated in the first survey and 89 in the second.
ResultsThe list of look-alike drug names with tall man letters which has been developed includes 107 names structured into 44 pairs or groups. Of the respondents, 93.3% felt that this technique should be implemented for identifying medications, not only on pharmaceutical industry labels (91.1%) but also in other places where drug names appear, such as computerized prescription screens (90%), pharmacy system screens (82.2%), automated dispensing cabinet screens (81.1%), labels for pharmacy preparations and shelves, etc. Only 9 hospitals (10%) were using this technique.
ConclusionsThe availability of this list of look-alike drug names for which tall man lettering is recommended may encourage the use of this technique for differentiating names in Spain where it is currently not greatly used.
La confusión entre los nombres de los medicamentos es una causa frecuente de errores de medicación1,2. Estos errores ocurren fundamentalmente por similitud entre nombres comerciales (por ejemplo, Sumial® y Luminal®) o nombres de principios activos (por ejemplo, dopamina y dobutamina), aunque también entre nombres comerciales y de principios activos (por ejemplo, Rohipnol® y ropinirol). Se comercializan un número muy elevado de medicamentos, por lo que no es extraño que algunos presenten nombres similares. En España, el Instituto para el Uso Seguro de los Medicamentos (ISMP-España) trabaja con el Consejo General de Colegios Oficiales de Farmacéuticos (COF) en el mantenimiento de una base de datos de nombres de medicamentos similares que se prestan a confusión, que en la actualidad está integrada por más de 350 pares de nombres3,4. En EE. UU. y otros países se publican también listas de medicamentos con nombres similares5.
Numerosos organismos e instituciones han emitido recomendaciones para prevenir los errores de medicación por esta causa6–9. Estas recomendaciones se centran fundamentalmente en dos líneas de actuación: establecer medidas para evitar el registro de nuevos nombres que sean similares a los ya existentes (estrategias premarketing) e implementar prácticas específicas para minimizar los errores por confusión entre los nombres existentes (estrategias postmarketing). Entre estas últimas, una técnica propuesta consiste en cambiar la apariencia de los nombres de los medicamentos similares en los lugares en que se visualizan (pantallas informáticas, etiquetados, etc.), utilizando letras mayúsculas (tall man letters) u otros elementos tipográficos para resaltar las secciones de los nombres que son distintas, con el fin de acentuar así sus diferencias1. Algunos estudios han mostrado que esta técnica puede resultar efectiva para reducir los errores de dispensación, cuando se utiliza en el etiquetado de los medicamentos10, y para minimizar los errores de selección de los nombres de los medicamentos en los sistemas informatizados de prescripción y de dispensación11,12.
La utilización de letras mayúsculas resaltadas para prevenir errores de medicación por similitud de nombres ha sido fomentada por distintos organismos8,9,13–16. Cabe destacar que el Institute for Safe Medication Practices (ISMP) y otros expertos11,17 recomiendan establecer un listado específico de referencia que estandarice el uso de esta técnica y la restrinja a un número limitado de nombres de medicamentos, para evitar que la eficacia de la técnica disminuya si se emplea de forma variable y generalizada.
En EE. UU., la Office of Generics Drugs de la Food and Drug Administration (FDA) implementó esta técnica en el año 200113. Solicitó a los fabricantes de 34 medicamentos genéricos que voluntariamente revisaran el diseño de su etiquetado y usaran letras mayúsculas o también color para diferenciar visualmente sus nombres. El ISMP editó un listado complementario al de la FDA con 42 pares de nombres de medicamentos adicionales17, al que acaba de incorporar nuevos nombres18, y ha promovido el uso de esta técnica por los profesionales e instituciones sanitarias. Recientemente el ISMP-Canadá ha llevado a cabo un proyecto conjunto con la Canadian Association of Provincial Cancer Agencies (CAPCA) para establecer un listado de nombres de medicamentos oncológicos similares con letras mayúsculas resaltadas19.
En nuestro país no se dispone de un listado estandarizado de referencia para su uso por los profesionales y las instituciones, y los disponibles en otros países no se ajustan por completo a nuestra realidad, principalmente por las diferencias existentes en los nombres comerciales y en los perfiles de consumo de los medicamentos. El objetivo principal de este estudio ha sido elaborar una relación de nombres de medicamentos similares con letras mayúsculas resaltadas, que facilite la implementación de esta técnica en las prácticas dirigidas a reducir los errores por confusión en los nombres, y que incluya aquellos nombres que presentan un riesgo elevado de confusión en nuestro país. De forma secundaria, se ha estudiado la opinión sobre la utilidad de esta técnica y su implantación en los hospitales.
Material y métodosEl estudio fue coordinado por el ISMP-España, que constituyó un grupo de expertos en seguridad y manejo de medicamentos de 13 hospitales españoles. Se basó en la realización de dos encuestas estructuradas en una muestra representativa de profesionales de servicios de farmacia, con distribución homogénea en cuanto a localización geográfica y tamaño del hospital. Cada integrante del grupo de expertos se encargó de contactar y tutorizar a varios farmacéuticos de otros hospitales, con el fin de hacer una difusión en cascada del estudio. La tabla 1 recoge la distribución por número de camas y comunidades autónomas de los hospitales en que trabajaban los 90 farmacéuticos que participaron.
Características de los hospitales en los que trabajaban los participantes en el estudio (n = 90)
| Características | Participantes | |
| n | % | |
| Número de camas | ||
| ≤ 199 camas | 13 | 14,4 |
| 200-499 camas | 33 | 36,7 |
| ≥ 500 camas | 44 | 48,9 |
| Finalidad asistencial | ||
| General | 87 | 96,7 |
| Monográfico | 3 | 3,3 |
| Comunidad autónoma | ||
| Andalucía | 16 | 17,8 |
| Aragón | 3 | 3,3 |
| Asturias | 3 | 3,3 |
| Baleares | 1 | 1,1 |
| Canarias | 5 | 5,6 |
| Cantabria | 1 | 1,1 |
| Castilla y León | 7 | 7,8 |
| Castilla-La Mancha | 5 | 5,6 |
| Cataluña | 16 | 17,8 |
| Extremadura | 1 | 1,1 |
| Galicia | 2 | 2,2 |
| Madrid | 10 | 11,1 |
| Murcia | 3 | 3,3 |
| Navarra | 3 | 3,3 |
| País Vasco | 6 | 6,7 |
| La Rioja | 1 | 1,1 |
| Valencia | 7 | 7,8 |
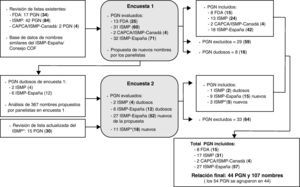
La primera encuesta se elaboró después de realizar una revisión de las relaciones de nombres de medicamentos con letras mayúsculas resaltadas disponibles en la bibliografía y de analizar la base de datos de nombres de medicamentos similares que mantiene el ISMP-España y el Consejo de COF, que se elabora a partir de los errores de medicación registrados por confusión de nombres. La figura 1 recoge un esquema del proceso seguido para seleccionar los nombres y elaborar la relación de los mismos con letras mayúsculas resaltadas. Para facilitar su comprensión, se ha utilizado el acrónimo PGN para indicar pares de nombres similares con letras mayúsculas resaltadas (por ejemplo, DOBUTamina-DOPamina), grupos de nombres (por ejemplo, cefAZOLina-cefTRIAXona-cefTAZIDima) o incluso nombres individuales valorados respecto a otros pares o grupos (por ejemplo, cefOXitina-en relación con otras cefalosporinas).
Proceso seguido para la elaboración de la lista de nombres de medicamentos similares con letras mayúsculas resaltadas. Entre paréntesis y en negrita se recoge el número de nombres individuales de medicamentos. CAPCA/ISMP-Canadá: Canadian Association of Provincial Cancer Agencies/Institute for Safe Medication Practices-Canada19; FDA: Food and Drug Administration13; ISMP: Institute for Safe Medication Practices17; ISMP*: Institute for Safe Medication Practices18; PGN: pares, grupos o nombres de medicamentos.
En esta primera encuesta se incluyeron los siguientes 4 bloques de PGN:
- –
13 PGN de la lista de 34 nombres de principios activos (17 PGN) establecida por la FDA en 200113. Se eliminaron 9 por no estar comercializados en España.
- –
31 PGN de la lista de 42 PGN establecida por el ISMP en EE. UU.17. Se eliminaron 11 por incluir nombres de medicamentos no comercializados en España. Se ofreció una doble opción para un PGN.
- –
2 PGN de la lista de nombres de principios activos de medicamentos oncológicos realizada por el ISMP-Canadá y CAPCA19. Se excluyeron otros ya incluidos en las listas anteriores.
- –
Lista con 32 PGN que se correspondían con pares o grupos de nombres similares no incluidos en los listados anteriores y que habían causado errores en España. Como se ha indicado previamente, se seleccionaron de la base de nombres similares del ISMP-España y del Consejo General de COF3,4.
Para elegir las letras o secciones de los nombres a resaltar en los nombres nuevos propuestos se utilizó la regla MID, siempre que fue posible11. En los nombres de los medicamentos procedentes de listas previas se mantuvieron las mismas letras resaltadas con mayúsculas, excepto en algún caso, en que se añadió algún nuevo nombre a un par o grupo ya incluido.
Los encuestados tenían que valorar cada PGN utilizando una escala de Likert de 5 categorías de respuesta, con puntuaciones del 1 al 5 correspondientes a las opiniones: muy en desacuerdo, en desacuerdo, indiferente, de acuerdo y muy de acuerdo, respectivamente.
En la primera encuesta se añadieron también los siguientes apartados:
- –
Una pregunta abierta para que los encuestados pudieran proponer nuevos nombres de medicamentos similares no incluidos anteriormente en los que recomendar el uso de letras mayúsculas resaltadas. Podían especificar si su propuesta se basaba en algún error de medicación ocurrido o en su opinión personal.
- –
Una pregunta para conocer la denominación utilizada en el hospital para designar a los medicamentos en diferentes procedimientos del sistema de utilización de estos (denominación por principio activo, comercial o ambos).
- –
Cuatro preguntas destinadas a conocer la opinión de los profesionales encuestados sobre la utilidad de la técnica de letras mayúsculas resaltadas y sobre las prácticas en las que podría ser útil su aplicación.
- –
Dos preguntas destinadas a conocer la implantación en los hospitales de la técnica de letras mayúsculas resaltadas.
La primera encuesta se envió junto con los objetivos y la metodología del proyecto en septiembre de 2010 y se dio un plazo para su difusión y cumplimentación de un mes y medio. Posteriormente, se realizó un análisis de las respuestas y se procedió a la preparación de la segunda encuesta.
La segunda encuesta se envió en febrero de 2011 y fue contestada por 89 de los 90 participantes anteriores. Incluyó los siguientes bloques de PGN para evaluar:
- –
Los 8 PGN que resultaron dudosos del análisis de la primera encuesta.
- –
27 PGN que incluían 52 nuevos nombres de los 367 propuestos por los participantes en la primera ronda. Considerando la recomendación del ISMP y otros expertos de limitar el número de nombres, para evitar una pérdida de efectividad de la técnica, se seleccionaron aquellos que tuvieran un mayor riesgo de causar incidentes graves en caso de confusión. Para ello se consideró la probabilidad de confusión en función de varios factores de riesgo (dosificación, vía de administración, forma de dosificación, intervalo posológico, indicación, condiciones de almacenamiento, población de pacientes y prescriptor) y la gravedad de las consecuencias del error en caso de producirse4,20.
- –
11 PGN de la lista actualizada por el ISMP en EE. UU. en noviembre de 201018. Se eliminaron 12 de los 30 nuevos nombres incorporados por no estar comercializados en España o haberse incluido previamente en la primera encuesta a sugerencia del ISMP-España (por ejemplo, valACiclovir-valGANCiclovir).
Finalmente, se incluyó también una pregunta para que los encuestados emitieran su opinión sobre los recursos tipográficos que consideraran más adecuados para resaltar las letras distintivas de los nombres, al aplicar la técnica en pantallas de aplicaciones informáticas, cuyas posibilidades tipográficas son limitadas, o en etiquetado, documentos y otros usos con mayores recursos.
Análisis estadísticoSe realizó un análisis estadístico en ambas encuestas, que consistió en calcular las principales medidas de tendencia central, dispersión y posición. De esta forma se obtuvo una visión de conjunto de las puntuaciones otorgadas por los encuestados a cada PGN, así como el porcentaje de respuestas con puntuaciones bajas (valores 1 o 2), medias (valor 3) o altas (valores 4 o 5) en la escala Likert utilizada. El criterio considerado para alcanzar el acuerdo por los encuestados en la selección de un PGN fue tener una puntuación media ≥ 4 puntos y un percentil 25 ≥ 4, puesto que implicaba que tan solo un 25% de los consultados se mostraban indiferentes o estaban en desacuerdo en incluir el PGN correspondiente. Se consideró que un resultado era dudoso y que, por tanto, no se podía afirmar que hubiera consenso cuando la media era ≥ 4 y el percentil 25 de 3.
El análisis de los datos se efectuó con el programa IBM SPSS Statistics 19.
ResultadosLa tabla 2 recoge la relación de nombres de medicamentos similares con letras mayúsculas resaltadas elaborada con los PGN en los que se alcanzó un acuerdo por los encuestados. De un total de 116 PGN evaluados entre las dos encuestas, se incluyeron por consenso 54 (46,6%) en la relación final. En la primera encuesta se incluyó un 52,6% de los PGN evaluados y 8 (10,3%) se consideraron dudosos. En la segunda encuesta el porcentaje de PGN incluidos fue menor (28,3%), alcanzándose el acuerdo en uno de los 8 PGN dudosos y en 10 de los 37 PGN nuevos evaluados. Ningún PGN resultó dudoso. En la relación final se reagruparon algunos PGN para facilitar su aplicación, dado que en las encuestas se habían estructurado por la fuente de donde procedían y algunos correspondían a medicamentos de los mismos grupos terapéuticos. De esta manera, la relación final recoge un total de 107 nombres de medicamentos agrupados en 44 PGN, en lugar de 54. De estos 44 PGN, 28 (63,6%) incluyen nombres de principios activos en forma de su denominación común internacional (DCI) (9 de los cuales contienen uno o más medicamentos citostáticos), 15 tienen nombres comerciales y uno comprende un nombre de principio activo y un nombre comercial.
Relación de nombres de medicamentos similares con letras mayúsculas resaltadas
| Par o grupo de nombres similares de medicamentos | Fuente/s |
| ADRENalina-ATROPina | ISMP-España |
| ADVAgraf-PROgraf | ISMP-España |
| ARICept-AZILect | ISMP-España |
| azaCITIDina-azaTIOprina | ISMP |
| BUpivacaína-MEpivacaína-ROpivacaína | ISMP-España |
| cefAZOLina-cefTRIAXona-cefTAZIdima-cefOXitina/cefOTAXima | ISMP/ISMP-España |
| CISplatino-CARBOplatino | ISMP |
| cloTIApina-cloZApina | ISMP-España |
| cloTRIMazol-cloMETIazol | ISMP-España |
| DACTINomicina-DAPTOmicina | ISMP |
| DASAtinib-LAPAtinib/SUNItinib-SORAfenib | ISMP-España/CAPCA/ISMP-Canada |
| DAUNOrubicina-DOXOrubicina/IDArubicina/EPIrubicina | FDA/ISMP/ISMP-España |
| DOBUTamina-DOPamina | FDA |
| DOCEtaxel-PACLitaxel | CAPCA/ISMP-Canada |
| DOLquine-DEPAkine | ISMP-España |
| EbiXA-EviSTA | ISMP-España |
| eFEDrina-EPINEFrina/FENILEFrina | ISMP/ISMP-España |
| EmCONcor-EnTOcord | ISMP-España |
| FLUoxetina-DULoxetina-PARoxetina | ISMP |
| FOSamax-TOPamax-IOPimax | ISMP-España |
| gliPIZida-gliBENCLAMida/gliCLAZida-gliMEPIRida | FDA/ISMP-España |
| hidrALAZINA-hidrOXIzina | FDA |
| HumaLOG-HumuLINA | ISMP |
| ISOtretinoína-tretinoína | ISMP |
| loRAtadina-loVAStatina | ISMP-España |
| metAMIzol-metroNIDAzol | ISMP-España |
| mitoXANTRONA/mitoMICINA | FDA/ISMP-España |
| MOVIcol-MONurol-MAGNurol | ISMP-España |
| niCARdipino-niFEdipino/niMODipino | FDA/ISMP |
| NovoRAPID-NovoMIX | ISMP-España |
| OXcarbazepina-carBAMazepina | ISMP |
| predniSONA-prednisoLONA | FDA |
| ProZAC-ProSCAR | ISMP-España |
| quiNINA-quiNIDina | ISMP |
| riTUXimab-inFLIXimab | ISMP |
| RoHIPnol-roPINIrol | ISMP-España |
| SandIMMUN-SandoSTATIN | ISMP |
| SinOGan-SinEQUan | ISMP-España |
| sulfaDIAzina-sulfaSALAzina | ISMP |
| SUmial-LUminal | ISMP-España |
| TiAPRIzal-TriLEPtal-TryPTIzol | ISMP-España |
| UrSOCHol-UroTRol-UroLOSIN | ISMP-España |
| valACiclovir-valGANCiclovir | ISMP-España |
| vinBLAStina-vinCRIStina/vinFLUNina-vinORELBina | FDA/ISMP-España |
Los nombres comerciales tienen la primera letra siempre en mayúscula. En algunos nombres comerciales se han incorporado letras mayúsculas resaltadas en su letra inicial y pueden no ser reconocidos como tales.
FDA: United States Food and Drug Administration13. ISMP: Institute for Safe Medication Practices17,18. CAPCA/ISMP-Canada: Canadian Association of Provincial Cancer Agencies/Institute for Safe Medication Practices-Canada19.
La denominación utilizada para designar a los medicamentos en los hospitales en los que trabajaban los encuestados se recoge en la tabla 3. La denominación por principio activo fue la más utilizada para el etiquetado de las preparaciones realizadas en farmacia (58,9%) y en la prescripción electrónica (36,7%), mientras que se utilizaban el nombre del principio activo y el comercial en la prescripción manual (67,8%) y en la información a los pacientes (68,9%). El nombre comercial fue el más utilizado para el almacenamiento de los medicamentos (40%).
Denominación utilizada para designar a los medicamentos para distintos procedimientos en los hospitales en que trabajaban los participantes en el estudio (n = 90)
| Procedimiento | Nombre principio activo | Nombre comercial | Ambos | No contesta |
| n (%) | n (%) | n (%) | n (%) | |
| Almacenar los medicamentos | 22 (24,4) | 36 (40) | 32 (35,6) | 0 |
| Etiquetar preparaciones | 53 (58,9) | 3 (3,3) | 33 (36,7) | 1 (1,1) |
| Prescripción manual | 6 (6,7) | 14 (15,6) | 61 (67,8) | 9 (10) |
| Sistema de prescripción electrónica | 33 (36,7) | 8 (8,9) | 28 (31,1) | 21 (23,3) |
| Sistema de dispensación de farmacia | 23 (25,6) | 33 (36,7) | 34 (37,8) | 0 |
| Hoja de administración de enfermería | 22 (24,4) | 23 (25,6) | 43 (47,8) | 2 (2,2) |
| Información al paciente | 5 (5,6) | 18 (20) | 62 (68,9) | 5 (5,6) |
La mayoría de los encuestados (93,3%) opinó que las letras mayúsculas resaltadas es una técnica útil que debería implantarse (tabla 4). En consonancia con el tipo de nombres utilizados en los hospitales, un elevado porcentaje (72,2%) de los encuestados manifestó que esta técnica debería implantarse para nombres de principios activos y comerciales, un 20% respondió que debería aplicarse preferentemente para nombres de principios activos y solo el 5,6% consideró conveniente su empleo exclusivo para nombres de principios activos.
Opinión de los encuestados sobre la utilidad de la técnica de letras mayúsculas resaltadas (n = 90)
| Pregunta | Respuesta | ||
| Sí | No | No sabe/no contesta | |
| n (%) | n (%) | n (%) | |
| Opinión sobre la utilidad de la técnica | |||
| La técnica es útil y debería implantarse | 84 (93,3) | 0 | 6 (6,7) |
| Procedimientos en los que podría ser efectiva | |||
| Etiquetado de los medicamentos comercializados por la industria farmacéutica | 82 (91,1) | 3 (3,3) | 5 (5,6) |
| Pantallas de prescripción informatizada | 81 (90) | 5 (5,6) | 4 (4,4) |
| Prescripciones preimpresas | 66 (73,3) | 9 (10) | 15 (16,7) |
| Etiquetas de gavetas o estantes de almacenamiento | 86 (95,6) | 2 (2,2) | 2 (2,2) |
| Etiquetas de preparaciones generadas en farmacia | 76 (84,4) | 8 (8,9) | 6 (6,7) |
| Pantallas del sistema informático de dispensación | 74 (82,2) | 7 (7,8) | 9 (10) |
| Pantallas de los sistemas automatizados de dispensación | 73 (81,1) | 4 (4,4) | 13 (14,4) |
| Hoja de administración de enfermería automatizada | 83 (92,2) | 5 (5,6) | 2 (2,2) |
| Bases de datos de bombas de infusión inteligentes | 57 (63,3) | 7 (7,8) | 26 (28,9) |
| Listados de medicación al alta para los pacientes | 65 (72,2) | 15 (16,7) | 10 (11,1) |
La mayor parte de los consultados (91,1%) respondieron que esta técnica podría ayudar a minimizar los errores de selección de medicamentos si se utilizara tanto para el etiquetado de estos por la industria farmacéutica como en otros procedimientos o elementos utilizados en hospitales, como en las pantallas de prescripción informatizada (90%), de los programas de farmacia (82,2%) y de los sistemas automatizados de dispensación (81,1%), el etiquetado de gavetas y estantes (95,6%) y de las preparaciones (84,4%), etc. Diecinueve encuestados indicaron diversos procedimientos en los que interesaría aplicar esta técnica, tales como la guía farmacoterapéutica, los informes y las recetas al alta, etc. Nueve de ellos coincidieron en destacar su utilidad para el etiquetado de los medicamentos reenvasados en dosis unitarias.
Solo 9 de los 90 encuestados utilizaban en los hospitales letras mayúsculas resaltadas para diferenciar los nombres de medicamentos similares en alguna práctica. En concreto, 4 hospitales las utilizaban en el etiquetado de gavetas y estantes, 3 en las pantallas de prescripción electrónica y 2 hospitales en el etiquetado de las preparaciones de farmacia, en las pantallas de los programas de dispensación y de los armarios automatizados de dispensación, y en la hoja informatizada de administración de enfermería.
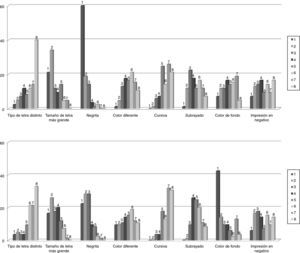
La figura 2 recoge la distribución de frecuencias de la opinión de los consultados sobre los posibles recursos tipográficos a utilizar para destacar las letras mayúsculas distintivas de los nombres de los medicamentos similares. Por lo que se refiere a la aplicación en sistemas informáticos, el recurso elegido con mayor frecuencia como primera opción fue el empleo de letra negrita (60%), seguido por un tamaño de letra más grande (21,2%). En el caso de resaltar estas letras en el etiquetado de medicamentos o en documentos en los que sea factible disponer de otros recursos, en especial que impliquen el uso de color, los encuestados prefirieron mayoritariamente como primera opción el uso de color de fondo (42,4%), seguido de negrita (22,4%), tamaño de letra más grande (16,5%) y color diferente (9,4%). Algunos consultados indicaron que la combinación de negrita y tamaño más grande sería óptimo en el primer caso, y en el segundo, el uso de color de fondo y mayor tamaño de letra.
Distribución de frecuencias de la opinión de los encuestados (n = 89) sobre los recursos tipográficos que consideraran más adecuados para resaltar las letras distintivas de los nombres en pantallas de aplicaciones informáticas (arriba) o en etiquetado y documentos (abajo). Los encuestados expresaban su preferencia ordenando del 1 al 8 las ocho opciones diferentes propuestas.
Los errores de medicación causados por la similitud en los nombres de los medicamentos son motivo de preocupación de organismos dedicados a la seguridad del paciente y autoridades sanitarias, que han difundido prácticas dirigidas a instituciones y profesionales para minimizarlos. En el año 2007, el grado de implantación en los hospitales de nuestro país de estas prácticas era bajo, y entre ellas, del uso de alertas auxiliares o de letras mayúsculas resaltadas en etiquetados y estantes de almacenamiento21.
Este estudio ha puesto de manifiesto que en la actualidad la utilización de letras mayúsculas resaltadas para diferenciar los nombres similares de los medicamentos en los hospitales sigue siendo escasa. Esta situación contrasta con la observada en EE. UU., donde, según las encuestas realizadas por el ISMP, se utiliza en más del 50% de los hospitales para diferenciar los nombres en los etiquetados de farmacia y de los estantes de almacenamiento, así como en las pantallas de los programas de farmacia, de prescripción electrónica y de los sistemas automatizados de dispensación. Estas diferencias podrían ser atribuidas probablemente al fomento de esta técnica en dicho país por diversos organismos, particularmente por la Joint Commission, que impulsó su aplicación al incorporar en 2005 la implantación de medidas para prevenir errores por nombres similares como objetivo de los National Patient Safety Goals, y en 2010 las pasó a estándares14, así como al hecho de disponer de listas específicas con los nombres similares con letras mayúsculas resaltadas en los que se recomienda utilizar13,17–19.
La falta de una lista de referencia, además de dificultar la aplicación de la técnica, puede llevar a su utilización de forma variable e indiscriminada, ya que las listas disponibles de otros países pueden no aproximarse a nuestra realidad y los profesionales de cada institución, en la voluntad de diferenciar aquellos nombres causantes de errores en el centro, pueden optar por aplicar letras mayúsculas a diferentes nombres y/o en diferentes letras o secciones de dichos nombres. Por este motivo, cuando se abordó este proyecto se planteó elaborar esta relación partiendo de dos premisas fundamentales. Primero, la conveniencia de promover una estandarización internacional, respetando y manteniendo aquellos nombres establecidos previamente en las listas disponibles que dieran lugar a errores en nuestro país. Segundo, adecuar dicha relación a nuestra realidad, incorporando otros nombres problemáticos en nuestro medio que no estuvieran en listas previas, posiblemente por tratarse de medicamentos no comercializados en otros países o comercializados con nombres diferentes. Por ejemplo, el metamizol es un medicamento no comercializado en otros países y de uso amplio en España, que da lugar a confusiones con el metronidazol. Otros ejemplos serían Sumial®-Luminal® o Prozac®-Proscar®.
La denominación de los medicamentos por principio activo en forma de su DCI, asignada por la Organización Mundial de la Salud, es una práctica de seguridad recomendada6,22 y las técnicas de diferenciación de nombres están más enfocadas a estos. Por ello, la relación elaborada contiene una mayor proporción de nombres de principios activos. No obstante, puesto que en nuestra práctica actual se utilizan también los nombres comerciales, según revelaron las respuestas de los encuestados, se consideró conveniente incluir ambos tipos de nombres en las encuestas y se incorporaron por consenso algunos de ellos en la relación final. Un medicamento resultó incluido tanto por su denominación común internacional (epinefrina) como por su nombre comercial (Adrenalina®), probablemente porque este último se utiliza también habitualmente para denominar al principio activo en textos de farmacología y es el nombre oficial en la farmacopea europea y en otros países.
Los recursos tipográficos preferidos por los profesionales consultados fueron similares a los elegidos en encuestas realizadas por el ISMP en EE. UU., aunque es difícil efectuar comparaciones, ya que en este estudio se dieron dos opciones según donde se fueran a aplicar. En todo caso, se trata simplemente de una medida de opinión que no ha sido refrendada por estudios que demuestren una evidencia objetiva de efectividad. En este sentido, en un estudio sobre eficacia de distintos recursos tipográficos para diferenciar nombres de medicamentos similares se observó que, aunque los participantes habían manifestado subjetivamente que el uso de color era el recuso más efectivo, esto no se correlacionó con los hallazgos objetivos, y la combinación de color con letras mayúsculas no añadió beneficios al empleo de letras mayúsculas solas23.
La relación elaborada de nombres de medicamentos similares con letras resaltadas puede ser una herramienta de utilidad que favorezca la implantación de esta técnica. Sin embargo, presenta varias limitaciones. En primer lugar, las derivadas de la metodología seguida para su elaboración, ya que se utilizaron encuestas y no se ha llegado a evaluar la eficacia de su aplicación en términos de reducción de errores. Esta limitación es análoga a la que presenta el resto de las listas disponibles, pues no se dispone de evidencia científica de si los errores por confusión entre los pares de nombres que incluyen han disminuido tras su aplicación. Por otro lado, los encuestados fueron farmacéuticos de hospital y los resultados se hubieran enriquecido con la participación de otros profesionales sanitarios y de diferentes entornos. No obstante, el grupo de trabajo considera que esta relación es un primer paso y que es una lista abierta que es preciso actualizar periódicamente. Finalmente, es necesario tener presentes las limitaciones propias de la técnica, ya que no se dispone apenas de estudios sobre las letras o secciones de los nombres que deben destacarse y cuál sería la tipografía más eficaz para destacarlas.
La principal aportación de este estudio es facilitar a los profesionales e instituciones que desean aplicar esta técnica una lista de referencia inicial. Cabe señalar que la utilización de letras mayúsculas resaltadas facilita la distinción entre los nombres, fundamentalmente por aumentar la atención hacia los medicamentos que las presentan, según han revelado los estudios realizados23. Por este motivo, es conveniente informar apropiadamente a los profesionales del objetivo de la técnica cuando se implante en prácticas de seguridad de la institución. El grupo de trabajo espera que esta relación contribuya a sensibilizar a los profesionales sobre este problema y favorezca la implantación de prácticas seguras para minimizar los errores por confusión de nombres en todos los procesos del sistema de utilización de los medicamentos, lo que en definitiva puede llevar a una mejora de la seguridad de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El grupo de trabajo agradece a Fernando A. Navarro, traductor médico, y a Trinidad Sánchez Muñoz, del Centro de Investigaciones Lingüísticas de la Universidad de Salamanca, su colaboración en la traducción de algunos términos lingüísticos.
ISMP-España, Hospital Universitario de Salamanca: María José Otero López, Rita Martín Muñoz, Ana María Moreno Gómez, Alfonso Domínguez-Gil Hurlé. Unidad de Investigación CAIBER, Hospital Universitario de Salamanca: Mercedes Sánchez Barba. Hospital Universitario Miguel Servet, Zaragoza: Reyes Abad Sazatornil. Hospital Universitari Germans Trias i Pujol, Badalona: Ángels Andreu Crespo. Hospital Universitario, Getafe: Marta Arteta Jiménez. Hospital Universitario Ramón y Cajal, Madrid: Teresa Bermejo Vicedo. Fundación Oncológica, San Sebastián: Gerardo Cajaraville Ordoñana. Hospital Clínic, Barcelona: Carlos Codina Jané. Empresa Pública Hospital Costa del Sol, Marbella: Vicente Faus Felipe. Hospital Universitari i Politècnic La Fe, Valencia: Isabel Font Noguera. Hospital General Universitario Gregorio Marañón, Madrid: Ana Herranz Alonso. Hospital Clínico Universitario, Valladolid: Ana María López González. Hospital Universitario Fundación Alcorcón, Madrid: Montserrat Pérez Encinas. Hospital Universitario Virgen de la Arrixaca, Murcia: Amelia de La Rubia Nieto. Hospital Universitario Virgen del Rocío, Sevilla: María Dolores Santos Rubio.
U. Baños Roldán (Hospital Universitario Virgen Macarena, Sevilla), C. Blanco Bermejo (Hospital Comarcal de la Axarquía, Torre del Mar, Málaga), J. Cabeza Barrera (Hospital Universitario San Cecilio, Granada), S. Corral Baena (Hospital San Juan de Dios del Aljarafe, Bormujos, Sevilla), V. Faus Felipe (Empresa Pública Hospital Costa del Sol, Marbella, Málaga), M.J. Fobelo Lozano (Hospital Universitario de Valme, Sevilla), A. Jiménez Morales (Hospital Virgen de las Nieves, Granada), M.D. López Malo de Molina (Hospital Universitario Reina Sofía, Córdoba), E. Molina Cuadrado (Hospital Torrecárdenas, Almería), A. Moreno Villar (Hospital San Juan de la Cruz, Úbeda, Jaén), V. Padilla Marín (Hospital de Antequera, Málaga), M.A. Rosado Souviron (Complejo Hospitalario Carlos Haya, Málaga), E. Sánchez Gómez (Hospital Juan Ramón Jiménez, Huelva), M.D. Santos Rubio (Hospital Universitario Virgen del Rocío, Sevilla), F. Verdejo Reche (Hospital de Poniente, El Ejido, Almería), A. Villa Rubio (Hospital SAS La Línea de la Concepción, Cádiz).
M.R. Abad Sazatornil (Hospital Universitario Miguel Servet, Zaragoza), M.A. Alcácera López (Hospital Clínico Universitario Lozano Blesa, Zaragoza), M.P. Amador Rodríguez (Hospital San Jorge, Huesca).
M.T. Iglesias García (Hospital Universitario Central de Asturias, Oviedo), A. Lozano Blázquez (Hospital de Cabueñes, Gijón), P. Terroba Alonso (Hospital San Agustín, Avilés).
A. Escrivá Torralva (Hospital Universitario Son Espases, Palma de Mallorca).
P. González Joyanes (Hospital Universitario Materno-Infantil de Canarias, Las Palmas de Gran Canaria), M.A. Ocaña Gómez (Complejo Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife), A.M. Quintana Holgado (Hospital General de La Palma), I. Rodríguez Pedrosa (Hospital Universitario de Canarias, La Laguna, Tenerife), M.A. Velaz Suárez (Hospital Universitario Insular de Gran Canaria, Las Palmas de Gran Canaria).
J. de la Puente Jiménez (Hospital Universitario Marqués de Valdecilla, Santander).
V.L. Areas del Águila (Hospital General de Ciudad Real), S. González Martínez (Hospital Universitario de Guadalajara), M. Martínez Camacho (Complejo Hospitalario de Toledo-Hospital Geriátrico Virgen del Valle, Toledo), C. Mora Herrera (Hospital Santa Bárbara, Puertollano, Ciudad Real), M. Pascual Martínez (Complejo Hospitalario Universitario de Albacete).
M.M. Andújar Arias (Complejo Asistencial de Ávila), M.I. Azcárate García (Complejo Hospitalario de Soria), T. Caro-Patón Carmona (Hospital Universitario Río Hortega, Valladolid), A.M. López González (Hospital Clínico Universitario de Valladolid), M.J. Otero López (Hospital Universitario de Salamanca), N. Revilla Cuesta (Hospital Santos Reyes, Aranda de Duero, Burgos), M. Rodríguez María (Hospital El Bierzo, Ponferrada, León).
A. Andreu Crespo (Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona), T. Arranz Castella (Consorci Sanitari de L’Alt Penedés, Villafranca del Penedés, Barcelona), T. Boada Port (Clínica Corachán, Barcelona), C. Codina Jané (Hospital Clínic i Provincial de Barcelona), E. Fernández de Gamarra Martínez (Hospital de la Santa Creu i Sant Pau, Barcelona), M.Q. Gorgas Torner (Corporació Sanitària Parc Taulí, Sabadell, Barcelona), P. Jolonch Santasusagna (Hospital Santa Tecla, Tarragona), M. Juan Aguilar (Hospital Verge de la Cinta, Tortosa, Tarragona), J.J. Machí Ribes (Hospital de Viladecans, Barcelona), J.M. Martínez Cutillas (Hospital Universitari Vall d’Hebrón, Barcelona), L. Pastó Cardona (Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat, Barcelona), A. Pérez Plasencia (Hospital Universitari Dr. Josep Trueta, Girona), P. Salvador Collado (Hospital Universitari Sant Joan de Reus, Reus, Tarragona), J.A. Schoenenberger Arnaiz (Hospital Universitari Arnau de Vilanova, Lleida), O. Urbina Bengoa (Parc de Salut Mar, Barcelona), A. Vilaseca Tomàs (Althaia Xarxa Assistencial de Manresa, Barcelona).
M.J. Estepa Alonso (Complejo Hospitalario Universitario de Badajoz-Hospital Infanta Cristina, Badajoz).
S. Albiñana Pérez (Hospital Arquitecto Marcide, El Ferrol, La Coruña), S. González Piñeiro (Complejo Hospitalario Universitario A Coruña, La Coruña).
M.J. Alfaro Alfaro (Fundación Hospital Calahorra, La Rioja).
M. Arteta Jiménez (Hospital Universitario de Getafe, Madrid), G. Baldominos Utrilla (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid), T. Bermejo Vicedo (Hospital Universitario Ramón y Cajal, Madrid), C. Calderón Acedo (Hospital Universitario de Móstoles, Madrid), A. Herranz Alonso (Hospital General Universitario Gregorio Marañón, Madrid), M.A. Lucena Campillo (Hospital Severo Ochoa, Leganés, Madrid), M. Manso Manrique (Hospital Universitario Puerta de Hierro, Madrid), M. Moro Agud (Hospital Universitario La Paz, Madrid), M. Pérez Encinas (Hospital Universitario Fundación Alcorcón, Madrid), O. Serrano Garrote (Hospital 12 de Octubre, Madrid).
M.T. Antequera Lardón (Hospital Reina Sofía, Murcia), M.C. Mira Sirvent (Hospital Santa María del Rosell, Cartagena, Murcia), A. de la Rubia Nieto (Hospital Universitario Virgen de la Arrixaca, Murcia).
C. Lacasa Arregui (Clínica Universitaria de Navarra, Pamplona), F. Marcotegui Ros (Complejo Hospitalario de Navarra-Hospital Virgen del Camino, Pamplona), V. Napal Lecumberri (Complejo Hospitalario de Navarra-Hospital de Navarra, Pamplona).
M. Álvarez Lavín (Hospital de Basurto, Bilbao), G. Cajaraville Ordoñana (Fundación Oncológica, San Sebastián), A. Campino Villegas (Hospital de Cruces, Barakaldo, Vizcaya), N. Mauleón Echeverría (Hospital Donostia, San Sebastián), J. Peral Aguirregoitia (Hospital de Galdakao, Vizcaya), A. Quintana Basterra (Hospital Txagorritxu, Vitoria).
M.T. Aznar Saliente (Hospital Universitari Sant Joan d’Alacant, Alicante), M.D. Bellés Medall (Hospital La Plana, Vila-real, Castellón), M. Climente Martí (Hospital Universitario Dr. Peset, Valencia), I. Font Noguera (Hospital Universitari i Politècnic La Fe, Valencia), J.D. Rosique Robles (Hospital de Sagunto, Valencia), M.T. Torrecilla Junyent (Hospital Clínico Universitario, Valencia), J.M. Ventura Cerdá (Hospital General de Castellón).