ORIGINALES
ESTUDIO COMPARATIVO DE BIODISPONIBILIDAD ENTRE DOS FORMULACIONESDIFERENTES DE OMEPRAZOL TRAS SU ADMINISTRACIÓN PORVÍA ORAL A VOLUNTARIOS SANOS
Jackson, D.*,Científico Diplomado;
Woodward, A. J.*,Científico Diplomado, GerenteAnalítica;
Morgan, R.*,Científico Diplomado, RA;
Gill, T. S.*,Gerente de Investigación;
Calvo, C. G.**.
*Simbec Research Ltd. South Wales, United Kingdon.
** Industrial Farmacéutica Cantabria, S. A.Madrid.
Correspondencia:
Carmen García Calvo.
Responsable Departamento Médico.
Industrial Farmacéutica Cantabria, S. A.
Arequipa, 1. Edificio Oficinas.
28043 Madrid.
Fecha derecepción: 18-6-99
Palabrasclave:
Biodisponibilidad. Bioequivalencia. Omeprazol. AUC0-t.AUC0-(infinity). Cmáx.Tmáx.
Resumen:
Objetivo: Este estudio fue diseñado para comparar labiodisponibilidad oral de dos formulaciones de omeprazol,Emeprotón®, I. F. Cantabria, S. A., yLosec®,Shering-Plough.
Método: El estudio, en el que se incluyeron a 16voluntarios sanos siguió un modelo cruzado estándar,simple ciego, con dos períodos y dos secuencias detratamiento. En cada uno de los períodos se administrandosis únicas de 40 mg de Emeprotón® o Losec®. Lasdeterminaciones plasmáticas de omeprazol en las muestrasextraídas se realizaron mediante una técnica de HPLCde fase reversa, mientras que los parámetrosfarmacocinéticos se obtuvieron a partir de las curvas deconcentración/tiempo de muestreo. Para el análisisestadístico se utilizó un análisis de lavarianza para datos pareados. Las variables relacionadas con laconcentración fueron transformadas logarítmicamenteprevio a su análisis, aceptándose bioequivalenciapara unos intervalos de confianza clásicos del 90%comprendidos entre el 80 y el 125%.
Resultados: Los intervalos de confianza al 90% para lasvariables relacionadas con la concentración fueron:99,3-112,7% para el área bajo la curva entre el tiempo 0hasta el último punto de muestreo (valor medio: 105,8%);99,9-113,9% para el área bajo la curva extrapolada ainfinito (valor medio: 106,9%) y 81,2-115,5% para laconcentración plasmática máxima (valor medio:96,9%). Los valores del tiempo para alcanzar laconcentración plasmática máxima, analizadossegún un modelo de aproximación noparamétrica, no mostraron diferencias superiores al20%.
Conclusiones: Este estudio demostró la bioequivalenciaentre ambas formulaciones de omeprazol.
COMPARATIVE STUDY OF THE BIOAVAILABILITY OF TWO DIFFERENTOMEPRAZOLE FORMULATIONS ADMINISTERED ORALLY TO HEALTHYVOLUNTEERS
Keywords:
Bioavailability. Bioequivalence. Omeprazole. AUC0-t.AUC0-(infinity). Cmax.Tmax.
Summary:
Objective: This study compared the oral bioavailability of theomeprazole formulations, Emeprotón® (I. F. Cantabria, S. A.) and Losec®(Schering-Plough). In 16 healthy volunteers, astandard crossover, simple blind study with two periods and twotreatment sequences was made. In each period, single doses of 40 mgof Emeprotón® orLosec® were administered.Plasma omeprazole was measured in samples extracted byreverse-phase HPLC. Pharmacokinetic parameters were derived fromthe concentration-time curves of specimens. Variance analysis ofpaired data was performed. The variablesrelated with concentration were transformed logarithmically beforeanalysis.
Bioequivalence was accepted for classic 90% confidence intervals of80 to 125%.
Results: The 90% confidence intervals for concentration-relatedvariables were 99.3-112.7% for the area under the curve betweentime 0 and the last sampling point (mean: 105.8%), 99.9-113.9% forthe area under the curve extrapolated to infinity (mean: 106.9%)and 81.2-115.5% for maximum plasma concentration (mean: 96.9%). Thetime to maximum plasma concentration, analyzed using anon-parametric estimation model, showed differences of no more than20%.
Conclusions: This study confirmed the bioequivalence of theseomeprazole formulations.
INTRODUCCIÓN
Omeprazol es uninhibidor selectivo de la bomba de protones (H+, K+-ATPasa) situadaen el canalículo secretor de la célula parietal de lamucosa gástrica, cuya acción se sigue de unainhibición irreversible de la secreción ácidagástrica (1, 2).
Químicamente, el omeprazol se define como un benzoimidazolsustituido, muy poco soluble en agua, pero muy soluble ensoluciones alcalinas. Es una sustancia anfolítica con un pKde 4 (piridinio) y de 8,8 (benzoimidazol). El omeprazol, trasabsorberse en el intestino delgado, es vehiculizado por la sangrehasta alcanzar las células parietales, donde es protonado enel medio ácido que existe en la luz del canalículosecretor de estas células, y convertido en un derivadosulfonamido, que reacciona de forma rápida e irreversiblecon el grupo sulfidrilo de la H+, K+-ATPasa, formando el denominadocomplejo inhibitorio (3, 4).
El efectoantisecretor mediado por omeprazol es dosis dependiente y de largaduración. Tras su absorción es metabolizado casi ensu totalidad en el hígado, eliminándose rápiday prácticamente en su totalidad por orina. Aunque la vidamedia de eliminación plasmática del fármaco escorta, de 0,5-2 horas, la inhibición de la secreciónácida ejercida por el fármaco es mucho máslarga (veinticuatro-cuarenta y ocho horas), lo que posibilita suadministración en dosis única diaria (5-7). El gradode supresión de la secreción ácidogástrica alcanzado tras la administración deomeprazol está relacionado con el área bajo la curvade concentración-tiempo (AUC) (5).
Omeprazol cuandoes expuesto a pH bajo se comporta como una base débilácido lábil, por lo que debe ser protegido de suexposición al jugo gástrico cuando se administra porvía oral (8, 9). Su absorción parece serformulación y dosis dependiente. Por ello se handesarrollado distintas formulaciones para mejorar subiodisponibilidad por vía oral. Las formulaciones deomeprazol en gránulos con cubierta gastrorresistenteprotegen al omeprazol de la agresión gástrica, comoes el caso de la especialidad farmacéuticaEmeprotón®,I. F.Cantabria, S. A., pero liberan elprincipio activo a nivel del intestino delgado al alcanzar el medioun pH cercano a 7. Estas formulaciones, de acuerdo con lafarmacopea (USP 23), deben ser estables durante dos horas en mediode ácido clorhídrico 0,1N (pH = 1), similar alpresente en la luz gástrica durante los períodos demáxima secreción ácida, y pasado este tiempo ycon un pH de 6,8, similar al presente en el intestino delgado, darlugar a una disolución de los gránulos, con laconsiguiente liberación de omeprazol (10).
El objetivo deeste estudio clínico fue el de demostrar la bioequivalencia,biodisponibilidad relativa, entre dos formulaciones demicrogránulos de omeprazol gastrorresistentes,Emeprotón®,I. F. Cantabria, S. A. (formulación test) yLosec®, Schering-Plough(formulación comercial tomada como referencia), tras laadministración de dosis únicas a voluntariossanos.
MÉTODO
Población del estudio
Se incluyeron eneste estudio a un total de 16 voluntarios sanos (13 varones y tresmujeres) con edades comprendidas entre los dieciocho y cuarenta ycinco años y peso corporal comprendido dentro delámbito del teórico ± un 15%.
El estudiosiguió en todo momento las directrices especificadas en ladeclaración de Helsinki de 1983 para la realizaciónde ensayos clínicos en humanos. El estudio fue presentadopara su valoración por el Comité ÉticoIndependiente de Simbec Research el 11 de febrero de 1997, siendoaprobado por dicho comité el 4 de marzo de 1997.
El reclutamientode los voluntarios se realizó entre el 3 de junio y el 10 dejulio de 1997. En los 15 días previos al inicio del estudiose sometió a todos los voluntarios preseleccionados a examenfísico, electrocardiograma, determinacioneshematológicas y bioquímicas, y análisis deorina, con detección de drogas. Todos los individuosincluidos en el estudio fueron debidamente informados de lascaracterísticas del mismo, otorgando su consentimientoinformado por escrito previamente a su inclusión. En el casode las mujeres preseleccionadas para el estudio se exigió elempleo de un adecuado método de anticoncepción y serealizó una prueba de embarazo previo a laadministración de la medicación delestudio.
Diseñoy desarrollo del estudio
El estudio sellevó a cabo en el Centro Clínico de Simbec Research.El primer período de tratamiento se inició el 24 dejunio de 1997, dándose por finalizado el segundoperíodo de tratamiento el 18 de julio de 1997.
El diseñodel estudio siguió un modelo cruzado estándar, simpleciego, con dos períodos y dos secuencias de tratamiento. Losdos tratamientos en estudio fueron asignados según uncódigo de aleatorización generado por Simbec Research(RANDO. SAS). Se determinó un período de lavado de almenos siete días entre la administración de los dostratamientos.
En cada uno delos dos períodos del estudio se administraron por víaoral dosis únicas de 40 mg de omeprazol:
-- Tratamiento 1. Emeprotón®,I. F. Cantabria, S. A.(formulación test): dosisúnica administrada de dos cápsulas, conteniendo cadauna 20 mg de omeprazol.
-- Tratamiento 2. Losec®,Shering-Plough (formulación referencia): dosis únicaadministrada de dos cápsulas, conteniendo cada una 20 mg deomeprazol.
Durante elperíodo de pretratamiento y a lo largo del estudio seprohibió la ingesta de otras medicaciones distintas a lasadministradas en el mismo, excepto paracetamol, a dosismáximas de 2 g diarios, limitando el consumo de alcoholdurante el período de pretratamiento y prohibiéndoloabsolutamente desde cuatro horas antes de la primera dosis hasta lafinalización del estudio.
Los voluntariosacudieron al Centro Clínico de Simbec Research la tardeanterior a los dos días prefijados para laadministración de la medicación, permaneciendo enéste hasta al menos doce horas tras la toma de la misma. Losvoluntarios permanecieron obligatoriamente sentados (con unainclinación de al menos 45°) o de pie durante las cuatrohoras siguientes a las tomas de la medicación. En estosdías los voluntarios debieron permanecer en ayunas al menosocho horas antes de la toma matinal de la medicación. A lascuatro, ocho y doce horas tras la toma de la medicación losindividuos recibieron tres comidas de acuerdo con un menúpreviamente estandarizado.
En cada uno delos dos días del estudio, inmediatamente antes deadministrar la medicación, y a la media, una, una y media,dos, dos y media, tres, cuatro, cinco, seis, nueve y doce horassiguientes a su administración se extrajeron muestras desangre (10 ml) a través de una vía venosaperiférica canalizada. Las muestras fueron inmediatamenteidentificadas, procediendo a su centrifugación a 1.500 G y4° C durante diez minutos.
El plasmaobtenido de cada una de las muestras fue guardado en tubosconvenientemente codificados que se almacenaron a 20° Chasta su análisis. El tiempo máximo transcurridoentre la extracción y congelación de las muestras nofue superior a los treinta minutos.
Durante eltiempo que los voluntarios permanecieron en el centro losdías correspondientes a las tomas de la medicación,así como al finalizar el segundo período detratamiento, se realizaron trazados electrocardiográficos,toma de constantes vitales y determinaciones analíticas deseguridad, de acuerdo con lo especificado en el protocolo delestudio. Asimismo se registraron en el formulario de recogida deefectos adversos todos los posibles efectos adversos acaecidosdurante el desarrollo del estudio, tanto aquellos referidos por losvoluntarios como los observados por el investigador. Seestableció que cualquier alteración analíticaconsiderada como relevante desde un punto de vista clínicofuera registrada en el correspondiente formulario.
Test dedisolución in vitro
Con anterioridada la realización de la parte clínica de este estudiode bioequivalencia y con la intención de confirmar que lascápsulas de Emeprotón® cumplen con las especificaciones descritas en las diferentesfarmacopeas para las formulaciones encapsuladas de gránuloscon recubrimiento entérico, se realizaron endiferentes lotes del producto determinacionesde gastrorresistencia y test de disolución in vitro.Asimismo se determinó el perfil de disolución invitro comparativo entre Emeprotón® yLosec® utilizando los mismoslotes que los empleados para el estudio debioequivalencia.
Ladeterminación de la gastrorresistencia se realizóintroduciendo la cápsula del producto en 500 ml de fluidogástrico artificial (pH ácido) a 37° C durantedos horas y midiendo seguidamente mediante cromatografía delíquidos de alta presión el porcentaje de omeprazolpresente en los gránulos.
El porcentaje dedisolución de omeprazol fue determinado in vitro trasintroducir durante dos horas una cápsula en 500 ml de fluidogástrico artificial a 37° C, añadiendoseguidamente 400 ml de H2NaPO4 (pH 6,8) y determinandotranscurridos treinta minutos el porcentaje de omeprazol disueltomediante cromatografía de líquidos de altapresión.
Determinaciones analíticas
Lasdeterminaciones plasmáticas de omeprazol en las muestrasobtenidas se realizaron en el departamento analítico deSimbec Research, siguiendo en todo momento las GLPinternacionalmente aceptadas, mediante la utilización de unmétodo convenientemente validado. Este métodopresenta una linearidad en el ámbito de losestándares utilizados (9,975-987,7 ng.ml1),con una inexactitud entre el +7,6 y el 9,3% y unaimprecisión no superior al 7,1%. El análisis porreplicado de los controles intra e interlotes mostró unainexactitud entre el 4,0 y el 12,2% y entre el 17,0y el 0,2%, respectivamente. La imprecisión del ensayono excedió del 10,6%. El rendimiento medio de omeprazol poreste método es del 87,5 ± 5,4%. El análisis serealizó mediante una técnica de HPLC de fase reversacon detección por luz ultravioleta. El sistema de HPLCutilizado está constituido por un autoinyector Jasco AS-950,una bomba de flujo para fasemóvil Jasco PU 980, un detector Shimadzu 10AV UV (fijado a302 nm) y un registrador Rikadenki RO1A. Para el análisis seutilizó una columna con relleno Beckman Ultraesphere C8(15 * 0,46 cm, tamaño departícula de 5 mm) con unaprecolumna Brownlee Newguard RP8.
Seutilizó una fase móvil de tampón fosfato 0,025M/ace-tonitrilo, 73/27 (v/v), y 1 ml/l de n-decilamina al 95%,ajustada a pH 7, bombeada isocráticamente a un flujo de 1,0ml.min1.Los límites máximos y mínimos decuantificación se establecieron de acuerdo con losestándares de calibración entre 9,975 y 987,7ng.ml1 deomeprazol.
Laadquisición e integración de los datos serealizó con un soporte informático MicroVax 3100,utilizando un programa Access* Chrom.
Análisis farmacocinético
Elanálisis farmacocinético se realizó de acuerdocon métodos estandarizados en el departamento defarmacocinética de Simbec Research, empleando el programa deanálisis farmacocinético Topfit, versión 2.0,según una aproximación no compartimental,independiente de modelo.
Los diferentesparámetros analizados se obtuvieron a partir de las curvasde concentración/tiempo de muestreo observadas tras cada unade las dosis en cada uno de los voluntarios. Laconcentración plasmática máxima(Cmáx) (expresada en ng.ml1)y el tiempo máximo en alcanzarla (Tmáx) (expresadoen horas) se obtuvieron directamente a través de lasconcentraciones plasmáticas observadas.
El áreabajo de curva extrapolada a infinito (AUC0-(infinity))(y expresada en ng.ml1.h) se determinó mediante la suma deAUC0-t (área bajola curva entre el tiempo 0 hasta el último punto detectablede muestreo) y del área residual (área bajo la curvaentre el último punto detectable de muestreo e infinito).AUC0-t fue calculada mediante una regla trapezoidal,mientras que el área residual se determinó medianteel cociente C/lz, siendo C laúltima concentración detectable y lz la constante deeliminación, siendo ésta definida como la pendientede la recta obtenida mediante regresión lineallogarítmica del segmento terminal de la curva deconcentración/tiempo de muestreo:
AUC0-(infinity) = AUC0-t + C/lz
La vida media deeliminación (t1/2) fue definida de acuerdo con la siguientefórmula:
t1/2 = Ln 2/lz
Labiodisponibilidad relativa fue definida como la relaciónentre AUC0-(infinity) Emeprotón®,I. F. Cantabria, S. A. (formulacióntest)/AUC0-(infinity)Losec®,Schering-Plough (formulación dereferencia).
Análisis estadístico
Para elanálisis estadístico de los datosfarmacocinéticos calculados se compararon las curvasplasmáticas de las concentraciones de omeprazol versus tiempos de muestreo, según un análisis dela varianza para datos pareados, tomando en consideraciónlas variables sujeto, secuencia y período. El testconstruido fue calculado para detectar diferenciasestadísticamente significativas (p < 0,05) entre las dosformulaciones. Se utilizó el programa PROC GLM(SAS/STAT®,versión 6.11).
Las variablesrelacionadas con la concentración Cmáx,AUC0-(infinity) y AUC0-t fueron transformadaslogarítmicamente previamente a su análisis, con laintención de normalizar los datos. Se aceptóbioequivalencia para unos intervalos de confianza clásicosdel 90% comprendidos entre el 80 y el 125% (paratransformación logarítmica de los datos) (11). Losvalores de Tmáx fueron analizados mediante elmodelo de aproximación no paramétrica de Wilcoxon SumRank.
RESULTADOS
Test dedisolución in vitro
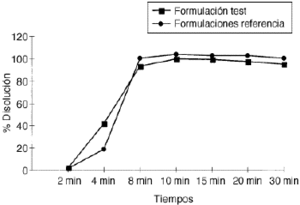
Los resultadosde los test de disolución in vitro y degastrorresistencia realizados con diferentes lotes deEmeprotón®,I. F. Cantabria, S. A., fabricados entre el 15 de octubre de 1997 yel 24 de febrero de 1997 quedan resumidos en la tabla 1. El lote L-09, fabricado el 24 defebrero de 1997, fue utilizado para este estudio debioequivalencia. En la figura 1 sepresentan los resultados del test de disolución invitro comparativo entre Emeprotón® (formulación test) y Losec® (formulación referencia).
| Tabla 1.Determinaciones de gastrorresistencia y test de disoluciónin vitro observadosparaEmeprotón®, I. F.Cantabria, S. A. | ||
| Lotes | Gastrorresistencia(>= 85%-2 h)* | Disolución(>= 75%-30 min)* |
| 27lotes (x ± DE) | 96,16 ± 1,88 | 92,55 ± 3,43 |
| L-09 | 95 | 91 |
| *Especificaciones de la USP 23 (x ± DE): media ±desviación estándar. | ||
Figura 1.--Perfiles comparativos de disolución invitro de Emeprotón®,I. F. Cantabria, S. A. (formulación test), yLosec®, Schering-Plough(formulación referencia).
Perfilesfarmacocinéticos
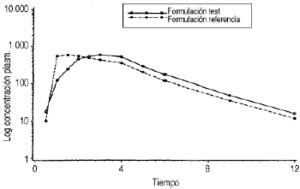
Laadministración de una dosis única de 40 mg deEmeprotón® (20 mg *2 cápsulas) porvía oral a 16 voluntarios sanos se siguió de valoresmedios de Cmáx de 932,39 ± 702,63ng.ml1 yde AUC0-(infinity) de2.554,37 ± 2.655,75 ng.ml1.h, situándose la Tmáx entre una ycuatro horas. Para la formulación de referencia,Losec®,los valores medios deCmáx fueron de 976,39 ± 686,24ng.ml1 yde 2.377,07 ± 2.587,27 ng.ml1.h para AUC0-(infinity), siendo laTmáx similar a la observada para laformulación test. La vida media de eliminación (t1/2)de omeprazol se situó entre 0,52 y 2,22 horas en el caso deEmeprotón® yentre 0,56 y 2,41 horas tras la administración deLosec®. En lafigura 2 se muestran los perfilesplasmáticos farmacocinéticos de las concentracionesplasmáticas medias, previa transformaciónlogarítmica de los datos (curvas de logconcentración-tiempo) obtenidos paraEmeprotón® (formulación test) y Losec® (formulación referencia). Los parámetrosfarmacocinéticos referidos a Cmáx,Tmáx, AUC0-(infinity),AUC0-t y t1/2, para ambas formulaciones, expresados comomedia (± DE), están recogidos en la tabla 2.
| Tabla 2.Parámetros farmacocinéticos observadosparaEmeprotón®, I. F.Cantabria, S. A.,y Losec®,Schering-Plough | ||
| Parámetros | Emeprotón®,I. F. Cantabria* | Losec®,Schering-Plough* |
| Cmáx (ng.ml1) | 932,39 (702,63) | 976,39 (686,24) |
| Tmáx (h) | 2,59 (1,05) | 2,03 (0,99) |
| AUC0-(infinity) (ng.ml1.h) | 2.554,37 (2.655,75) | 2.377,07 (2.587,27) |
| AUC0-t (ng.ml1.h) | 2.470,12 (2.561,53) | 2.312,81 (2.497,69) |
| t1/2(h) | 1,04 (0,55) | 1,03 (0,51) |
| *Desviación estándar. Cmáx:concentración máxima. Tmáx: tiempoen alcanzar Cmáx. AUC0-(infinity):área bajo la curva extrapolada a infinito.AUC0-t: área bajo la curva entre el tiempo 0hasta el último punto detectable de muestreo. t1/2: vidamedia de eliminación. | ||
Figura 2.--Perfiles plasmáticos farmacocinéticosde las concentraciones plasmáticas medias, previatransformación logarítmica de los datos (curvas delog concentración-tiempo) obtenidos paraEmeprotón®,I. F. Cantabria, S. A. (formulación test), yLosec®,Schering-Plough (formulación referencia).
Estudio debioequivalencia
Los valores dela biodisponibilidad relativa, entendida ésta como larelación formulación referencia/formulacióntest (R/T), así como los intervalos de confianza al 90% paralas variables analizadas, AUC0-(infinity),AUC0-t y Cmáx, previatransformación logarítmica de los datos, quedanresumidos en la tabla 3. No seobservaron diferencias significativas para Tmáxentre la formulación test y la de referencia (p =0,1206).
| Tabla 3.Relación R/T e intervalos de confianza al 90% paraomeprazol, previa transformación logarítmica de losdatos | |||
| Parámetros | IC 90%(límiteinferior) | IC 90%(relaciónR/T) | IC 90%(límitesuperior) |
| Cmáx (ng.ml1) | 81,2 | 96,6 | 115,5 |
| AUC0-(infinity) (ng.ml1.h) | 99,9 | 106,9 | 113,9 |
| AUC0-t (ng.ml1.h) | 99,3 | 105,8 | 112,7 |
| IC90%: intervalos de confianza al 90%. R/T: referencia/test.Cmáx: concentración máxima.Tmáx: tiempo en alcanzar Cmáx.AUC0-(infinity): área bajo la curva extrapolada ainfinito. AUC0-t: área bajo la curva entre eltiempo 0 hasta el último punto detectable de muestreo.Análisis de la varianza para datos pareados (PROC GLM,SAS/STAT®, versión 6.11). | |||
DISCUSIÓN
El objetivo decualquier estudio de bioequivalencia es determinar si dosformulaciones son o no esencialmente similares, aceptándoseen general una bioequivalencia, biodisponibilidad relativa, entreambas cuando se determina una diferencia inferior al 20%, para unnivel de significación alfa del 0,05% y un poder del 80%.Según consenso, los parámetrosfarmacocinéticos más adecuados para determinar estadiferencia son AUC, Cmáx yTmáx. El método estadísticoutilizado en este estudio, y más frecuentemente utilizado enla mayoría de los estudios de bioequivalencia realizados, esel análisis de la varianza para datos pareados, tomando enconsideración las variables sujeto, secuencia yperíodo. Las variables relacionadas con laconcentración, Cmáx,AUC0-(infinity) y AUC0-t fueron transformadaslogarítmicamente previamente a su análisis con laintención de normalizar los datos, utilizándose comocriterio de equivalencia los intervalos de confianzaclásicos al 90% de los cocientes entre las medias, dado quepermiten cuantificar mejor la variabilidad entre losparámetros. Los valores de Tmáx fueronanalizados mediante un modelo de aproximación noparamétrica.
Los resultadosde los estudios de disolución in vitro realizados conEmeprotón® muestran que la formulación cumple con las especificacionesestablecidas por la US Phamacopoeia para las formulacionesencapsuladas de gránulos con recubrimiento entérico:ausente o mínima liberación de omeprazol en la faseácida (0-5%) y liberación superior al 75% a pH 7.Ambas formulaciones, Emeprotón® y Losec®, presentanun perfil semejante de disolución invitro.
En ausencia dedatos sobre la variabilidad de la formulación test, seconsideró un tamaño muestral de 16 individuosadecuado para alcanzar los objetivos del estudio. Lainclusión de tres mujeres en el mismo tuvo como objetivo elde determinar posibles diferencias relacionadas con elgénero de los individuos en el perfil farmacocinéticode omeprazol.
Elanálisis de los datos farmacocinéticos obtenidos enel estudio de bioequivalencia, de acuerdo con la metodologíapreviamente expuesta, demuestra que ambas formulaciones deomeprazol, Emeprotón® (formulación test) yLosec® (formulaciónreferencia), no presentan diferencias significativas en losparámetros comúnmente analizados para demostrarbioequivalencia, Cmáx, AU0-(infinity)y Tmáx. Los intervalos de confianza al 90% trastransformación logarítmica de los datos, 99,3-112,7%para AUC0-t (valor medio: 105,8%), 99,9-113,9% paraAUC0-(infinity) (valor medio: 106,9%) y 81,2-115,5% paraCmáx (valor medio: 96,9%) se encuentran asimismoentre los intervalos del 80-125% admitidos para aceptarbioequivalencia entre dos formulaciones diferentes. Para laTmáx no se observan diferencias superiores al 20%entre ambas formulaciones. Este estudio fue realizado en todomomento de acuerdo con los criterios internacionalmenteestablecidos para la realización de ensayos clínicoscon medicamentos en humanos, no observándose desviacionessignificativas del protocolo previamente autorizado por elComité Ético Independiente. Tampoco se evidenciarondurante el desarrollo del estudio alteraciones clínicas oanalíticas significativas, no registrándose efectosadversos que se pudieran relacionar con la administración delos productos estudiados. Ninguno de los voluntariosabandonó el estudio durante el desarrollo delmismo.
Enconclusión, el análisis estadístico de losdatos farmacocinéticos obtenidos en este estudio, referidosa Cmáx, AUC0-(infinity) yTmáx, demostró la bioequivalencia entreambas formulaciones de omeprazol: Emeprotón®,I. F. Cantabria, S. A. (formulación test) yLosec®, Schering-Plough(formulación referencia). Las dos formulaciones presentaronuna buena tolerancia, sin observarse efectos adversos durante larealización del estudio.
BIBLIOGRAFIA
1.Fellenius E,Berglindh T, Sachs G. Subtituted benzimidazoles inhibit gastricacid secretion by blocking (H+ K+)-ATPase. Nature 1981;290:159-61.
2.Wallmark B,Lorentzon P, Larsson H. The mechanism of action of omeprazole - asurvey of its inhibitory actions in vitro. Scand JGastroenterol 1985;108:37-51.
3.Wallmark B,Brandstrom A, Larsson H. Evidence for acid-induced transformationof omeprazole into an active inhibitor of (H+ K+)-ATPase within theparietal cell. Biochim Biophys Acta 1984;778:549-58.
4. Larsson H,Mattsson H, Sundell G, Carlsson E. Animal pharmacodynamics ofomeprazole. A survey of the pharmacological properties ofomeprazole in animals. Scand J Gastroenterol1985;20:23-35.
5. Lind T,Cederberg C, Ekenved G, Haglund U, Olbe L. Effect of omeprazole - agastric proton pump inhibitor-on pentagastrin stimulated acidsecretion in man. Gut 1983;24:270-6.
6. Regardh CG,Gabrielsson M, Hoffmann KJ, Lofberg I, Skanberg I. Pharmacokineticsand metabolism of omeprazole in animals and man - an overview.Scand J Gastroenterol 1985;20:79-94.
7. Regardh CG.Pharmacokinetics and metabolism of omeprazole in man. Scand JGastroenterol 1986;21: 99-104.
8. AHFS DrugInformation 97. American Hospital Formulary Service. Bethesda:American Society of Hospital Pharmacists Inc.; 1997.
9. Howden CW.Clinical pharmacology of omeprazole. Clin Pharmacokin1991;20:38-49.
10. UnitedStates Pharmacopoeia, 23 ed, 1995. p. 1795-6.
11. EuropeanAgency for the Evaluation of Medicina Products. Investigation ofbioavailability and bioequivalence. CPMP III/54791.