Evaluar la eficacia y seguridad del omalizumab. Las condiciones para la administración de dicho fármaco fueron las indicadas en ficha técnica: edad superior a 12 años, asma alérgica grave persistente, mal control de síntomas, FEV1<80°%, IgE total entre 30 y 700 UI/mL y pruebas cutáneas y/o IgE específica positiva al alérgeno persistente.
MétodoEstudio retrospectivo observacional de pacientes que hubieran sido tratados con omalizumab en la indicación de asma grave durante el período enero 2010 a julio de 2011. Se registraron la edad, sexo, peso, IgE y reactividad in vitro a los alergenos perennes, FEV1, tratamiento de base, exacerbaciones asmáticas y necesidad de corticosteroides sistémicos o ingresos en urgencias, presencia de síntomas durante el día o que originen despertares durante la noche al inicio del tratamiento, a las 16 semanas, 32 semanas y a los 1,5 años tras al inicio del tratamiento. Se recogieron los efectos secundarios y los cambios en el tratamiento de base.
Resultados22 pacientes con un peso medio de 73 kg (51-102). La concentración basal de IgE antes del inicio de omalizumab fue de 203 UI/ml (30-992). 21 pacientes presentaban una función pulmonar reducida, con un FEV1 al inicio del 60% (30-93%). El FEV1 a las 16 semanas fue del 60% (39-71%) y a las 32 semanas del 68% (29-102%). La dosis media de omalizumab administrada cada 30 días fue de 368 mg (150-900 mg). Se observaron reacciones adversas en 4 pacientes, uno de los cuales requirió la retirada del tratamiento. Al final del periodo de seguimiento 14 pacientes habían disminuido el tratamiento control y doce presentaron mejoría global.
ConclusiónOmalizumab se ha utilizado en pacientes con asma grave alérgica no respondedores a terapia convencional observándose una disminución en el número de exacerbaciones y visitas a urgencias e ingresos. Sólo un 55% experimentan una mejoría global según criterios clínicos y no se observaron cambios estadísticamente significativos en la FEV1.
To assess the efficacy and safety profile of omalizumab treatment. The conditions under which omalizumab was prescribed agreed with those in Xolair® drug information: age > 12 years old, severe uncontrolled asthma, FEV1 < 80%, IgE 30-700 UI/ml and positive test results for perennial allergens.
MethodsAsthmatic patients treated with omalizumab between January 2010 and July 2011 were evaluated retrospectively. Age, sex, weight, IgE level, concomitant asthma medications, change in FEV1, emergency department visits, hospitalizations, asthma exacerbations and corticosteroids bursts were recorded before and after omalizumab initiation. A 1.5-year period was chosen.
ResultsA total of 22 patients were included. The mean weight of subjects was 73 Kg (range, 51-102). Mean IgE was 203 UI/ml (range, 30-992) and mean FEV1 60% (range, 30-93%) at baseline. Adverse events were observed in 4 patients. There were no significant changes in FEV1 values after omalizumab treatment but omalizumab was associated with a reduction in concomitant asthma medications use in 14 patients and improvements in global asthma control in 12.
ConclusionsIn these patients add-on therapy with omalizumab reduced asthma exacerbations and emergency visits or hospitalizations. Only 55% of patients significantly improved global asthma control and no significant changes in FEV1 were observed.mejoría global según criterios clínicos y no se observaron cambios estadísticamente significativos en la FEV1.
El asma es una enfermedad inflamatoria crónica de las vías respiratorias, caracterizada por diversos fenotipos inmunopatológicos y clínicos, en la que participan diferentes tipos de células inmunes e inflamatorias. Un 5-10% de los pacientes presentan asma grave con síntomas respiratorios persistentes y elevado número de exacerbaciones, a pesar de recibir el mejor tratamiento disponible, lo que conlleva un notable deterioro en su calidad de vida y un alto riesgo de morbi-mortalidad1,2. Con las terapias estándar actuales, basadas en la combinación de glucocorticoides inhalados a dosis altas y agonistas β2 adrenérgicos de larga duración, se ha logrado un buen control de la enfermedad en un gran número de pacientes con asma grave3,4,5. En aquellos pacientes con asma alérgica grave persistente en los que la combinación de altas dosis de glucocorticoides inhalados y agonistas β2 adrenérgicos de larga duración se ha mostrado ineficaz en el control de los síntomas debe considerarse el uso de otros fármacos de mantenimiento, como son los antileukotrienos, la teofilina o el omalizumab.
Es conocido que la Inmunoglobulina E (IgE) es un anticuerpo que juega un papel clave en los mecanismos inmunoinflamatorios que subyacen en el asma alérgica y otras patologías atópicas. Por ello las terapias dirigidas a bloquear la acción de la IgE pueden resultar muy beneficiosas en el tratamiento de la enfermedad. Omalizumab es el único anticuerpo monoclonal recombinante humanizado anti-IgE aprobado para el tratamiento del asma alérgico. Está indicado en el asma alérgico grave persistente en pacientes con niveles de IgE elevados y test cutáneo positivo o reactividad in vitro para aeroalergenos y con síntomas no controlados con corticoides inhalados. Se administra vía subcutánea cada 2-4 semanas, según los niveles circulantes de IgE y peso6,7. Omalizumab disminuye los niveles de IgE circulantes uniéndose a la región constante de IgE, evitando así la unión de la IgE a receptores de baja y alta afinidad (Fc RI y Fc RII), y reduce la expresión de Fc RI en basófilos y células de la submucosa traqueobronquial7,8. También se ha observado una atenuación del incremento de afinidad del Fc RII en células musculares lisas bronquiales in vitro8.
La eficacia de omalizumab ha sido evaluada en varios ensayos clínicos randomizados y estudios post-autorización tanto en adultos como en pediatría diagnosticados de asma alérgica grave persistente, demostrándose ser un tratamiento coste-efectivo comparado con en tratamiento estándar. Se ha observado una disminución en el número de exacerbaciones, hospitalizaciones, visitas a urgencias y necesidades de corticoides y una mejoría en la calidad de vida; sin embargo, en la mayoría de estudios no se han encontraron diferencias en los valores de volumen espiratorio forzado (FEV1) al añadir omalizumab al tratamiento estándar.
El objetivo de este estudio es evaluar la eficacia del omalizumab en un hospital de tercer nivel en las mismas condiciones de utilización que en la ficha técnica: asma alérgica grave persistente, mal control de los síntomas (reagudizaciones, despertares frecuentes por la noche, disnea), FEV1 < 80%, IgE total entre 30 y 700 UI/mL y pruebas cutáneas y/o IgE específica positiva al alérgeno persistente. El objetivo secundario es evaluar la seguridad mediante el registro de los efectos secundarios. Se realiza una valoración de la respuesta a las 16 semanas de tratamiento y en caso de que no se produzca una mejoría significativa de los síntomas se procede a la retirada de omalizumab.
MétodosSe realizó un estudio retrospectivo observacional no controlado en un hospital de tercer nivel en el que se incluyeron a todos los pacientes que hubieran seguido tratamiento con omalizumab en la indicación de asma grave durante el período enero 2010 a julio de 2011. No se obtuvo consentimiento informado de los pacientes debido a que se trata de un estudio retrospectivo no intervencional. La información confidencial de los pacientes fue protegida de acuerdo a la normativa nacional establecida. Este artículo ha sido revisado para su publicación por el Comité Ético de Investigación Clínica (CEIC) del Hospital de Bellvitge.
Los datos se obtuvieron de la historia clínica electrónica del paciente. Se registraron la edad, sexo, peso, valor de la IgE y reactividad in vitro a los alergenos perennes, FEV1, tratamiento al inicio con corticoides inhalados asociado a un agonista beta-2, número de exacerbaciones asmáticas en el año anterior al inicio del tratamiento y requerimiento de corticosteroides sistémicos o ingresos en urgencias, presencia de síntomas durante el día o que originen despertares durante la noche al inicio del tratamiento, a las 16 semanas, 32 semanas y a los 1,5 años tras el inicio del tratamiento. Se recogieron también los efectos secundarios registrados durante el tratamiento así como el tratamiento concomitante al inicio del tratamiento y durante el mismo.
El análisis estadístico se realizó con SPSS versión 19.0 (© 2010 SPSS Inc.)
ResultadosCaracterísticas demográficasLas características demográficas y las evaluaciones clínicas y funcionales de los pacientes incluidos en el estudio al inicio del tratamiento, a las 16 semanas, 32 semanas y a los 1,5 años se muestran en la tabla 1.
Características demográficas, posología de omalizumab, resultados de prick test, valores de IgE y FEV1 y número de pacientes con exacerbaciones y visitas a urgencias o no programadas al inicio del tratamiento con omalizumab, a las 16 y 32 semanas y a los 1,5 años tras el inicio del tratamiento
| Inicio | 16 semanas | 32 semana | 1,5 años | |
|---|---|---|---|---|
| Edad | 49 (19-64) | - | - | - |
| Hombres/Mujeres | 8/14 | - | - | - |
| Peso (kg)HombresMujeres | 73 (51-102)81 (65-102)65 (51-92) | |||
| Prick test positivo | Dermatophagoides farinae, Dermatophagoides pteronysinus, Aspergillus fumigatus, Parietaria | |||
| IgE total (UI/ml) | 203 (30-992) | - | - | - |
| FEV1 (%) | 60 % (30-93) | 60 % (39-71) | 68 % (29-102) | 62% (21-116) |
| Exacerbaciones graves que requieren dosis altas de corticoides sistémicos | 22 | 9 | ||
| Visitas a urgencias o no programadas a CEX | 22 | - | - | 8 |
| Frecuencia de administración (n) Cada 2 semanas | 7 | - | - | - |
| Cada 4 semanas | 15 |
Se incluyeron en el estudio a 22 pacientes con asma grave persistente tratados con omalizumab (14 mujeres). El peso medio al inicio del tratamiento fue de 73 kg (intervalo, 51-102 kg), 65 kg en mujeres (intervalo, 51-92 kg) y 81 en hombres (intervalo, 65-102 kg). La concentración basal de IgE (UI/ml) antes de la administración de la primera dosis de omalizumab fue de 203 UI/ml (intervalo, 30-992). 21 pacientes presentaban una función pulmonar reducida, con un valor de FEV1 al inicio del 60% (intervalo, 30-93%). El FEV1 medio al final del seguimiento fue del 62 % (intervalo, 21-116 %) con una diferencia media entre el inicio y el final del seguimiento del 3% (p > 0,05); sólo en 4 pacientes el FEV1 supera el 80% al final del seguimiento. El FEV1 a las 16 semanas fue del 60% (intervalo, 39-71%) y las 32 semanas del 68% (intervalo, 29-102%) (Tabla 1) (p > 0,05).
La dosis media de omalizumab administrada cada 30 días fue de 368 mg (intervalo, 150-900 mg) con una media de 22 dosis recibidas al finalizar el estudio. El periodo de seguimiento fue de 1,5 años. Se observaron reacciones adversas al tratamiento con omalizumab en 4 pacientes, uno de los cuales requirió la retirada del tratamiento (pérdida de peso, parestesia, ataxia, tos, urticaria, artralgia y entumecimiento de la lengua), el resto presentaron urticaria (1), dolor abdominal (1) y dolor torácico (1).
Influencia de omalizumab en las exacerbacionesTodos los pacientes presentaron exacerbaciones asmáticas graves que requieren corticoides sistémicos durante el año anterior al inicio de omalizumab, 20 pacientes requirieron ser atendidos a urgencias o ingreso hospitalario y 19 presentaban síntomas frecuentes durante el día o despertares por la noche. Nueve pacientes (41%) presentaron una media de 3 exacerbaciones asmáticas que requirieron dosis altas de corticoides sistémicos durante el tratamiento con omalizumab y ocho (36%) realizaron una media de 5 visitas a urgencias relacionadas con el asma, de los cuales tres requirieron ingreso hospitalario (media de 2 ingresos hospitalarios por paciente). Doce pacientes (55%) presentaron mejoría global durante el tratamiento con omalizumab y 14 (64%) dismunyeron el tratamiento control.
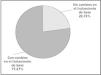
Influencia de omalizumab en el tratamiento concomitanteTodos los pacientes eran tratados con corticoides inhalados a dosis altas asociado a una agonista beta-2 inhalado de larga duración al inicio del tratamiento con omalizumab; 17 (77%) de ellos llevaban además agonistas beta-2 de corta duración, 9 (41%) corticoides orales, 12(55%) montelukast y anticolinérgicos, 6 (27%) acetilcisteína y corticoides nasales, 2 (9%) azatioprina, 1 teofilina y 1 antihistamínicos (Figura 1).
Respecto a los cambios producidos en el tratamiento de base al inicio del tratamiento con omalizumab 17 pacientes tuvieron al menos un cambio durante el tratamiento con omalizumab, 9 con más de un cambio (Figura 2). La mayoría de los cambios se producen en los agonistas beta de corta duración con 9 pacientes con reducción de dosis o suspensión de tratamiento y 2 con aumento de dosis. Respecto a los corticoides orales 5 pacientes suspendieron el tratamiento y un paciente requirió aumento de dosis; 2 pacientes suspendieron el tratamiento con montelukast y 2 iniciaron el tratamiento; 3 pacientes suspendieron el tratamiento con anticolinérgicos orales y en un paciente se disminuyó dosis; 3 pacientes iniciaron tratamiento con corticoides nasales y dos lo suspendieron o redujeron dosis. Dos pacientes suspendieron o redujeron dosis de corticoides inhalados, un paciente inició agonistas beta 2 de larga duración y otro lo suspendió (Tabla 2).
Cambios del tratamiento de base durante el tratamiento con Omalizumab
| Agonista beta-2 adrenérgico de corta duración | Corticoides orales | Montelukast | Anticolinérgicos orales | Corticoides nasales | Corticoides inhalados | Agonistas beta-2-adrenérgicos de larga duración | |
|---|---|---|---|---|---|---|---|
| Aumento de dosis o inicio | 2 | 1 | 2 | 0 | 3 | 0 | 1 |
| Disminución de dosis o suspensión | 9 | 5 | 2 | 4 | 2 | 2 | 1 |
La eficacia de omalizumab se evaluó en el estudio INNÓVATE (Investigation of Omalizumab in Severe Asthma Treatment), incluyendo a 419 pacientes, aunque no todos recibían corticoides inhalados a dosis altas9. La FEV1 al inicio del estudio fue del 41-80% y asociada a exacerbaciones clínicamente significativas (2,1 exacerbaciones/año). Se observó una disminución estadísticamente significativa de las visitas a urgencias comparado con placebo y el número de exacerbaciones que requieren corticoides sistémicos pero no se pudo evaluar el efecto de omalizumab añadido al tratamiento con altas dosis de corticoides inhalados y beta-2-agonistas de larga duración, tal como recomiendan las guías clínicas. Rodrigo GJ et al.10 realizaron una revisión sistemática de 8 estudios controlados con placebo, y evaluaron la eficacia de omalizumab añadido a terapia de corticoides inhalados. Observaron un menor número de exacerbaciones por paciente en el grupo del omalizumab respecto a placebo (0,41 vs 0,77 respectivamente). El análisis demostró que el número de pacientes a los que se les suspenden los corticoides o continúan sin ellos en el grupo omalizumab era superior que en el grupo placebo. Sin embargo, no encontraron diferencias estadísticamente significativas en la FEV1 entre los dos grupos y sólo una pequeña diferencia en la PEF de la mañana. En nuestro grupo de pacientes sólo 2 pacientes suspendieron o redujeron dosis de corticoides inhalados y no se observaron diferencias estadísticamente significativas en la FEV1 sólo se observó una mejoría global en el 55% de los pacientes.
Hanaia et al11 evaluaron la eficacia y seguridad de omalizumab en 820 pacientes con asma grave persistente no controlada con altas dosis de corticoides inhalados y beta-2-agonistas de larga duración. En este estudio se demostró una reducción del 25% en las exacerbaciones (incidencia, 0,66 vs 0,88; p = 0,006) y una mejora en la calidad de vida (AQLQ semana 48, 67,8 vs 61%, p = 0,042). La reducción en el número de exacerbaciones fue mayor en pacientes tratados con altas dosis de corticoides inhalados y beta-2-agonistas de larga duración exclusivamente (reducción del 34 %) que en pacientes que recibían también corticoides orales aunque las diferencias no fueron estadísticamente significativas. En nuestro estudio la reducción en el número de exacerbaciones fue mayor en el grupo de pacientes tratados con corticoides inhalados y beta-2 agonistas solos o asociados a montelukast (64% de los pacientes sin exacerbaciones que requieren corticoide sistémico). El 45% de estos pacientes llevaba asociado montelukast.
En otro estudio en el que se incluyeron a 419 pacientes12, se comparó omalizumab con placebo observándose una reducción de los síntomas y exacerbaciones (30,3% vs 48,8%), hospitalizaciones (1,5% vs 6,3%) y necesidad de glucocorticoides. No se detectaron diferencias desde el punto de vista de seguridad en ambos grupos. En nuestro estudio tanto el número de pacientes que presentó exacerbaciones (100% vs 41%) como los que requirieron visitas a urgencias (100% vs 36%) disminuyeron, pero no se observaron cambios en la necesidad de corticoides inhalados como tratamiento de base.
Bousquet et al.13 observan que los pacientes no respondedores a omalizumab en la semana 16 y 32 (no respondedores persistentes) presentaban características demográficas similares al resto de pacientes, sin embargo, la media de los niveles IgE sérica total eran menores que el valor global (160,7 [33,2-595,5] vs 196,4 [30,7-692,0]). En nuestro estudio, el número de pacientes es insuficiente para encontrar esta relación, así, entre los pacientes que no mejoraron y suspendieron el tratamiento (n = 3) los valores fueron discordantes (uno tenía el valor IgE menor que la media y los otros dos superior). El FEV1 fue superior en el grupo omalizumab a la semana 16 (68,4% vs 64,8%, p = 0,024) y 32 (68,1% vs 63,7%, p = 0,007). La mejoría en el FEV1 fue de 0,11 L [0,01-0,2 L) (p = 0,036) a la semana 16 y 0,13 L [0,03-0,23] (p = 0,011) a la semana 32. En nuestro estudio el FEV1 medio a las 16 semanas fue del 60% (intervalo, 39-71%), a las 32 semanas del 68% (intervalo, 29-102%) y al final del seguimiento fue del 62 % (intervalo, 21-116%) con una diferencia media entre el inicio y el final del seguimiento del 3% (p > 0,05); sólo en 4 pacientes el FEV1 supera el 80% al final del seguimiento. El 12,7% de los pacientes presentaron efectos adversos: cefalea, artralgia, dolor en el lugar de inyección, malestar, mareo, espasmos musculares, mialgia, prurito, urticaria y dolor en extremidades. Nueve pacientes (3,3%) del grupo omalizumab suspendieron el tratamiento por reacciones adversas, dos de cuales presentaron reacciones adversas graves. En nuestro grupo de pacientes se suspendió el tratamiento por reacciones adversas graves en un paciente (4,5%) y 4 pacientes presentaron reacciones adversas al tratamiento con omalizumab (18%).
Asimismo, un nivel bajo de IgE se asoció a un menor beneficio en un estudio aunque en los 7 ensayos clínicos randomizados que se han realizado con omalizumab han observado la misma eficacia independientemente de los niveles séricos de IgE totales14,15. Los datos de nuestro estudio concuerdan con los de los 7 ensayos randomizados realizados; la IgE media en los pacientes que no presentan exacerbaciones, visitas a urgencias e ingresos y con mejoría global fue de 346,1 UI/ml (si dentro de este grupo tenemos en cuenta sólo los que presentan una disminución del tratamiento de control, la IgE media observada fue de 385,25 UI/ml) y en los pacientes que presentan exacerbaciones de 148,6 UI/ml (en aquellos con exacerbaciones, visitas a urgencias y/o ingresos y sin mejoría global ni disminución del tratamiento control fue de 59,5 UI/ml).
En el estudio de Ayres JG et al.16 evaluaron la eficacia de omalizumab respecto a placebo en asma moderada a severa tratados con el mejor tratamiento de base (corticoide inhalado +/- agonista beta-2 de larga duración o corticoides sistémicos). El número de exacerbaciones y la dosis de corticoide oral en el grupo del omalizumab fueron menores que en el grupo paralelo. Los efectos secundarios fueron comparables entre los dos grupos. Los datos concuerdan con los obtenidos por Busse et al12 y con los de nuestro estudio.
Milgrom et al.17 evaluaron la seguridad y el impacto sobre las exacerbaciones y la disminución del uso de corticodes en pacientes pediátricos tratados con omalizumab. Observaron una reducción media en el uso de corticodes (100% vs 66,7% -55% vs 39% pudieron suspenderlos). La incidencia de exacerbaciones fueron significativamente inferiores en el grupo del omalizumab 18,2% vs 38,5%) pero se detectaron pocos cambios en algunos de los scores de síntomas de asma matinales (PEFR, FEV-1, FVC). Los resultados de nuestro estudio, aunque no incluye a pacientes pediátricos, en cuanto a la evolución de FEV1 durante el tratamiento, concuerdan con los de este estudio.
Otro estudio18 realizado en pacientes pediátricos (n = 627, edad = 6-12 años) con asma alérgica de moderada a severa persistente, a pesar de ser tratados con dosis medias o altas de corticoides inhalados, se comprobó una reducción significativa del número de exacerbaciones en el grupo tratado con omalizumab respecto del grupo tratado con placebo en las semanas 24 (31%) y 52 (43%). Además durante las últimas 28 semanas del estudio, se logró reducir la dosis de corticoides un 4% en el grupo tratado con omalizumab mientras que el grupo placebo hubo un incremento del 2%, aunque la diferencia no fue significativa. El perfil de seguridad fue similar en ambos grupos, no hubo diferencias en la incidencia de reacciones adversas. En la mayoría de los casos fueron de carácter leve a moderado en ambos grupos. Berger W et al.19 observaron un 6,7% (15 de 225) de los pacientes experimentaron alguna reacción adversa relacionada con el tratamiento con omalizumab durante el periodo de seguimiento (52 semanas). Uno de los efectos adversos fue grave (urticaria), siendo los más frecuentes infecciones del tracto respiratorio inferior, cefalea, faringitis e infección vírica. No se detectaron diferencias clínicamente significativas en la temperatura corporal, tensión sistólica/diastólica, frecuencia respiratoria ni datos analíticos, incluyendo el recuento plaquetar.
El comité OJTF constituido por la Academia y el Colegio americanos de asma alergia e inmunología, se ideó para revisar las reacciones anafilácticas a partir de los ensayos clínicos y los datos de farmacovigilancia, concluyendo que la anafilaxis aparecía en aproximadamente el 0,09% de los pacientes20,21. La mayoría de las reacciones (61%) ocurrieron en las primeras 2 horas después de las tres primeras inyecciones y el 16% después de la primera media hora después de la inyección a partir de la cuarta o posterior. Recomiendan tomar una serie de precauciones dirigidas a incrementar la seguridad del paciente entre ellas establecer un periodo de observación del paciente después de la administración y adiestrar en el uso de autoinyectores de adrenalina. Ricardo A Tan et al.22 llevaron a cabo una revisión de todos los datos publicados sobre la seguridad del omalizumab siendo las reacciones adversas más comunes: nasofaringitis, infecciones del tracto respiratorio superior, dolor de cabeza, sinusitis, gripe, dolor faringo-laríngeo y dolor de espalda. En nuestro estudio el 4,5% de los pacientes suspendieron el tratamiento por reacciones adversas en el grupo omalizumab. Un paciente presentó anorexia con perdida de peso, parestesia, ataxia, tos, urticaria, atralgia y entumecimiento de la lengua. Dolor abdominal y dolor torácico fueron otros efectos no deseados encontrados en los pacientes tratados con el fármaco a estudio. En cuanto a los datos obtenidos sobre la incidencia de cáncer tras el análisis de estudios en fase I-III se observó que era mayor en el grupo tratado con omalizumab frente a placebo (0,5% vs 0,18%). Las neoplasias más en el grupo frecuentes fueron cáncer de piel (no melanoma), mama y próstata. No se puedo encontrar una relación causal entre omalizumab y neoplasia.
En estudios previos al Excels no se detectaron reacciones adversas a nivel cardíaco ni cerebrovascular, en cambio en este estudio23 los datos sugieren incremento arritmias, isquemia, fallo cardiaco, cardiomiopatía, hipertensión, alteraciones cerebrovasculares, embolismo y tromboembolismo. Por todo ello la FDA publicó el 16 de junio de 2009 la alerta «Early Communications about an ongoing safety review of omalizumab (marketed as Xolair)»23 donde comunican los datos del estudio Excels y en el 201 124 la MHRA alerta el incremento de riesgo de eventos tromboembólicas asociados a omalizumab. Asimismo, algunas referencias recomiendan no utilizar omalizumab en el asma persistente grave debido a la incertidumbre que presenta en la eficacia y a los efectos secundarios que pueden llegar a ser graves25. Cabe destacar, que en un análisis multivariantes observacional no se asoció omalizumab con un aumento del riesgo de eventos tromboembólicas (HR 1,11; IC 95% Cl 0,70-1,76)27.
ConclusionesEn conclusión la adición de omalizumab al tratamiento de base permitió en la mayoría de pacientes con asma grave alérgica no respondedores a terapia convencional, disminuir el número de exacerbaciones y las visitas a urgencias e ingresos, así como la suspensión o disminución en gran parte de los pacientes del tratamiento de base (mayoritariamente corticoides orales y betabloqueantes de corta duración); siendo en general bien tolerado. Sin embargo, sólo el 55% experimentaron una mejoría global según criterios clínicos y en ciertos parámetros, como la FEV1, la mejoría fue muy modesta y no se detectó hasta la semana 22 (p estadísticamente no significativa). Es necesario realizar una correcta evaluación de la respuesta a las semanas 16 y 32 tras el inicio del tratamiento valorando su suspensión si la respuesta no es la esperada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Retrospective analysis of omalizumab in patients with severe allergic asthma
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas