ORIGINALES
EVALUACION DE LA UTILIZACION DE INMUNOGLOBULINAS INESPECIFICAS INTRAVENOSAS EN LOS HOSPITALES PUBLICOS DE ANDALUCIA
Millán García, R.*, Especialista en Farmacia Hospitalaria, Jefe de Sección; Zamora Ardoy, M. A.**, Especialista en Farmacia Hospitalaria, Adjunta; Quero González, P.***, Especialista en Farmacia Hospitalaria, Adjunta; Vallejo Rodríguez, I., Especialista en Farmacia Hospitalaria.
En representación de GAUME.
* H. G. E. Ciudad de Jaén. Jaén.
** Hospital de Poniente. Elegido (Almería).
*** Hospital Gutiérrez Ortega. Valdepeñas (Ciudad Real).
Correspondencia:
Rosa Millán García.
Servicio de Farmacia.
H. G. E. Ciudad de Jaén.
Ejército Español, 10.
23007 Jaén.
E-mail: rmillang@sefh.es
Fecha de recepción: 14-6-99
Palabras clave:
Inmunoglobulinas inespecíficas. Utilización. Indicación. Prescripción. Consumo. Protocolos. Dosificación. Dispensación.
Resumen:
Los objetivos del presente trabajo son conocer la utilización de inmunoglobulinas inespecíficas intravenosas (IgIV) en los hospitales públicos andaluces en cuanto a consumo, indicaciones, régimen de dosificación, servicios prescriptores, control de dispensación, etc., y establecer el grado de adaptación de la práctica clínica actual a las indicaciones y dosificaciones aprobadas por la Dirección General de Farmacia y Productos Sanitarios (DGFPS) y a las recomendadas por la bibliografía científica internacional.
Se realizó un estudio transversal de indicación-prescripción de un mes de duración. Participaron 24 hospitales de los 32 encuestados. Se recogieron los datos de 175 tratamientos, de los que el 69% correspondieron a indicaciones autorizadas por la DGFPS y el 25% a indicaciones no aprobadas en España, pero avaladas por la bibliografía científica. En general se observó infradosificación con respecto a las dosis recomendadas y poco control en la dispensación y utilización de estos medicamentos.
Los servicios más prescriptores fueron hematología, pediatría, neurología y medicina interna.
EVALUATION OF THE USE OF NONSPECIFIC INTRAVENOUS IMMUNOGLOBULINS IN PUBLIC HOSPITALS OF ANDALUCIA (SPAIN)
Key words:
Nonspecific immunoglobulins. Indication use. Prescription. Consuption. Protocolos. Dosing. Dispensation.
Summary:
The objetives of this study were to know how nonspecific intravenous immunoglobulins (IgIVC) are used in public hospitals of Andalucía (Spain) in terms of consumption, indications, dosing regime, prescription servicies, control of dispensation, etc. We also determined the extent of adaptation of current clinical practice to the indications and dosages approved by the General Director of Pharmacy and Health Products and recommended in the international scientific literature.
A one-month long cross-sectional study was made of indications and prescriptions. Twenty-four of the 32 hospitals surveyed participated. Data from 175 treatments were compiled, of which 69% were indications authorized by the General Director of Pharmacy and Health Products and 25% were indications no approved in Spain but supported by scientific evidence. In general, we found under-dosing with respect to recommended doses and poor control of the dispensation and use of these medications.
The services that most often prescribed nonspecific intravenous immunoglobulins were hematology, pediatrics, neurology, and internal medicine.
INTRODUCCION
En el uso de las inmunoglobulinas inespecíficas intravenosas (IgIV) existe una gran controversia sobre las situaciones en las que son realmente útiles. Por un lado están las indicaciones, aprobadas por la Dirección General de Farmacia y Productos Sanitarios (DGFPS), por otro las aprobadas por la FDA en Estados Unidos y por último las aprobadas o reconocidas por los comités de expertos y la bibliografía científica.
En este contexto, con este trabajo nos planteamos los siguientes objetivos:
--Saber qué cantidad de IgIV se utilizan en los hospitales andaluces.
--Conocer si esta utilización se realiza de forma controlada y/o restringida.
--Conocer los hábitos de prescripción de IgIV en estos hospitales en cuanto a indicaciones, pautas de dosificación y servicios médicos prescriptores.
--Establecer el grado de adaptación de la práctica clínica actual a las indicaciones y dosificaciones aceptadas por la DGFPS y a las recomendadas por la bibliografía internacional.
MÉTODO
Diseño del estudio
Se realizó un estudio transversal de indicación-prescripción de IgIV de un mes de duración (1 al 31 de marzo de 1998). Se incluyeron todos los tratamientos con IgIV prescritos en los hospitales participantes tan-to en pacientes hospitalizados como de hospital de día. Los tratamientos que a fecha 1 de marzo ya habían comenzado se incluyeron, haciéndoles un seguimiento retrospectivo para completar los datos necesarios; de la misma forma, a los tratamientos que el día 31 no habían finalizados se les hizo un seguimiento hasta su conclusión.
Recogida de datos y hospitales participantes
Se elaboró un impreso de recogida de datos de los tramientos, así como de características generales del hospital y consumo de IgIV (Anexo 1):
Anexo 1. Hoja de recogida de datos
Anexo 1. Hoja de recogida de datos (continuación)
-- Datos generales del hospital: nombre, ciudad, tipo de hospital, número de camas y de estancias durante el año 1997, existencia de un modelo especial de petición de IgIV y año de la última modificación, existencia de criterios aprobados por la Comisión de Farmacia y Terapéutica para la utilización de IgIV y año de la última revisión de los mismos y, por último, si se efectuaba algún seguimiento y control del cumplimiento de los mismos.
--Datos de consumo: coste del consumo total de medicamentos y del de IgIV del hospital en 1997. Gramos de IgIV utilizados en ese año.
--Indicación-prescripción: para cada tratamiento se tenían que registrar: edad, peso y sexo del paciente, servicio prescriptor, indicación, dosis/día, duración del tratamiento y marca comercial utilizada.
Para la recogida de los datos se utilizó la estructura de GAUME (Grupo Andaluz para el Estudio de la Utilización de Medicamentos), enviando los impresos de recogida de datos a los responsables de este grupo en todos los hospitales públicos de Andalucía (los pertenecientes al SAS y los gestionados por empresas públicas).
Los datos recogidos se unieron a los de hospitales del resto de España para realizar este estudio a nivel nacional.
Análisis de datos
El procesamiento informático de los datos se efectuó en Microsoft Access para Windows 95 versión 7.0. Para el análisis estadístico se utilizó el programa Epi-Info, versión 6.1, usando técnicas de estadística descriptiva. La unidad de medida utilizada para los consumos fue el número de gramos por 100 estancias-día.
Para el análisis del estudio de indicación-prescripción las indicaciones de las IgIV se clasificaron en tres categorías junto con las dosis recomendadas, según el trabajo de revisión publicado en este mismo número de la revista de la SEFH (1):
--Categoría I: indicaciones autorizadas en España por la DGFPS (tabla 1).
Tabla 1. Categoría I: indicaciones autorizadas en España por la DGFPS | |
| Indicaciones | Dosis |
| Tratamiento de reposición en agammaglobulinemias e hipogammaglobulinemias congénitas y otros síndromes de inmunodeficiencia primaria tales como inmunodeficiencia común variable, síndrome de Wiskott-Aldrich, inmunodeficiencia severa combinada | 200-400 mg/kg/cuatro semanas. |
| Hipogammaglobulinemia secundaria en pacientes con leucemia linfocítica crónica con infec ciones bacterianas recurrentes | 250-400 mg/kg/cada tres-cuatro semanas. |
| Hipogammaglobulinemia secundaria en pacientes con mieloma múltiple con infecciones bac terianas recurrentes | 400 mg/kg/cuatro semanas. |
| Tratamiento de la púrpura trombocitopénica idiopática cuando se necesita aumentar rápidamente la cifra de plaquetas para controlar las pérdidas hemáticas o permitir que un pacien te sea sometido a cirugía | 400 mg/kg/día * cinco días o 1 g/kg/día * dos días. |
| SIDA en pacientes pediátricos con infecciones bacterianas de repetición | 400 mg/kg/cuatro semanas. |
| Enfermedad de Kawasaky | 400 mg/kg/día * cuatro días o 2 g/kg en dosis única. |
| Profilaxis de infecciones y de la enfermedad de injerto contra huésped tras el trasplante de médula ósea | 500-1.000 mg/kg cada una-dos semanas desde semana 1 hasta 100-120 días post-TMO. |
| Tratamiento prenatal y postnatal de la enfermedad hemolítica del recién nacido (incompatibi lidad al factor Rh) | Madre: 1 g/kg/semana. Niño: 1 dosis 500 mg/kg. |
| Síndrome de Guillain-Barré | 400 mg/kg/día * cinco días. |
--Categoría II: indicaciones no autorizadas en España pero avaladas científicamente en determinadas situaciones (tabla 2).
Tabla 2. Categoría II: indicaciones no autorizadas en España por la DGFPS pero avaladas científicamente en determinadas situaciones clínicas | |
| Indicaciones | Dosis |
| Episodio de descompensación grave de Miastenia gravis cuando el tratamiento habitual está contraindicado, no se tolera o no se ha obtenido respuesta al mismo | 400 mg/kg * cinco días. |
| Polineuropatía desmielinizante inflamatoria crónica | 400 mg/kg/día * cinco días. |
| Profilaxis de las infecciones en neonatos de menos de 1.500 mg de peso al nacer | No establecida. |
| Anemia hemolítica autoinmune cuando el tratamiento habitual está contraindicado, no se to tolera o no se ha obtenido respuesta al mismo | Variable. |
| Neutropenias inmunes cuando el tratamiento habitual está contraindicado, no se tolera o no se ha obtenido respuesta al mismo | Variable. |
| Trombocitopenia neonatal aloinmune grave cuando el tratamiento habitual está contraindi cado, no se tolera o no se ha obtenido respuesta al mismo | Variable. |
| Aplasia pura de células rojas con infección confirmada por Parvovirus B19 y anemia severa | Variable. |
| Trombocitopenia refractaria a transfusiones sanguíneas de base inmunitaria cuando el tratamiento habitual está contraindicado, no se tolera o no se ha obtenido respuesta al mismo | Variable. |
| Púrpura postransfusional grave | 400 mg/kg * cinco días. |
| Dermatomiositis cuando el tratamiento habitual está contraindicado, no se tolera o no se ha obtenido respuesta al mismo | 1-2 g/kg/día * dos días/mes durante seis meses. |
| Polimiositis en enfermedad aguda resistente o cuando el tratamiento habitual está contra indicado | 1-2 g/kg/día * dos días/mes durante cuatros meses. |
| Trasplante de órganos sólidos donante CMV, receptor CMV+ | Variable. |
| Epilepsia intratable en pediatría | Variable. |
| Síndrome de vasculitis sistémica cuando el tratamiento habitual está contraindicado, no se tolera o no se ha obtenido respuesta al mismo | 400 mg/kg/día * cinco días. |
| Síndrome de lupus eritematoso cuando el tratamiento habitual está contraindicado, no se tolera o no se ha obtenido respuesta al mismo | 400 mg/kg/día * cinco días. |
--Categoría III: indicaciones no autorizadas en España y de uso cuestionable. Son indicaciones no incluidas en ninguna de las categorías anteriores, por ejemplo, trombocitopenia refractaria a transfusión de plaquetas, SIDA en adultos, etc.
RESULTADOS
Las encuestas se enviaron a 32 hospitales, de los que contestaron 24 (75%), siendo 22 de ellos consumidores de IgIV. Hay que advertir que en los regionales en dos casos sólo dispusimos de los datos de alguno de los hospitales que lo forman. Los datos de consumo recogidos correspondieron al 62% de las camas totales durante 1997 de los hospitales encuestados y al 65% de las estancias. En la tabla 3 se recogen los datos de participación para cada tipo de hospital (siguiendo la clasificación del sistema INHIOS)
Tabla 3. Participación según el tipo de hospital | ||
| Tipo de hospital | Hospitales encuestados | Hospitales participantes |
| Comarcal | 18 | 13 (72%) |
| Especialidades | 19 | 18 (89%) |
| Regional | 15 | 13 (60%) |
| Total | 32 | 24 (75%) |
En la tabla 4 se reflejan los datos referentes a la existencia de modelos especiales de petición, criterios de uso aceptados por la Comisión de Farmacia y Terapéutica y seguimiento del cumplimiento de los mismos. Se observa escaso control en la dispensación de IgIV y poco seguimiento de su uso.
Tabla 4. Control de la dispensación según el tipo de hospital | ||||||
| Tipo de hospital | Modelo especial de petición de IgIV | Protocolo de uso de IgIV | Control y seguimiento | |||
| n | % | n | % | n | % | |
| Comarcal | 2 | 18 | 1 | 19 | 1 | 9 |
| Especialidades | 2 | 25 | 2 | 25 | 0 | 0 |
| Regional | 1 | 33 | 1 | 33 | 0 | 0 |
| Total | 5 | 23 | 4 | 18 | 1 | 5 |
El consumo medio de IgIV durante 1997 en los hospitales participantes fue de 2,76 g/100 estancias-día (DE = 3,21). En la tabla 5 se detallan estos datos para cada tipo de hospital.
Tabla 5. Consumo medio de IgIV en 1997 según el tipo de hospital | |
| Tipo de hospital | G/100 estancias días (media ± DE) |
| Comarcal | 1,10 ± 1,19 |
| Especialidades | 3,18 ± 1,97 |
| Regional | 8,83 ± 4,78 |
| Total | 2,76 ± 3,21 |
En el estudio de indicación-prescripción, durante el período estudiado recibieron IgIV 175 pacientes, de los que 91 (52%) fueron hombres y 84 (48%) mujeres. El 36% de los tratamientos correspondieron a niños menores de catorce años.
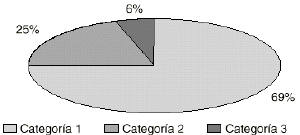
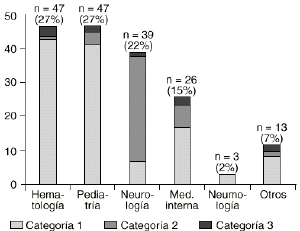
En la figura 1 aparece la distribución de los tratamientos en función de la categoría de la indicación. En la tabla 6 se muestra el número de tratamientos clasificados según el servicio prescriptor y la categoría de la indicación. Estos mismos datos se presentan de forma más gráfica en la figura 2.
Figura 1.--Distribución de las indicaciones por categorías.
Figura 2.--Distribución de los tratamientos por servicios y categorías de las indicaciones.
Tabla 6. Distribución de las indicaciones por categorías en cada servicio (n = 175) | ||||
| Servicio | Total | Categoría 1 | Categoría 2 | Categoría 3 |
| Hematología | 47 | 43 (91%) | 1 (2%) | 3 (7%) |
| Pediatría | 47 | 41 (87%) | 4 (9%) | 2 (4%) |
| Neurología | 39 | 7 (18%) | 31 (79%) | 1 (3%) |
| Medicina interna | 26 | 17 (65%) | 7 (27%) | 2 (8%) |
| Neumología | 3 | 3 (100%) | 0 ( | 0 ( |
| Tocoginecología | 2 | 2 (100%) | 0 ( | 0 ( |
| Nefrología | 2 | 1 (50%) | 0 ( | 1 (50%) |
| Alergia | 2 | 2 (100%) | 0 ( | 0 ( |
| Otros | 7 | 5 (72%) | 1 (14%) | 1 (14%) |
| Total | 175 | 121 (69%) | 44 (25%) | 10 (6%) |
En la tabla 7 aparecen las indicaciones más frecuentes para las que se utilizaron durante este período las IgIV, con el número de tratamientos para cada una de ellas, la media de las dosis conocidas y el número de dosificaciones correctas e incorrectas.
Tabla 7. Indicaciones más frecuentes y dosificaciones | |||||
| Indicación | N.° de pacientes | Dosis conocida | Dosis (mg/kg/d) media ± DE | Dosis correcta | Dosis incorrecta |
| PTI | 37 | 20 | 201,5 ± 75,1 | 0 | 20 |
| Neuropatía desmielinizante crónica | 23 | 21 | 252,6 ± 40,2 | 0 | 21 |
| SIDA en pediatría | 21 | 21 | 267,1 ± 51,1 | 0 | 21 |
| Inmunodeficiencia común variable | 17 | 10 | 1469,3 ± 300,8 | 4 | 16 |
| Síndrome de Guillen-Barré | 9 | 8 | 269,3 ± 30,2 | 0 | 18 |
| Leucemia linfática crónica | 10 | 9 | 1412,4 ± 371,9 | 2 | 17 |
| Epilepsia intratable en pediatría | 6 | 6 | 1691,2 ± 355,2 | -- | -- |
| Enfermedad de Bruton | 5 | 5 | 270,2 ± 81,2 | 4 | 11 |
| Síndrome lupus eritematoso | 5 | 5 | 256,8 ± 42,9 | 0 | 15 |
| Profilaxis, infecciones y EICH post-TMO | 4 | 4 | 221,8 ± 46,9 | 0 | 14 |
| Miastenia gravis | 4 | 3 | 278,7 ± 33,2 | 0 | 13 |
| Ataxia-teleangiectasia | 2 | 1 | 265 ± 01 | 1 | 10 |
| Dermatomiositis activa grave | 2 | 2 | 249,0 ± 4,21 | 0 | 12 |
| Isoinmunización RH | 2 | 2 | 11477 ± 16,3 | 0 | 12 |
| Miopatía inflamatoria | 2 | 0 | -- | -- | -- |
| Síndrome de Kawasaki | 2 | 1 | 51 ± 0 | 0 | 11 |
| Inmunodeficiencia congénita | 2 | 2 | 1254 ± 0,7 | 0 | 12 |
| PTI: púrpura trombocitopénica idiopática. EICH: enfermedad de injerto contra el huésped. TMO: trasplante de médula ósea. | |||||
El coste de las IgIV no se analizó por existir en Andalucía un programa de autoabastecimiento de derivados del plasma humano, que se desarrolla desde la red de centros de transfusión y que suministra estos productos a los hospitales a precio cero.
DISCUSIÓN
Dado el nivel de participación, los resultados obtenidos los podemos considerar representativos de los hospitales públicos andaluces en general.
De los resultados se desprende que las IgIV son medicamentos con poco control en su dispensación, pues si bien en el 23% de los casos (cinco de los 22 hospitales participantes consumidores de IgIV) se exige modelo especial para su petición, sólo el 18% (cuatro hospitales) tienen unos criterios de utilización aprobados por la Comisión de Farmacia y Terapéutica y sólo en el 5%, un único hospital, se hace un seguimiento del cumplimiento de estos criterios.
Al analizar los datos de consumo anual vemos cómo éste aumenta al aumentar la complejidad de los hospitales, lo que es lógico debido a que las patologías para las que se utilizan estos medicamentos muchas veces son tratadas en hospitales más especializados.
Las indicaciones para las que se utilizaron se adaptan en un 69% (n = 121) a las autorizadas en España. Esta cifra es intermedia de la obtenida en otros estudios de utilización de IgIV (2-4). En esta categoría destaca la púrpura trombocitopénica idiopática (PTI), con 37 de los 175 tratamientos recogidos (21%), seguido de SIDA en pediatría (12%), inmunodeficiencia común variable (10%), síndrome de Guillen-Barré (5%) e hipoganmaglobulinemia secundaria en pacientes con leucemia linfocítica crónica (5%). Es de destacar que en los casos de Guillen-Barré a ningún paciente se le sometió previamente a plasmaféresis, prefiriendo el uso de IgIV por su mayor facilidad de administración, lo que concuerda con otros estudios (2).
De las indicaciones no aprobadas en España pero admitidas por la bibliografía científica (25%) (n = 44) destaca la neuropatía desmielinizante crónica con 23 casos (13% del total de tratamientos), la epilepsia intratable en pediatría (3%) y el síndrome de lupus eritematoso (3%).
Las indicaciones de IgIV incluidas en la tercera categoría representan el 6% (n = l0) de las prescripciones. Normalmente son patologías en las que no existen estudios controlados y bien diseñados, por lo que no se recomienda su uso, pero en la mayoría de los casos se trata de pacientes refractarios a los tratamientos convencionales.
El uso de IgIV en indicaciones de las categorías dos y tres, al no estar autorizadas en España, debe de hacerse como medicamentos de uso compasivo, entendiendo como tal «la utilización en pacientes aislados y al margen de un ensayo clínico, de especialidades farmacéuticas para uso en indicaciones distintas a las autorizadas, cuando el médico, bajo su exclusiva responsabilidad, considera indispensable su utilización» (5).
Los servicios más prescriptores de IgIV fueron hematología, pediatría, neurología y medicina interna. De éstos los que más se ajustaron a las indicaciones autorizadas en España fueron hematología y pediatría, siendo neurología la que presentó mayor porcentaje de indicaciones de la categoría dos, fundamentalmente debido a la neuropatía desmielinizante crónica, que según hemos comentado fue la segunda indicación más frecuente.
La dosis administrada por kg de peso sólo se pudo calcular para el 79,5% de los tratamientos debido a la falta de datos. Llama la atención los pocos tratamientos en los que la dosis podría considerarse correcta. En la mayoría de los casos se observó una infradosificación con respecto a las dosis recomendadas.
La falta de criterios de calidad en cuanto a las indicaciones y dosificaciones puede estar relacionado con el escaso control y seguimiento que se hace de estas dispensaciones desde el servicio de farmacia y desde la Comisión de Farmacia y Terapéutica. Así, hay trabajos que relacionan la implantación de un modelo especial para la prescripción de IgIV con un cambio en los hábitos de prescripción, lo que se refleja en el consumo (6).
Concluimos indicando lo siguiente:
--Es necesario elaborar protocolos consensuados que recojan los criterios de utilización de IgIV y el seguimiento por parte del servicio de farmacia, para que indicaciones y dosificaciones se ajusten a las establecidas.
--Se necesita una política activa de intervención en el uso de IgIV que corrija las desviaciones detectadas.
--Los tratamientos para indicaciones no autorizadas por la DGFPS deben solicitarse siempre como medicamentos compasivos e informar de los resultados obtenidos para que puedan usarse como base de datos para una posible ampliación de las indicaciones autorizadas.
--Los estudios multicéntricos de utilización de medicamentos se muestran una vez más como una vía para conocer los hábitos generales de prescripción y poder tomar medidas si éstos resultan ser incorrectos.
BIBLIOGRAFÍA
1.Vallejo I, Socias MS, López C, Mangues I, Marín IF, Sacristán MP, Millán R, Molero R. Inmunoglobulinas de administración intravenosa. Actualización de sus indicaciones. Farm Hosp 1999;23:
2.Mangues I, Vallés R, Ferrer A, Fernández A, Llop JM, Ibars M. Indicaciones de uso inmunoglobulinas intravenosas en un hospital universitario. XLI Congreso de la Sociedad Española de Farmacia Hospitalaria. Sevilla; 1996.
3.Artacho S, Marín MC, Martín R, Miguel M. Evaluación del uso de imunoglobulinas intravenosas en un hospital general. Farm Hosp 1998;22:70-5.
4.Gol V, Alonso P, Montoro JB. Análisis de la utilización de inmunoglobulinas intravenosas en un hospital de tercer nivel. XLII Congreso de la Sociedad Espanola de Farmacia Hospitalaria. Santiago de Compostela; 1997.
5.Ministerio de Sanidad y Consumo. Real Decreto 561/1993, de 16 de abril, art. 23. BOE de 13 de mayo de 1993.
6.Sánchez A, Gimeno MJ, Acosta P, Tarín MJ, Alférez I, Ortega JM. Inmunoglobulinas intravenosas inespecí-ficas: impacto de un impreso de solicitud en su utili-zación. XLII Congreso de la Sociedad Española
de Farmacia Hospitalaria. Santiago de Compostela; 1997.
LISTA DE COLABORADORES
Hospital Torrecárdenas (Almería)
Doctores M.a José Tarín, José M.a Villegas Aranda y Esther Fernández Iglesias.
Hospital de Poniente (Elegido, Almería)
Doctora Trinidad Moreno Díaz.
Hospital La Inmaculada (Huercal-Overa, Almería)
Doctor Antonio Miguel García Fernández.
Hospital del SAS de Jerez (Jerez, Cádiz)
Doctores M.a Asunción Almendral Vicente, M.a Teresa Gómez de Travacedo y Calvo, Manuel Lobato Ballesteros y Víctor Márquez Cañizares.
Hospital de Puerto Real (Puerto Real, Cádiz)
Doctores Carmen Martínez Díaz y Juan Manuel Borrero Rubio.
Hospital de La Línea (La Línea de la Concepción, Cádiz)
Doctores Margarita Beltrán García y José Ramón Ávila Álvarez.
Hospital Valle de los Pedroches (Pozoblanco, Córdoba)
Doctores M.a de la O Caraballo Camacho, Concha Álvarez del Hoyo y Máximo Cobos Marín.
Hospital Virgen de las Nieves (Granada)
Doctores Jorge Hernández Magdalena, Miguel Ángel Calleja Hernández y Marta Gómez Espárrago.
Hospital San Cecilio (Granada)
Doctoras M.a Carmen Malo Poyatos, M.a Soledad Socias Manzano, M.a Jesús Arias Muñoz y Manuela Márquez Ferrando.
Hospital General Básico de Motril (Motril, Granada)
Doctor Marcos Camacho Romera.
Hospital General Básico de Baza (Baza, Granada)
Doctores M.a Carmen Marín Guzmán y Antonio Miguel García Fernández.
Hospital Juan Ramón Jiménez (Huelva)
Doctores M.a Teresa Garrido Martínez, José M.a Cremades Molina, Lucrecia García Martínez, M.a Carmen Hermoso Martínez, Emilio Campos Dávila, Salvador Grutzmancher Sáez y Ascensión López San Román.
Hospital Infanta Elena (Huelva)
Doctora M.a Antonia Bolívar Raya.
Hospital GE Ciudad de Jaén (Jaén)
Doctores M.a Antonia Mora Mora, Trinidad Vilchez Medina, Aurora Zamora Ardoy, Juan Francisco Marín Pozo y Rosa Millán García.
Hospital Princesa de España (Jaén)
Doctoras Isabel Caba Porras y Florentina Hornos Ureña.
Hospital San Agustín (Linares, Jaén)
Doctoras M.a Trinidad Cantal Sánchez y Guadalupe Fernández Martínez.
Hospital San Juan de la Cruz (Ubeda, Jaén)
Doctoras Teresa Ruiz-Rico Ruiz-Morón y M.a José García Ruiz.
Hospital Carlos Haya (Málaga)
Doctoras Carmen Gallego Fernández y Gloria Hernández Hernández.
Hospital Virgen de la Victoria (Málaga)
Doctoras Rosa Garrido Fernández y Rosario Mora Santiago.
Hospital HB de Antequera (Antequera, Málaga)
Doctor Victoriano Padilla Marín.
Hospital de la Axarquía (Velez Málaga, Málaga)
Doctora M.a José Barbero Hernández.
Hospital Costa del Sol (Marbella, Málaga)
Doctora Isabel M.a Escudero Santos.
Hospital Virgen del Rocío (Sevilla)
Doctores Javier Bautista Paloma, Pablo Quintero García y Concha Álvarez del Vago.
Hospital de Valme (Sevilla)
Doctora M.a Jesús Gómez Belver.