Describir, en pacientes sometidos a cirugía colorrectal (CCR), la farmacocinética de una dosis única preoperatoria de metronidazol 1.500 mg más gentamicina 240 mg como pauta profiláctica, y estimar su efectividad de acuerdo con parámetros subrogados farmacodinámicos y microbiológicos.
MétodoTreinta y seis pacientes sometidos a CCR aceptaron su participación en el estudio. De cada uno de ellos se tomaron tres muestras de sangre: Cmáx, 15 min tras finalizar la infusión de la mezcla, CfinIQ al finalizar la cirugía, y Cmín entre las 12 y 24 h posteriores a la administración. Se determinaron las concentraciones de metronidazol y gentamicina en cada muestra y se estimaron los parámetros farmacocinéticos (Vd: volumen de distribución, Cl: aclaramiento plasmático). Para el metronidazol, se consideraron efectivas concentraciones superiores a 8 μg/ml, y para la gentamicina, Cmáx superiores a 9 μg/ml y cocientes de inhibición superiores a 8.
ResultadosTodas las concentraciones de metronidazol, tanto CmáxMTZ como CfinIQMTZ fueron superiores a 8 μg/ml, y todas las CmáxGEN, superiores a 9 μg/ml. El CIGEN fue de 13,8±3,8, con ningún valor individual inferior a 8. Para el metronidazol, se estimó un Vd de 0,68±0,2l/kg y un Cl de 3,15±1,20l/h, y para la gentamicina, el Vd fue de 0,23±0,06l/kg, y el Cl, de 4,71±1,95l/h.
ConclusiónEn pacientes sometidos a CCR la intervención quirúrgica no modifica significativamente la farmacocinética del metronidazol y la gentamicina respecto a otros grupos de pacientes. La profilaxis en dosis única prequirúrgica permite alcanzar, para ambos antimicrobianos, concentraciones de magnitud suficiente para garantizar su efectividad clínica.
To describe, in patients undergoing colorectal surgery (CRS), the pharmacokinetics of a single, prophylactic preoperative dose of 1,500 mg of metronidazole plus 240 mg gentamicin and measure its efficacy in accordance with the accepted pharmacodynamic and microbiological parameters.
MethodThirty-six patients undergoing CRS agreed to participate in the study. Three blood samples were taken from each. Cmax 15 minutes after finishing the infusion of the mixture, CfinIQ on finishing the surgery, and Cmin between 12 and 24 hours post-administration. The concentrations of metronidazole and gentamicin in each simple were measured and the pharmacokinetic parameters were estimated (dV- distribution volume, Cl-plasma clearance). For the metronidazole, concentrations in excess of 8 μg/ml were considered effective, and for gentamicin, Cmax in excess of 9μg/ml and inhibition quotients above 8.
ResultsAll the concentrations of metronidazole, both CmaxMTZ and CfinIQMTZ were above 8μg/ml and all the CmaxGEN in excess of 9μg/ml. The CIGEN was 13.8±3.8, with no individual value below 8. For the metronidazole, a dV of 0.68±0.2l/kg was estimated and a Cl of 3.15±1.20 l/h and for the gentamicin, the dV as 0.23±0.06 l/kg and the Cl was 4.71±1.95 l/h.
ConclusionIn patients undergoing CRS, surgical intervention did not significantly modify the pharmacokinetics of metronidazole or gentamicin in comparison with other groups of patients. The prophylaxis using a single, pre-surgical dose enables the achievement, for both antimicrobial agents, concentrations of a sufficient size to guarantee clinical efficacy.
La aparición de antimicrobianos de semivida moderadamente larga y espectro antibacteriano amplio ha impulsado la incorporación de la profilaxis antibiótica quirúrgica en dosis única en la práctica asistencial. Entre las ventajas potenciales de este esquema terapéutico cabe citar la disminución del coste asociado, la reducción de los efectos adversos y la minimización del riesgo ecológico de desarrollar resistencias bacterianas. Para asegurar concentraciones plasmáticas y tisulares adecuadas durante toda la intervención quirúrgica, la profilaxis antibiótica en dosis única requiere la administración de dosis elevadas dentro de las dos horas previas al inicio de la intervención quirúrgica1-4.
La cirugía colorrectal (CCR) se considera limpia-contaminada o contaminada dependiendo del tipo de operación. La tasa de infección posquirúrgica, con profilaxis antibiótica, es del 11,1%, valorando conjuntamente la CCR programada (CCRP) y la urgente (CCRU). La mortalidad en el periodo posquirúrgico oscila entre el 0,9% para los pacientes menores de 65 años y el 8,1% para los mayores de 85 años en CCRP3,5-11.
Los antimicrobianos utilizados en profilaxis para CCR, tanto en dosis única como en dosis múltiple, deben cubrir un espectro amplio de bacterias potencialmente causantes de infección posquirúrgica, principalmente anaerobios y enterobacterias gramnegativas. La combinación de un antibiótico activo frente a anaerobios, como el metronidazol, con un antibiótico activo frente a gram negativos, como la gentamicina, es la base de muchos protocolos asistenciales2,3,5,12. El metronidazol y la gentamicina son bactericidas frente a microorganismos anaerobios y aerobios gram-negativos sensibles respectivamente. Ambos ejercen un efecto concentración dependiente y presentan un efecto postantibiótico superior a 3 h. Estas propiedades condicionan que su mayor efectividad se logre mediante el empleo de dosis altas con una frecuencia baja de administración13,14. A diferencia de otros antibióticos concentración dependientes, no existe para el metronidazol una relación definida entre las concentraciones séricas o tisulares y la Concentración Mínima Inhibitoria (CMI) que garantice, o al menos prediga, la efectividad "in vivo". Según el summary of antimicrobial susceptibility test results de la Universidad de Duke15, concentraciones superiores a 8 μg/ml son activas frente al 100% de las cepas de Bacteroides spp.. En este mismo sentido, Credito et al observaron que concentraciones de metronidazol 4 veces superiores a la CMI eran bactericidas en 24 h frente al 100% de las cepas de anaerobios ensayadas, incluyendo Bacteroides spp., y frente al 80% en 48 h para CMI entre 0,03 y 2 μg/ml16. Por otra parte, de acuerdo con el último consenso propuesto por el comité nacional para los estándares de laboratorios clínicos en Estados Unidos de América17 (NCCLS 2005), y el summary of antimicrobial susceptibility test results de la Universidad de Duke15, el valor umbral de sensibilidad de los microorganismos ensayados (enterobacterias, Pseudomonas aeruginosa y otros gram-negativo no enterobacterias, Staphylococcus spp. y Enterococcus) para la gentamicina es de 4 μg/ml. Este valor podría considerarse muy conservador respecto a la práctica clínica habitual, entorno en el que la CMI oscila entre 0,5 y 1,2 μg/ml para los mismos microorganismos, excepto Entorococcus faecalis, cuya CMI se encuentra entre 4 y 16 μg/ml18-21. Este valor resulta clave desde un punto de vista farmacodinámico, ya que el cociente inhibitorio (CI), predictor de la actividad antibacteriana, se define como la relación entre la concentración máxima de antibiótico (CmáxGEN) y la CMI (CI = Cmáx / CMI) y se asocia con la efectividad clínica de la gentamicina. Particularmente, para obtener una respuesta bactericida superior al 90% (CMI90), se estima necesario un CIGEN ≥ 8-10, mientras que un ratio de 4 obtiene una respuesta bactericida del 70%. En cualquier caso, superar estos cocientes requiere necesariamente la administración de dosis elevadas de gentamicina, que permitan obtener CmáxGEN superiores a los 20 μg/ml21-23.
Este estudio pretende estimar los parámetros farmacocinéticos del metronidazol y la gentamicina en pacientes sometidos a CCRP, e intentará demostrar que la administración profiláctica de una dosis única preoperatoria de la mezcla de metronidazol 1.500 mg y gentamicina 240 mg por vía i.v. presenta un perfil farmacocinético que garantiza su efectividad de acuerdo con parámetros subrogados farmacodinámicos y microbiológicos.
MÉTODOSDiseño del estudio y pacientesSe trata de un estudio prospectivo, aprobado por el Comité Ético de Investigación Clínica del Hospital, sobre una cohorte de 36 pacientes (58% varones) intervenidos de CCRP no laparoscópica por un mismo equipo quirúrgico durante el año 2001, y que recibieron como pauta antibiótica profiláctica una dosis única de 1.500 mg de metronidazol más 240 mg de gentamicina. Para cada paciente, esta mezcla se preparó en la unidad centralizada de mezclas i.v., y se dispensó individualizadamente a través del sistema de dispensación de medicamentos en dosis unitarias del servicio de farmacia. La administración se realizó en 15 min durante la fase de inducción anestésica previa a la cirugía.
Los sujetos candidatos a participar en el estudio cumplieron los siguientes criterios de inclusión: a) pacientes de ambos sexos, con edades comprendidas entre 18 y 90 años, b) incluidos en el protocolo de CCRP del servicio de cirugía del hospital, c) sin tratamiento antibiótico en las 48 h previas a la intervención, y d) que otorgaron su consentimiento informado tras haber recibido información adecuada sobre el protocolo de estudio. No se incluyó en el estudio ningún sujeto que presentara alguno de los siguientes criterios de exclusión: a) alergia demostrada a antibióticos aminoglucósidos y/o nitroimidazoles, b) pacientes embarazadas, c) aclaramiento de creatinina sérica (Clcrs) inferior a 20 ml/min, d) pacientes en tratamiento con 5-Fluorouracilo, e) enolismo crónico y f) no cumplir alguno de los criterios de inclusión. Los sujetos pudieron abandonar el estudio a petición propia o de su representante legal, o a criterio del investigador, cuando se consideró que la continuación del sujeto en el estudio iba en detrimento de su calidad asistencial y/o de su calidad de vida. Con estos criterios, un paciente no consintió su participación en el estudio y dos pacientes no se evaluaron por anulación de la intervención quirúrgica programada.
Toma de muestrasDe cada uno de los participantes se recogieron, mediante venopunción, tres muestras de sangre periférica (volumen mínimo 1 ml) a los siguientes tiempos: 15 min tras la administración de la mezcla antibiótica (muestra 1, equivalente a la Cmáx), al finalizar la intervención quirúrgica (muestra 2), y entre las 12 y las 24 h posteriores a la administración de la mezcla antibiótica (muestra 3, equivalente a la Cmín). El inicio de la administración de la mezcla antibiótica siempre se realizó en la hora inmediatamente anterior al inicio de la intervención quirúrgica, de forma que los Cmáx se extrajeron, bien inmediatamente antes del inicio de la cirugía, bien en los primeros minutos de iniciada.
Técnicas analíticasLa detección y cuantificación de metronidazol en suero se realizó mediante una técnica de cromatografía líquida de alta resolución (CLAR) en fase inversa. Se utilizó un equipo cromatográfico Merck-Hitachi®, provisto de una bomba modelo L-6200", detector UV-VIS L-4250 y registrador integrador D-2500". Todos los reactivos utilizados fueron de calidad para análisis, empleándose para la preparación de fase móvil disolventes específicos de grado "HPLC". El metronidazol utilizado en la preparación de estándares y el tinidazol utilizado como patrón interno fueron suministrados por Sigma Chemical®. Como fase estacionaria apolar se utilizó una columna LichroCART® 125-4 RP-18 de 12,5 cm de longitud y 5 μim de diámetro de partícula interna, con relleno de octadecilsilano (C-18) y por un cartucho o precolumna purificadora de iguales características (LichroCART® 4-4 guard colum, RP-18 [5 μm]), suministrados por Merck KGaA®. La fase móvil la constituyó una solución de acetonitrilo:agua 15:85 v/v, pH = 6.3.
Las muestras séricas se obtuvieron por centrifugación de sangre total a 5400 r.p.m. durante 7 min. Se tomaron 900 μl de muestra, a los que se adicionaron 100 μl de la disolución de patrón interno (tinidazol 100 μg/ml en suero libre de metronidazol y tinidazol) y se agitaron durante un minuto en "Vortex-Mixter". Se tomaron 800 μl de la mezcla anterior y se adicionaron a un cartucho de extracción proteínica por ultrafiltración Cetrifree®, de Millipore®. Tras centrifugación de las muestras a 3.700 r.p.m. durante 25 min, se obtuvo una elución de ultrafiltrado que pudo inyectarse directamente en el sistema cromatográfico. El volumen de muestra inyectada en el sistema cromatográfico se limitó a 20 μl mediante un bucle de dicha capacidad. El flujo de elución fue de 1 ml/min y la detección se realizó a una longitud de onda de 318 nm. Cada una de las muestras se procesó por duplicado.
A partir de muestras de suero humano libre de metronidazol y tinidazol se prepararon las rectas de calibración, a concentraciones fijas de tinidazol (10 μg/ml) y variables de metronidazol (entre 1 y 100 μg/ml). Se estudió la linealidad de la técnica para las relaciones entre las áreas de los picos de metronidazol y tinidazol y la concentración de metronidazol mediante regresión lineal simple. La recuperación de la técnica se calculó como porcentaje, y la reproducibilidad, interdía e intradía, como coeficiente de variación (CV) en porcentaje (100-[Desv.estandar/valor medio]). Se calculó el límite de detección (LD) del método analítico, en μg/ml, a partir del error estándar (EE) asociado a la pendiente (m) y a la ordenada en el origen (b) de la recta de calibración de acuerdo con el criterio 3s (3-EEm/b).
La determinación de la concentración de gentamicina en suero se efectuó mediante una técnica de inmunofluorescencia polarizada (AsXYM®, Abbott Diagnostic Division). Dado que la técnica goza de buena sensibilidad y especificidad y de que se trata de una técnica automatizada, las muestras de gentamicina se procesaron una sola vez.
Análisis farmacocinéticoLos parámetros farmacocinéticos de metronidazol y gentamicina se estimaron mediante el ajustado a un modelo cinético monocompartimental empleando un método iterativo en dos etapas, la primera de ellas mediante regresión no lineal y la segunda mediante un modelo bayesiano, utilizando la aplicación informática Abbotbase Pharmacokinetic System® versión 1.1. Se calcularon, para cada paciente, el aclaramiento plasmático (Clp), la semivida de eliminación (t1/2) y el volumen aparente de distribución (Vd) de ambos fármacos.
Modelo farmacocinético-farmacodinámico (FC-FD). Parámetros subrogados de efectividad del tratamiento antibióticoPara el metronidazol no se ha definido el intervalo terapéutico usual. En este estudio, se evaluó la efectividad potencial del antibiótico como la relación entre las concentraciones plasmáticas (CMTZ) individuales y el límite de sensibilidad para los patógenos más frecuentes, establecido por Credito et al en una CMI inferior o igual a 2 μg/ml16. De acuerdo con el criterio de estos autores, se consideraron potencialmente efectivas CMTZ superiores a 8 μg/ml, es decir, cuatro veces superiores a la CMI de 2 μg/ml.
Para la gentamicina, se evaluó el cociente de inhibición (CIGEN) de cada paciente, calculado como el cociente entre la CmáxGEN y una CMI de 1,2 μg/ml (límite superior de sensibilidad en la práctica clínica). Se consideran potencialmente efectivos CIGEN ≥ 8. Asimismo, se evaluaron para la gentamicina, como criterio subrogado de efectividad, las CmáxGEN, de forma que se consideran efectivos valores superiores a 9 μg/ml24-26.
Análisis estadísticoLa comparación de variables cuantitativas independientes que cumplen los supuestos de la ley normal y la homogeneidad de varianzas se efectuó mediante la prueba t-Student. Si alguno de estos supuestos no se cumplió, se aplicó la prueba no paramétrica U Mann-Whitney, con independencia del número de casos, por tratarse de una prueba más conservadora que la t-Student en muestras grandes (> 30 casos) que no cumplen la ley normal. Las correlaciones entre los valores de aclaramiento y volumen de distribución se estimaron mediante el coeficiente de correlación de Pearson (r). En todas las pruebas se consideró una significación alfa de 0,05.
RESULTADOSLa figura 1 muestra el cromatograma del metronidazol en una muestra patrón de suero, obtenido tras aplicar la metodología descrita. El método proporciona una separación adecuada y completa del resto de las sustancias presentes en las muestras sanguíneas de los pacientes. El empleo en la preparación de la muestra de filtros especialmente diseñados para separar ultrafiltrados exentos de proteínas plasmáticas ha permitido conseguir recuperaciones no inferiores en ningún caso al 96%. Los valores de los coeficientes de correlación obtenidos en las rectas de calibración, con ordenada en el origen y sin ella, son superiores a 0,999, confirmando una excelente linealidad entre las áreas de los picos cromatográficos y las concentraciones de metronidazol. Respecto a la precisión del método analítico del metronidazol, cabe destacar que el CV intradía no fue superior al 2% para ninguna concentración ensayada, mientras que en el ensayo interdía siempre fue inferior al 5%. Destaca igualmente la sensibilidad de la técnica, que permite cuantificar concentraciones de metronidazol de hasta 0,41 μg/ml, valor muy inferior a las concentraciones séricas que aparecen entre las 12 y las 24 h postadministración, cuyo valor medio es de 8,45 μg/ml.
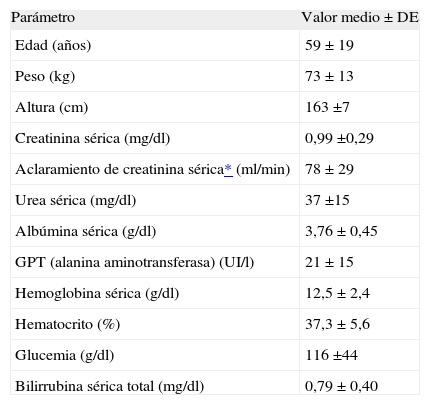
En la tabla 1 se recogen los valores antropométricos y analíticos medios prequirúrgicos de los 36 pacientes reclutados. La duración media de las intervenciones quirúrgicas efectuadas fue de 83 ±52 min y las intervenciones más frecuentes fueron las resecciones colónicas o rectales, efectuadas en 18 casos.
Valores antropométricos, bioquímicos y hematológicos antes de la cirugía
| Parámetro | Valor medio ± DE |
| Edad (años) | 59 ± 19 |
| Peso (kg) | 73 ± 13 |
| Altura (cm) | 163 ±7 |
| Creatinina sérica (mg/dl) | 0,99 ±0,29 |
| Aclaramiento de creatinina sérica* (ml/min) | 78 ± 29 |
| Urea sérica (mg/dl) | 37 ±15 |
| Albúmina sérica (g/dl) | 3,76 ± 0,45 |
| GPT (alanina aminotransferasa) (UI/l) | 21 ± 15 |
| Hemoglobina sérica (g/dl) | 12,5 ± 2,4 |
| Hematocrito (%) | 37,3 ± 5,6 |
| Glucemia (g/dl) | 116 ±44 |
| Bilirrubina sérica total (mg/dl) | 0,79 ± 0,40 |
DE: desviación estándar.
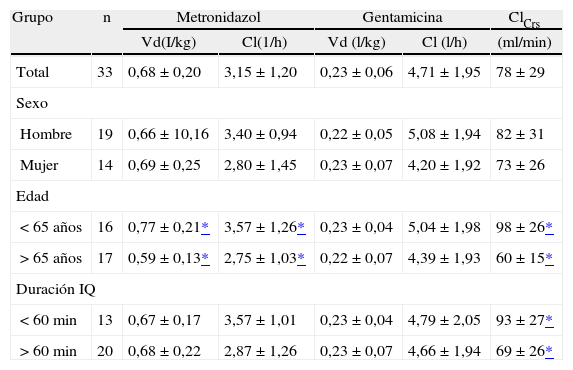
La tabla 2 muestra los parámetros farmacocinéticos medios del metronidazol y la gentamicina obtenidos. La semivida de eliminación se estimó en 11,8 ± 5,1 h para el metronidazol y en 2,3 ± 1,4 h para la gentamicina. Las correlaciones entre ClCrs y CIMTZ, y entre ClCrs y C1GEN se mostraron débiles en ambos casos (r = 0,340, r = 0,363 respectivamente). Tampoco se hallaron correlaciones significativas entre los volúmenes de distribución (VdMTZ-VdGEN, r = 0,207) y los aclaramientos de ambos fármacos (C1MTZ-C1QEN, r = 0,211). De acuerdo con el test t-Student no se apreciaron diferencias significativas en los parámetros farmacocinéticos de ambos fármacos según el sexo. Respecto a la edad, tomando como punto de corte la edad de 65 años, se observaron diferencias en el CIMTZ, el VdMTZ y en el ClCrs, no observándose este comportamiento en la gentamicina. La duración de la intervención quirúrgica no modifica significativamente los parámetros farmacocinéticos de ambos fármacos, aunque se aprecia un ClCrs significativamente menor en los pacientes sometidos a intervenciones de duración superior a una hora.
Parámetros farmacocinéticos medios del metronidazol y la gentamicina estratificados por edad, sexo y duración de la intervención quirúrgica
| Grupo | n | Metronidazol | Gentamicina | ClCrs | ||
| Vd(I/kg) | Cl(1/h) | Vd (l/kg) | Cl (l/h) | (ml/min) | ||
| Total | 33 | 0,68 ± 0,20 | 3,15 ± 1,20 | 0,23 ± 0,06 | 4,71 ± 1,95 | 78 ± 29 |
| Sexo | ||||||
| Hombre | 19 | 0,66 ± 10,16 | 3,40 ± 0,94 | 0,22 ± 0,05 | 5,08 ± 1,94 | 82 ± 31 |
| Mujer | 14 | 0,69 ± 0,25 | 2,80 ± 1,45 | 0,23 ± 0,07 | 4,20 ± 1,92 | 73 ± 26 |
| Edad | ||||||
| < 65 años | 16 | 0,77 ± 0,21* | 3,57 ± 1,26* | 0,23 ± 0,04 | 5,04 ± 1,98 | 98 ± 26* |
| > 65 años | 17 | 0,59 ± 0,13* | 2,75 ± 1,03* | 0,22 ± 0,07 | 4,39 ± 1,93 | 60 ± 15* |
| Duración IQ | ||||||
| < 60 min | 13 | 0,67 ± 0,17 | 3,57 ± 1,01 | 0,23 ± 0,04 | 4,79 ± 2,05 | 93 ± 27* |
| > 60 min | 20 | 0,68 ± 0,22 | 2,87 ± 1,26 | 0,23 ± 0,07 | 4,66 ± 1,94 | 69 ± 26* |
Cl: Aclaramiento total; Vd: volumen aparente de distribución.
La tabla 3 muestra las concentraciones séricas medias de metronidazol y gentamicina. En todos los casos, las CmáxGEN fueron superiores a 9 μg/ml, y en dieciocho de los pacientes, estas concentraciones superaron los 15 μg/ml. Respecto a la CmínGEN, en un paciente se obtuvo un valor superior a 1 μg/ml, y en ningún paciente la concentración fue superior a 2 μg/ml. Todas las concentraciones de metronidazol, tanto al finalizar la perfusión (CmáxMTZ) como al finalizar la intervención quirúrgica (CfinIQMTZ), fueron superiores a 8 μg/ml, valor cuatro veces superior al límite CMI admitido (CMI = 2 μg/ml). El valor medio del CIGEN fue de 13,8 ± 3,8, con ningún valor individual inferior a 8.
Concentraciones séricas medias de metronidazol (CMTZ) y gentamicina (CGEN)
| Muestra | text* | CMTZ (µg/ml) | CGEN (µg/ml) |
| Cmáx | 39 ± 9 min | 34,74 ±11,10 | 16,54 ±4,59 |
| Fin IQ | 119 ±47 min | 25,60 ± 8,38 | 9,46 ± 4,24 |
| Cmín | 1374 ± 108 min | 8,45 ± 4,10 | 0,44 ± 0,24 |
Diferentes combinaciones de antibióticos se han mostrado eficaces en la prevención de la infección posquirúrgica en CCR y, entre ellas, la combinación de metronidazol y gentamicina. La administración profiláctica en dosis única incorpora indudables ventajas logísticas, especialmente por cuanto facilita su preparación centralizada y garantiza la administración completa y en el momento adecuado de la mezcla antibiótica. Además, este esquema ha demostrado una efectividad similar al esquema en dosis múltiple acompañado de una reducción de costes27.
Cabría esperar, de acuerdo con las alteraciones biológicas provocadas por la cirugía, que los parámetros farmacocinéticos de ambos fármacos se vieran modificados respecto a los valores de referencia de otras poblaciones. Sin embargo, en el presente trabajo, los valores estimados de los parámetros farmacocinéticos de metronidazol y gentamicina no difieren en magnitud de los valores de referencia en pacientes adultos, sometidos o no a CCR21,24,28. No se observaron diferencias en el comportamiento cinético de la gentamicina respecto al sexo o la edad, pese a que el aclaramiento de creatinina es significativamente menor en los pacientes mayores de 65 años. Este hallazgo concuerda con la débil correlación encontrada entre el ClCrs y el ClGEN, confirmando el hecho de que el ClCrs no es necesariamente un buen predictor del aclaramiento de gentamicina29. A diferencia de la gentamicina, los pacientes menores de 65 años presentan para el metronidazol volúmenes de distribución y aclaramientos significativamente superiores a los obtenidos en los pacientes mayores de 65 años. Este mayor volumen aparente de distribución es probablemente debido a la confluencia de un menor porcentaje de grasa corporal y un mayor porcentaje de masa magra en pacientes más jóvenes, circunstancias que condicionan una difusión más rápida a tejidos y un retorno igualmente más rápido al plasma. La más rápida eliminación de metronidazol en menores de 65 años puede atribuirse a una mejor funcionalidad metabólica, dado que el aclaramiento, al igual que el de la gentamicina, no se correlacionó con el aclaramiento de creatinina.
La duración de la intervención quirúrgica en la cirugía colorrectal es muy variable, consecuencia de los diferentes procedimientos y diagnósticos que incluye. Las intervenciones inferiores a 60 min corresponden principalmente a procedimientos de cirugía menor (anal o hemorroidal), en pacientes con patología aguda y menos complicada desde el punto de vista del funcionamiento hepático o renal. Son los pacientes más jóvenes los que se someten mayoritariamente a estos tipos de cirugía más sencilla. El perfil de cirugía mayor colorrectal es el de un paciente de edad avanzada, generalmente diagnosticado de neoplasia intestinal. Es lógico, por tanto, que el aclaramiento de creatinina de los pacientes sometidos a intervenciones de duración más corta sea mayor. Este hallazgo no ha condicionado que el Vd y el Cl, tanto del metronidazol como de la gentamicina, se modifiquen significativamente con la duración de la intervención quirúrgica.
Entre los factores de los cuales depende la infección posquirúrgica en CCR se encuentran la concentración sérica de antibióticos al final de la intervención, la presencia de diabetes mellitus, los estomas y la edad avanzada del paciente24. Dado que ambos antibióticos siguen un modelo farmacocinético-farmacodinámico concentración dependiente, la efectividad de ambos dependerá fundamentalmente de las concentraciones máximas (Cmáx) que, a su vez, determinan las concentraciones al finalizar la intervención quirúrgica. El hecho de no conocer ningún valor umbral para el CI del metronidazol obliga, en la mayoría de los casos, a la estimación de su potencial efectividad comparando la magnitud de sus concentraciones con la CMI. En el presente trabajo dos hechos garantizan la cobertura del antibiótico frente a los bacilos anaerobios más frecuentes. De una parte, que la totalidad de las concentraciones de metronidazol al finalizar la intervención fueron superiores a 8 μg/ml y, de otra, que se estime en 47 h el tiempo necesario para que la concentración de metronidazol descienda por debajo de 2 μg/ml16 (valor de referencia como CMI).
En todos los pacientes la CmáxGEN superó los 9 μg/ml, sobrepasando la concentración objetivo que en la actualidad se recomienda en los esquemas de tratamiento y profilaxis con gentamicina en dosis única24-26. Asimismo, en todos los casos, las CmáxGEN medidas en el presente estudio permiten estimar, teniendo en cuenta las CMI habituales de la mayor parte de microorganismos sensibles, CI superiores a 8, exceptuando microorganismos que presentan una CMI > 4 μg/ml, en cuyo caso se cuestionaría el empleo de gentamicina. Estos valores garantizan, de forma indirecta, una adecuada actividad bactericida y efecto postantibiótico22,30.
En conclusión, se ha estudiado una muestra heterogénea de sujetos sometidos a CCRP, pero representativa de la realidad asistencial. En estos pacientes, la intervención quirúrgica no modifica significativamente la farmacocinética del metronidazol y la gentamicina respecto a otros grupos de pacientes adultos. El esquema profiláctico en dosis única de 1.500 mg de metronidazol más 240 mg de gentamicina permite alcanzar concentraciones de ambos antimicrobianos de magnitud suficiente para garantizar su efectividad clínica en términos farmacodinámicos y microbiológicos.