describir el proceso de implantación de un sistema de trazabilidad y elaboración segura de medicamentos en la sala blanca de un servicio de farmacia para incrementar la seguridad en el paciente, cumpliendo la legislación vigente.
Métodoel proceso se llevó a cabo entre septiembre de 2021 y julio de 2022. El programa informático integró todas las fases del proceso de elaboración que se recomiendan en la Guía de Buenas Prácticas de preparación de medicamentos en los Servicios de Farmacia (GBBPP). Se parametrizaron los siguientes apartados en el programa informático: personal, instalaciones, equipos, materiales de partida, material de acondicionamiento, procedimientos normalizados de trabajo y controles de calidad.
Resultadosse incluyeron un total de 50 usuarios, 4 zonas de elaboración y 113 equipos. Se parametrizaron 435 componentes (195 materias primas y 240 especialidades farmacéuticas), 54 materiales de acondicionamiento, 376 procedimientos normalizados de trabajo (123 de ellos correspondientes a medicamentos estériles y 253 a medicamentos no estériles, de los cuales 52 no estériles eran peligrosos), además 17 eran de alto riesgo, 327 de riesgo medio, 32 de riesgo bajo y 13 controles de calidad.
Conclusionesla informatización del proceso de elaboración de medicamentos ha permitido la implantación de un sistema de trazabilidad y elaboración segura de medicamentos en la sala blanca, que cumple con la legislación vigente.
To describe the process of implementing a traceability and safe drug manufacturing system in the clean room of a Pharmacy Service to increase patient safety, in accordance with current legislation.
MethodsThe process was carried out between September 2021 and July 2022. The software program integrated all the recommended stages of the manufacturing process outlined in the “Good Practices Guide for Medication Preparation in Pharmacy Services” (GBPP). The following sections were parameterized in the software program: personnel, facilities, equipment, starting materials, packaging materials, standardized work procedures, and quality controls.
ResultsA total of 50 users, 4 elaboration areas and 113 equipments were included. 435 components were parameterized (195 raw materials and 240 pharmaceutical specialties), 54 packaging materials, 376 standardized work procedures (123 of them corresponding to sterile medicines and 253 to non-sterile medicines, of which 52 non-sterile were dangerous), in addition 17 were high risk, 327 medium risk, 32 low risk, and 13 quality controls.
ConclusionsThe computerization of the production process has allowed the implementation of a traceability and secure drug manufacturing system in a controlled environment in accordance with current legislation.
El arsenal terapéutico crece cada día a la par que aumentan los conocimientos de las diferentes enfermedades, con el objeto de prevenir o tratar las mismas. Sin embargo, en ciertos casos, las presentaciones comerciales de medicamentos no satisfacen las necesidades de tratamiento, particularmente en el ámbito pediátrico. Los niños enfrentan desafíos como dificultades para tragar, enfermedades metabólicas y neurológicas que requieren de dispositivos invasivos como sondas, y dosificaciones que no se ajustan a las presentaciones disponibles1.
Para abordar estas necesidades, es necesario adaptar los medicamentos existentes a las necesidades de pacientes individuales, manteniendo altos estándares de calidad y seguridad. La legislación europea, con el Programa de Cooperación de Inspección Farmacéutica (PIC/S) Guide to good Practices for the Preparation of Medicinal Products in Healthcare Establishments2 y la normativa española, con el Real Decreto Ley 16/2012 de 20 de abril, sobre la manipulación y adecuación de preparaciones de medicamentos3 y Real Decreto 175/2001, que recoge las «normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales»4, establecen directrices para garantizar la calidad y seguridad en la preparación de medicamentos en entornos hospitalarios.
En 2014, el Ministerio de Sanidad de España publicó la Guía de buenas prácticas de preparación de medicamentos en servicios de farmacia hospitalaria (GBBPP)5, armonizando las recomendaciones existentes. La Sociedad Española de Farmacia Hospitalaria (SEFH) también emitió un documento en 2022 sobre trazabilidad y uso seguro de medicamentos en los hospitales6, destacando la mejora en la eficiencia y seguridad al aplicar la trazabilidad a través de tecnologías como la prescripción electrónica y sistemas automatizados de dispensación.
El objetivo de este estudio es describir el proceso de implantación de un sistema de trazabilidad y seguridad en el área de elaboración de medicamentos en una sala blanca de un servicio de farmacia cumpliendo con la normativa vigente.
MétodosEl proceso de implantación se llevó a cabo entre septiembre de 2021 y julio de 2022, comenzando en una primera fase en el área de preparados no estériles y en una segunda fase en el área de preparados estériles.
La parametrización del programa informático se realizó siguiendo los capítulos de la GBBPP5.
PersonalPor cada elaborador se hizo un registro de los datos personales (nombre, apellidos y DNI) y se adjudicó una categoría con un nivel de responsabilidad definido.
Instalaciones y equiposSe definieron las características de las instalaciones y las distintas áreas de elaboración de medicamentos.
Para cada equipo se creó una ficha que recogía el nombre, modelo, número de serie, fabricante, registro de revisiones y manual de usuario.
Materiales de partida y materiales de acondicionamientoPara las materias primas y especialidades farmacéuticas se definieron las siguientes características: principio activo, presentación, nombre comercial, fabricante, proveedor habitual, ficha técnica, código nacional, código de barras o código 2D del fabricante (datamatrix), conservación, ubicación, unidad contable (gramos, comprimidos, cápsulas, viales, etc.), cantidad en cada envase, dosis de cada unidad, estado físico, nivel de peligrosidad según la lista NIOSH y tipo de etiqueta.
También se definieron todos los materiales de acondicionamiento disponibles.
Preparación y procedimientos normalizados de trabajoSe parametrizaron todos los procedimientos normalizados de trabajo (PNT) de los medicamentos elaborados desde el servicio de farmacia. En cada procedimiento se registró: nombre del elaborado (principio activo, dosis o concentración y forma farmacéutica), si se trataba de un elaborado estéril o no, nivel de riesgo según la matriz de riesgo de la GBBPP, categoría del personal elaborador, zona de elaboración, equipamiento, protocolo de trabajo, grupo anatómico-terapéutico-químico (ATC), tipo de paciente al que se le dispensa, materias primas y cantidad, forma farmacéutica y vía de administración, conservación, caducidad, controles de calidad, material de acondicionamiento, excipientes de declaración obligatoria, bibliografía, autores, observaciones y validación galénica. Cada protocolo tuvo que ser validado por un farmacéutico.
Controles de calidadLos controles de calidad se parametrizaron siguiendo las recomendaciones de la GBBPP y el Formulario Nacional en función del tipo de elaborado. Se adjuntó la monografía del Formulario Nacional de los controles que estaban descritos en ella.
ResultadosPersonalSe parametrizaron un total de 50 usuarios, de los cuales 21 correspondían con el perfil de farmacéutico, 25 de enfermero, 3 de técnico de farmacia y uno de informático, cada perfil con un nivel de responsabilidad distinto.
Instalaciones y equiposSe definieron 4 zonas de elaboración: laboratorio de farmacotecnia, zona de elaboración de peligrosos orales, sala de cabinas de flujo laminar horizontal y sala de cabinas de flujo laminar vertical. De estas 4 zonas, las 2 primeras están clasificadas como clase C y las 2 últimas como clase B.
Se parametrizaron un total de 113 equipos, divididos en 6 balanzas, 5 cabinas, 11 ordenadores, 7 impresoras, 4 lectores ópticos, 33 materiales de laboratorio y 47 materiales fungibles. En cuanto a las cabinas, se registró su localización y el tipo de cabina. Se incluyeron 2 cabinas de flujo laminar vertical, 2 cabinas de flujo laminar horizontal y una cabina de bioseguridad tipo 1.
Materiales de partida y materiales de acondicionamientoSe parametrizaron 435 componentes, de los cuales 195 correspondían a materias primas y 240 a especialidades farmacéuticas. El 8,5% de los materiales de partida eran peligrosos.
Se introdujo el código datamatrix de todas las materias primas y especialidades farmacéuticas, para asegurar la trazabilidad y seguridad en el proceso de elaboración.
También se parametrizaron un total de 54 materiales de acondicionamiento.
Preparación y procedimientos normalizados de trabajoSe parametrizaron un total de 376 procedimientos normalizados de trabajo (PNT) (tabla 1), de los cuales 123 (32,7%) correspondían con elaboraciones estériles. No se incluyeron preparados estériles peligrosos debido a que la gestión de su elaboración se hace desde otro programa informático.
Número total de procedimientos normalizados de trabajo de elaboraciones no estériles clasificadas en función de la forma farmacéutica y peligrosidad
| Tipo de elaboración | Forma farmacéutica | Número de PNT revisados |
|---|---|---|
| Estériles | 123 (32,7%) | |
| No peligrosos | 123 | |
| Colirios | 10 | |
| Soluciones intradérmicas | 3 | |
| Jeringa intramuscular | 1 | |
| Soluciones intratecales | 3 | |
| Soluciones intravítreas | 5 | |
| Perfusión intravenosa | 63 | |
| Jeringas sellado de catéter | 6 | |
| Media fill test | 3 | |
| Soluciones subcutáneas | 29 | |
| No estériles | 253 (67,3%) | |
| No peligrosos | 201 (79,4%) | |
| Cápsulas orales | 4 | |
| Enema | 1 | |
| Gel tópico | 1 | |
| Jarabes | 2 | |
| Jeringas nasales | 6 | |
| Jeringas bucales | 5 | |
| Papelillos orales | 100 | |
| Parches para pruebas de alergia | 1 | |
| Pomadas tópicas | 7 | |
| Soluciones orales | 22 | |
| Suspensiones orales | 52 | |
| Peligrosos | 52 (20,6%) | |
| Cremas tópicas | 2 | |
| Papelillos orales | 7 | |
| Pastas tópicas | 1 | |
| Pomadas tópicas | 3 | |
| Soluciones orales | 16 | |
| Suspensiones orales | 23 | |
| Total | 376 |
PNT: procedimientos normalizados de trabajo.
El 67,3% eran procedimientos no estériles, de los cuales alrededor del 80% eran principios activos no peligrosos.
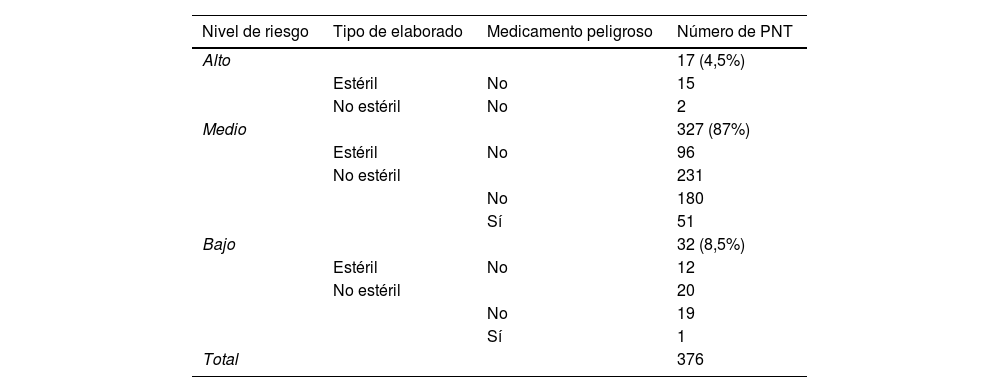
A su vez, aplicando la matriz de riesgo para preparaciones estériles y no estériles de la GBBPP, de los 376 procedimientos normalizados de trabajo parametrizados, 17 (4,5%) corresponden a un riesgo alto, 327 (87%) tienen un riesgo medio y 32 (8,5%) un riesgo bajo. En la tabla 2 se puede comprobar un desglose más detallado de los tipos de preparaciones en función del nivel de riesgo.
Número y tipo de elaboraciones en función del nivel de riesgo
| Nivel de riesgo | Tipo de elaborado | Medicamento peligroso | Número de PNT |
|---|---|---|---|
| Alto | 17 (4,5%) | ||
| Estéril | No | 15 | |
| No estéril | No | 2 | |
| Medio | 327 (87%) | ||
| Estéril | No | 96 | |
| No estéril | 231 | ||
| No | 180 | ||
| Sí | 51 | ||
| Bajo | 32 (8,5%) | ||
| Estéril | No | 12 | |
| No estéril | 20 | ||
| No | 19 | ||
| Sí | 1 | ||
| Total | 376 |
PNT: procedimientos normalizados de trabajo.
En cada PNT se registró el tipo de paciente más habitual al cual se le dispensa dicha preparación: paciente externo, paciente ingresado, almacén de farmacotecnia, almacén general, domiciliaria, paliativos, hospital de día médico, unidad de hospitalización a domicilio y hospital de día oncológico.
Controles de calidadSe registraron un total de 13 controles de calidad, los cuales debían ser realizados por parte del personal elaborador o por el farmacéutico que valida cada preparado. Como indica la GBBPP y el Formulario Nacional, en las preparaciones no estériles se debe realizar control de pH, control de aspecto final y caracteres organolépticos. En las preparaciones estériles se requiere control gravimétrico y control de limpidez y de aspecto final.
DiscusiónTodos los medicamentos que se elaboran desde los servicios de farmacia deben ser seguros y eficaces. Para ello se debe seguir la normativa española y europea dictada para tal efecto.
El farmacéutico es el responsable técnico de la preparación de medicamentos, por lo que debe tomar las acciones necesarias para que las preparaciones elaboradas sean adecuadas para su uso, seguras, eficaces y que cumplan unos estándares de calidad definidos. En este sentido, la informatización del proceso de elaboración permitirá y facilitará que se cumplan todos estos objetivos.
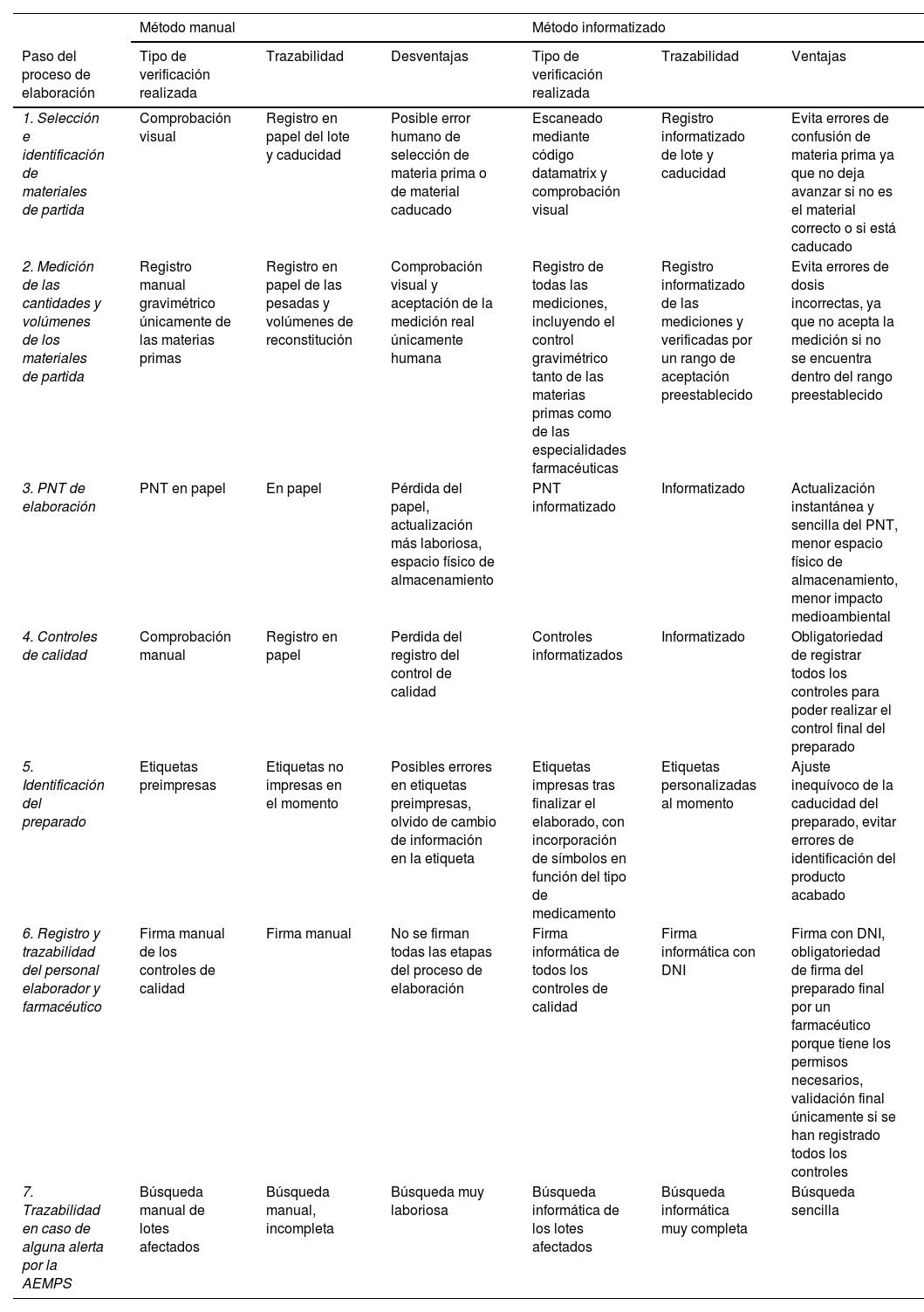
Una de las ventajas que ha permitido la informatización del área de elaboración es la completa trazabilidad del producto final elaborado, incluyendo desde la orden de elaboración hasta la validación farmacéutica final (tabla 3).
Comparación de los sistemas de elaboración y trazabilidad de los flujos de trabajo manual e informático
| Método manual | Método informatizado | |||||
|---|---|---|---|---|---|---|
| Paso del proceso de elaboración | Tipo de verificación realizada | Trazabilidad | Desventajas | Tipo de verificación realizada | Trazabilidad | Ventajas |
| 1. Selección e identificación de materiales de partida | Comprobación visual | Registro en papel del lote y caducidad | Posible error humano de selección de materia prima o de material caducado | Escaneado mediante código datamatrix y comprobación visual | Registro informatizado de lote y caducidad | Evita errores de confusión de materia prima ya que no deja avanzar si no es el material correcto o si está caducado |
| 2. Medición de las cantidades y volúmenes de los materiales de partida | Registro manual gravimétrico únicamente de las materias primas | Registro en papel de las pesadas y volúmenes de reconstitución | Comprobación visual y aceptación de la medición real únicamente humana | Registro de todas las mediciones, incluyendo el control gravimétrico tanto de las materias primas como de las especialidades farmacéuticas | Registro informatizado de las mediciones y verificadas por un rango de aceptación preestablecido | Evita errores de dosis incorrectas, ya que no acepta la medición si no se encuentra dentro del rango preestablecido |
| 3. PNT de elaboración | PNT en papel | En papel | Pérdida del papel, actualización más laboriosa, espacio físico de almacenamiento | PNT informatizado | Informatizado | Actualización instantánea y sencilla del PNT, menor espacio físico de almacenamiento, menor impacto medioambiental |
| 4. Controles de calidad | Comprobación manual | Registro en papel | Perdida del registro del control de calidad | Controles informatizados | Informatizado | Obligatoriedad de registrar todos los controles para poder realizar el control final del preparado |
| 5. Identificación del preparado | Etiquetas preimpresas | Etiquetas no impresas en el momento | Posibles errores en etiquetas preimpresas, olvido de cambio de información en la etiqueta | Etiquetas impresas tras finalizar el elaborado, con incorporación de símbolos en función del tipo de medicamento | Etiquetas personalizadas al momento | Ajuste inequívoco de la caducidad del preparado, evitar errores de identificación del producto acabado |
| 6. Registro y trazabilidad del personal elaborador y farmacéutico | Firma manual de los controles de calidad | Firma manual | No se firman todas las etapas del proceso de elaboración | Firma informática de todos los controles de calidad | Firma informática con DNI | Firma con DNI, obligatoriedad de firma del preparado final por un farmacéutico porque tiene los permisos necesarios, validación final únicamente si se han registrado todos los controles |
| 7. Trazabilidad en caso de alguna alerta por la AEMPS | Búsqueda manual de lotes afectados | Búsqueda manual, incompleta | Búsqueda muy laboriosa | Búsqueda informática de los lotes afectados | Búsqueda informática muy completa | Búsqueda sencilla |
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; DNI: documento nacional de identidad; PNT: procedimientos normalizados de trabajo.
Como fortalezas del estudio cabe destacar que los resultados obtenidos son los datos de un proceso llevado a cabo en vida real en el área de elaboración de un servicio de farmacia de un hospital. Así mismo, son los primeros datos disponibles de un proceso de informatización de elaboración segura de medicamentos en sala blanca de un servicio de farmacia español, por lo que puede ayudar a instaurar este sistema en otros servicios de farmacia.
Como limitaciones encontramos el alto coste de las tecnologías de la trazabilidad y la ausencia de códigos estandarizados de identificación, lo que implica la necesidad de reetiquetar las materias primas y especialidades farmacéuticas previo al proceso de elaboración. No se incluyeron en este sistema preparados estériles peligrosos porque no se dispone de un sistema único de trabajo en el área de elaboración.
Como conclusión, cabe destacar que la completa trazabilidad del proceso de elaboración permite tener un nivel de seguridad extremadamente alto, cumpliendo así con los estándares de calidad establecidos para la elaboración de medicamentos en los servicios de farmacia de los hospitales españoles.
Aportación a la literatura científicaLas conclusiones y los resultados obtenidos en este estudio pueden ser de utilidad como punto de partida para otros servicios de farmacia que quieran implantar un sistema de trazabilidad y elaboración segura de medicamentos en una sala blanca.
Responsabilidades éticasEl autor para correspondencia tiene el consentimiento de todos los autores para el envío y la publicación del artículo que se ha enviado para evaluar.
El artículo es original, no ha sido publicado previamente y no se ha enviado simultáneamente para su evaluación a otra revista.
El artículo no contiene material inédito copiado de otros autores sin consentimiento de estos.
FinanciaciónNinguna.
Conflicto de interesesSin conflicto de intereses.
AgradecimientosNoe González Rodríguez, cofundador y gerente en Basesoft.
Declaración de contribución de autoría CRediTMarta Echávarri de Miguel: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Funding acquisition, Formal analysis, Data curation, Conceptualization. Belén Riva de la Hoz: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Funding acquisition, Formal analysis, Data curation, Conceptualization. Margarita Cuervas-Mons Vendrell: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Funding acquisition, Formal analysis, Data curation, Conceptualization. Beatriz Leal Pino: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision. Luis Fernandez Romero: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision.