el seguimiento farmacoterapéutico (SFT) realizado por el farmacéutico clínico puede enmarcarse dentro de 3 actividades: la identificación, la resolución y la prevención de eventos adversos a medicamentos. Estas deben ajustarse a los requerimientos y los recursos de cada institución, generando la necesidad de desarrollar procedimientos que aumenten la eficiencia del SFT y garanticen la seguridad del paciente. Los farmacéuticos clínicos de la Red de Salud UC-CHRISTUS Chile desarrollamos un Proceso Estandarizado de Evaluación Farmacoterapéutica (PEEF). El objetivo principal del estudio fue evaluar el impacto de esta herramienta en términos del número de evaluaciones e intervenciones de los farmacéuticos clínicos y secundariamente determinar el ahorro de costos potenciales y directos asociados a las intervenciones en la Unidad de Cuidados Intensivos (UCI).
Métodoestudio cuasi-experimental que evaluó la frecuencia y tipo de evaluaciones e intervenciones realizadas por los farmacéuticos clínicos en unidades de pacientes adultos de la Red UC-CHRISTUS, previo y posterior a la utilización del PEEF. La distribución de variables se evaluó mediante el test Shapiro–Wilk, la asociación entre el uso del PEEF y el número de evaluaciones e intervenciones fue realizada mediante el test Chi cuadrado. La evaluación de costos asociados a las intervenciones del farmacéutico clínico en UCI se realizó utilizando la metodología propuesta por Hammond et al.10.
Resultadosel total de pacientes evaluados pre- y pos-PEEF fue de 1.781 y 2.129, respectivamente. Las evaluaciones e intervenciones en el periodo pre-PEEF fueron 5.209 y 2.246, en el periodo pos-PEEF fueron 6.105 y 2.641, respectivamente. El aumento de las evaluaciones como de las intervenciones fue significativo solo en las unidades de mayor complejidad. La reducción potencial de costos estimados en el periodo pos-PEEF en UCI fue de 492.805 dólares americanos. La intervención que más ahorro generó fue la prevención de eventos adversos mayores (reducción del 60,2%). El ahorro directo total por terapia secuencial fue de 8.072 dólares americanos en el periodo de estudio.
Conclusionesesta investigación demuestra que la utilización del PEEF permite aumentar el número de evaluaciones e intervenciones del farmacéutico clínico en diferentes servicios clínicos, siendo significativo en unidades de mayor complejidad. Se sugiere en futuras investigaciones evaluar la calidad y el impacto clínico de estas intervenciones.
The Pharmacotherapeutic follow-up program (PFU) carried out by the clinical pharmacist can be categorized within 3 fundamental activities; identification, resolution and prevention of adverse drug events. These must be adjusted to the requirements and resources of each institution, developing procedures to increase PFU efficiency and to guarantee patient safety. The clinical pharmacists of UC-CHRISTUS Healthcare Network developed a Standardized Pharmacotherapeutic Evaluation Process (SPEP). The main goal of our study is to evaluate the impact of this tool through the pharmacist evaluation number and pharmacist interventions number. Secondarily to determine the potential and direct cost savings associated with the pharmacist interventions in an Intensive care unit (ICU).
MethodsA quasi-experimental study evaluated the frequency and type of pharmacist evaluation and pharmacist interventions performed by clinical pharmacists in adult patients units of UC-CHRISTUS Healthcare Network, before and after the implementation of SPEP. The distribution of variables was evaluated using the Shapiro–Wilk test and the association between the use of SPEP and the pharmacist evaluation and pharmacist interventions number was performed using the Chi-square test. The cost evaluation associated with pharmacist interventions in the ICU was carried out using methodology proposed by Hammond et al.
ResultsA total number of 1,781 patients was evaluated before and 2,129 after the SPEP. The pharmacist evaluation and pharmacist interventions number in the before-SPEP period were 5,209 and 2,246. In the after-SPEP period were 6,105 and 2,641, respectively. The increase in both the pharmacist evaluation and pharmacist interventions number was significant only in critical care patients. The potential cost saving in after-SPEP period in the ICU was USD 492,805. Major adverse drug events prevention was the intervention that generated the most savings with a reduction of 60.2%. The total direct savings for sequential therapy was USD 8,072 in the study period.
ConclusionsThis study shows a clinical pharmacist developed tool called SPEP that increased the pharmacist evaluation and pharmacist interventions number in multiple clinical scenarios. These were significant only in critical care patients. Future investigations should make effort to evaluate the quality and clinical impact of these interventions.
El farmacéutico es el profesional de la salud encargado de asegurar el uso seguro de los medicamentos. Dentro de las áreas en las que se puede desempeñar se encuentra la farmacia clínica, la cual se define como «la disciplina de las ciencias de la salud mediante la cual el farmacéutico provee cuidados al paciente optimizando la terapia con medicamentos y promoviendo la salud, el bienestar y la prevención de enfermedades»1. Es, por tanto, el farmacéutico clínico (FC) quien dentro de sus labores se encarga de realizar el seguimiento farmacoterapéutico (SFT) de los pacientes con el fin de conseguir el máximo beneficio clínico de los fármacos2,3. La dinámica de su trabajo suele ser diversa, enfocando su actividad en lograr el óptimo uso de los medicamentos, enfatizando en su dosificación, monitorización, detección de eventos adversos y eficiencia económica que permita lograr mejores resultados en la atención de salud4,5. Así, es posible encontrar un sinnúmero de otras labores y funciones, sin embargo, todas confluyen en al menos 3 actividades fundamentales: la identificación, la resolución y la prevención de eventos adversos a la medicación (EAM)6,7.
A pesar de que múltiples estudios han demostrado que el FC tiene el potencial de disminuir la incidencia de EAM8, esta labor no está exenta de dificultades. Los años de experiencia en el ejercicio de la actividad han dejado en manifiesto que en la mayoría de los casos, sus funciones están supeditadas a los requerimientos de cada institución y de sus recursos, generando la necesidad de desarrollar procedimientos que logren dar estructura al SFT, creando estándares de práctica que garanticen la calidad y seguridad en la atención de salud6.
En la actualidad, existen pocas herramientas que permitan al FC, no entrenado en la práctica clínica, familiarizarse con el proceso de SFT. Algunas como la FASTHUG-MAIDENS ayudan al FC a proporcionar un enfoque escalonado en la identificación de los EAM y con esto disminuir la ansiedad y aprehensión ante la falta de experticia en la Unidad de Cuidados Intensivos (UCI)9. Otras, como el Método Dader, se enfocan en dar estructura mediante procedimientos para el SFT en cualquier entorno clínico en que se pueda desarrollar el FC6.
Es importante destacar que cada herramienta desarrollada hasta ahora no considera las limitaciones asociadas al recurso humano y tecnológico disponible en cada institución, por esto su aplicabilidad puede verse limitada al momento de la implementación. A consecuencia de lo anterior, los FC de la Red de Salud UC-CHRISTUS Chile desarrollamos un Proceso Estandarizado de Evaluación Farmacéutica (PEEF), basado en las actividades descritas en la literatura, pero adaptado a las necesidades y a los recursos disponibles en nuestra institución.
El objetivo principal del estudio fue evaluar el impacto de esta herramienta en términos del número de evaluaciones e intervenciones de los FC y secundariamente determinar el ahorro de costos potenciales y directos asociados a las intervenciones en la Unidad de Cuidados Intensivos (UCI).
MetodologíaSe realizó un estudio cuasiexperimental antes-después, el cual evaluó la frecuencia y el tipo de Evaluaciones Farmacéuticas (EF) e Intervenciones Farmacéuticas (IF) realizadas por 4 FC que trabajan en diferentes unidades hospitalarias de adultos del Hospital Clínico UC-CHRISTUS y la unidad ambulatoria Centro del Cáncer de la Red UC-CHRISTUS, previo y posterior a la utilización del PEEF. El Hospital Clínico UC-CHRISTUS corresponde a un hospital de alta complejidad ubicado en Santiago de Chile, el cual cuenta con 420 camas, de las cuales 331 corresponden a pacientes adultos y que además dentro de esta red se encuentra el Centro Ambulatorio de Cáncer, compuesta por diversos especialistas que atienden a pacientes con tumores sólidos y hematológicos. El primer periodo comprendió los meses de julio 2018 a febrero 2019 y el segundo, los meses de mayo 2019 a diciembre 2019. Los servicios clínicos incluidos fueron: Médico-Quirúrgico (MQ), Unidad de Tratamiento Intermedio (UTI), Unidad de Cuidados Intensivos (UCI) y la Unidad Ambulatoria de Oncología Médica (UAOM), ya que son los servicios clínicos que cuentan con FC en la red UC-CHRISTUS.
El PEEF consideró 9 aspectos de evaluación: 1) tromboprofilaxis (TPF): inicio, suspensión, cambio de dosis o de anticoagulante; 2) profilaxis gástrica para úlcera por estrés (PGUE): inicio, suspensión, cambio de dosis o de antisecretor; 3) dosificación y monitorización terapéutico de fármacos (TDM): ajuste de dosis por función renal, terapia de reemplazo renal (TRR), función hepática y monitorización de niveles plasmáticos de fármacos; 4) administración: indicación de la forma de administración la estabilidad y el almacenamiento de los medicamentos; 5) interacciones farmacológicas: inicio, suspensión o cambio de dosis de uno o más medicamentos por una interacción de relevancia clínica; 6) monitorización de toxicidades y reacción adversa a medicamentos (RAM): prevención, manejo o reporte de RAM a entidad regulatoria nacional; 7) terapia secuencial (TS): cambio de formulación endovenosa a formulación enteral; 8) indicación/conciliación: inicio, suspensión o reinicio de un medicamento por condición aguda o crónica del paciente; 9) información: resolución de consultas por búsqueda bibliográfica o gestión administrativa.
Se definió como evaluación farmacéutica (EF) al proceso de revisión y análisis de la terapia farmacológica de un paciente, e intervención farmacéutica (IF) a la sugerencia del FC al equipo clínico. La intervención se consideró aceptada cuando esta motivó un cambio en la indicación farmacológica o en una práctica de uso del medicamento.
Las variables cuantitativas fueron expresadas como el promedio con desviación estándar o rango mínimo/máximo y las variables cualitativas como frecuencia. La distribución de las variables se evaluó mediante el test de Shapiro–Wilk. La asociación entre el uso del PEEF y el número de evaluaciones e intervenciones fue realizada con el test Chi cuadrado y se consideró significación estadística p < 0,05.
Evaluación de costos en el periodo pos Proceso Estandarizado de Evaluación FarmacéuticaLa reducción de costos asociado a las IF del FC en la UCI se realizó utilizando la metodología propuesta por Hammond et al.10, metodología solo validada en pacientes UCI por lo que no puede ser extrapolada a pacientes de servicios de menor complejidad. Además, para estimar la reducción de costos por la TS se utilizaron los valores proporcionados por nuestro hospital. Se escogieron los fármacos omeprazol, levetiracetam y paracetamol, como ejemplos de este análisis, porque presentan una diferencia significativa en los costos de las presentaciones intravenosas (IV) y orales (VO) y porque además tienen un alto consumo dentro del hospital. El consumo de estos fármacos se obtuvo a través de los registros electrónicos de abastecimiento del Servicio de Farmacia.
ResultadosEl total de pacientes evaluados en los periodos pre- y pos-PEEF fue de 1.781 y 2.129 respectivamente. La distribución por servicio fue (pre-PEEF/pos-PEEF): MQ (371/389), UTI (531/729), UCI (293/397) y UAOM (586/614).
De acuerdo a datos históricos de nuestro hospital, MQ cuenta con el mayor número de camas disponibles por día (160), comparado con UTI y UCI que tienen alrededor de 30 camas. Por su parte, la UAOM recibe diariamente alrededor de 48 pacientes. Tanto MQ, UTI y UCI atienden en su mayoría a pacientes polimedicados (más de 7 medicamentos) con un promedio de edad que supera los 60 años, mientras que el promedio de edad de los pacientes de la UAOM es cercano a los 50 años. Respecto a los periodos de hospitalización, UTI presenta el menor tiempo de estancia, con un promedio de 3 días, comparado con MQ y UCI que fluctúa entre 7 y 9 días.
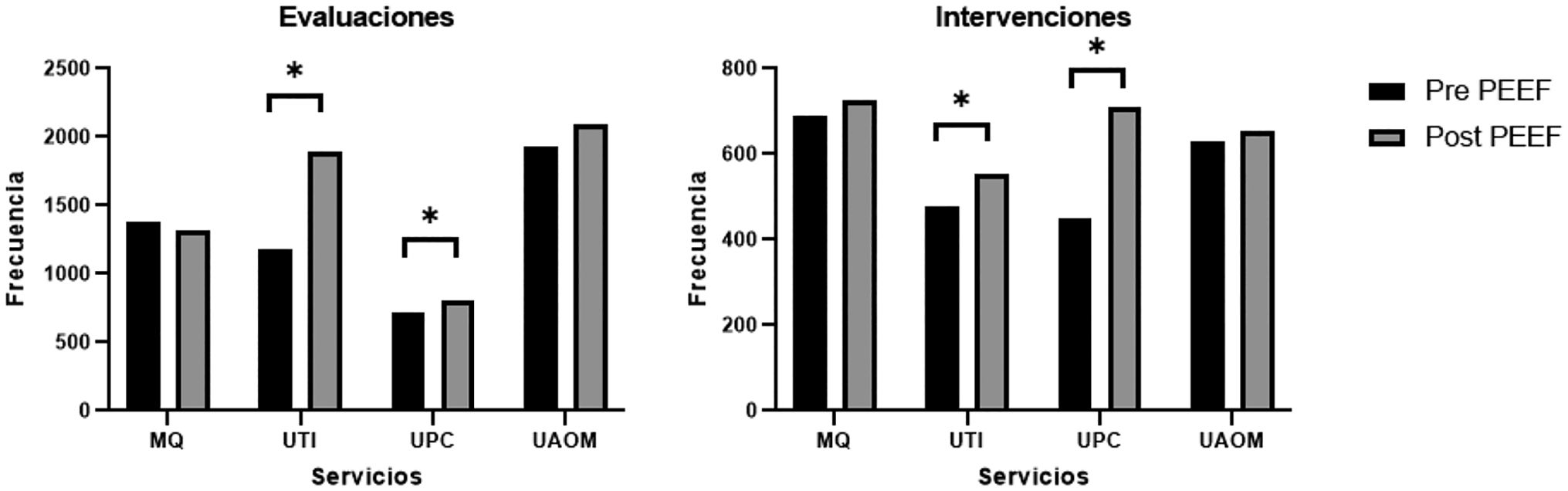
Evaluaciones e intervenciones totalesLas EF e IF en el periodo pre-PEEF fueron 5.209 y 2.246, respectivamente, mientras que en el periodo pos-PEEF fueron 6.105 y 2.641. Como se presenta en el figura 1, tanto las EF como las IF mostraron un aumento estadísticamente significativo, utilizando el test Chi cuadrado, luego de la implementación del PEEF en los servicios UCI y UTI (valor p < 0,01, en ambos servicios), no así en los servicios MQ y UAOM (valor p = 0,23 y valor p = 0,97, respectivamente). Las EF e IF realizadas en UCI fueron: pre-PEEF 713/450 y pos-PEEF 821/708. Por su parte en UTI, fueron: pre-PEEF 1.184/476 y pos-PEEF 1.894/552.
Número de evaluaciones e intervenciones farmacéuticas distribuidas por servicio clínico.
MQ: Médico-Quirúrgico; UTI: Unidad de Tratamiento Intermedio; UCI: Unidad de Cuidados Intensivos; UAOM: Unidad Ambulatoria de Oncología Médica.
(*) Diferencia significativa según Test Chi cuadrado con valor-p < 0,05.
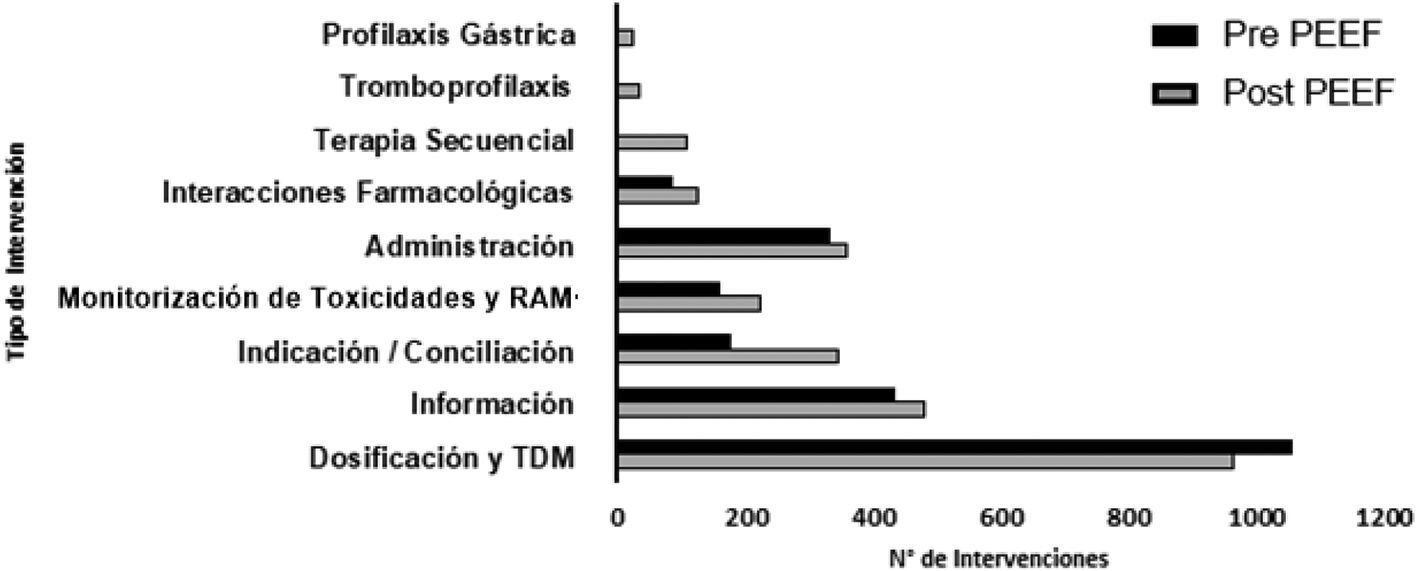
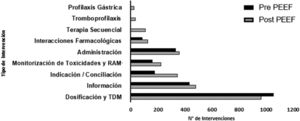
En relación a la frecuencia y tipo de intervenciones realizadas durante ambos periodos (fig. 2), se observó que todas las IF aumentaron su frecuencia posterior a la implementación de PEEF con excepción de dosificación y TDM. Para las IF de PGUE, TPF y TS no existían datos del período pre-PEEF.
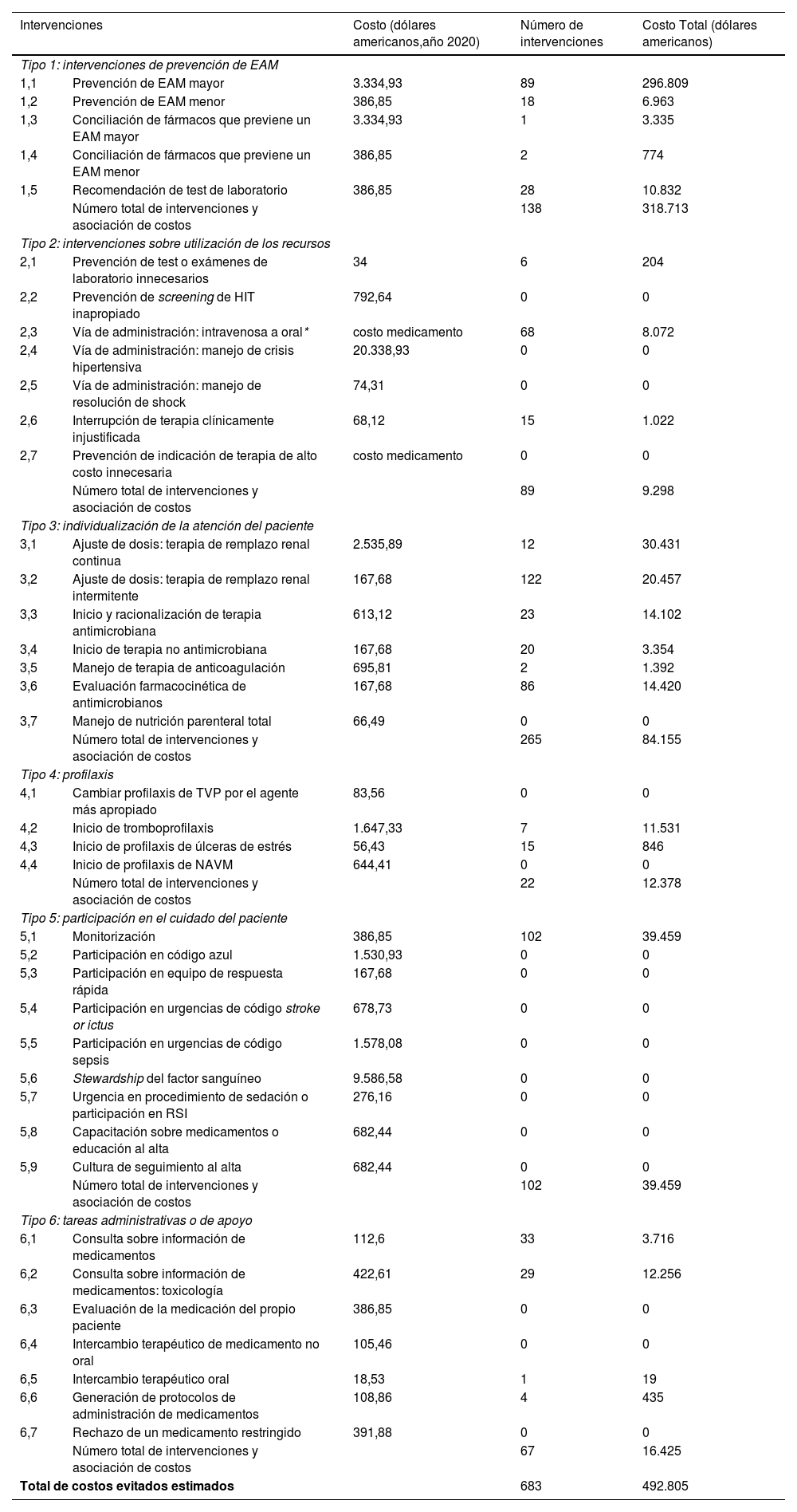
Análisis fármaco-económicoDel total de intervenciones realizadas por el FC en UCI, 683 fueron aceptadas (96,5%) como se muestra en la tabla 1, que corresponde a la metodología de Hammond et al.10. De las intervenciones aceptadas, 265 (38,8%) correspondieron a individualización de la atención del paciente, 138 (20,2%) se clasificaron como intervenciones de prevención de efectos adversos a medicamentos, 102 (14,9%) como participación en el cuidado del paciente, 89 (13%) como intervenciones sobre utilización de los recursos, 67 (9,8%) como tareas administrativas o de apoyo y 22 (3,2%) como profilaxis.
Reducción de costos asociados a la actividad del FC en UCI según tipo de intervención⁎
| Intervenciones | Costo (dólares americanos,año 2020) | Número de intervenciones | Costo Total (dólares americanos) | |
|---|---|---|---|---|
| Tipo 1: intervenciones de prevención de EAM | ||||
| 1,1 | Prevención de EAM mayor | 3.334,93 | 89 | 296.809 |
| 1,2 | Prevención de EAM menor | 386,85 | 18 | 6.963 |
| 1,3 | Conciliación de fármacos que previene un EAM mayor | 3.334,93 | 1 | 3.335 |
| 1,4 | Conciliación de fármacos que previene un EAM menor | 386,85 | 2 | 774 |
| 1,5 | Recomendación de test de laboratorio | 386,85 | 28 | 10.832 |
| Número total de intervenciones y asociación de costos | 138 | 318.713 | ||
| Tipo 2: intervenciones sobre utilización de los recursos | ||||
| 2,1 | Prevención de test o exámenes de laboratorio innecesarios | 34 | 6 | 204 |
| 2,2 | Prevención de screening de HIT inapropiado | 792,64 | 0 | 0 |
| 2,3 | Vía de administración: intravenosa a oral* | costo medicamento | 68 | 8.072 |
| 2,4 | Vía de administración: manejo de crisis hipertensiva | 20.338,93 | 0 | 0 |
| 2,5 | Vía de administración: manejo de resolución de shock | 74,31 | 0 | 0 |
| 2,6 | Interrupción de terapia clínicamente injustificada | 68,12 | 15 | 1.022 |
| 2,7 | Prevención de indicación de terapia de alto costo innecesaria | costo medicamento | 0 | 0 |
| Número total de intervenciones y asociación de costos | 89 | 9.298 | ||
| Tipo 3: individualización de la atención del paciente | ||||
| 3,1 | Ajuste de dosis: terapia de remplazo renal continua | 2.535,89 | 12 | 30.431 |
| 3,2 | Ajuste de dosis: terapia de remplazo renal intermitente | 167,68 | 122 | 20.457 |
| 3,3 | Inicio y racionalización de terapia antimicrobiana | 613,12 | 23 | 14.102 |
| 3,4 | Inicio de terapia no antimicrobiana | 167,68 | 20 | 3.354 |
| 3,5 | Manejo de terapia de anticoagulación | 695,81 | 2 | 1.392 |
| 3,6 | Evaluación farmacocinética de antimicrobianos | 167,68 | 86 | 14.420 |
| 3,7 | Manejo de nutrición parenteral total | 66,49 | 0 | 0 |
| Número total de intervenciones y asociación de costos | 265 | 84.155 | ||
| Tipo 4: profilaxis | ||||
| 4,1 | Cambiar profilaxis de TVP por el agente más apropiado | 83,56 | 0 | 0 |
| 4,2 | Inicio de tromboprofilaxis | 1.647,33 | 7 | 11.531 |
| 4,3 | Inicio de profilaxis de úlceras de estrés | 56,43 | 15 | 846 |
| 4,4 | Inicio de profilaxis de NAVM | 644,41 | 0 | 0 |
| Número total de intervenciones y asociación de costos | 22 | 12.378 | ||
| Tipo 5: participación en el cuidado del paciente | ||||
| 5,1 | Monitorización | 386,85 | 102 | 39.459 |
| 5,2 | Participación en código azul | 1.530,93 | 0 | 0 |
| 5,3 | Participación en equipo de respuesta rápida | 167,68 | 0 | 0 |
| 5,4 | Participación en urgencias de código stroke or ictus | 678,73 | 0 | 0 |
| 5,5 | Participación en urgencias de código sepsis | 1.578,08 | 0 | 0 |
| 5,6 | Stewardship del factor sanguíneo | 9.586,58 | 0 | 0 |
| 5,7 | Urgencia en procedimiento de sedación o participación en RSI | 276,16 | 0 | 0 |
| 5,8 | Capacitación sobre medicamentos o educación al alta | 682,44 | 0 | 0 |
| 5,9 | Cultura de seguimiento al alta | 682,44 | 0 | 0 |
| Número total de intervenciones y asociación de costos | 102 | 39.459 | ||
| Tipo 6: tareas administrativas o de apoyo | ||||
| 6,1 | Consulta sobre información de medicamentos | 112,6 | 33 | 3.716 |
| 6,2 | Consulta sobre información de medicamentos: toxicología | 422,61 | 29 | 12.256 |
| 6,3 | Evaluación de la medicación del propio paciente | 386,85 | 0 | 0 |
| 6,4 | Intercambio terapéutico de medicamento no oral | 105,46 | 0 | 0 |
| 6,5 | Intercambio terapéutico oral | 18,53 | 1 | 19 |
| 6,6 | Generación de protocolos de administración de medicamentos | 108,86 | 4 | 435 |
| 6,7 | Rechazo de un medicamento restringido | 391,88 | 0 | 0 |
| Número total de intervenciones y asociación de costos | 67 | 16.425 | ||
| Total de costos evitados estimados | 683 | 492.805 | ||
EAM: Efectos adversos a medicamentos; HIT: Heparin Induced Thrombocytopenia o Trombocitopenia Inducida por Heparina; NAVM: Neumonía Asociada a Ventilación Mecánica; RSI: Rapid Sequence Intubation o Secuencia Rápida de Intubación; TVP: Trombosis Venosa Profunda.
La reducción potencial de costos estimados a partir de la metodología de Hammond et al.10 en el periodo pos-PEEF en la UCI fue de 492.805 dólares americanos (tabla 1). Las intervenciones que generaron mayor ahorro fueron: prevención de eventos adversos mayores con una reducción de 296.809 dólares americanos (60,2%), seguido de la monitorización con 39.459 dólares americanos (8%) y el ajuste de dosis en TRR continua, 30.431 dólares americanos (6,2%).
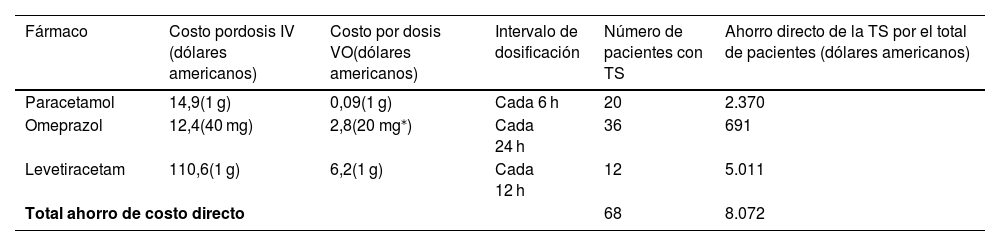
Por otro lado, el ahorro de costo directo total debido a la TS de los 3 medicamentos evaluados fue de 8.072 dólares americanos (tabla 2). La mayor reducción se observó con el cambio de levetiracetam EV a VO.
Ahorros directos asociados a la terapia secuencial por 2 días de tratamiento
| Fármaco | Costo pordosis IV (dólares americanos) | Costo por dosis VO(dólares americanos) | Intervalo de dosificación | Número de pacientes con TS | Ahorro directo de la TS por el total de pacientes (dólares americanos) |
|---|---|---|---|---|---|
| Paracetamol | 14,9(1 g) | 0,09(1 g) | Cada 6 h | 20 | 2.370 |
| Omeprazol | 12,4(40 mg) | 2,8(20 mg⁎) | Cada 24 h | 36 | 691 |
| Levetiracetam | 110,6(1 g) | 6,2(1 g) | Cada 12 h | 12 | 5.011 |
| Total ahorro de costo directo | 68 | 8.072 | |||
IV: Intravenoso; TS: terapia secuencial; VO: Vía oral/enteral.
Este estudio propone una nueva herramienta para estandarizar y sistematizar las actividades del FC en servicios hospitalarios de diferentes complejidades y así lograr una mayor eficiencia en la atención farmacéutica. A este nuevo enfoque de trabajo le denominamos PEEF.
Para el desarrollo del PEEF, una de las fuentes de referencia utilizadas fue la nemotecnia denominada FASTHUG-MAIDENS, la cual propone un abordaje estructurado y estandarizado de evaluaciones al FC que trabaja en UCI9,11. El PEEF incorpora aquellos tópicos generales propuestos por FASTHUG-MAIDENS que pudieran ser aplicados por el FC en diferentes unidades hospitalarias, tales como: tromboprofilaxis, PGUE, indicación/conciliación farmacológica, dosificación y TDM e interacciones farmacológicas12–18. Además, incluye 4 tópicos que pueden realizar los FC y que han demostrado generar un impacto clínico y económico. Estos son: administración de fármacos, monitorización de toxicidades y RAM, información al equipo clínico y TS19–24.
A partir de la utilización del PEEF pudimos observar un aumento de las EF en 3 de los 4 servicios estudiados (fig. 1), a pesar que el número de pacientes evaluados aumentó en cada uno de los servicios del periodo pre a pos-PEEF. La leve disminución de las EF que se aprecian en MQ pudo deberse a que es el servicio de menor complejidad y con mayor volumen de pacientes en relación a los otros, en donde aplicar los 9 puntos del PEEF puede tomar una mayor cantidad de tiempo, lo cual impacta directamente con la cantidad de pacientes que pueden ser evaluados en el mismo periodo de tiempo.
Respecto a las IF, se observó un aumento en los 4 servicios clínicos (fig. 1). Sin embargo, solo en las unidades de alta y mediana complejidad este aumento fue estadísticamente significativo. Dentro de las posibles causas que explicarían lo observado en UCI y UTI está la accesibilidad que tiene el FC al equipo médico, pues estos son servicios cerrados con presencia continua de médicos tratantes y cuyo funcionamiento permitía incorporar al FC en la visita médica. Además, la complejidad propia de estos pacientes (polifarmacia, medicamentos de alto riesgo, terapias de soporte, gravedad) le otorgó al FC una mayor oportunidad de intervención25,26.
Al contrario, en MQ el FC debió ser capaz de seleccionar los pacientes que se beneficiarían en mayor medida de su evaluación en un universo de camas disponibles 5 veces mayor que UTI y UCI, sin disponer de apoyo informático o ficha clínica electrónica. Sumado a lo anterior, físicamente los médicos tratantes se encontraban en los diferentes pisos que componen el servicio de MQ, lo que dificultaba la comunicación y ejecución de cada intervención.
En el caso de la UAOM, una de las causas por la cual las EF no aumentaron de forma significativa posterior a la implementación del PEEF, se debió a que la oportunidad de evaluación del FC se mantuvo constante en el tiempo pues es un servicio cerrado donde diariamente ingresa el mismo número de pacientes. En relación a las IF, tampoco se observó un aumento significativo en el segundo periodo, esto puede deberse a que en la práctica, solo 6 de 9 puntos del PEEF pueden ser aplicados en pacientes ambulatorios. Futuras adaptaciones de nuestra herramienta dirigida a paciente ambulatorio serían de utilidad para expandir el número de funciones y servicios farmacéuticos ofrecidos.
Respecto al tipo de IF se observó que en todos los casos hubo un aumento de estas posterior a la implementación del PEEF, a excepción de dosificación y TDM (fig. 2). Esto pudo estar relacionado con la forma y objetivos de trabajo del FC previo al desarrollo del PEEF, donde el ajuste de dosis según falla orgánica y TDM eran las principales actividades. Durante este periodo se desarrollaron guías para ajustes y capacitaciones a médicos y enfermeras, lo que sumado al estrecho trabajo con el FC, les otorgaban mayor autonomía para la toma de decisión en este punto.
En relación a las intervenciones de TPF, PGUE y TS solo existieron registros en el periodo post-PEEF, pues en el periodo previo no estaba estructurado el registro de este tipo de intervenciones y podían ser clasificadas dentro de otras categorías como indicación o administración. Sin embargo, la implementación no solo permitió una correcta clasificación de la intervención, sino que además, las incorporó en el proceso diario de EF de una forma sistemática y estructurada, generando con ello un aumento de las IF10.
Análisis económicoEn el análisis de ahorro de costos potenciales solo fue posible evaluar el impacto asociado de las IF en UCI debido a que la metodología publicada actualmente fue desarrollada para este grupo de pacientes10.
El ahorro de costos potenciales estimados fue de 492.805 dólares americanos en un periodo de 8 meses posterior a la implementación de PEEF. Estos resultados fueron consistentes con lo publicado por Muñoz D., et al.27 quienes estimaron un ahorro potencial de 263.498 dólares americanos en un periodo de 12 meses, en la UCI de un hospital de alta complejidad de la zona sur de Chile. Las diferencias en el ahorro neto pudieron estar asociadas a las horas de trabajo semanal de los FC en UCI, 44 y 22 horas respectivamente y en el número de camas disponibles. Según esta clasificación la IF que generó el mayor ahorro de costo potencial fue la prevención de eventos adversos mayores, definidas en nuestro estudio como: ajuste de dosis y cambio o suspensión de medicamento por interacción farmacológica. También, la IF que fue realizada con mayor frecuencia fue la de individualización de la atención del paciente, principalmente lo relacionado al ajuste en falla renal, TRR intermitente y continua y TDM.
Si bien la propuesta de Hammond et al. ha sido utilizada por otros investigadores y nos permitió comparar nuestros resultados, asume gastos asociados a la atención de salud que no son fácilmente extrapolables a los diferentes hospitales. Por ejemplo, en el caso de la TS nuestro estudio solo pudo estimar el ahorro de costos asociados al cambio de formulación y no a la prevención de complicaciones como lo describe Hammond et al. (insumos médicos, desarrollo de tromboflebitis, infección del catéter, etc.)10,28–30.
Limitaciones y fortalezasUna de las limitaciones de este estudio fue la diferencia en la forma de registrar las IF realizadas entre ambos periodos. En el periodo pre-PEEF se contó con información menos detallada sobre el tipo de IF, lo que dificultó la clasificación de las intervenciones y además no permitió llevar a cabo el análisis de reducción de costos en este periodo.
Por otro lado, no fue realizado un proceso de capacitación formal para la utilización del PEEF, lo que pudo generar diferencias en la forma de trabajar de los FC. Dado lo anterior, se excluyeron del análisis los meses de marzo y abril 2019, pues se consideraron como periodos de adaptación de las nuevas actividades.
Por último, esta investigación fue realizada en solo un centro de salud privado y pueden existir diferencias al momento de extrapolar nuestros resultados con los centros de salud públicos.
Como fortalezas de este estudio, se planteó una propuesta de seguimiento y evaluación farmacoterapéutica para el FC que atiende a pacientes en diferentes niveles de complejidad. Sumado a lo anterior, el diseño de estudio antes y después permitió estimar el impacto del PEEF al comparar su utilización con un periodo sin esta herramienta.
ConclusionesNuestra investigación demuestra que la utilización del PEEF permite aumentar el número de EF e IF del FC en diferentes servicios clínicos, siendo significativo en unidades de mayor complejidad. Sin embargo, se sugiere a futuras investigaciones evaluar la calidad y el impacto en el desenlace clínico de estas intervenciones.
Este estudio nos permite cuantificar la importante disminución de costos potenciales y directos asociados a la incorporación del FC en UCI, pero se necesitan más estudios con metodologías similares a la de Hammond et al. que sean representativos de la realidad nacional.
Aportación a la literatura científicaDebido a la falta de estandarización en la enseñanza y entrenamiento de los FC, sus tareas suelen ser diversas, supeditadas a los requerimientos de cada institución y complejidad del servicio donde trabajan y no valorizadas para medir el impacto económico de sus intervenciones. Tales actividades no necesariamente incluyen labores mínimas del quehacer farmacéutico, lo que origina falta de estructura en la estandarización de actividades, generando limitaciones considerables a la hora de establecer la eficiencia, calidad y comparación de los servicios farmacéuticos proporcionados por el FC.
Nuestro artículo puede servir de referencia de como la adherencia a una herramienta denominada PEEF puede aumentar sistemáticamente el número de evaluaciones e intervenciones realizadas por el FC en servicios médicos donde no existan modelos de servicios farmacéuticos definidos. Además, esta herramienta se podría utilizar en modelos de evaluación económica para estimar reducción de costos de las intervenciones de los FC.
FinanciaciónSin financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Responsabilidades éticasEste estudio fue autorizado por el Comité de ética CEC-Salud UC de la Pontificia Universidad Católica de Chile (ID: 210731003).
AgradecimientosAgradecer al Servicio de Farmacia del Hospital Clínico UC-CHRISTUS y del Centro Ambulatorio de Oncología de la Red de Salud UC-CHRISTUS de Chile.
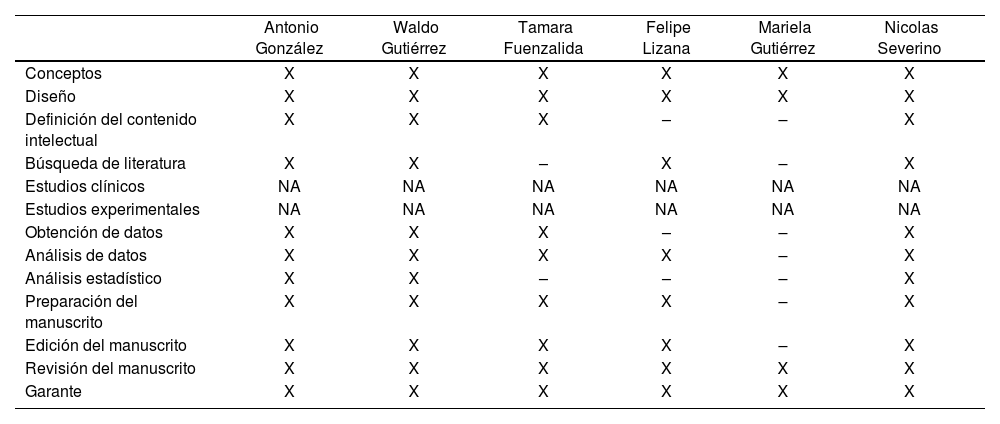
Contribuciones
| Antonio González | Waldo Gutiérrez | Tamara Fuenzalida | Felipe Lizana | Mariela Gutiérrez | Nicolas Severino | |
| Conceptos | X | X | X | X | X | X |
| Diseño | X | X | X | X | X | X |
| Definición del contenido intelectual | X | X | X | – | – | X |
| Búsqueda de literatura | X | X | – | X | – | X |
| Estudios clínicos | NA | NA | NA | NA | NA | NA |
| Estudios experimentales | NA | NA | NA | NA | NA | NA |
| Obtención de datos | X | X | X | – | – | X |
| Análisis de datos | X | X | X | X | – | X |
| Análisis estadístico | X | X | – | – | – | X |
| Preparación del manuscrito | X | X | X | X | – | X |
| Edición del manuscrito | X | X | X | X | – | X |
| Revisión del manuscrito | X | X | X | X | X | X |
| Garante | X | X | X | X | X | X |