Describir el perfil de utilización en la práctica asistencial de los antirretrovirales de última generación (AUG): darunavir, raltegravir, maraviroc y etravirina.
MétodoEstudio observacional, transversal y descriptivo realizado en pacientes adultos que hubiesen iniciado tratamiento con algún AUG entre mayo de 2008 y abril de 2009. Se definieron las variables asociadas al uso de AUG: a) relacionadas con la eficacia: resistencias según pruebas geno/fenotípicas, o potenciales por amplia experiencia previa a antirretrovirales; y/o deterioro inmunológico grave (CD4 inferior a 200 células/mcl). b) Relacionadas con la seguridad: toxicidad previa a antirretrovirales clásicos, y/o comorbilidad que condiciona su uso. c) Variable combinada de eficacia y seguridad (variable principal): priorizando las variables detectadas se clasificaron a los pacientes como multirresistencia geno/fenotípica (multi-G/F), mutirresistencia según histórico de tratamiento, y otras situaciones. Los datos se obtuvieron de la historia clínica informatizada, las pruebas de laboratorio, y el registro de la entrevista y las dispensaciones del Servicio de Farmacia.
ResultadosSe incluyeron 73 pacientes de los que el 40% tenía carga viral indetectable y el 38,4% deterioro inmunológico grave. La multi-G/F ocurrió en el 45%, y la multirresistencia según histórico en el 33% de los pacientes. Los pacientes clasificados como “otras situaciones” se caracterizaron por tener mayor carga viral y peor situación inmunológica. De los pacientes que no presentaron multi-G/F en el 90% se detectaron dos o más variables asociadas al uso de AUG.
DiscusiónLa realidad asistencial del uso de los AUG muestra su papel en situaciones clínicas muy variadas, particulares y difíciles de manejar.
To describe the indications for use, in medical practice, of next-generation antiretroviral drugs (NGA): darunavir, raltegravir, maraviroc and etravirine.
MethodAn observational, transversal and descriptive study conducted in adult patients who have started to receive a NGA between May 2008 and April 2009. The variables associated with the use of NGA were defined as follows: a) Variables related to efficacy: resistance confirmed by geno/phenotype tests or potencial resistance as a result of extensive exposure to antiretroviral agents, and/or severe immunological deterioration (CD4 less than 200 cells/mcl). b) Variables related to safety: prior toxicity to classic antiretroviral drugs and/or comorbidity which compromises their use. c) Combined efficacy and safety variable (main variable): prioritizing the variables which were detected, the patients were classified into three groups: multiresistant geno/phenotype (multi-G/P), multiresistant as a result of treatment history and other situations. Data was obtained from electronic medical records, laboratory tests, and records of interviews and drugs dispensed by the Pharmacy Service.
ResultsSeventy three patients, 40% of whom had an undetectable viral load and 38.4% who showed severe immunological deterioration, were included in the study. Multi-G/P occurred in 45% and multiresistance as a result of treatment history was found in 33% of patients. Patients classified as belonging to the “other situations” category were characterized by having a greater viral load and a poorer immunological status. In 90% of the patients without multi-G/P two or more variables associated with the use of NGA were detected.
DiscussionThe medical reality of using NGA shows that they play a role in clinical situations which are very different, specific and difficult to manage.
En los últimos dos años se han comercializado cuatro nuevos fármacos antirretrovirales (ART) eficaces en el tratamiento de adultos infectados por VIH. Estos fármacos han supuesto una gran aportación al arsenal terapéutico disponible, ya que amplían el abordaje de la terapia antirretroviral con nuevos mecanismos de acción y permiten diseñar pautas de rescate eficaces en pacientes en situación de multirresistencia. Estos nuevos antirretrovirales son darunavir, raltegravir, maraviroc y etravirina y en este estudio se han denominado antirretrovirales de última generación (AUG).
En los estudios de registro se ha demostrado la eficacia de estos fármacos asociados o no al tratamiento de base optimizado en pacientes multirresistentes. Su asociación aumentó un 20-35% el porcentaje de pacientes que negativizaron la carga viral a las 48 semanas de tratamiento1. Además, la eficacia de estos AUG también ha sido estudiada en pacientes con menos experiencia previa a ART y en pacientes naives2-8.
Paralelamente, hay datos que sugieren que estos fármacos poseen ventajas adicionales tanto relacionadas con la eficacia como con la seguridad. En el caso del raltegravir parece presentar una gran rapidez de acción ya que, comparado con efavirenz, consigue una mayor respuesta virológica a las dos, cuatro y ocho semanas de tratamiento9-11. El maraviroc parece influir en la recuperación inmunológica12,13 y el darunavir podría ser más potente que el lopinavir (ambos potenciados con ritonavir) en algunas situaciones clínicas2,3. También hay autores que sugieren que raltegravir y maraviroc tienen escaso impacto metabólico6,13,14,15, y además raltegravir presenta un buen perfil a nivel de interacciones, ya que no es sustrato, ni inhibidor ni inductor, del CYP4501.
Finalmente y en comparación con otras alternativas empleadas en pacientes con pocas opciones terapéuticas, los AUG no presentan los problemas de toxicidad hepática de tipranavir ni los problemas asociados a la administración subcutánea diaria del enfuvirtide.
No obstante, debido a las limitaciones de los AUG, al nivel todavía no muy rotundo de evidencia científica que avale estas ventajas potenciales, a la falta de experiencia clínica y al elevado coste, estos fármacos se han posicionado en la mayor parte de los hospitales españoles como alternativas terapéuticas en pacientes con pocas opciones terapéuticas16.
Las principales recomendaciones de tratamiento antirretroviral14,17 fijan como objetivo farmacológico la indetectabilidad de la carga viral incluso en los pacientes con pocas opciones terapéuticas. Para llegar a este objetivo parece imprescindible utilizar regímenes compuestos por 2 o 3 fármacos completamente activos. Por eso, la utilización de AUG en el diseño del régimen antirretroviral parece imprescindible en situaciones de presencia de cepas multirresistentes, y también en situaciones en las que existan otros fármacos activos pero cuyo uso está contraindicado o condicionado por comorbilidades presentes en el paciente o por antecedentes de toxicidad.
La EMEA ha recogido todas estas matizaciones en el registro de estos fármacos, y la indicación que se ha aprobado para todos ellos es la del tratamiento de pacientes pretratados, sin especificar el requerimiento de multirresistencia1.
Dado el amplio abanico de situaciones clínicas en las que se puede requerir el uso de AUG, el objetivo de este estudio es describir el perfil de indicación de uso de estos fármacos (darunavir, etravirina, raltegravir y maraviroc) en la práctica asistencial de un hospital general universitario.
MétodosSe llevó a cabo un estudio observacional, transversal y descriptivo realizado en el ámbito de pacientes externos infectados por VIH en tratamiento antirretroviral.
Población de estudioPacientes adultos en tratamiento antirretroviral que hayan iniciado tratamiento con uno o varios AUG en el periodo comprendido entre mayo de 2008 y abril de 2009, ambos inclusive.
Fueron excluidos aquellos pacientes con inicio de AUG en el marco de un ensayo clínico o pacientes cuya terapia antirretroviral con AUG fue iniciada en otro centro hospitalario.
Variables de medidaSe recogieron las siguientes variables:
- -
Variables demográficas: edad y sexo.
- -
Variables clínicas: carga viral y recuento medio de CD4 previos al inicio con AUG.
- -
Variables de tratamiento antirretroviral: régimen antirretroviral completo, coste anual, y tasa de adherencia durante el año previo al inicio con AUG. Se definió no-adherencia cuando la tasa de adherencia era inferior al 90% según los registros de dispensaciones.
- -
Variables asociadas al uso de AUG: son las variables susceptibles de motivar el uso de AUG. Son las siguientes:
- 1.
Variables relacionadas con la eficacia del régimen antirretroviral:
- 1.1
Resistencias documentadas por pruebas fenotípicas o genotípicas: cuando al analizar todos los tests de resistencias realizados a un paciente se encontraban cepas con mutaciones que confieren resistencia alta o media a algún ART. En función de las mutaciones detectadas se clasificaron los pacientes como:
- 1.1.1
Multirresistencia: presencia de mutaciones que confieren resistencia alta o media a fármacos de las tres familias clásicas de antirretrovirales (análogos de la transcriptasa inversa [ITIAN], no análogos de la transcriptasa inversa [ITINN] e inhibidores de la proteasa [IP]), o a todos los fármacos de dos de las tres familias clásicas (incluso cuando no existía ninguna mutación de resistencia a la tercera familia, debido al riesgo de monoterapia funcional utilizando sólo antirretrovirales clásicos).
- 1.1.2
Algunas mutaciones de resistencia: presencia de mutaciones que confieren resistencia alta o media a algunos de los fármacos de una o dos de las tres familias clásicas.
- 1.1.3
Mutaciones de resistencias no documentadas: presencia de mutaciones detectadas que no confieren resistencia o ésta es baja, o casos sin datos de realización de test de resistencia.
- 1.1.1
- 1.2
Resistencia potenciales por amplia experiencia previa a antirretrovirales: cuando el paciente ha tenido tratamiento antirretroviral previo con al menos un fármaco de cada familia clásica de antirretrovirales durante un tiempo igual o superior a seis meses.
- 1.3
Deterioro inmunológico grave: cuando el recuento de CD4 en la analítica previa al inicio con AUGs era inferior a 200 células/mcl.
- 1.1
- 2.
Variables relacionadas con la seguridad del tratamiento:
- 2.1
Toxicidad que contraindica el uso de algún ART: reacción adversa grave (que haya limitado la actividad para la vida normal o que haya requerido ingreso hospitalario), diagnosticada clínicamente, asociada a algún ITIAN, ITINN o IP y que contraindica su uso (ejemplo: reacción de hipersensibilidad a abacavir, fallo renal grave asociado al tenofovir, acidosis láctica, pancreatitis, rash cutáneo por ITINN, hepatitis tóxica por nevirapina, neuropatía limitante, hiperbilirrubinemia grave o colestasis por atazanavir).
- 2.2
Comorbilidad que condiciona directamente el uso de algún ART: patología crónica que pueda estar motivada o potenciada por algún ART y que pueda limitar la supervivencia del paciente (ejemplo: enfermedad cardiovascular, diabetes mellitus, hiperlipidemia, hepatopatía grave (estadio>3 o cirrosis), osteopenia, o insuficiencia renal crónica).
- 2.3
Comorbilidad que condiciona indirectamente el uso de algún ART: se consideran las siguientes situaciones:
- -
Comorbilidad que requiera un tratamiento farmacológico que pueda interaccionar con los antirretrovirales
- -
Comorbilidad que conlleve un deterioro clínico importante (ejemplo: epilepsia, EPOC, hipertensión pulmonar, linfoma o tuberculosis).
- -
- 2.4
Toxicidad producida por algún ART que afecta a la calidad de vida: lipodistrofia o diarreas asociadas a tratamiento antirretroviral basado en IP.
- 2.1
- 3.
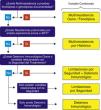
Variable combinada de eficacia y seguridad: es la variable principal relacionada con el uso de AUG. Se definieron 5 categorías diferentes según el algoritmo descrito en la figura 1 por el que se priorizan las variables susceptibles de motivar el uso de AUG anteriormente expuestas.
Figura 1.Algoritmo por el que se priorizan las variables susceptibles de motivar el uso de antirretrovirales de última generación para establecer la variable combinada de eficacia y seguridad*:
*Las variables combinadas: limitaciones por seguridad+deterioro inmunológico, limitaciones por seguridad, y deterioro inmunológico, se agrupan en una supracategoría denominada Otras situaciones.
ART: antirretrovirales.
- 1.
En los pacientes con modificación de AUG durante el periodo de estudio, se registraron las variables demográficas, las clínicas, la tasa de adherencia y las variables asociadas al uso de AUG en el momento del primer tratamiento con uno de estos fármacos. El coste y el régimen antirretroviral analizados fueron los de la última terapia prescrita con AUG.
Fuentes de datosLas fuentes de datos revisadas fueron:
- -
Aplicación informática de la historia clínica: acceso unificado desde 2005 con datos analíticos, informes clínicos de consultas externas y de altas de hospitalización y pruebas de imagen desde 2003.
- -
Registro de la Atención Farmacéutica con los datos recogidos en la entrevista clínica.
- -
Registros informáticos de dispensaciones, disponibles desde el año 1998.
- -
Informes de tests de resistencias proporcionados directamente por el Servicio de Microbiología. Los tests genotípicos han sido realizados por Truegene® (Visible Genetics, Canadá) desde 2002 y los de fenotipo virtual por Vircotype® (Virco, Bélgica) desde 2003.
El Servicio de Farmacia realizó un informe de cada paciente en el momento de su inclusión en el estudio. Este informe describía la información disponible de manera sistemática y se estructuraba, basándose en las recomendaciones de GESIDA/PNS para seleccionar el régimen antirretroviral14, de la siguiente forma:
- -
Descripción de la terapia antirretroviral con AUG.
- -
Resultado de las pruebas de resistencias: se cruzó la interpretación de las mutaciones según Truegene® (Visible Genetics, Canadá), Vircotype® (Virco, Bélgica) y la obtenida por el sistema de interpretación de resistencia de la Universidad de Standford. Este sistema prioriza las opciones de tratamiento en función de las mutaciones de resistencia presentes en el paciente. La accesibilidad a este sistema se realiza a través de la página web de la Universidad de Stanford (http://hivdb.stanford.edu/pages/algs/sierra_mutation.html).
- -
Antecedentes de tratamiento antirretroviral y tasa de adherencia durante el año previo al inicio con AUG.
- -
Comorbilidades y antecedentes de toxicidades relacionadas con los ART.
- -
Medicación concomitante y análisis de las interacciones potenciales.
Estos informes se presentaron en las reuniones del Grupo para el Manejo de Antirretrovirales de nuestro centro, y posteriormente las variables fueron introducidas en una base de datos para su explotación global. Sólo cuando la variable combinada no era multirresistencia geno/fenotípica (G/F), se procedió al análisis del resto de las variables asociadas con el uso de AUG.
Análisis estadísticoLos datos se expresan como frecuencias y porcentajes en las variables cualitativas y como media y desviación estándar (DE) en las variables cuantitativas. Las pruebas estadísticas utilizadas para comparar variables fueron la prueba χ2 y la prueba exacta de Fisher para las variables cualitativas y la U de Mann-Whitney, Anova y Kruskall-Wallis para las variables cuantitativas. Se consideraron como estadísticamente significativos los resultados cuya p fue inferior al 0,05. El análisis estadístico de los datos se hizo con el programa SPSS 16.0 para Windows.
ResultadosEn el periodo de estudio iniciaron tratamiento antirretroviral con AUG un total de 83 pacientes de los cuales, 73 cumplían criterios de inclusión. La incorporación de pacientes que inician con AUGs a lo largo del periodo de estudio queda reflejada en la figura 2.
El 66% eran varones y la media de edad fue de 46 (DE=10) años. El 40% de los pacientes tenían carga viral indetectable, el 11% entre 50 y 1.000 copias/ml, el 40% entre 1.000 y 100.000 copias/ml y el 9% más de 100.000 copias/ml. El recuento medio de CD4 fue 347 (DE=276) células/mcl y el 38,4% de los pacientes presentaban un deterioro inmunológico grave.
Los tratamientos estaban constituidos por una media de 3,4 ART (DE=0,9), incluyendo una media de 1,6 AUG (DE=0,8). El 42% de los pacientes utilizaba más de tres ART (sin contabilizar el ritonavir como potenciador), y el 59% de los regímenes estudiados incluía un solo AUG. El 34,4% de los pacientes habían sido no-adherentes en el año previo al inicio con AUG. El coste medio anual por paciente fue de 21.674 euros.
Descripción de las variables asociadas al uso de AUGEn la tabla 1 se describe el número de pacientes según las variables asociadas con el uso de AUG detectados. El 45% tenía evidencias de multirresistencia G/F, el 22% presentaba algunas mutaciones de resistencia y en el 33% no había mutaciones de resistencia documentadas.
Número de pacientes según presencia de variables asociadas al uso de AUG
| Variables de eficacia | Variables de seguridad | Variable combinada | ||||||||
| Resistencias documentas | Experiencia previa con ART | DI | 0 | 1 | >2 | MultiG/F | Multi H | Otros | ||
| DI+LS | LS | DI | ||||||||
| Multirresistente | NP | NP | NP | NP | NP | 33 | 0 | 0 | 0 | 0 |
| Algunas mutaciones de resistencia | Experiencia previa con ART | Sí | 1 | 0 | 2 | 0 | 3 | 0 | 0 | 0 |
| No | 1 | 1 | 3 | 0 | 5 | 0 | 0 | 0 | ||
| No experiencia previa con ART | Sí | 3 | 1 | 1 | 0 | 0 | 2 | 0 | 3 | |
| No | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | ||
| Sin datos | Sí | 0 | 0 | 2 | 0 | 0 | 2 | 0 | 0 | |
| No | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Mutaciones de resistencias no documentadas | experiencia previa con ART | Sí | 2 | 3 | 3 | 0 | 8 | 0 | 0 | 0 |
| No | 1 | 2 | 5 | 0 | 8 | 0 | 0 | 0 | ||
| No experiencia previa con ART | Sí | 1 | 2 | 0 | 0 | 0 | 2 | 1 | ||
| No | 0 | 0 | 3 | 0 | 0 | 0 | 3 | 0 | ||
| Sin datos | Sí | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | |
| No | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | ||
| TOTAL | 10 | 11 | 19 | 33 | 24 | 6 | 5 | 5 | ||
ART: antiretrovirales; AUG: antirretrovirales de última generación; DI: deterioro inmunológico (CD4<200 células/mcl); LS: limitación por seguridad; MultiG/F: multirresistencia geno/fenotípica; Multi H: multirresistencia por histórico; NP: no procede su análisis.
No presentaron multirresistencia G/F 40 pacientes, en los cuales se analizó el resto de las variables asociadas con el uso de AUG. En el 90% de estos pacientes se detectaron dos o más de estas variables y en el 62% más de tres. En 30 pacientes (75% de los pacientes analizados) se encontró al menos una variable relacionada con la seguridad del tratamiento: el 30% tenía antecedentes de toxicidad que contraindica el uso de algún ART, el 52,5% presentaba alguna comorbilidad que condiciona directamente el uso de algún ART, el 20% alguna comorbilidad que condiciona indirectamente el uso de algún ART, y el 17,5% había desarrollado alguna toxicidad producida por algún ART que afecta a la calidad de vida.
La distribución según la variable principal asociada al uso de AUGs fue la siguiente. La multirresistencia G/F ocurrió en el 45% y la multirresistencia según histórico en el 33% de los pacientes. Las limitaciones por seguridad junto con un deterioro inmunológico grave ocurrieron en 6 pacientes (8,2%). En 5 pacientes (6,9%) las limitaciones por seguridad fueron la variable principal, y 4 de ellos presentaron al menos una variable más asociada al uso de AUGs. En otros 5 pacientes (6,9%) la variable principal fue el deterioro inmunológico grave, que en 3 pacientes iba acompañado de fracaso virológico y presencia de algunas mutaciones de resistencia.
En la tabla 2 se describen las características de los pacientes según la variable principal asociada al uso de AUGs. Los pacientes con multirresistencia G/F presentaron mejor situación inmunológica, utilizaron un mayor número de AUGs y tuvieron un coste medio anual superior al resto de los grupos (diferencias estadísticamente significativas).
Características de los pacientes según la variable principal de uso de AUG
| Multirresistencia geno/fenotípica (45%) | Multirresistencia por histórico (33%) | Otros (22%) | |
| % CV>1000 | 55 | 29 | 69a,b |
| % CD4<200 | 18 | 46a | 69a |
| % >1AUG | 70 | 13a | 25a |
| % >3ART | 46 | 42 | 38 |
| % No adherentesc | 22 | 36 | 70a |
| Coste anual (euros) | 25.408 | 17.770a | 19.829a |
ART: antirretrovirales; AUG: antirretrovirales de última generación; CV: carga viral.
Los pacientes que no tenían multirresistencia ni G/F ni por histórico se caracterizaron por tener mayor carga viral (diferencias estadísticamente significativas con ambos grupos) y peor situación inmunológica (diferencia estadísticamente significativa con el grupo de multirresistencia G/F). Además, estos pacientes habían sido peor adherentes al tratamiento antirretroviral previo (diferencias estadísticamente significativas con el grupo multirresistencia G/F).
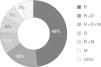
Descripción de los regímenes utilizadosLas combinaciones de antirretrovirales empleadas en estos pacientes fueron muy variadas. Con relación a los AUG empleados, el 88% utilizó raltegravir, el 40% darunavir, el 24% maraviroc y el 8% etravirina (fig. 2). Salvo la etravirina que no se utilizó como único AUG, los otros tres fármacos se utilizaron tanto así como acompañados por otros AUG, de tal manera que el 48% de los pacientes emplearon el raltegravir como único AUG, el 16% raltegravir junto con maraviroc y el 11% raltegravir con darunavir y maraviroc. El resto de las combinaciones de AUG se utilizaron en menor medida (fig. 3). De los 73 pacientes incluidos, 5 sufrieron cambio de AUG durante el estudio.
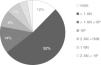
En el 12% de los pacientes los AUG no se asociaron a otros ART, en el 52% sólo a ITIAN, y en el 14% a ITIAN más un IP diferente a darunavir (fig. 4). El 75% de los regímenes incluían algún ITIAN, siendo los más utilizados el tenofovir (84%) y el abacavir (18%) principalmente en sus presentaciones combo. El 22% de los pacientes utilizaron IP diferente a darunavir, siendo los más utilizados el lopinavir (37%) y el atazanavir (31%) potenciados.
Distribución de pacientes según las combinaciones de antirretrovirales que se asociaron a los antirretrovirales de última generación (% de pacientes).
AN: inhibidores de la transcriptasa inversa análogos de núcleos/tidos; NN: inhibidores de la transcriptasa inversa no análogos de núcleosidos; IP: inhibidores de la proteasa; IF: inhibidores de la fusión.
Este estudio pretende aproximarse a la realidad asistencial y conocer el perfil de utilización de los antirretrovirales más novedosos del mercado. Pone de manifiesto la gran diversidad de situaciones clínicas que pueden requerir la utilización de antirretrovirales de última generación: darunavir, maraviroc, etravirina y raltegravir. En la mayor parte de los pacientes (45%), lo que ha limitado las posibilidades terapéuticas es la multirresistencia con evidencias geno/fenotípicas, pero también se han presentado situaciones en las que la eficacia o la seguridad de los tratamientos clásicos estaba muy comprometida por otros motivos.
Por un lado, se ha detectado un 33% de pacientes con multirresistencia sospechada dada su amplia experiencia con antirretrovirales. Se ha considerado esta situación como variable principal del uso de AUG porque las técnicas analíticas actuales para la detección de mutaciones de resistencias presentan limitaciones, como son la escasa sensibilidad cuando la carga viral es inferior a 1.000 copias /ml o la baja especificidad cuando la población de virus con estas mutaciones representa un porcentaje inferior al 20% de la población total. Por eso, en estas situaciones adquiere gran importancia el análisis de las terapias antirretovirales previas14.
Por otro lado, en este estudio se ha observado más de un 20% de pacientes (grupo de pacientes clasificado como “otras situaciones”) en los que existían antirretrovirales clásicos activos en número suficiente como para poder constituir un régimen terapéutico adecuado, no obstante, eran pacientes muy complejos, con una situación clínica muy crítica, carga viral alta, deterioro inmunológico grave y/o comorbilidades asociadas. Además, en muchas ocasiones tenían alto riesgo de toxicidad con los antirretrovirales clásicos. Es decir, la necesidad de utilizar AUG en sus regimenes terapéuticos fue principalmente la combinación de varios factores relacionados con la eficacia y la seguridad.
Arribas ha realizado recientemente una revisión sobre las ventajas e inconvenientes de darunavir, etravirina, maraviroc y reltegravir, y, en base a ello, ha planteado el posible papel de estos fármacos en la terapéutica actual13. Los resultados de nuestro estudio ponen de manifiesto que el posicionamiento teórico que Arribas ha realizado sobre los AUG se impone en la práctica clínica y que, además de su papel en situaciones de rescate, las ventajas que ofrecen principalmente en cuanto a seguridad, hacen que estos nuevos fármacos en ocasiones sean necesarios.
De manera paralela, en un estudio realizado en el año 200718 se plantearon recomendaciones de uso para diversos antirretrovirales y se analizó el grado de cumplimiento de las mismas. Para el darunavir se consideró la indicación de pacientes que hubiesen tenido al menos un fracaso con un régimen que incluyera IP, que tuviesen evidencia documentada de fracaso virológico (CV>1.000 copias por mililitro) y que pudieran tolerar dosis bajas de ritonavir. Los resultados obtenidos al revisar las prescripciones realizadas durante un año y medio tras la comercialización de este fármaco demostraron que en un 21,2% de las prescripciones no se habían seguido estos criterios.
La toxicidad del tratamiento antirretroviral es uno de los aspectos más importantes relacionados con su uso. La prevalencia de toxicidad varía según las familias prescritas oscilando entre el 15 y el 50% para los tratamientos orales13. Martín et al19, en un trabajo realizado en pacientes de nuestro entorno, analizaron la relación entre las reacciones adversas y el cumplimiento terapéutico. Encontraron que un 66% de los pacientes referían haber sufrido alguna reacción adversa en los últimos 6 meses de tratamiento. En otro artículo recientemente publicado se analizó la toxicidad del tratamiento antirretroviral en mujeres embarazadas20. La prevalencia de las reacciones adversas detectadas mediante revisión de la historia médica, las pruebas de laboratorio y la información del paciente fue del 48% en esa población. En nuestro estudio se analizaron las variables de seguridad en 40 pacientes y se detectó que un 75% tenía al menos una de estas variables. Luego, aun con la distancia que marcan las diferencias metodológicas, todos estos datos muestran que la población de nuestro estudio presentaba una peor tolerancia al tratamiento antirretroviral que la población media. Esto también apoya la hipótesis de que la seguridad de los AUG tiene un papel decisivo en su uso.
La adherencia al tratamiento previo al inicio con AUG fue baja si se compara con los últimos datos de nuestro hospital. Entre mayo de 2007 y mayo del 2008 se realizó un estudio descriptivo retrospectivo de la adherencia durante los seis primeros meses de tratamiento antirretroviral en pacientes naive adultos. En este trabajo se detectaron un 22,7% de pacientes no adherentes frente al 34,4% encontrado en los pacientes con AUG del estudio actual. Estos resultados son coherentes puesto que las dos poblaciones tienen importantes diferencias. Los pacientes con AUG presentan dos factores que la población naive no tiene: mucho más tiempo en tratamiento y muchas más experiencias negativas durante el mismo. Estos dos factores influyen negativamente en la adherencia al disminuir la satisfacción del paciente con su medicación21.
Recientemente se han publicado estudios sobre adherencia realizados en poblaciones con experiencia al tratamiento antirretroviral. Kim et al21 encontraron un 27,4% de pacientes no adherentes con la realización de cuestionarios autodeclarados en el año 2007. Otro estudio realizado en 68 pacientes con una media de dos fallos virológicos previos detectaba un 23,5% de pacientes que declaraban no haber superado el 95% de las dosis necesarias en el último mes en un cuestionario autodeclarado22. En nuestra opinión, nuestro estudio detecta un porcentaje mayor de no adherentes porque estos cuestionarios suelen sobreestimar la adherencia, y porque la definición de adherencia que hemos utilizado es más exigente al valorar todo un año de tratamiento.
Por otro lado, es interesante destacar que la adherencia previa al inicio con AUG fue mucho más baja en el grupo de pacientes clasificado como “otras situaciones” (70% de no adherentes), que en los otros dos grupos. Ante el riesgo y la repercusión clínica de que estos pacientes tuvieran un fracaso terapéutico por falta de adherencia al tratamiento con AUG, en el Grupo para el Manejo de Antirretrovirales de nuestro centro se decidió incluirlos en un programa especial de seguimiento de adherencia realizado en el Servicio de Farmacia.
Por otro lado, en el estudio de Martín MT et al19 el 38% de los pacientes que habían referido reacciones adversas tenia una tasa de cumplimiento inferior al 90% (medida mediante el recuento de medicación sobrante o por registro de dispensaciones), encontrándose diferencias estadísticamente significativas con la tasa de cumplimiento de los pacientes con buena tolerancia. Estos valores se asemejan a los encontrados en nuestro estudio ya que, de los 30 pacientes que presentaron alguna variable relacionada con la seguridad, el 36% fue no adherente.
Como es de esperar, en este estudio, paralelamente a la alta heterogeneidad de la población incluida, se ha descrito una gran variabilidad en las pautas antirretrovirales utilizadas. La más empleada ha sido la combinación de raltegravir con dos inhibidores de la transcriptasa análogos de núcleos/tidos, probablemente debido a los beneficios en cuanto a tolerancia e interacciones que aporta el raltegravir. Por otro lado, el coste de los AUG es elevado, lo cual ha contribuido a que el coste medio anual haya sido de 21.674 euros por paciente. Teniendo en cuenta que el coste medio del tratamiento antirretroviral en nuestro centro es aproximadamente de 9.000 euros por paciente y año, se puede indicar que estas situaciones críticas conllevan un coste en fármacos dos veces y medio más elevado que la media.
La metodología utilizada en este estudio es adecuada teniendo como principal limitación que no se ha revisado la parte de la historia médica que solo está disponible en formato papel. Esto podría aportar nuevos datos relacionados con el seguimiento clínico del paciente que ayudarían principalmente en el esclarecimiento de las variables relacionadas con la seguridad del tratamiento antirretroviral.
En definitiva, este estudio observacional pone de manifiesto la realidad asistencial del uso de los nuevos antirretrovirales introducidos en el mercado. Se trata, en general, de situaciones clínicas muy particulares y difíciles de manejar, lo cual, unido al elevado coste de estos fármacos, hace especialmente interesante el diálogo y el consenso terapéutico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Emilio Bouza y al resto de los miembros del Grupo para el Manejo de Antirretrovirales del Hospital General Universitario Gregorio Marañón por su colaboración.