La inmunoglobulina específica frente a citomegalovirus ha demostrado su eficacia en la prevención y tratamiento de la infección en el trasplante de órganos sólidos. Distintos estudios indican una eficacia similar respecto a las presentaciones de Ig inespecíficas.
El objetivo de este estudio es determinar la titulación de inmunoglobulina anti-citomegalovirus de una de las presentaciones de inmunoglobulinas inespecíficas autorizadas en España.
MétodoEstudio observacional en el que se analizó la titulación de anticuerpos anti-citomegalovirus de distintos lotes de Flebogamma® 5% 5g utilizados en el Hospital Universitari Vall d’Hebron durante los años 2008 y 2009.
ResultadosSe analizaron 27 lotes, que incluyeron 18.944 viales de Flebogamma® 5%. En función del origen, la concentración mediana de inmunoglobulina anti-citomegalovirus fue de 28UPEI/ml y 22UPEI/ml para los viales de origen norteamericano y español, respectivamente (IC 95 % para la diferencia de las medianas de 5 a 6UPEI/ml; p<0,001).
ConclusionesLa concentración de anticuerpos anti-citomegalovirus de los lotes de inmunoglobulina inespecífica analizados es ligeramente inferior respecto a las especialidades de inmunoglobulinas específicas. Estas diferencias pueden compensarse mediante un ajuste posológico.
Specific immunoglobulin against cytomegalovirus has demonstrated its effectiveness in preventing and treating infections in solid organ transplantation. Several studies indicate that non-specific immunoglobulin is just as effective.
This study aims to determine anti-cytomegalovirus immunoglobulin titres from one of the non-specific immunoglobulin presentations authorised in Spain.
MethodThis was an observational study, in which we analysed the anti-cytomegalovirus antibody titres from different batches of Flebogamma® 5% 5g used at the Hospital Universitari Vall d'Hebron during 2008 and 2009.
ResultsWe analysed 27 batches, which included 18,944 vials of Flebogamma® 5%. Depending on the origin, the median concentration of anti-cytomegalovirus immunoglobulin was 28PEI-U/ml and 22PEI-U/ml per vial of North American and Spanish origin, respectively (CI 95% for the difference of the medians 5 to 6PEI-U/ml; p<0.001).
ConclusionsThe anti-cytomegalovirus antibody concentration of the non-specific immunoglobulin batches analysed was slightly lower than in the specific immunoglobulin preparations. These differences can be compensated by adjusting the dosage.
La inmunoglobulina (Ig) específica, o hiperinmune, frente a citomegalovirus (CMV), conjuntamente a otros fármacos con una adecuada actividad frente al virus, ha demostrado su eficacia en la prevención y tratamiento de la infección por CMV en pacientes sometidos a trasplante de órgano sólido, especialmente en aquellos casos con mayor riesgo de contraer la enfermedad1,2.
Las especialidades farmacéuticas comercializadas como Ig específica frente a CMV contienen una mezcla purificada de anticuerpos procedentes de plasma o suero humano, con un contenido mayoritario en Ig G y con una titulación estandarizada frente al virus3.
No existe ninguna monografía para las Ig específicas frente a CMV en la Real Farmacopea Española ni en la Farmacopea Europea4,5. Por ello, las características de estos productos se ajustan a las monografías publicadas para las Ig humanas inespecíficas.
Las especialidades de Ig específicas frente a CMV garantizan una concentración mínima de anticuerpos anti-CMV de 50UPEI/ml (UPEI=Unidad Paul Erlich Institut. La titulación de cada lote se establece por comparación frente a un estándar de referencia propuesto por el Paul-Ehrlich-Institut, Langen, Alemania)6–8.
En España no se comercializa ninguna especialidad farmacéutica de Ig específica frente a CMV. Esta situación supone una limitación en cuanto a su disponibilidad y, dado el carácter urgente que puede representar su administración (por ejemplo, inmediatamente antes del inicio del trasplante), genera una dificultad en el manejo de los pacientes que puedan requerirla. Por ello, puede ser interesante disponer de una presentación alternativa a la Ig específica frente a CMV. Por sus similares características, las preparaciones de Ig inespecíficas podrían ofrecer esta opción. Para ello, sería necesario conocer la titulación de anticuerpos frente a CMV de estas presentaciones y establecer, en caso necesario, el ajuste posológico adecuado para garantizar la administración de la cantidad necesaria de anticuerpos activos frente al virus.
El objetivo principal del estudio es determinar la titulación frente a CMV de una de las presentaciones de Ig inespecíficas autorizadas en España. Los objetivos secundarios son el cálculo de una pauta posológica adecuada de Ig inespecífica que garantice la administración de una cantidad suficiente de Ig anti-CMV y el análisis farmacoeconómico de la opción de utilizar Ig inespecíficas frente a Ig específica anti-CMV en el trasplante de órgano sólido.
MétodosSe trata de un estudio observacional, retrospectivo, transversal, en el que se analizó la titulación de anticuerpos anti-CMV de todos los lotes de la especialidad Flebogamma® 5% 5g utilizados en el Hospital Universitari Vall d’Hebron durante los años 2008 y 2009.
La determinación analítica se realizó secuencialmente en el Instituto Grifols SA, al final del proceso de producción para cada uno de los lotes. El análisis se realizó por técnica ELISA, mediante el kit Bioelisa CMV IgG de Biokit®.
La variable principal del estudio fue la titulación media de anticuerpos anti-CMV de la muestra analizada. Como variables secundarias se analizaron, por separado, la titulación media de anticuerpos anti-CMV, en función del origen del plasma.
Para la comparación de medias se aplicó el test de la t-Student para distribuciones normales. En caso de distribución no normal, se aplicó la prueba de la U-Mann-Whitney. Se utilizó el test de Kolmogorov-Smirnov para evaluar la distribución de las muestras. Para evaluar la significación estadística de las diferencias se consideró un valor bilateral de p<0,05 y el intervalo de confianza del 95%. El análisis estadístico de los datos se realizó mediante el programa informático SPSS 12,0.
Para calcular el régimen posológico a partir de la presentación de Ig inespecífica se utilizó el esquema autorizado de la presentación de Ig específica frente a CMV en profilaxis de trasplante de órgano sólido: primera dosis post trasplante 150mg/kg; semanas 2, 4, 6 y 8 pos-trasplante 150mg/kg; semanas 12 y 16 post trasplante 100mg/kg. En cuanto a títulos de Ig específica frente a CMV, la pauta anteriormente descrita corresponde a, como mínimo, 75UPEI/ml y 50UPEI/ml, respectivamente.
El análisis farmacoeconómico se realizó desde la perspectiva del servicio de farmacia, mediante un modelo de minimización de costes, asumiendo que la eficacia y seguridad de las 2 opciones terapéuticas son equivalentes. Se consideró un paciente de 75kg de peso para realizar el cálculo posológico. El coste de adquisición de las 2 presentaciones de Ig corresponde al registrado en 2008 (Cytotec® 10%, 10ml: 130€; Flebogamma® 5%, 100ml: 265,10€). No se tuvieron en cuenta los costes de almacenamiento, preparación ni administración, ya que en ambas opciones estos son similares. El análisis farmacoeconómico se realizó mediante el programa informático Pharma-Decision versión Hospital 1,2.
ResultadosSe analizaron 27 lotes, que incluyeron 18.944 viales de la especialidad Flebogamma® 5%. La titulación de Ig anti-CMV de los viales presentó una distribución no normal (test de Kolmogorov-Smirnov p<0,001). La concentración media de Ig anti-CMV fue de 22,86UPEI/ml (SD=±4,05).
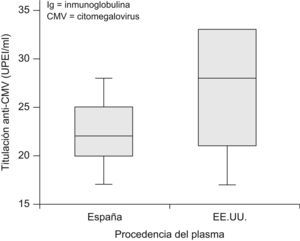
En función del origen del plasma, la concentración mediana de Ig anti-CMV fue de 28UPEI/ml y de 22UPEI/ml para los lotes de origen norteamericano y español, respectivamente (IC 95% para la diferencia de las medianas 5 a 6UPEI/ml; p<0,001) (fig. 1 y tabla 1).
Titulación de anticuerpos anti-CMV de los diferentes lotes analizados de Ig inespecífica
| N.o viales | Media (UPEI/ml) (SD) | Mediana (UPEI/ml) | Rango (UPEI/ml) | |
| España | 15.018 | 22,06 (3,09) | 22,00 | 17–28 |
| EE.UU. | 3.926 | 25,89 (5,78) | 28,00 | 17–33 |
| Total | 18.944 | 22,86 (4,05) | 23,00 | 17–33 |
CMV:citomegalovirus; UPEI:unidades Paul Erlich Institute.
Considerando la misma pauta posológica de 150mg/kg, correspondiente a las especialidades específicas Ig anti-CMV, se alcanzó la concentración de 75UPEI/kg en el 35% de los viales, a partir de la especialidad Flebogamma® 5%. Con una dosis de 200mg/kg de Flebogamma® 5%, la predicción de alcanzar el objetivo de 75UPEI/kg es del 99,9%. Para garantizar al 100% la administración establecida de Ig anti-CMV, se debería recomendar una dosis de 220mg/kg, debido a la presencia de algún lote de Ig inespecífica con una concentración de 17UPEI/ml.
La dosis de Ig inespecífica equivalente a 100mg/kg de la especialidad específica anti-CMV, en cuanto a concentración de títulos frente al virus, es de 147mg/kg.
Para un paciente de 75kg de peso, el coste de la opción Ig específica anti-CMV fue de 9.265,6 €, para la totalidad del tratamiento. El coste de la opción Flebogamma®, garantizando al 100% la misma concentración mínima de anticuerpo anti-CMV, fue de 5.543,7€, para la totalidad del tratamiento. En una pauta de profilaxis frente a la enfermedad por CMV en trasplante de órgano sólido, el coste diferencial de la opción Flebogamma® fue de–3.721,9€.
DiscusiónEn este trabajo se ha estudiado la concentración de Ig anti-CMV de una especialidad de Ig inespecífica de amplio uso en nuestro hospital, así como en la mayoría de hospitales españoles. Los resultados obtenidos demuestran que la titulación de Ig anti-CMV de la especialidad inespecífica es ligeramente inferior respecto a la titulación mínima estandarizada de las especialidades Ig específicas anti-CMV (tabla 2). Este dato se explica por el hecho que el origen de las presentaciones específicas son pools de donaciones seleccionadas con un contenido mínimo de anticuerpos anti-CMV3.
Contenido de anticuerpos anti-CMV de diferentes presentaciones de inmunoglobulinas humanas
| Inmunoglobulina inespecífica | Inmunoglobulina específica anti-CMV | ||
| Flebogamma® 5% 100ml | Cytotect® 10% 50ml | Cytogam® 5% 50ml | |
| Concentración Ig (%) | 5 | 10 | 5 |
| Ig total (g) | 5 | 5 | 2,5 |
| Concentración mínima Ig G (%) | 97 | 95 | nd |
| Concentración Ig anti-CMV (UPEI/ml) | 22,89* | 50** | 25** |
| Ig anti-CMV total (UPEI) | 2.289* | 2.500** | 1.250** |
CMV: cytomegalovirus; Ig:inmunoglobulina; nd:no disponible.
Las diferencias observadas en la concentración de anticuerpos anti-CMV entre las especialidades específicas e inespecíficas puede superarse mediante un ajuste adecuado de la especialidad de Ig inespecífica, garantizando una administración similar de anticuerpos anti-CMV.
En función del origen del plasma a partir del cual se han purificado las inmunoglobulinas (donaciones procedentes de centros españoles o de centros norteamericanos), se han documentado diferencias relevantes en cuanto al contenido de anticuerpos anti-CMV, aunque este no fue el principal objetivo del estudio y, probablemente, el número de lotes analizados procedentes de EE.UU. ha sido insuficiente. En cualquier caso, estas diferencias pueden explicarse por 2 motivos: a) la diferencia de prevalencia de seropositividad frente a CMV y, por lo tanto, en el título de anticuerpos anti-CMV de la población de donantes y b) por diferencias en los métodos de purificación y elaboración de las especialidades9. En este estudio se ha analizado la titulación de una sola especialidad farmacéutica de Ig inespecífica. Por lo tanto, se pueden descartar diferencias en el método de elaboración y, por lo tanto, es probable que las diferencias en la concentración de títulos anti-CMV sea consecuencia del distinto grado de inmunización de las poblaciones de donantes. A pesar de ello, es complejo poder asegurar el posible origen de estas diferencias ya que son numerosos los factores que pueden afectar la seroprevalencia frente a CMV de la población de donantes (edad, sexo, nivel socioeconómico)10–12. Además, algunos datos publicados previamente se oponen a los obtenidos en este estudio13,14.
El análisis farmacoeconómico se ha realizado mediante un modelo de minimización de costes. Esta opción queda justificada al considerar ambas posibilidades terapéuticas equivalentes15,16. La utilización de la especialidad Ig inespecífica es la opción más eficiente, con una importante reducción del coste de la profilaxis. Probablemente, la diferencia de costes entre las 2 especialidades de Ig pueda ser superior a la documentada en este trabajo, ya que en algunos hospitales existe un contrato mediante el cual, la empresa que purifica y fracciona los excedentes de plasma obtenidos del banco de sangre, entrega, sin coste, parte de su producción de Ig inespecífica al hospital. Esta circunstancia reduce significativamente el coste de adquisición de Flebogamma® 5%.
La pauta posológica propuesta, basada en el contenido de anticuerpos anti-CMV, debe considerarse segura, ya que no supera a las propuestas para otras muchas indicaciones terapéuticas de las Ig inespecíficas17. En cualquier caso, sería necesario confirmar la eficacia clínica y la seguridad de la dosis propuesta de Ig inespecífica en la prevención de infección por CMV en pacientes trasplantados de órgano sólido, aunque este tipo de ensayo clínico, por las complejidades que conlleva, difícilmente pueda llevarse a cabo.
En conclusión, este trabajo aporta datos que facilitan la posibilidad de utilizar una alternativa frente a una especialidad farmacéutica no comercializada en España. El razonamiento del análisis se basa en un idéntico origen, proceso de manufacturación y especificaciones por farmacopeas de ambas especialidades de Ig, específicas e inespecíficas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.