existe incertidumbre sobre cómo afecta la edad a la eficacia de la inmunoterapia debido al proceso natural de inmunosenescencia. El objetivo de esta revisión sistemática y metaanálisis es evaluar si la edad superior a 65 años afecta a la eficacia, en términos de supervivencia global, de los tratamientos de inmunoterapia en combinación con quimioterapia o doble inmunoterapia, utilizados en primera línea del cáncer de pulmón no microcítico metastásico sin alteraciones moleculares.
Métodose realizó una revisión sistemática y un metaanálisis. Se llevó a cabo una búsqueda sistemática en PubMed y Cochrane Library hasta el 30 de abril de 2024, para identificar ensayos clínicos aleatorizados que compararan un tratamiento experimental con inhibidores de puntos de control inmunitario más quimioterapia, frente a un doblete de quimioterapia basado en platino, en pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, sin mutaciones moleculares y con cualquier nivel de expresión de ligando 1 de muerte programada. La variable principal fue la diferencia en eficacia entre mayores y menores de 65 años, medida en términos de diferencia en el hazard ratio de supervivencia global. Se calculó el hazard ratio de supervivencia global agrupado con su intervalo de confianza del 95%, en ambos grupos etarios, y se evaluó la heterogeneidad mediante una prueba de interacción.
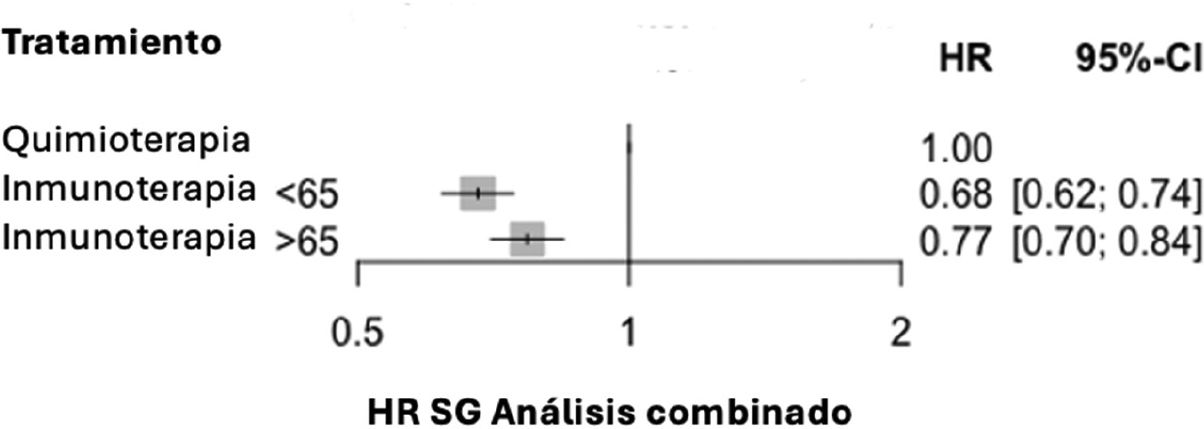
Resultadosse identificaron 1.505 publicaciones, de las cuales se incluyeron 7 ensayos clínicos. Además, se incorporó el informe público europeo de evaluación de pembrolizumab en combinación con platino y nab-paclitaxel. En total, el análisis incluyó 5.572 pacientes: 2.893 menores de 65 años y 2.679 de 65 años o más. El hazard ratio agrupado de supervivencia global para los pacientes del primer grupo fue de 0,68 (IC 95%: 0,62–0,74), y para el segundo de 0,77 (IC 95%: 0,70–0,84). La p de interacción entre los hazard ratio combinados de ambos grupos fue de 0,0551.
Conclusionestanto los menores como los mayores de 65 años se benefician de la inmunoterapia combinada con quimioterapia en el tratamiento del cáncer de pulmón no microcítico. Aunque parece haber una mayor eficacia en los menores de 65 años, la influencia de la edad no es completamente clara.
There is uncertainty about how age affects the efficacy of immunotherapy due to the natural process of immunosenescence. The aim of this systematic review and meta-analysis is to assess whether age over 65 years affects the efficacy, in terms of overall survival, of immunotherapy treatments in combination with chemotherapy or double immunotherapy, used in first-line metastatic non-small cell lung cancer without molecular alterations.
MethodsA systematic review and meta-analysis were performed. A systematic search of PubMed and Cochrane Library until April 30, 2024 was conducted to identify randomized clinical trials comparing an experimental treatment with immune checkpoint inhibitors plus chemotherapy versus a platinum-based chemotherapy doublet in patients with locally advanced or metastatic non-small cell lung cancer, without molecular mutations and with any level of programmed death ligand 1 expression. The primary endpoint was the difference in efficacy between those older and younger than 65 years, measured in terms of difference in overall survival hazard ratio. We calculated the hazard ratio for overall survival with its 95% confidence interval in both age groups and assessed heterogeneity using an interaction test.
ResultsA total of 1,505 publications were identified, of which 7 clinical trials were included. In addition, the European public report evaluating pembrolizumab in combination with platinum and nab-paclitaxel was incorporated. In total, the analysis included 5,572 patients: 2,893 under 65 years of age and 2,679 aged 65 years or older. The pooled Hazard Ratio for overall survival for patients in the first group was 0.68 (95% CI: 0.62–0.74), and for the second 0.77 (95% CI: 0.70–0.84). The p-interaction between the pooled Hazard Ratio of both groups was 0.0551.
ConclusionsBoth those younger and older than 65 years benefit from immunotherapy combined with chemotherapy in the treatment of non-small cell lung cancer. Although there appears to be greater efficacy in those younger than 65 years, the influence of age is not entirely clear.
El cáncer de pulmón es el tercer cáncer más frecuente a nivel mundial1. Se estimaron 238.340 nuevos casos y 127.070 muertes en el año en 2023. Es el responsable del mayor número de fallecimientos a nivel mundial (20,8% de todas las muertes por cáncer)2.
El cáncer de pulmón se divide en 2 grupos en función de la morfología celular: de células pequeñas o microcítico, y de células no pequeñas o no microcítico (CPNM). Este último representa el 80–85% de todos los casos de cáncer de pulmón. A su vez, el CPNM se clasifica en 3 subtipos histológicos: adenocarcinoma, carcinoma epidermoide o de células escamosas y carcinoma de células grandes3.
El tratamiento del CPNM varía en función de la histología del tumor, el estadio de la enfermedad, la presencia de mutaciones moleculares, la edad, el estado funcional, las comorbilidades y las preferencias del paciente. En el caso de enfermedad metastásica, el tratamiento estándar de primera línea en pacientes con mutaciones moleculares es la terapia dirigida4. En pacientes sin mutaciones moleculares, la estrategia de tratamiento depende de la histología y genotipo del tumor, la expresión del ligando 1 de muerte programada (PD-L1), el estado funcional, las comorbilidades y preferencias del paciente. En el caso de que no esté contraindicada la inmunoterapia y el paciente tenga un buen estado funcional, con performance estatus (PS) de 0–1 según la escala Eastern Cooperative Oncology Group (ECOG), las opciones terapéuticas consisten en inmunoterapia sola, en combinación con quimioterapia o combinaciones de inmunoterapia, en función, entre otros factores, del nivel de expresión de PD-L15.
Los puntos de control inmunitario proteína 1 de muerte celular programada (PD-1) /PD-L1 y antígeno 4 del linfocito T citotóxico (CTLA-4) desempeñan un papel fundamental en el desarrollo del tumor. La interacción de los ligandos con sus receptores regula negativamente y detiene la activación de las células T, debilitando el sistema inmune y favoreciendo la proliferación de células tumorales. Los inhibidores de punto de control inmunitario (ICI), fármacos dirigidos frente a estos receptores y ligandos, anti-PD-1/PD-L1 y anti-CTLA-4, evitan la interacción entre los linfocitos T y las células tumorales, induciendo una regulación positiva de la actividad de las células T6.
Estos fármacos forman parte del estándar de tratamiento del CPNM metastásico sin mutaciones moleculares.
La inmunosenescencia hace referencia al deterioro progresivo del sistema inmunitario debido al proceso de envejecimiento. Esta parece incidir en la evolución de los tumores y en la efectividad de la respuesta inmune antitumoral debido a la disminución de la capacidad del cuerpo para generarla7. Aunque la incidencia del cáncer en pacientes de edad avanzada cada vez es mayor, la participación de estos en ensayos clínicos oncológicos es escasa. En el caso del cáncer de pulmón, en la práctica asistencial, la mediana de edad al diagnóstico es de 70 años, y aproximadamente la mitad de los pacientes se engloba dentro del grupo de población geriátrica. Sin embargo, los pacientes incluidos en los ensayos clínicos son más jóvenes8. Esto es, en parte, debido a que con frecuencia los pacientes de edad avanzada presentan comorbilidades y no cumplen los criterios de inclusión de los ensayos clínicos9.
Existe información contradictoria sobre el posible beneficio del tratamiento con ICI en población anciana, tanto en monoterapia10–12 como en terapia de combinación10,12. La información proviene principalmente de análisis de subgrupos de los ensayos clínicos con baja potencia estadística, y de estudios de vida real13–15.
El objetivo de esta revisión sistemática y metaanálisis es evaluar si la edad superior a 65 años es un factor que afecta a la eficacia, en términos de SG, de los tratamientos de inmunoterapia en combinación con quimioterapia o doble inmunoterapia, utilizados en primera línea en pacientes con CPNM metastásico sin alteraciones moleculares.
MétodosEl protocolo para esta revisión fue registrado en la base de datos PROSPERO (CRD420251032819)16.
Estrategia de búsquedaSe siguieron las guías PRISMA para la elaboración de la revisión sistemática y metaanálisis. Se buscaron en PubMed y Cochrane Library ensayos clínicos fase 3 hasta el 30 de abril de 2024. También se revisaron otros documentos, como los informes públicos europeos de evaluación (EPAR) de los diferentes fármacos publicados por la Agencia Europea del Medicamento. Dos investigadores (A.A. y L.M.) hicieron la búsqueda de manera independiente en dichas bases de datos. Los términos de búsqueda fueron «pembrolizumab», «atezolizumab», «nivolumab», «ipilimumab», «durvalumab», «tremelimumab», «cemiplimab», «non-small cell lung cancer» y «randomized controlled trial». Se utilizaron las siguientes estrategias de búsqueda: ([pembrolizumab] AND [non-small cell lung cancer] AND [randomized controlled trial]), ([atezolizumab] AND [non-small cell lung cancer] AND [randomized controlled trial]), ([nivolumab] AND [ipilimumab] AND [non-small cell lung cancer] AND [randomized controlled trial]), ([durvalumab] AND [tremelimumab] AND [non-small cell lung cancer] AND [randomized controlled trial]), ([cemiplimab] AND [non-small cell lung cancer] AND [randomized controlled trial]).
Criterios de inclusiónSe identificaron todos los ensayos controlados y aleatorizados fase III realizados en pacientes adultos con CPNM localmente avanzado o metastásico, sin mutaciones moleculares, con histología escamosa y no escamosa, con un PS 0–1 y cualquier nivel de expresión de PD-L1. Se seleccionaron aquellos ensayos clínicos que comparaban un tratamiento experimental en primera línea con pembrolizumab, atezolizumab, nivolumab, ipilimumab, durvalumab, tremelimumab o cemiplimab en combinación con quimioterapia, o sin quimioterapia en el caso de nivolumab-ipilimumab, frente a un grupo control con un doblete de quimioterapia basado en platino. Se incluyó la combinación de nivolumab-ipilimumab sin quimioterapia, puesto que es una de las opciones terapéuticas posicionadas al mismo nivel que el resto de tratamientos de inmunoterapia en combinación con quimioterapia en pacientes con nivel de expresión de PD-L1 ≥ 1%5. Para ser incluidos, los ensayos clínicos debían evaluar la eficacia en términos de hazard ratio (HR) de supervivencia global (SG) en función de la edad.
Criterios de exclusiónSe excluyeron estudios prospectivos, retrospectivos, series de casos o reportes de casos realizados en vida real y ensayos clínicos fase II. Cuando se identificaron varias publicaciones del mismo ensayo clínico con resultados correspondientes a diferentes años, se seleccionaron aquellas que tuvieran un tiempo de seguimiento similar, para asegurar que los datos fueran comparables entre sí. Las demás publicaciones del mismo ensayo se excluyeron del análisis.
Se excluyeron los artículos cuyo texto completo estaban publicados en idiomas diferentes al inglés o el español. La exclusión de datos de cohortes en vida real y ensayos clínicos fase II se realizó para garantizar una mayor validez interna en los resultados del estudio.
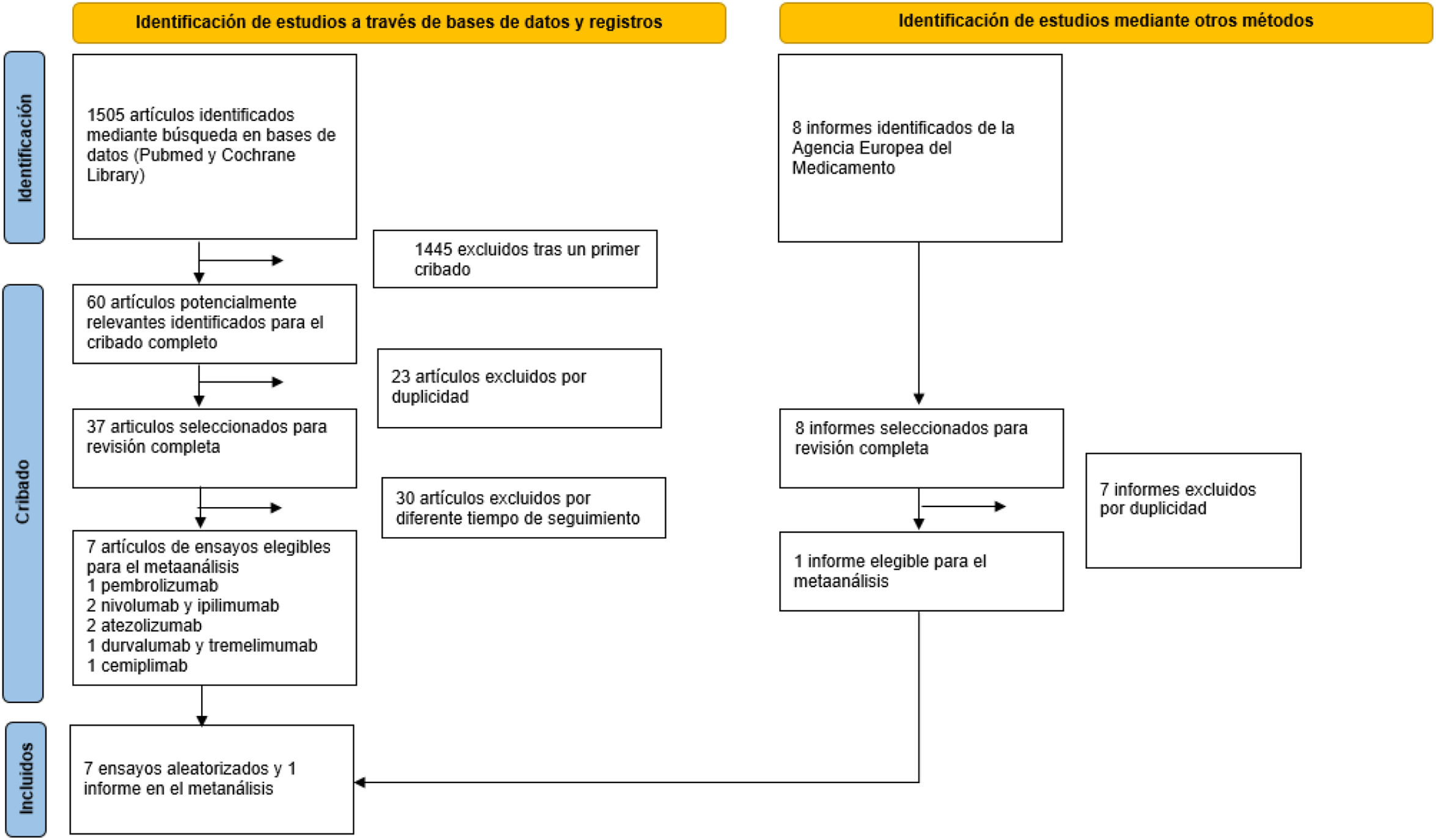
Dos investigadores (A.A. y L.M.) revisaron de manera independiente la lista de artículos seleccionados para elegir aquellos que cumplían los criterios de inclusión (fig. 1). Los desacuerdos se discutieron y resolvieron con el consenso de un tercer investigador (J.C.).
Extracción de datosDe cada estudio, A.A. y L.M. extrajeron de manera independiente la información relevante de los estudios incluidos, utilizando un formulario de extracción de datos. Extrajeron el nombre del estudio, primer autor y año de publicación, tratamiento del grupo control, las características de los pacientes, el tiempo de seguimiento, el HR de SG de los pacientes en función de la edad, número de pacientes de cada grupo y la mediana de SG del grupo control. Las características de los estudios y sus resultados se presentaron en tablas.
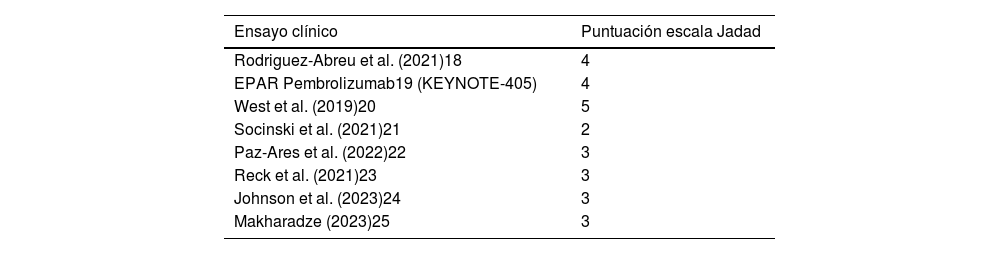
Se evaluó la calidad metodológica de los ensayos utilizando la clasificación de Jadad. La variable principal fue la eficacia de las combinaciones de inmunoterapia y quimioterapia en función de la edad, medida en términos de diferencia de HR de SG en mayores y menores de 65 años.
Se calculó el HR combinado y su intervalo de confianza (IC 95%) en pacientes mayores y menores de 65 años mediante un modelo de efectos aleatorizados. Se evaluó la heterogeneidad entre las 2 estimaciones utilizando una prueba de interacción. Se calculó la prueba Q de Cochrane para evaluar la heterogeneidad entre estudios y el estadístico I2, que expresa el porcentaje de la variabilidad total observada debido a la heterogeneidad del estudio.
El metaanálisis se realizó utilizando el programa RStudio V4.01, librería netmeta.
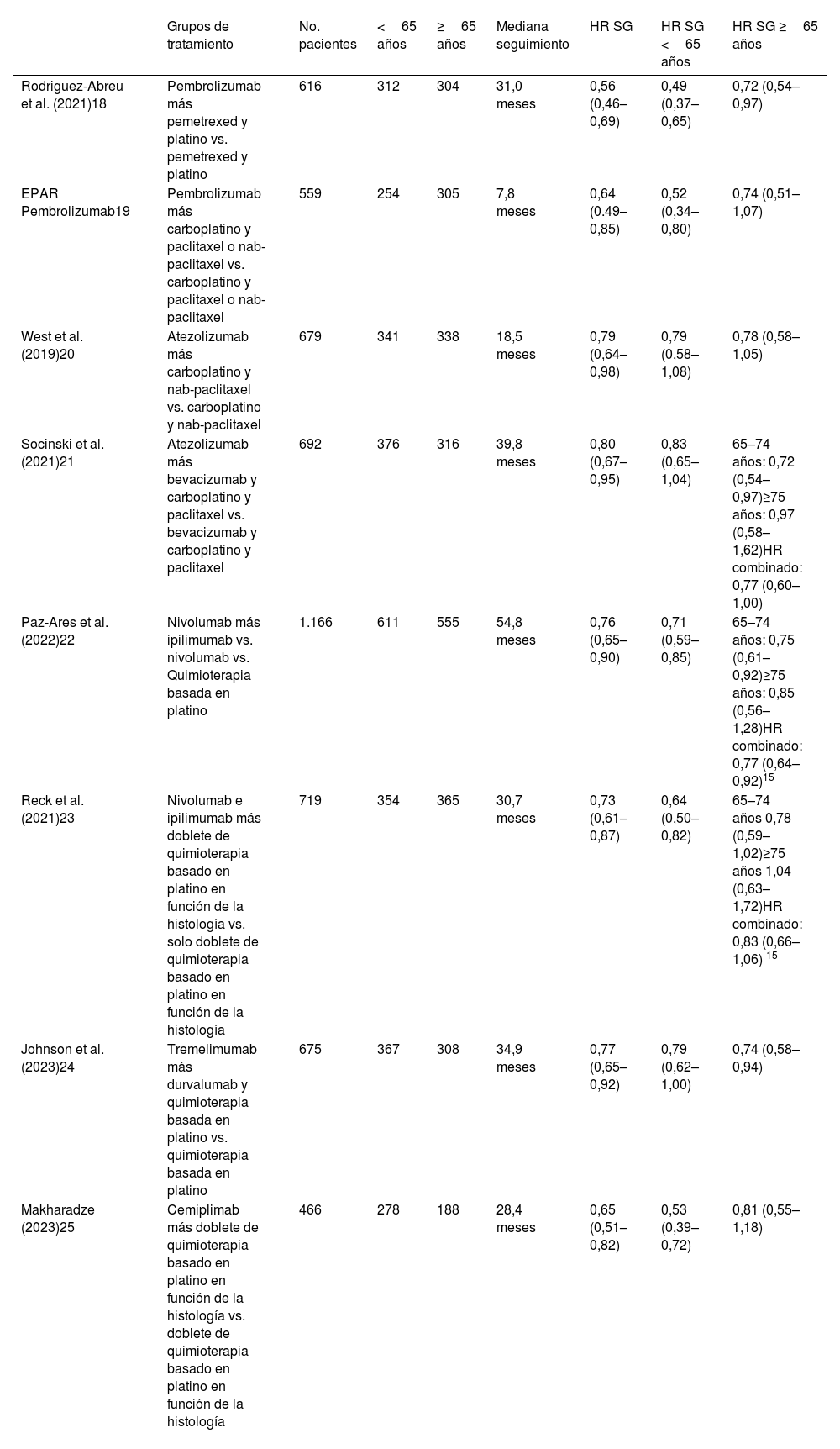
ResultadosCon los criterios de búsqueda seleccionados, se encontraron 1.505 publicaciones en las bases de datos MEDLINE/PubMed y Cochrane Library, de las cuales se seleccionaron 60 artículos potencialmente relevantes. Tras eliminar los duplicados y las publicaciones de los mismos ensayos con diferente tiempo de seguimiento, 7 ensayos clínicos controlados cumplían los criterios de inclusión (tabla 1). Se incluyó un ensayo clínico con pembrolizumab, 2 con atezolizumab, 2 con nivolumab e ipilimumab, uno con durvalumab y tremelimumab y uno con cemiplimab. Todos los ensayos eran fase III y se realizaron en pacientes con CPNM localmente avanzado o metastásico que no habían recibido tratamiento. Se añadió el EPAR de pembrolizumab en combinación con platino y nab-paclitaxel, en el que aparecían los datos del segundo análisis intermedio del ensayo clínico KEYNOTE-40517 con los datos de HR en función de la edad, los cuales no se encontraron en los artículos identificados en las bases de datos nombradas anteriormente. Se incluyeron un total de 5.572 pacientes, 2.893 menores de 65 años y 2.679 con 65 años o más. Participaron en ensayos de pembrolizumab 1.175 pacientes, 1.371 en ensayos de atezolizumab, 1.885 en ensayos de nivolumab e ipilimumab, 675 en ensayos de durvalumab y tremelimumab y 466 en ensayos de cemiplimab. La mediana de seguimiento fue de 30,8 meses (rango 7,8–54,8 meses).
Descripción de los ensayos incluidos en el metaanálisis
| Grupos de tratamiento | No. pacientes | <65 años | ≥65 años | Mediana seguimiento | HR SG | HR SG <65 años | HR SG ≥65 años | |
|---|---|---|---|---|---|---|---|---|
| Rodriguez-Abreu et al. (2021)18 | Pembrolizumab más pemetrexed y platino vs. pemetrexed y platino | 616 | 312 | 304 | 31,0 meses | 0,56 (0,46–0,69) | 0,49 (0,37–0,65) | 0,72 (0,54–0,97) |
| EPAR Pembrolizumab19 | Pembrolizumab más carboplatino y paclitaxel o nab-paclitaxel vs. carboplatino y paclitaxel o nab-paclitaxel | 559 | 254 | 305 | 7,8 meses | 0,64 (0.49–0,85) | 0,52 (0,34–0,80) | 0,74 (0,51–1,07) |
| West et al. (2019)20 | Atezolizumab más carboplatino y nab-paclitaxel vs. carboplatino y nab-paclitaxel | 679 | 341 | 338 | 18,5 meses | 0,79 (0,64–0,98) | 0,79 (0,58–1,08) | 0,78 (0,58–1,05) |
| Socinski et al. (2021)21 | Atezolizumab más bevacizumab y carboplatino y paclitaxel vs. bevacizumab y carboplatino y paclitaxel | 692 | 376 | 316 | 39,8 meses | 0,80 (0,67–0,95) | 0,83 (0,65–1,04) | 65–74 años: 0,72 (0,54–0,97)≥75 años: 0,97 (0,58–1,62)HR combinado: 0,77 (0,60–1,00) |
| Paz-Ares et al. (2022)22 | Nivolumab más ipilimumab vs. nivolumab vs. Quimioterapia basada en platino | 1.166 | 611 | 555 | 54,8 meses | 0,76 (0,65–0,90) | 0,71 (0,59–0,85) | 65–74 años: 0,75 (0,61–0,92)≥75 años: 0,85 (0,56–1,28)HR combinado: 0,77 (0,64–0,92)15 |
| Reck et al. (2021)23 | Nivolumab e ipilimumab más doblete de quimioterapia basado en platino en función de la histología vs. solo doblete de quimioterapia basado en platino en función de la histología | 719 | 354 | 365 | 30,7 meses | 0,73 (0,61–0,87) | 0,64 (0,50–0,82) | 65–74 años 0,78 (0,59–1,02)≥75 años 1,04 (0,63–1,72)HR combinado: 0,83 (0,66–1,06) 15 |
| Johnson et al. (2023)24 | Tremelimumab más durvalumab y quimioterapia basada en platino vs. quimioterapia basada en platino | 675 | 367 | 308 | 34,9 meses | 0,77 (0,65–0,92) | 0,79 (0,62–1,00) | 0,74 (0,58–0,94) |
| Makharadze (2023)25 | Cemiplimab más doblete de quimioterapia basado en platino en función de la histología vs. doblete de quimioterapia basado en platino en función de la histología | 466 | 278 | 188 | 28,4 meses | 0,65 (0,51–0,82) | 0,53 (0,39–0,72) | 0,81 (0,55–1,18) |
HR: hazard ratio; SG: supervivencia global.
Dos ensayos, West et al.11 y Socinski et al.12, incluyeron a pacientes con mutaciones moleculares; sin embargo, para realizar el metaanálisis con poblaciones más homogéneas, se incluyeron solo los datos del subgrupo de pacientes wild-type. Las características y resultados de los ensayos clínicos incluidos en el metaanálisis se reflejan en la tabla 1.
En la tabla 2 se enumeran las puntuaciones de la escala Jadad de los ensayos seleccionados. Los pacientes menores de 65 años tratados con una combinación de inmunoterapia y quimioterapia, o sin quimioterapia en el caso de nivolumab e ipilimumab, presentaron un riesgo de muerte significativamente menor en comparación con los del grupo control (HR combinado de SG 0,68 (IC 95%: 0,62–0,74; p < 0,000001). En los mayores a 65 años, el beneficio obtenido con el tratamiento experimental respecto al control aportó un HR combinado de SG 0,77 (IC 95%: 0,70–0,84), p < 0,000001) (fig. 2).
Los valores de estimación de heterogeneidad fueron: Q de heterogeneidad 14,84, p = 0,03812, I2 53% (IC 95%: 0–79%) en el grupo de los menores de 65 años, y Q de heterogeneidad 0,81, p = 0,99,733, I2 0% (IC 95%: 0–0%) en el de los mayores de 65 años.
La p-interacción calculada entre los HR combinados de los grupos de menores y mayores de 65 años fue de 0,0551.
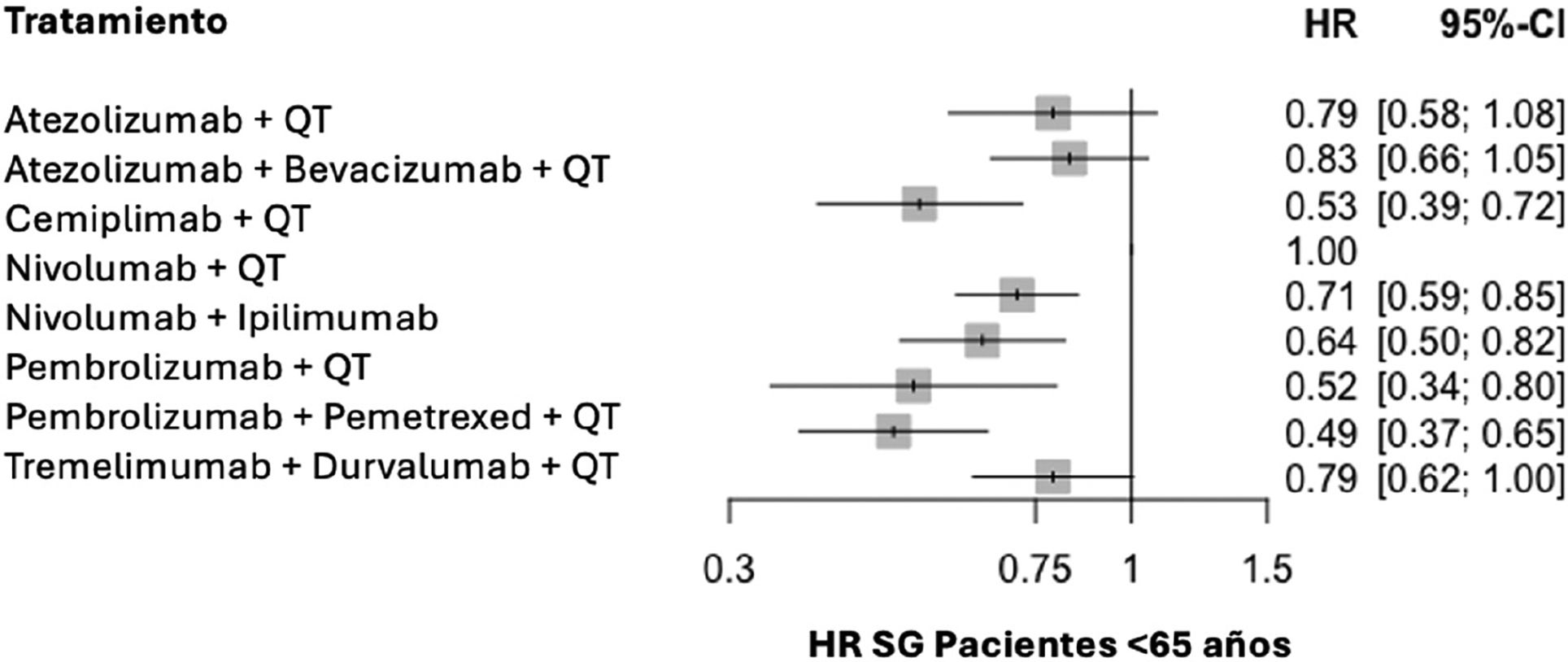
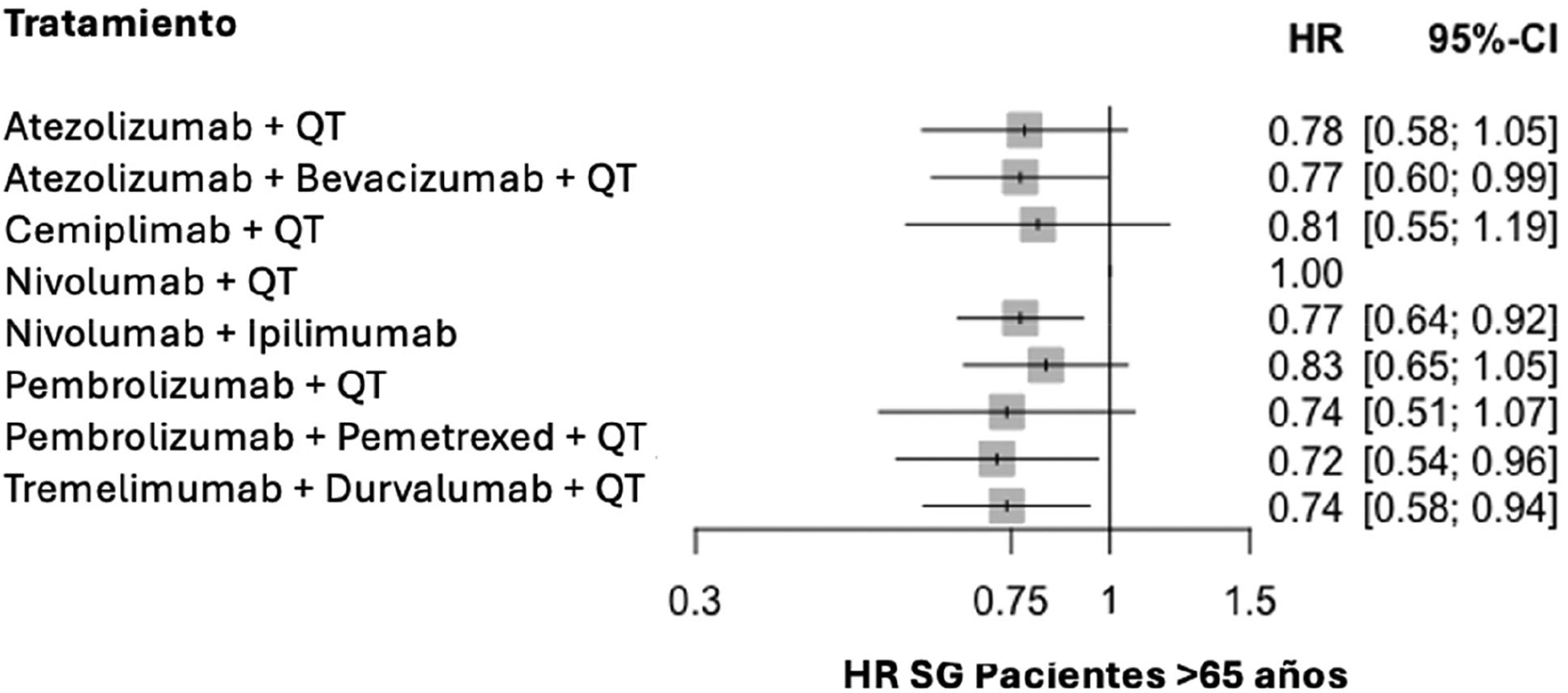
A continuación, se presentan los HR de SG de todos los grupos de tratamiento, organizados según la edad: menores de 65 años (fig. 3) y mayores de 65 años (fig. 4).
Se observaron diferencias significativas entre el tratamiento con inmunoterapia-quimioterapia y placebo-quimioterapia en ambos grupos de pacientes, a favor de inmunoterapia-quimioterapia. Los resultados son compatibles con un menor efecto en pacientes mayores de 65 años, aunque la combinación de inmunoterapia con quimioterapia resultó eficaz en ambos grupos de edad.
Estos resultados respaldan la hipótesis de que, en los pacientes de edad avanzada, la inmunosenescencia podría afectar la eficacia de los ICI26.
El análisis de heterogeneidad mostró consistencia en los resultados en mayores de 65 años, (I2 = 0%), no así en los menores de esa edad (I2 = 53%). La heterogeneidad en el grupo más joven se centra en los 2 ensayos de pembrolizumab, que presentan mejor resultado de HR; sin embargo, no es posible inferir solo a partir de esto una eficacia diferencial del fármaco en este grupo de edad.
Estos resultados contrastan con los hallazgos del metaanálisis de Wu et al. 27, donde se observa una tendencia a un mayor beneficio de la inmunoterapia en los pacientes mayores de 65 años en comparación con los más jóvenes (HR de SG: 0,64 vs. 0,73; p = 0,025). Sin embargo, es importante considerar las diferencias en el diseño y composición de ambos análisis. Wu et al. 27 incluye una población más heterogénea en cuanto a enfermedades y el efecto de la diferencia de edad en la SG de los pacientes con melanoma es mayor que en los de CPNM. Además, los tratamientos evaluados en su análisis son en monoterapia, mientras que nuestro estudio se centró principalmente en combinaciones de inmunoterapia con quimioterapia. Estas diferencias metodológicas podrían explicar la disparidad observada en los resultados.
En cambio, nuestros hallazgos están más alineados con los de Ferrara et al.11, quienes describen un beneficio significativo de los anti-PD-1 y PD-L1 en adultos mayores, excepto en aquellos mayores de 75 años. La falta de beneficio de los ICI en pacientes mayores de 75 años es coherente con los datos de los ensayos clínicos que describen los datos desagregados de HR de SG en este grupo específico de pacientes, que quedan reflejados en la tabla 121–23, si bien en el presente estudio no se realizó análisis en este grupo poblacional.
Sin embargo, Ferrara et al.11, en la revisión también incluyen estudios de vida real más extensos que demuestran que no hay una diferencia significativa en la eficacia y ni en la toxicidad de estas terapias entre adultos jóvenes y aquellos mayores de 70 años.
A pesar de que casi la mitad de los diagnósticos de cáncer de pulmón ocurren en personas mayores de 70 años, no existen ensayos clínicos específicos para evaluar la eficacia y seguridad de los agentes anti-PD-1/PD-L1 en la población anciana. Casaluce et al.28 llevaron a cabo una revisión de los resultados de eficacia obtenidos, en los análisis de subgrupos, en pacientes de edad avanzada, de los ensayos clínicos pivotales que llevaron a la aprobación, por parte de la Food and Drug Administration, de los fármacos anti-PD-1/PD-L1 en el CPNM. Concluyen que los datos son limitados por la escasa representación de esta población en los ensayos, y no esclarece si la edad influye, y en qué medida, en la respuesta a los ICI.
Otros estudios y revisiones recientes ofrecen perspectivas complementarias. Por ejemplo, en la revisión narrativa realizada por Zhang et al.29, se concluye que el beneficio clínico en pacientes mayores de 65 años tratados con pembrolizumab, nivolumab o atezolizumab en monoterapia en CPNM es comparable al observado en pacientes más jóvenes. Sin embargo, señalan que estos resultados derivan de ensayos que seleccionan pacientes con excelente estado de salud y condición física, lo cual limita su aplicabilidad a la población anciana general, que frecuentemente presenta comorbilidades, fragilidad y otras características que podrían modificar la respuesta al tratamiento. Esta limitación también ha sido destacada por Tagliamento et al.10, quienes describieron los datos de eficacia del tratamiento de inmunoterapia en combinación con quimioterapia en pacientes con CPNM metastásico. Subrayan la escasa representación de los pacientes mayores de 75 años en los ensayos clínicos y la necesidad de interpretar los resultados con cautela en este subgrupo.
Los datos procedentes de estudios en vida real ofrecen una perspectiva adicional sobre la eficacia de los ICI en la población anciana. Ramos et al.30 llevaron a cabo un estudio retrospectivo de cohortes en vida real para evaluar la efectividad de la inmunoterapia en pacientes jóvenes y mayores con tumores sólidos metastásicos. El uso de ICI no muestra diferencias significativas en cuanto a la SG y la supervivencia libre de progresión entre grupos de edad (p = 0,388). Estos resultados refuerzan la idea de que la edad cronológica, por sí sola, no debe ser un criterio exclusivo para decidir el tratamiento, y respaldan la necesidad de evaluar a los pacientes de forma individualizada mediante herramientas específicas de valoración geriátrica.
Por su parte, Gomes et al.12 recalcan la importancia de generar evidencia para abordar el uso de la inmunoterapia en la población de edad avanzada, incluyendo medidas de fragilidad y variables como la calidad de vida reportada por los pacientes. Destacan la relevancia de evaluar la inmunosenescencia mediante el uso de marcadores biológicos y pruebas específicas, con el fin de determinar si los cambios en el sistema inmunitario debidos a la edad afectan la eficacia y toxicidad del tratamiento. Remarcan la importancia de diseñar ensayos centrados en esta población de pacientes, incluir subgrupos de pacientes de edad avanzada en los ensayos clínicos pivotales y fomentar la publicación de datos de vida real.
De forma concordante, Montrone et al.31 recomiendan el uso de inmunoterapia en pacientes mayores, aunque enfatizan la necesidad de evaluar el balance beneficio-riesgo en pacientes muy ancianos, ya que algunas combinaciones, como las de anti PD-1 y anti-CTLA-4, pueden resultar muy tóxicas y poco eficaces en estos casos. Además, subrayan la importancia de realizar una evaluación preliminar utilizando herramientas de fragilidad y considerar la polifarmacia en pacientes ancianos.
Un metaanálisis similar al nuestro, realizado por Hu et al.32, que evalúa el impacto de características como el sexo, la edad, el estado funcional y el estado de tabaquismo en la SG de los pacientes con CPNM avanzado tratados con ICI, concluye que los ICI mejoran significativamente la supervivencia independientemente de la edad, tanto en pacientes menores de 65 años (HR 0,74) como en aquellos de 65 años o más (HR 0,80), de forma estadísticamente significativa. De manera similar, otro metanaanálisis llevado a cabo por Kim et al.33 concluye que la eficacia de los ICI fue comparable entre pacientes jóvenes (menores de 65 años) y mayores de 65 años, con una HR para la SG de 0,77 en ambos grupos. Los resultados de ambos metaanálisis concuerdan con nuestros hallazgos.
En términos generales, el tratamiento con ICI debe contemplar varios aspectos relevantes, como la infrarrepresentación sistemática de pacientes mayores, especialmente aquellos mayores de 75 años, en los ensayos clínicos10,28; la necesidad de aplicar escalas de fragilidad y evaluaciones geriátricas para una adecuada selección de candidatos a inmunoterapia12,31; y el valor añadido de los estudios en vida real para complementar los hallazgos de los ensayos clínicos12.
Desde el punto de vista metodológico, un punto fuerte de este trabajo es que se incluyeron 8 ensayos clínicos con resultados de supervivencia global de 5.572 pacientes, lo que otorga solidez y validez interna a los resultados. Sin embargo, el análisis también presenta varias limitaciones. En primer lugar, se incluyeron ensayos en los que el tratamiento del grupo experimental utiliza ICI con diferentes mecanismos de acción inmunológica (anti-PD-L1, anti-PD-1, anti-CTLA-4), incluso algunos utilizan combinaciones de estos fármacos. El metaanálisis incluyó la combinación de nivolumab e ipilimumab sin quimioterapia, ya que forma parte del arsenal terapéutico aprobado en el escenario analizado. Sin embargo, es importante señalar que existe incertidumbre sobre si los resultados de eficacia son comparables al resto de combinaciones de inmunoterapia y quimioterapia.
Además, se incluyeron regímenes de tratamiento aprobados para histología no escamosa, escamosa y ambas, y se analizaron los datos de eficacia en conjunto. Sin embargo, en los análisis de subgrupos de las combinaciones aprobadas en ambas histologías, no se observaron diferencias en términos de eficacia entre la escamosa y no escamosa, por lo que no se esperaba que esto introdujera un sesgo importante en el metaanálisis.
Una importante limitación de esta investigación radica en el punto de corte de la edad. Se optó por utilizar los 65 años, dado que es el criterio más común en los estudios revisados, pero habría sido valioso disponer de una mayor desagregación para evaluar diferencias en la eficacia, particularmente en pacientes de mayor edad, cuya respuesta al tratamiento podría verse más influenciada por la inmunosenescencia. Además, es razonable suponer que los pacientes de edad avanzada incluidos en los estudios sobre quimioterapia son, en su mayoría, aquellos que presentan un mejor estado de salud.
Por último, es importante destacar que en el estudio solo se incluyeron datos de ensayos clínicos aleatorizados para garantizar una mayor validez interna en los resultados del estudio y controlar los posibles sesgos. Sin embargo, esto implicó excluir datos de cohortes en vida real, lo que limita la generalización de los hallazgos a la práctica clínica habitual.
En conclusión, tanto los pacientes menores como mayores de 65 años obtienen beneficios del uso de la inmunoterapia en combinación con quimioterapia en el tratamiento del CPNM localmente avanzado o metastásico. Aunque los resultados son compatibles con una mayor eficacia en pacientes menores de 65 años, existe incertidumbre sobre este posible efecto relacionado con la edad.
Aportación a la literaturaEste metaanálisis tiene como objetivo evaluar la influencia de la edad en la eficacia de los tratamientos basados en quimioterapia combinada con inmunoterapia o doble inmunoterapia, en pacientes con cáncer de pulmón no microcítico metastásico. Este enfoque es clave porque permite desagregar los beneficios del tratamiento, ofreciendo así una visión más precisa y personalizada, esencial en el contexto de la medicina basada en evidencia.
Los resultados de este metaanálisis cobran especial importancia en el contexto clínico, dado que los pacientes mayores de 65 años, aunque representan una proporción significativa en la práctica clínica habitual, suelen estar infrarrepresentados en los ensayos clínicos. Generar evidencia específica para este grupo permite ajustar las decisiones terapéuticas a sus características particulares. Esta información ofrece a los profesionales de la salud una herramienta valiosa para orientar mejor el tratamiento, equilibrando riesgos y beneficios según la edad, y garantizando así una atención más adecuada, segura y respaldada por datos concretos en pacientes de edad avanzada.
FinanciaciónLos autores declaran que no han recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Declaración de contribución de autoría CRediTAlicia Aguado-Paredes: Writing – original draft, Visualization, Validation, Supervision, Software, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Laura Moñino-Dominguez: Writing – original draft, Visualization, Validation, Supervision, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Jaime Cordero-Ramos: Writing – original draft, Validation, Supervision, Software, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Emilio Alegre-Del-Rey: Writing – original draft, Validation, Supervision, Software, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization.