analizar posibles cambios en la política antibiótica de ceftazidima-avibactam durante la pandemia por SARS-CoV-2 en una unidad de medicina intensiva, determinar la mortalidad de los pacientes a los 28 días del inicio del antimicrobiano y describir los microorganismos que más frecuentemente colonizan a los pacientes críticos.
Material y métodosestudio observacional, unicéntrico y de cohortes que incluyó a pacientes en tratamiento con ceftazidima-avibactam en medicina intensiva entre marzo de 2020 y septiembre de 2021. Se recogieron variables demográficas (edad, sexo), microbiológicas (colonización, microorganismos aislados en hemocultivos), farmacoterapéuticas (duración de tratamiento con ceftazidima-avibactam, antimicrobianos empleados en sinergia con ceftazidima-avibactam) y clínicas (mortalidad, tiempo de estancia hospitalaria y comorbilidades). Como comorbilidades asociadas, se identificaron cuántos de los pacientes incluidos en el estudio presentaron diabetes mellitus (DM), enfermedad renal crónica (ERC), enfermedad pulmonar obstructiva crónica (EPOC) u obesidad.
Resultadosse incluyeron 89 pacientes, siendo el 85,39% hombres. Presentaron infección por SARS-CoV-2 49 pacientes. La mediana de estancia en la UCI fue de 46 días (RIQ = 58–27) en infectados por SARS-CoV-2 y de 34 días (RIQ = 51–24) en pacientes no infectados. Los pacientes estuvieron en tratamiento con ceftazidima-avibactam durante una mediana de 8 días (RIQ = 13–4), siendo de 7 días (RIQ = 11–2) en pacientes COVID-19 positivos y de 11 días (RIQ = 14–6) en los negativos (p > 0,05). El 41,57% (n = 37) de los pacientes había comenzado el tratamiento con ceftazidima-avibactam de forma empírica. El porcentaje de inicios empíricos en pacientes infectados por SARS-CoV-2 fue del 43% y en los pacientes no infectados del 40%, no habiendo diferencias estadísticamente significativas entre el inicio de forma empírica según el estado de diagnóstico de SARS-CoV-2 (p > 0,05). El 43,8% (n = 39) de los pacientes estaba colonizado por alguna bacteria multirresistente (BMR). Con respecto a los microorganismos que presentaban los pacientes colonizados, el más frecuente fue Klebsiella pneumoniae, presente en el 66,6% de los pacientes (n = 26 pacientes). La mortalidad global fue del 41,6%, no observándose diferencias estadísticamente significativas entre los infectados y los no infectados por SARS-CoV-2 (42,9 y 40%, respectivamente; p > 0,05).
Conclusiónla pandemia por SARS-CoV-2 no conllevó un cambio en los criterios de utilización de ceftazidima-avibactam en el paciente crítico.
The objective of the study was to analyse possible changes in antibiotic policy with ceftazidime-avibactam during the SARS-CoV-2 pandemic in an Intensive Care Unit (ICU) to determine patient mortality 28 days after initiation of antimicrobial therapy and to describe the microorganisms that most frequently colonise critically ill patients.
Material and methodObservational, single-centre, cohort study that included patients on treatment with ceftazidime-avibactam in ICU between March 2020 and September 2021. Demographic (age, sex), microbiological (colonisation, microorganisms isolated in blood cultures), pharmacotherapeutic (duration of treatment with ceftazidime-avibactam, antimicrobials used in synergy with ceftazidime-avibactam) and clinical (mortality, length of hospital stay and comorbidities) variables were collected. As associated comorbidities, we identified how many of the patients included in the study had diabetes mellitus (DM), chronic kidney disease (CKD), chronic obstructive pulmonary disease (COPD) or obesity.
ResultsEighty-nine patients were included, 85.39% of whom were male. Forty-nine patients were infected with Sars-CoV-2. Median ICU stay was 46 days (RIQ = 58–27) in SARS-CoV-2 infected and 34 days (RIQ = 51–24) in non-infected patients. Patients were on ceftazidime-avibactam treatment for a median of 8 days (RIQ = 13–4), being 7 days (RIQ = 11–2) in COVID-19 positive patients and 11 days (RIQ = 14–6) in COVID-19 negative patients (p > 0.05). Empirical treatment with ceftazidime-avibactam was started empirically in 41.57% (n = 37) of the patients. The percentage of empiric initiations in SARS-CoV-2 infected patients was 43% and in non-infected patients 40%, with no statistically significant difference between empiric initiation according to SARS-CoV-2 diagnostic status (p > 0.05). A total of 43.8% (n = 39) of the patients were colonised by a multidrug-resistant (MDR) bacterium. Regarding on the microorganisms that colonised patients had, the most frequent was Klebsiella pneumoniae, present in 66.6% of patients (n = 26 patients). Overall mortality was 41.6%, with no statistically significant differences between SARS-CoV-2 infected and non-infected patients (42.9% and 40%, respectively; p > 0.05).
ConclusionThe SARS-CoV-2 pandemic did not lead to a change in the criteria for the use of ceftazidime-avibactam in the critically ill patient.
La resistencia antibiótica conlleva gran morbimortalidad y, por ello, actualmente puede considerarse una amenaza mundial para la salud1. En parte, se debe al uso inadecuado y excesivo que se hace de los antibióticos2. En un artículo publicado recientemente, los autores estimaron que en 2019 4.950.000 muertes se asociaron a la resistencia antibiótica3.
Los antibióticos betalactámicos y carbapenémicos son efectivos para combatir infecciones por bacterias gramnegativas, aunque su efectividad se ha visto reducida debido a distintos mecanismos de resistencia de los microorganismos, tales como bombas de eflujo, producción de betalactamasas o modificaciones en la diana4. Esto ha llevado al desarrollo y la comercialización de nuevos antibióticos que puedan evadir estos mecanismos y sean eficaces frente a los microorganismos.
Ceftazidima–avibactam es una combinación de 2 principios activos que evade uno de los mecanismos de resistencia que presentan los microorganismos a las cefalosporinas5. Ceftazidima es una cefalosporina de tercera generación de amplio espectro con gran actividad frente a bacilos gramnegativos aerobios, pero puede ser inactivado por cefamicinasas (AmpC), por carbapenemasas y por betalactamasas de espectro extendido (BLEE)6. Avibactam presenta una estructura de diazabiciclooctano, que se une de forma covalente y reversiblemente a betalactamasas5. Ceftazidima-avibactam es un antibiótico autorizado en España desde 2016, con restricción de financiación para infecciones muy graves producidas por cepas bacterianas resistentes a carbapenémicos cuando no existe alternativa terapéutica. En el caso de que se emplee como tratamiento empírico, la financiación se restringe a situaciones en las que el paciente está colonizado por Klebsiella, productora de KPC o OXA-487.
El uso empírico de ceftazidima-avibactam podría estar justificado en ciertas situaciones, como en pacientes colonizados por microorganismos multirresistentes o en pacientes críticos con alto riesgo de presentar una infección por microorganismos multirresistentes. En un estudio retrospectivo llevado a cabo en India se describió que el antibiótico ceftazidima-avibactam fue empleado en bastantes ocasiones de manera empírica en pacientes críticos en los que se sospechaba de infecciones nosocomiales8.
La sobrecarga asistencial durante las primeras olas de la pandemia producida por el virus SARS-CoV-2 y la gravedad de los pacientes generaron un incremento en el consumo global de ciertos antimicrobianos en el entorno hospitalario9. Se ha reportado que los antibióticos más frecuentemente prescritos durante la primera ola de la pandemia fueron las quinolonas y las cefalosporinas de tercera generación10. Además, después de los años de pandemia, la resistencia antimicrobiana a antibióticos ha aumentado11.
La mayor parte de los inicios de tratamiento antimicrobiano en unidades de medicina intensiva (UMI) suele ser empírico, teniendo en cuenta comorbilidades del paciente, lugar donde se produce la infección y la severidad clínica del paciente12.
Por ello, el objetivo del presente estudio fue comparar el patrón de uso de ceftazidima-avibactam en una UMI durante la época pandémica.
Material y métodosSe llevó a cabo un estudio retrospectivo, observacional, unicéntrico y de cohortes en un hospital de clase 5 según la clasificación Clúster de hospitales. Se incluyeron todos los pacientes que estuvieron ingresados en la UMI y que recibieron tratamiento con ceftazidima-avibactam en el periodo comprendido entre marzo de 2020 y septiembre de 2021. Una de las cohortes incluyó a los pacientes con diagnóstico de SARS-CoV-2 (confirmado mediante la detección de ARN del virus SARS-CoV-2 por la prueba de reacción en cadena de la polimerasa de transcripción inversa en tiempo real [RT-PCR] o confirmado mediante la detección de anticuerpos IgM y IgG) y la otra cohorte incluyó a los pacientes sin diagnóstico de SARS-CoV-2. Los datos se obtuvieron a través de la historia clínica electrónica integrada con la prescripción electrónica asistida.
El objetivo primario fue comparar el patrón de uso de ceftazidima-avibactam en pacientes con infección por SARS-CoV-2 frente a pacientes no infectados durante la pandemia en una UMI. Entre los objetivos secundarios del estudio se encontraron determinar la mortalidad de los pacientes a los 28 días del inicio del antimicrobiano y describir los microorganismos más frecuentemente aislados en pacientes críticos.
Se recogieron variables demográficas (edad, sexo), microbiológicas (colonización, microorganismos aislados en hemocultivos), farmacoterapéuticas (duración de tratamiento con ceftazidima-avibactam, antimicrobianos empleados en sinergia con ceftazidima-avibactam) y clínicas (mortalidad, tiempo de estancia hospitalaria y comorbilidades). Como comorbilidades asociadas se identificaron cuántos de los pacientes incluidos en el estudio presentaron diabetes mellitus (DM), enfermedad renal crónica (ERC), enfermedad pulmonar obstructiva crónica (EPOC) u obesidad.
Se definió bacteriemia como la presencia de bacterias en uno o más hemocultivos. La sepsis se definió, desde el año 2016, como «una disfunción orgánica potencialmente mortal causada por una respuesta exagerada del paciente a la infección, con una disfunción orgánica identificada basándose en el aumento de al menos 2 puntos en la escala que evalúa el fallo orgánico secuencial (escala SOFA)»13.
Para el análisis estadístico, se realizó un análisis descriptivo y un análisis inferencial. En el primer tipo de análisis, los resultados se expresaron a través de la media, la desviación estándar, mediana y rango intercuartílico (RIQ). En el segundo análisis, la comparación de variables cuantitativas se realizó mediante la prueba t de Student. Las diferencias entre esas variables fueron consideradas significativas cuando p < 0,05.
El estudio fue aprobado por el Comité de Ética del medicamento del centro, con código interno 24/010.
ResultadosSe incluyeron 89 pacientes, de los cuales el 85,40% fueron hombres. El 55% (n = 49) presentaron infección por SARS-CoV-2. En la tabla 1 se describen las principales características de los pacientes de ambas cohortes.
Características de los pacientes a estudio
| Cohorte de infectados por SARS-CoV-2 (n = 49) | Cohorte control (n = 40) | Total | |
|---|---|---|---|
| Comorbilidades | |||
| Edad media(rango) | 56 (64–50) | 50 (63–33) | |
| Sexo | 45 varones (91,9%) | 31 varones (77,5%) | 89 |
| DM | 10 (71,43%) | 4 (28,57%) | 14 |
| ERC | 2 (33,33%) | 4 (66,67%) | 6 |
| EPOC | – | 3 (100%) | 3 |
| Obesidada | 17 (94,44%) | 1 (5,56%) | 18 |
DM: diabetes mellitus; ERC: enfermedad renal crónica; EPOC: enfermedad pulmonar obstructiva crónica.
La mediana de estancia hospitalaria fue de 45 días (RIQ = 66–33) y la mediana de estancia en UMI, de 40 días (RIQ = 54–25), siendo esta última de 46 días (RIQ = 58–27) en infectados por SARS-CoV-2 y de 34 días (RIQ = 51–24) en pacientes no infectados. Los pacientes estuvieron en tratamiento con ceftazidima-avibactam durante una mediana de 8 días (RIQ = 13–4), siendo de 7 días (RIQ = 11–2) en pacientes COVID-19 positivos y de 11 días (RIQ = 14–6) en los negativos (p > 0,05).
El 41,57% (n = 37) de los pacientes había comenzado el tratamiento con ceftazidima-avibactam de forma empírica. El porcentaje de inicios empíricos en pacientes infectados por SARS-CoV-2 fue del 43% y en los pacientes no infectados del 40%, no habiendo diferencias estadísticamente significativas entre el inicio de forma empírica según el estado de diagnóstico de SARS-CoV-2 (p > 0,05).
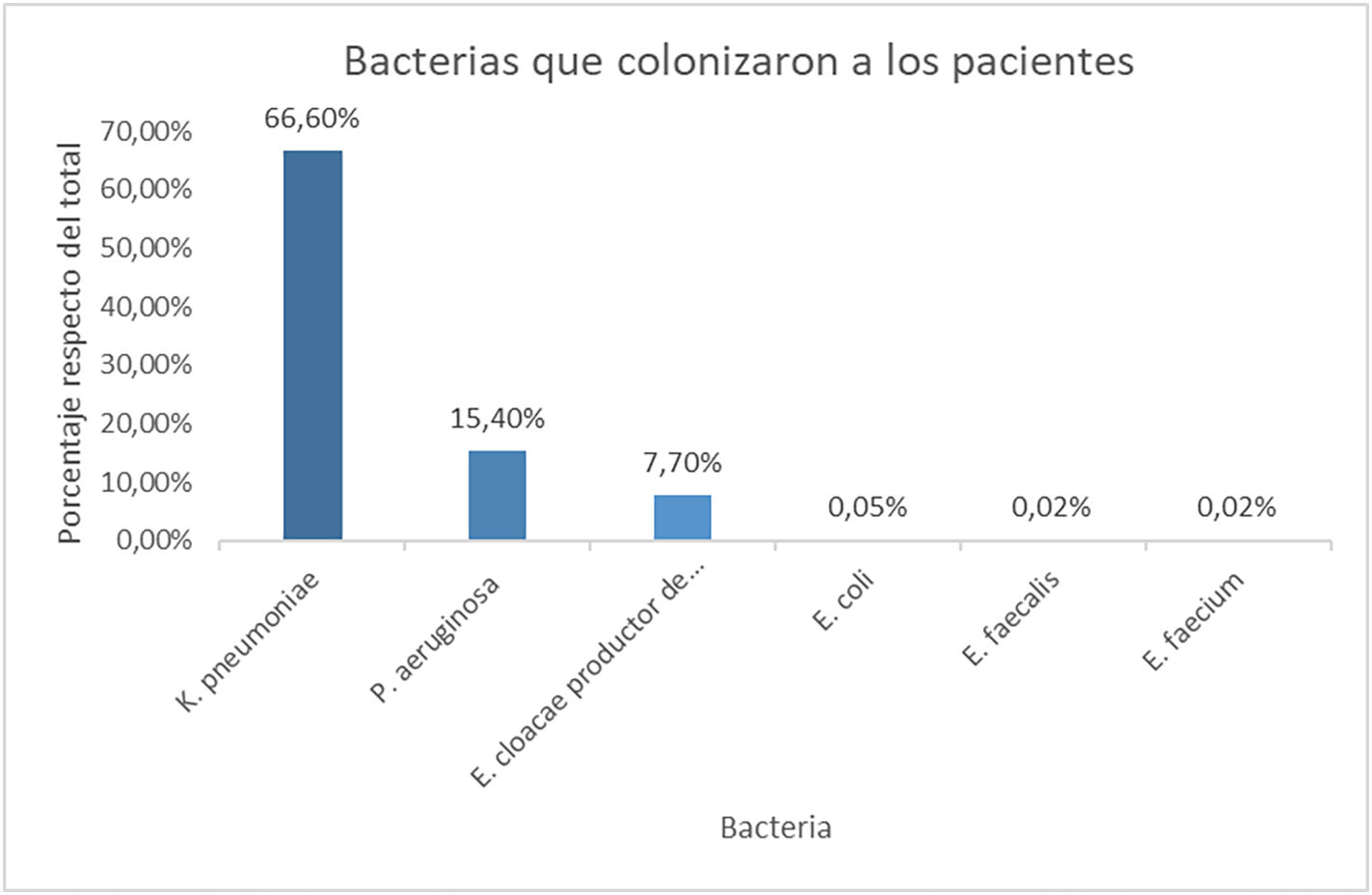
El 43,8% (n = 39) de los pacientes estaba colonizado por alguna bacteria multirresistente (BMR). De estos, el 51,3% (n = 20) presentaba infección por SARS-CoV-2 y entre ambos grupos (COVID-19 positivos y negativos) no se encontraron diferencias estadísticamente significativas (p > 0,05). Con respecto a los microorganismos que presentaban los pacientes colonizados, el más frecuente fue Klebsiella Pneumoniae (K. pneumoniae), presente en 26 pacientes (66,6%). De ellos, 19 eran cepas productoras de VIM.
En la figura 1 se describen todos los microorganismos responsables de la colonización de los pacientes.
Al 52,8% (n = 47) se les prescribió aztreonam conjuntamente por su efecto sinérgico. De ellos, el 36, 17% (n = 17), había iniciado tratamiento de forma empírica. En la tabla 2 se muestran los porcentajes de pacientes con ceftazidima-avibactam y aztreonam en cada cohorte.
Pacientes en tratamiento con ceftazidima-avibactam y aztreonam en cada cohorte de pacientes
| Infectados por SARS- CoV-2 (n = 49) n (%) | Cohorte control (n = 40) n (%) | Total | |
|---|---|---|---|
| Pacientes con ceftazidima- avibactam + aztreonam | 24 (51,06) | 23 (48,94) | 47 |
| Pacientes que iniciaron empíricamente ceftazidima- avibactam | 21 (56,76) | 16 (43,24) | 37 |
| Pacientes que iniciaron empíricamente ceftazidima- avibactam + aztreonam | 9 (52,94) | 8 (47,06) | 17 |
En el 10,1% (n = 9) de los pacientes se confirmó la presencia de bacteriemia. De ellos, el 88,88% (n = 8) presentaba diagnóstico de SARS-CoV-2, y en 4 de estos pacientes la bacteriemia fue causada por K. pneumoniae, en 3 por Pseudomonas aeruginosa y en uno por Enterococcus faecium. En el paciente que no era COVID-19 positivo la bacteria aislada fue Enterobacter asburiae.
La mortalidad global fue del 41,6%, no observándose diferencias estadísticamente significativas entre los infectados y los no infectados por SARS-CoV-2 (42,9 y 40%, respectivamente; p > 0,05).
El 81% de los pacientes que fallecieron lo hicieron antes de 28 días tras el inicio de tratamiento con ceftazidima-avibactam. En la tabla 3 se representa la mortalidad en función de las comorbilidades de los pacientes a estudio.
Mortalidad según comorbilidad de los pacientes
| Comorbilidad | Número total de fallecidos, n (%) | Número de fallecidos que estaba infectado de COVID-19, n (%) |
|---|---|---|
| DM (n = 14) | 9 (64,29) | 6 (42,86) |
| ERC (n = 6) | 3 (50) | – |
| EPOC (n = 3) | 2 (66,67) | – |
| Obesidad (n = 18) | 9 (50) | 9 (50) |
DM: diabetes mellitus; ERC: enfermedad renal crónica; EPOC: enfermedad pulmonar obstructiva crónica.
En nuestro estudio observacional retrospectivo, que pretendía evaluar el uso de ceftazidima-avibactam en UMI en las primeras olas de la pandemia, no se ha observado un patrón de uso distinto en pacientes con infección por COVID-19 frente a los no infectados.
En otro trabajo llevado a cabo en un hospital de tercer nivel español en pacientes con COVID-19, el 80% de los pacientes ingresados en UCI había recibido tratamiento empírico de amplio espectro14. No obstante, no se debería comparar este porcentaje con el obtenido en nuestro estudio, ya que el antibiótico que mayormente se utilizó de forma empírica en los pacientes incluidos en el trabajo de Nebreda-Mayoral T. et al., fue ceftriaxona y en nuestro trabajo únicamente evaluamos el uso empírico de ceftazidima-avibactam, determinándose que el 43% de los pacientes con SARS-CoV-2 había comenzado tratamiento con el mismo de forma empírica.
Sí hay trabajos que evalúan el uso de ceftazidima-avibactam de forma empírica, como el llevado a cabo por Hernández-Terciado C. et al.15, que se realizó en un periodo anterior al nuestro (entre julio de 2018 y junio de 2019, antes, por tanto, de la pandemia). En él se describió que el 67% de los pacientes que habían recibido al menos una dosis de ceftazidima-avibactam lo habían hecho de forma empírica. En nuestro estudio la prescripción empírica de este antibiótico se realizó en un 41,57% de los pacientes, incluyendo tanto a infectados como a no infectados de SARS-CoV-2. Aunque en el trabajo de Hernández-Terciado C. et. al. no se clasifica la utilización de este antibiótico en función del servicio médico prescriptor, y en el nuestro solo evaluamos a pacientes ingresados en UMI, se puede describir que el porcentaje de inicio empírico con el mismo ya era elevado en un período prepandemia.
Con respecto a la edad, si comparamos nuestros resultados con los del estudio llevado a cabo por Docherty et al.16, que incluyó a pacientes COVID-19 positivos, la edad media de los pacientes en nuestro hospital fue inferior, ya que en este trabajo la edad media de los pacientes hospitalizados fue de 72 años. Sin embargo, si comparamos la edad media de nuestro estudio (53 años) con la del estudio de García-Vidal et al.17, estas son semejantes, ya que en él, la edad media de los pacientes incluidos en la revisión sistemática fue de 59 años.
En una revisión sistemática llevada a cabo por Rees EM et al.18, se estableció que la mediana de estancia en UMI de los pacientes COVID-19 positivos fue de 8 días en China y de 7 días en otros países. Esto difiere bastante con lo hallado en nuestro estudio, con una mediana de estancia en UMI de 46 días (RIQ = 58–27) en infectados por SARS-CoV-2.
Con respecto a la mortalidad, en el análisis de subgrupos de Hulme KD et al.19, se observó que la obesidad se asocia a una mayor mortalidad en pacientes infectados por SARS-CoV-2, con independencia de la conexión a ventilación mecánica invasiva (VMI) o a presentar insuficiencia respiratoria. Esto concuerda con lo hallado en nuestro estudio, en el que se determinó que el 100% de los pacientes obesos fallecidos eran COVID-19 positivos. Lo mismo ocurrió con pacientes que presentaban DM, que en nuestro estudio el 66,6% de los pacientes fallecidos con esta enfermedad eran COVID-19 positivos. En el estudio de Lim S. et al.20 se indicó que la hiperglucemia podría favorecer la replicación vírica, aumentando la morbimortalidad de los pacientes con SARS-CoV-2.
Si se evalúan las bacterias más frecuentemente aisladas en hemocultivos en nuestro estudio con las del estudio llevado a cabo por Aguilera-Calzadilla Y. et al.21, en ambos fueron mayormente gramnegativas. Esto concuerda con lo descrito en la revisión de Grau S. et al., en el que se indica que la mayoría de microorganismos aislados en unidades de críticos son los gramnegativos, correspondiendo al 67% de los microorganismos aislados en esa área22. La bacteria que fue aislada en mayor proporción en los pacientes con SARS-CoV-2 del estudio de Aguilera-Calzadilla Y. et. al.21 fue Escherichia coli, seguida de K. pneumoniae, lo que varía con lo hallado por nosotros, que fue K. pneumoniae seguida de P. aeruginosa.
Como limitaciones de nuestro estudio se pueden encontrar que no hemos evaluado el uso de ceftazidima-avibactam durante un periodo sin pandemia y que no hemos diferenciado la infección secundaria asociada a COVID-19 y coinfección bacteriana en los pacientes COVID-19 positivos. En diversos estudios se destaca la diferencia entre infección secundaria asociada a COVID-19 o sobreinfección y coinfección bacteriana en los pacientes COVID-19 positivos, describiendo que la coinfección ocurría en las primeras 48 horas tras el ingreso hospitalario y la infección secundaria, tras esas 48 horas17. En nuestro estudio no se evaluó cuándo se aisló una bacteria BMR en el paciente, por lo que no podemos analizar la prevalencia de coinfección bacteriana y de infección secundaria asociada a COVID-19. Existen estudios en los que se evaluó el uso de ceftazidima-avibactam en pacientes con infección por SARS-CoV-2 ingresados en la UCI con neumonía asociada a ventilación mecánica, como es el caso del estudio de Burastero G.J. et al.23; no obstante, no se encontró en la literatura ningún estudio que compare el patrón de uso de ceftazidima-avibactam en función de la infección por SARS-CoV-2.
Aportación a la literatura científicaEl presente estudio aporta experiencia de uso de ceftazidima-avibactam en la época pandémica de SARS-CoV-2. Dado que actualmente no existen muchos estudios publicados en España que describan cómo se estuvieron utilizando los antibióticos durante esa época, ni cuáles fueron los microorganismos que en mayor medida colonizaron a los pacientes, con este estudio se podría determinar si un antibiótico con restricción de uso presentó un mayor número de inicios empíricos o no durante esos años.
Declaración de contribución de autoría CRediTFátima Mayo Olveira: Conceptualization, Data curation, Formal analysis, Funding acquisition, Investigation, Methodology, Project administration, Resources, Software, Supervision, Validation, Visualization, Writing – original draft, Writing – review & editing. José Manuel Caro Teller: Methodology, Visualization, Writing – original draft, Writing – review & editing. María Dolores Canales Siguero: Conceptualization, Formal analysis, Investigation. Sara Ortiz Pérez: Funding acquisition, Software, Validation. María del Carmen Jiménez León: Formal analysis, Validation. José Miguel Ferrari Piquero: Investigation, Project administration, Resources, Visualization.