el cáncer de endometrio con inestabilidad de microsatélites (MSI) representa el 30% de casos diagnosticados. Existe incertidumbre respecto al tratamiento de segunda línea, tras una primera línea basada en platino. El objetivo de este estudio fue realizar una revisión sistemática sobre la evidencia científica de los tratamientos inmunoterápicos para el cáncer de endometrio con MSI.
Métodosse realizó una búsqueda en la base de datos PubMed y Embase hasta el 28 de mayo de 2024. Se incluyeron ensayos clínicos con pacientes que presentaran deficiencia de reparación de emparejamientos erróneos (dMMR) o alta inestabilidad de microsatélites (MSI-H) diagnosticados de cáncer de endometrio avanzado y metastásico que habían recibido previamente quimioterapia basada en platino. Se descartaron los ensayos clínicos con un tamaño de población de dMMR o MSI-H inferior a 10 pacientes. Para determinar los fármacos de mayor interés se emplearon los resultados de eficacia en supervivencia global, supervivencia libre de progresión y tasa de respuesta objetiva. Se realizó un análisis sobre la seguridad de las terapias.
Resultadosse encontraron 54 estudios, de los cuales 14 ensayos clínicos fueron incluidos. Los siguientes fármacos fueron evaluados: pembrolizumab en monoterapia, pembrolizumab más lenvatinib, durvalumab, durvalumab en combinación con tremelimumab, dostarlimab, nivolumab y avelumab. El mayor efecto numérico en eficacia se alcanzó con pembrolizumab, seguido de pembrolizumab en combinación con lenvatinib. Los eventos adversos más frecuentes fueron fatiga y alteraciones gastrointestinales.
Conclusionesla eficacia de pembrolizumab y del régimen pembrolizumab-lenvatinib parece prometedora. Sin embargo, son necesarios estudios con mayor tamaño muestral, seguimiento más prolongado y diseño comparativo con análisis de subgrupos basado en diferencias en los mecanismos de reparación de microsatélites para un posicionamiento terapéutico adecuado.
Endometrial cancer with microsatellite instability (MSI) involves 30% of diagnosed cases. There are some uncertainty about second-line treatment, after platinum-based first-line treatment. The aim of this study was to perform a systematic review on the scientific evidence of immunotherapies for endometrial cancer with MSI.
MethodsPubMed and Embase databases were searched up to May 28, 2024. We included clinical trials about patients with mismatch repair deficiency (dMMR) or high microsatellite instability (MSI-H) diagnosed with advanced and/or metastatic endometrial cancer who had previously received platinum-based chemotherapy. Clinical trials with a dMMR or MSI-H population size of less than 10 patients were discarded. Efficacy results in overall survival, progression-free survival and objective response rate were used to determine the most interesting drugs. A safety analysis of therapies was developed.
ResultsFifty-four studies were found in a systematic search. Fourteen clinical trials were selected. The following drugs were evaluated: pembrolizumab monotherapy, pembrolizumab plus lenvatinib, durvalumab, durvalumab-tremelimumab combination, dostarlimab, nivolumab and avelumab. The greatest numerical efficacy effect was achieved by pembrolizumab, followed by pembrolizumab in combination with lenvatinib. The most common adverse events were fatigue and gastrointestinal disorders.
ConclusionThe efficacy of pembrolizumab and pembrolizumab-lenvatinib regimen appears promising. However, studies with larger sample size, longer follow-up and comparative design with subgroup analysis based on differences in microsatellite repair mechanisms are needed for proper therapeutic positioning.
El cáncer de endometrio (CE) es la sexta neoplasia más diagnosticada en mujeres. En 2020, esta enfermedad causó 97.000 muertes en todo el mundo1. Algunos casos de CE se han asociado con inestabilidad de microsatélites (MSI, por sus siglas en inglés). Se estima que la prevalencia de MSI en el CE es de alrededor del 30% de los casos diagnosticados2.
El mecanismo de generación de microsatélites (MS) podría explicarse por el desplazamiento del ADN durante la replicación o por un desajuste entre la cadena codificante y la cadena molde durante el proceso de replicación y reparación. Esto da lugar a la adición o deleción errónea de uno o más pares de bases3. El sistema de reparación de desajustes (MMR, por sus siglas en inglés) es un mecanismo de reparación del ADN en células sanas y preserva el número de repeticiones de MS en cada división celular. Las deficiencias en el MMR impiden que las células regulen estas secuencias y se origina la MSI3,4. La ausencia de una o más proteínas MMR (MSH2, MSH6, MLH1 y PMS2) da lugar a una deficiencia de MMR (dMMR). Según la frecuencia de la producción de errores, se distinguen 3 tipos de MSI: MSI alta (MSI-H), MSI baja (MSI-L) y MS estable (MSS)3. Por otro lado, la presencia de todas las proteínas MMR confiere un sistema competente (MMRp)5. Un porcentaje significativo de tumores MSI-H presentan dMMR, mientras que los caracterizados como MSI-L parecen manifestar MMRp. Algunos estudios sugieren que los tumores con características MSI-L o MSS no difieren en su caracterización molecular o fisiológica6,7.
La investigación molecular de los defectos genéticos ha permitido diferenciar otro gen relacionado con la MS, cuya mutación conduce a una elevada acumulación de errores. Las alteraciones en el dominio exonucleasa del gen de la polimerasa ɛ (POLE) se asocian con MSI-H3.
Hasta la fecha, la quimioterapia con platino ha sido el tratamiento de primera línea habitual en el CE avanzado8. Comparado con el CE con MSS, el CE caracterizado por la presencia de MSI se ha asociado con una mayor carga de neoantígenos y un aumento de CD3(+), CD8(+) y de la proteína 1 de muerte celular programada (PD-1) en los linfocitos infiltrantes tumorales9. Del mismo modo, se ha observado un aumento de la expresión del ligando de muerte programada 1 (PD-L1) en las células inmunitarias intraepiteliales de los tumores MSI. Estos hallazgos han conducido al uso de terapias dirigidas a la inhibición de PD-1 o PD-L1 en el tratamiento del CE con MSI. El objetivo de este trabajo fue realizar una revisión sistemática de la literatura sobre la evidencia científica de los fármacos inmunoterapéuticos para el CE con MSI previamente tratado con quimioterapia basada en platino.
MétodosBúsqueda de literatura y selección de estudiosSe aplicó el modelo PICOS para realizar la búsqueda bibliográfica: pacientes, intervención, comparador, objetivo y diseño del estudio10. Se seleccionaron pacientes con dMMR o MSI-H diagnosticados con CE avanzado o metastásico que previamente habían recibido quimioterapia con platino. Se incluyeron todas las inmunoterapias utilizadas como intervención y todos los comparadores. Se seleccionaron como criterios de valoración la tasa de respuesta objetiva (TRO), la supervivencia libre de progresión (SLP) y la supervivencia global (SG). En cuanto al diseño, se incluyeron ensayos clínicos (EC) con un mínimo de 10 pacientes. Debido a la falta de información, se excluyeron las comunicaciones a congresos.
Se utilizó la metodología PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses)11 para realizar una revisión en las bases de datos PubMed y Embase hasta el 28 de mayo de 2024. Se aplicó el filtro «clinical trials» con los siguientes términos: [microsatellite instability OR mismatch repair deficient] AND endometrial cancer. Se utilizó la herramienta PICO en la base de datos Embase® según el modelo PICOS descrito anteriormente. Se usaron los siguientes términos de búsqueda en la base de datos Embase®: (‘endometrium cancer’/exp. AND ‘microsatellite instability’ OR ‘mismatch repair deficient’/exp) AND ‘immunotherapy’/exp. AND (‘objective response rate’/exp. OR ‘progression free survival’/exp. OR ‘overall survival’/exp) AND ‘clinical trial’/exp. AND [< 1966–2024]/py.
Dos investigadores realizaron la búsqueda de forma independiente. Las discrepancias se resolvieron mediante consenso entre los autores del estudio. Se examinaron los títulos y los resúmenes para excluir los resultados que no cumplían los criterios de inclusión del estudio. Se revisaron los artículos completos durante el proceso de elegibilidad. Se aceptaron estudios en inglés o español.
Extracción de datosLos datos de todos los estudios fueron extraídos y validados por 2 investigadores. Se recopilaron las siguientes variables de los ensayos: autores y fechas de publicación, diseño del estudio, histología, estadio, líneas de tratamiento, mediana de seguimiento, número de pacientes, tratamientos utilizados como intervención y control. Para los criterios de valoración de la eficacia, se recopilaron los valores de la TRO, SLP y SG, los intervalos de confianza y los valores relativos en los EC comparativos. En cuanto a la seguridad, se registraron los acontecimientos adversos (AA) más frecuentes de cualquier grado, los de grado 3 o superior y los AA mediados por el sistema inmunitario. También se recogieron datos sobre reducciones de dosis, interrupciones y las muertes atribuidas a AA en aquellos estudios que los detallaron.
Análisis de datos
La importancia de los resultados se determinó en función de la relevancia clínica para el análisis de la eficacia de las alternativas terapéuticas. La variable final más importante fue la SG (tiempo desde la aleatorización hasta la muerte por cualquier causa). La SLP (tiempo desde la aleatorización hasta la progresión o la muerte por cualquier causa) se estableció como la variable subrogada de mayor valor. La TRO, definida como la proporción de pacientes con respuesta parcial o completa según los criterios de evaluación de la respuesta en tumores sólidos (RECIST) versión 1.112, se analizó como la variable subrogada menos relevante. Las alternativas terapéuticas más interesantes se determinaron en función de los criterios de eficacia mencionados anteriormente.
En términos de seguridad, se evaluaron los AA en pacientes que habían recibido al menos una dosis del fármaco durante el EC. Los AA de grado 3 o superior se consideraron los más importantes debido a su difícil manejo. Se comprobaron los AA más frecuentes (independientemente del grado) y los AA mediados por el sistema inmunitario. Se revisaron otros datos, como las reducciones e interrupciones del tratamiento o las muertes relacionadas al mismo.
Los estudios seleccionados se agruparon según los regímenes de tratamiento utilizados.
Riesgo de sesgoSe evaluó la disponibilidad de datos exclusivos sobre la población objetivo (CE avanzado o metastásico que había recibido previamente quimioterapia basada en platino) o los análisis de subgrupos. La calidad de los datos de la población objetivo (pacientes tratados previamente) es superior a la calidad de los resultados de las poblaciones que incluyen pacientes de diferentes líneas de tratamiento. La interpretación inadecuada de los datos agregados podría influir en las conclusiones. También se analizaron los tamaños de las muestras de los EC y los períodos de seguimiento. Se obtienen resultados más fiables con muestras de gran tamaño y períodos de seguimiento prolongados. Un tamaño adecuado de la muestra y un seguimiento adecuado de los pacientes permiten minimizar la obtención de resultados con una dispersión poco realista, así como determinar un número aceptable de eventos.
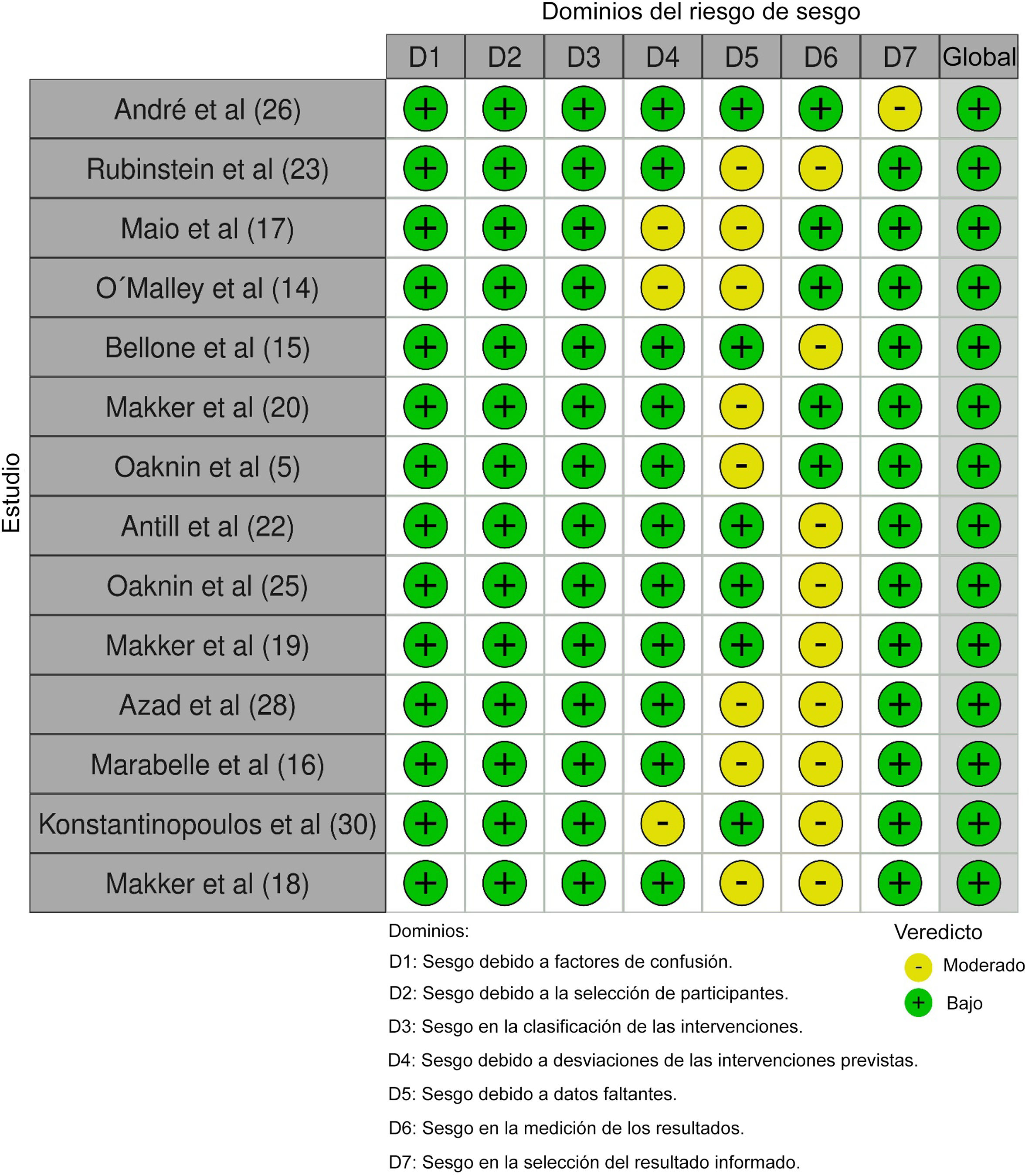
Se aplicó la herramienta Cochrane de evaluación del riesgo de sesgo a los estudios incluidos13, que abarca 8 ámbitos: sesgo de confusión; sesgo de selección de los participantes en el estudio (o en el análisis); sesgo de clasificación de las intervenciones; sesgo de desviación de las intervenciones previstas; sesgo de datos perdidos; sesgo de medición de los resultados; selección de los resultados comunicados; y sesgo general. Dos investigadores evaluaron de forma independiente el riesgo de sesgo.
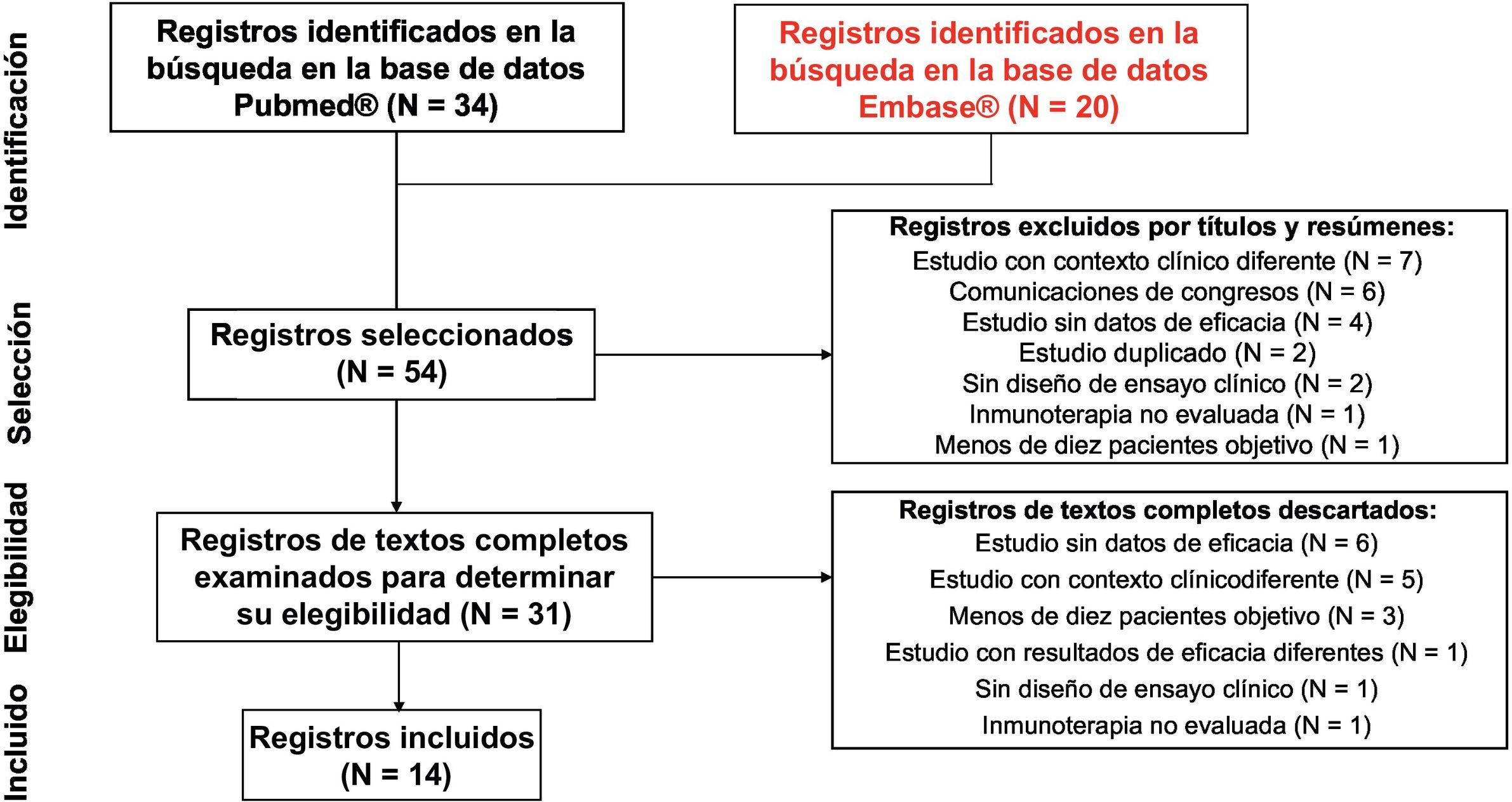
ResultadosBúsqueda bibliográfica, selección de estudios y extracción de datosSe encontraron un total de 54 registros en la búsqueda sistemática y se excluyeron 40 publicaciones. Las razones para la exclusión de los estudios fueron las siguientes: 12 se desarrollaron en un contexto clínico diferente; 10 no incluían datos de los resultados de eficacia para los tratamientos farmacológicos; 6 eran comunicaciones de congresos; 4 incluían menos de 10 pacientes; 3 no eran EC; 2 estaban duplicados; 2 no evaluaban la inmunoterapia y uno incluía diferentes variables de eficacia. Finalmente, se incluyeron 14 estudios5,14–26. En la figura 1 se muestra la revisión sistemática realizada según la metodología PRISMA. Dos de los estudios incluidos14,17 eran estudios de extensión del ensayo de Marabelle et al.16. Según el diseño, se incluyeron 8 estudios no aleatorizados en fase II; 3 estudios no aleatorizados en fase I; un estudio aleatorizado en fase II; un estudio aleatorizado en fase III y un estudio aleatorizado en fase Ib/II. Todos los ensayos incluyeron a pacientes que habían recibido al menos un tratamiento de primera línea con platino. De los EC, el 14,3% incluyó a pacientes con CE avanzado21,24, el 14,3% con enfermedad metastásica15,18 y el 71,4% con ambos5,14,16,17,19,20,22,23,25,26. Todos los estudios incluían datos de seguimiento de pacientes (valores de mediana entre 6 y 42,6 meses). Los tamaños de las muestras de pacientes incluidos oscilaron entre 11 y 143. Los regímenes analizados fueron: pembrolizumab en monoterapia, pembrolizumab más lenvatinib en combinación, durvalumab, durvalumab más tremelimumab, dostarlimab, nivolumab y avelumab. Solo 2 ensayos incluyeron un grupo de comparación. En la tabla 1 se muestran los datos y los resultados de los estudios seleccionados.
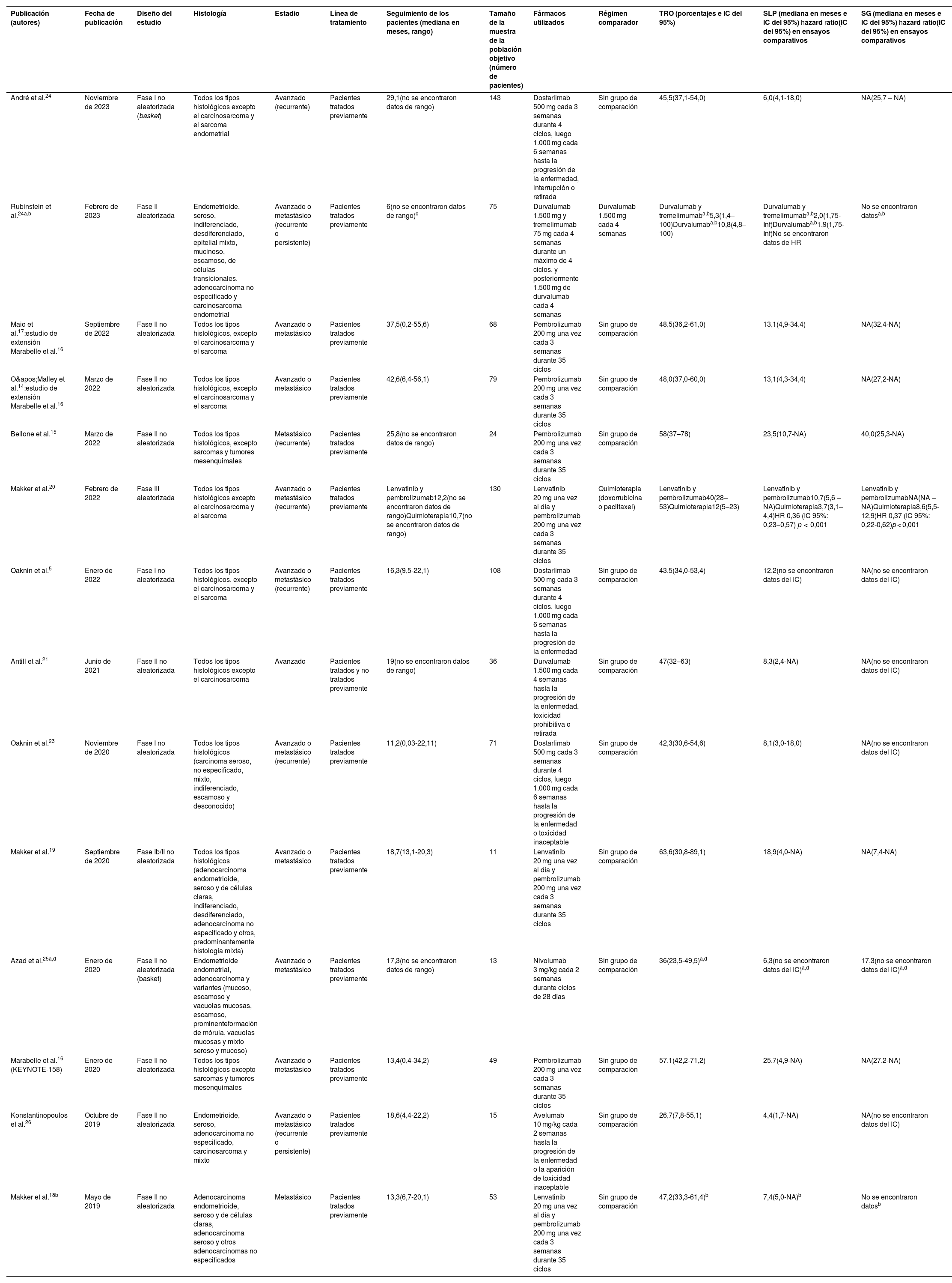
Características y datos de eficacia de los estudios
| Publicación (autores) | Fecha de publicación | Diseño del estudio | Histología | Estadio | Línea de tratamiento | Seguimiento de los pacientes (mediana en meses, rango) | Tamaño de la muestra de la población objetivo (número de pacientes) | Fármacos utilizados | Régimen comparador | TRO (porcentajes e IC del 95%) | SLP (mediana en meses e IC del 95%) hazard ratio(IC del 95%) en ensayos comparativos | SG (mediana en meses e IC del 95%) hazard ratio(IC del 95%) en ensayos comparativos |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| André et al.24 | Noviembre de 2023 | Fase I no aleatorizada (basket) | Todos los tipos histológicos excepto el carcinosarcoma y el sarcoma endometrial | Avanzado (recurrente) | Pacientes tratados previamente | 29,1(no se encontraron datos de rango) | 143 | Dostarlimab 500 mg cada 3 semanas durante 4 ciclos, luego 1.000 mg cada 6 semanas hasta la progresión de la enfermedad, interrupción o retirada | Sin grupo de comparación | 45,5(37,1-54,0) | 6,0(4,1-18,0) | NA(25,7 – NA) |
| Rubinstein et al.24a,b | Febrero de 2023 | Fase II aleatorizada | Endometrioide, seroso, indiferenciado, desdiferenciado, epitelial mixto, mucinoso, escamoso, de células transicionales, adenocarcinoma no especificado y carcinosarcoma endometrial | Avanzado o metastásico (recurrente o persistente) | Pacientes tratados previamente | 6(no se encontraron datos de rango)c | 75 | Durvalumab 1.500 mg y tremelimumab 75 mg cada 4 semanas durante un máximo de 4 ciclos, y posteriormente 1.500 mg de durvalumab cada 4 semanas | Durvalumab 1.500 mg cada 4 semanas | Durvalumab y tremelimumaba,b5,3(1,4–100)Durvalumaba,b10,8(4,8–100) | Durvalumab y tremelimumaba,b2,0(1,75-Inf)Durvalumaba,b1,9(1,75-Inf)No se encontraron datos de HR | No se encontraron datosa,b |
| Maio et al.17:estudio de extensión Marabelle et al.16 | Septiembre de 2022 | Fase II no aleatorizada | Todos los tipos histológicos, excepto el carcinosarcoma y el sarcoma | Avanzado o metastásico | Pacientes tratados previamente | 37,5(0,2-55,6) | 68 | Pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Sin grupo de comparación | 48,5(36,2-61,0) | 13,1(4,9-34,4) | NA(32,4-NA) |
| O'Malley et al.14:estudio de extensión Marabelle et al.16 | Marzo de 2022 | Fase II no aleatorizada | Todos los tipos histológicos, excepto el carcinosarcoma y el sarcoma | Avanzado o metastásico | Pacientes tratados previamente | 42,6(6,4-56,1) | 79 | Pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Sin grupo de comparación | 48,0(37,0-60,0) | 13,1(4,3-34,4) | NA(27,2-NA) |
| Bellone et al.15 | Marzo de 2022 | Fase II no aleatorizada | Todos los tipos histológicos, excepto sarcomas y tumores mesenquimales | Metastásico (recurrente) | Pacientes tratados previamente | 25,8(no se encontraron datos de rango) | 24 | Pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Sin grupo de comparación | 58(37–78) | 23,5(10,7-NA) | 40,0(25,3-NA) |
| Makker et al.20 | Febrero de 2022 | Fase III aleatorizada | Todos los tipos histológicos excepto el carcinosarcoma y el sarcoma | Avanzado o metastásico (recurrente) | Pacientes tratados previamente | Lenvatinib y pembrolizumab12,2(no se encontraron datos de rango)Quimioterapia10,7(no se encontraron datos de rango) | 130 | Lenvatinib 20 mg una vez al día y pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Quimioterapia (doxorrubicina o paclitaxel) | Lenvatinib y pembrolizumab40(28–53)Quimioterapia12(5–23) | Lenvatinib y pembrolizumab10,7(5,6 – NA)Quimioterapia3,7(3,1–4,4)HR 0,36 (IC 95%: 0,23–0,57) p < 0,001 | Lenvatinib y pembrolizumabNA(NA – NA)Quimioterapia8,6(5,5-12,9)HR 0,37 (IC 95%: 0,22-0,62)p < 0,001 |
| Oaknin et al.5 | Enero de 2022 | Fase I no aleatorizada | Todos los tipos histológicos, excepto el carcinosarcoma y el sarcoma | Avanzado o metastásico (recurrente) | Pacientes tratados previamente | 16,3(9,5-22,1) | 108 | Dostarlimab 500 mg cada 3 semanas durante 4 ciclos, luego 1.000 mg cada 6 semanas hasta la progresión de la enfermedad | Sin grupo de comparación | 43,5(34,0-53,4) | 12,2(no se encontraron datos del IC) | NA(no se encontraron datos del IC) |
| Antill et al.21 | Junio de 2021 | Fase II no aleatorizada | Todos los tipos histológicos excepto el carcinosarcoma | Avanzado | Pacientes tratados y no tratados previamente | 19(no se encontraron datos de rango) | 36 | Durvalumab 1.500 mg cada 4 semanas hasta la progresión de la enfermedad, toxicidad prohibitiva o retirada | Sin grupo de comparación | 47(32–63) | 8,3(2,4-NA) | NA(no se encontraron datos del IC) |
| Oaknin et al.23 | Noviembre de 2020 | Fase I no aleatorizada | Todos los tipos histológicos (carcinoma seroso, no especificado, mixto, indiferenciado, escamoso y desconocido) | Avanzado o metastásico (recurrente) | Pacientes tratados previamente | 11,2(0,03-22,11) | 71 | Dostarlimab 500 mg cada 3 semanas durante 4 ciclos, luego 1.000 mg cada 6 semanas hasta la progresión de la enfermedad o toxicidad inaceptable | Sin grupo de comparación | 42,3(30,6-54,6) | 8,1(3,0-18,0) | NA(no se encontraron datos del IC) |
| Makker et al.19 | Septiembre de 2020 | Fase Ib/II no aleatorizada | Todos los tipos histológicos (adenocarcinoma endometrioide, seroso y de células claras, indiferenciado, desdiferenciado, adenocarcinoma no especificado y otros, predominantemente histología mixta) | Avanzado o metastásico | Pacientes tratados previamente | 18,7(13,1-20,3) | 11 | Lenvatinib 20 mg una vez al día y pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Sin grupo de comparación | 63,6(30,8-89,1) | 18,9(4,0-NA) | NA(7,4-NA) |
| Azad et al.25a,d | Enero de 2020 | Fase II no aleatorizada (basket) | Endometrioide endometrial, adenocarcinoma y variantes (mucoso, escamoso y vacuolas mucosas, escamoso, prominenteformación de mórula, vacuolas mucosas y mixto seroso y mucoso) | Avanzado o metastásico | Pacientes tratados previamente | 17,3(no se encontraron datos de rango) | 13 | Nivolumab 3 mg/kg cada 2 semanas durante ciclos de 28 días | Sin grupo de comparación | 36(23,5-49,5)a,d | 6,3(no se encontraron datos del IC)a,d | 17,3(no se encontraron datos del IC)a,d |
| Marabelle et al.16 (KEYNOTE-158) | Enero de 2020 | Fase II no aleatorizada | Todos los tipos histológicos excepto sarcomas y tumores mesenquimales | Avanzado o metastásico | Pacientes tratados previamente | 13,4(0,4-34,2) | 49 | Pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Sin grupo de comparación | 57,1(42,2-71,2) | 25,7(4,9-NA) | NA(27,2-NA) |
| Konstantinopoulos et al.26 | Octubre de 2019 | Fase II no aleatorizada | Endometrioide, seroso, adenocarcinoma no especificado, carcinosarcoma y mixto | Avanzado o metastásico (recurrente o persistente) | Pacientes tratados previamente | 18,6(4,4-22,2) | 15 | Avelumab 10 mg/kg cada 2 semanas hasta la progresión de la enfermedad o la aparición de toxicidad inaceptable | Sin grupo de comparación | 26,7(7,8-55,1) | 4,4(1,7-NA) | NA(no se encontraron datos del IC) |
| Makker et al.18b | Mayo de 2019 | Fase II no aleatorizada | Adenocarcinoma endometrioide, seroso y de células claras, adenocarcinoma seroso y otros adenocarcinomas no especificados | Metastásico | Pacientes tratados previamente | 13,3(6,7-20,1) | 53 | Lenvatinib 20 mg una vez al día y pembrolizumab 200 mg una vez cada 3 semanas durante 35 ciclos | Sin grupo de comparación | 47,2(33,3-61,4)b | 7,4(5,0-NA)b | No se encontraron datosb |
HR: hazard ratio; dMMR: deficiencia en la reparación de desajustes; IC 95%: intervalo de confianza del 95%; MMRp: competencia en la reparación de desajustes; NA: no alcanzado; SG: supervivencia global; SLP: supervivencia libre de progresión; TRO: tasa de respuesta objetiva.
El mayor efecto numérico se observó con pembrolizumab tras una mediana de seguimiento de 25,8 meses (SG = 40,0 meses [IC 95%: 25,3-NA (No alcanzado)]); (SLP = 23,5 meses [IC 95%: 10,7-NA]); (TRO = 58% [IC 95%: 37–78])15. El pembrolizumab más lenvatinib se posicionó como otra alternativa interesante tras 12,2 meses de seguimiento (SG = NA [IC 95%: NA-NA]); (SLP = 10,7 meses [IC 95%: 5,6-NA]); (TRO = 40% [IC 95%: 28–53])20. No se encontraron datos de SG en 2 ensayos (14,3%)18,22.
PembrolizumabEl pembrolizumab es un anticuerpo monoclonal IgG4 anti-PD-1 que bloquea la interacción entre PD-1 y sus ligandos PD-L1 y PD-L214,15. En el estudio multicohorte KEYNOTE-158 se mostraron los resultados del uso de pembrolizumab en pacientes diagnosticados con cáncer con MSI-H/dMMR, excluyendo el cáncer colorrectal16. Se trataba de un EC no aleatorizado, multicéntrico y de un solo brazo en fase II. Posteriormente, se publicaron 2 extensiones de este estudio que incluían los resultados de las cohortes D y K con pacientes diagnosticados de CE con MSI-H/dMMR14,17. O'Malley et al.14 incluyeron a 90 pacientes de las cohortes D (n = 11) y K (n = 79). Con una mediana de seguimiento de 42,6 meses (IC 95%: 6,4-56,1), se alcanzó una TRO del 48,0% (IC 95%: 37,0-60,0), según un comité radiológico independiente. La mediana de la SLP observada fue de 13,1 meses (IC 95%: 4,3-34,4), mientras que no se alcanzó la mediana de la SG. Bellone et al.15 diseñaron una investigación con características similares al ensayo KEYNOTE-158. La mediana del seguimiento fue de 25,8 meses. Se logró una TRO del 58% (IC 95%: 37–78), según el análisis del investigador. La mediana de la SLP fue de 23,5 meses (IC 95%: 10,7-NA), y la mediana de la SG fue de 40,0 meses (IC 95%: 25,3-NA).
En otros estudios se combinaron pembrolizumab con lenvatinib, como los de Makker et al.18 y Makker et al.19. Ambos estudios son fase II y contaban con un solo brazo. Se incluyó a pacientes con MSI-H/dMMR y MSS/MMRp. Makker et al. detectaron MSS/MMRp en 94 pacientes19, y 11 pacientes presentaban MSI-H/dMMR. La TRO basada en la evaluación del investigador para el grupo MSI-H/dMMR fue del 63,6% (IC 95%: 30,8-89,1). La mediana de SLP fue de 18,9 meses (IC 95%: 4,0-NA) y no se alcanzó la mediana de SG en este grupo MSI-H/dMMR. Makker et al.20 fue un EC comparativo abierto y aleatorizado en fase III. Se evaluó el régimen de pembrolizumab-lenvatinib frente a la quimioterapia. La TRO de la población MSI-H/dMMR fue del 40% (IC 95%: 28–53) en el grupo de pembrolizumab más lenvatinib y del 12% (IC 95%: 5–23) en el grupo de control. La mediana de la SLP en el grupo que recibió pembrolizumab en combinación con lenvatinib fue de 10,7 meses (IC 95%: 5,6-NA) y de 3,7 meses (IC 95%: 3,1-4,4) en el grupo de control. No se alcanzó la mediana de la SG en el grupo de intervención y fue de 8,6 meses (IC 95%: 5,5-12,9) en el grupo de quimioterapia.
En cuanto al análisis de seguridad, en el estudio KEYNOTE-158 se mostró que los AA más frecuentes de la monoterapia con pembrolizumab eran fatiga (14,6%), prurito (12,9%) y diarrea (12,0%)16. En cuanto a los AA de grado 3 o superior, el pembrolizumab se asoció con un aumento de las transaminasas (1,7%) y neumonitis (1,3%). Un total del 9,4% de los pacientes del estudio KEYNOTE-158 interrumpió el tratamiento debido a los AA. Ningún paciente falleció por AA asociado al tratamiento. En el estudio de Bellone15, pembrolizumab causó con frecuencia diarrea (56,0%), fatiga (48,0%) y trastornos cutáneos (44,0%). En este ensayo, los AA de grado 3 o superior más frecuentes fueron hiperglucemia (16,0%) y diarrea (12,0%). No se informó de interrupciones, retrasos o fallecimientos. En Makker et al.20, los AA más comunes de la combinación de pembrolizumab y lenvatinib fueron hipertensión (64,0%), hipotiroidismo (57,4%) y diarrea (54,2%). Del mismo modo, el régimen de pembrolizumab-lenvatinib tuvo como AA predominantes de grado 3 o superior la hipertensión (37,9%), pérdida de peso (10,3%) y disminución del apetito (7,9%). Además, el 69,2% de la población interrumpió la terapia combinada. Se produjeron 2 muertes en el grupo de pacientes que recibieron pembrolizumab-lenvatinib.
DurvalumabEste anticuerpo monoclonal IgG1 de tipo κ bloquea selectivamente la interacción de PD-L1 con PD-1 y CD8027. En esta revisión se incluyeron 2 estudios con durvalumab, uno de los cuales utilizó la combinación de durvalumab y tremelimumab. En el estudio de Antill21 se evaluó durvalumab en monoterapia para pacientes con dMMR (n = 36) y MMRp (n = 35). Sin embargo, 21 pacientes con dMMR no habían recibido ninguna línea de tratamiento previa. Se describe un ensayo no aleatorizado y con un solo brazo en fase II. El seguimiento de la población con dMMR fue de 19 meses. La TRO evaluada por el investigador en el grupo con dMMR alcanzó el 47% (IC 95%: 32–63). La mediana de la SLP fue de 8,3 meses (IC 95%: 2,4-NA) y no se alcanzó la mediana de la SG. El régimen de durvalumab más tremelimumab se evaluó en un estudio abierto, con comparador activo y aleatorizado en fase II22. Se asignaron 38 pacientes al grupo de monoterapia con durvalumab y 39 pacientes al grupo de combinación de durvalumab y tremelimumab. Se determinó el dMMR en el 13,2% de los pacientes tratados con monoterapia con durvalumab y en el 10,3% de la población con una combinación de agentes inmunoterapéuticos. La TRO a los 6 meses fue del 10,8% (IC 90%: 4,8–100) en el grupo de durvalumab y del 5,3% (IC 90%: 1,4–100) en el grupo de durvalumab-tremelimumab. La mediana de la SLP fue similar en ambos grupos: 1,9 meses (IC 90%: 1,75-Inf) para durvalumab y 2,0 meses (IC 90%: 1,75-Inf) para durvalumab más tremelimumab. No se encontraron datos de SG.
Los AA mediados por el sistema inmunitario se recopilaron en Antill et al.21 y destacaban los trastornos tiroideos: hipotiroidismo (14,0%) e hipertiroidismo (9,0%). Tres pacientes interrumpieron el tratamiento debido a los AA. No se comunicaron otros datos de seguridad en este estudio. En Rubinstein et al.22 los AA más frecuentes fueron hiperglucemia (95% en el grupo de monoterapia y 92% en el grupo de durvalumab-tremelimumab) y anemia (82,0 y 87,0%, respectivamente). Los AA de grado 3 o superior más frecuentes fueron anemia (29,0% para durvalumab y 28,0% para el régimen de durvalumab-tremelimumab) y disminución del recuento de linfocitos (26,0 y 38,0%, respectivamente). No se comunicaron datos sobre reducciones del tratamiento, interrupciones o muertes debidas a AA.
DostarlimabEl mecanismo de acción de este anticuerpo monoclonal IgG4 se basa en la unión a los receptores PD-1 y el bloqueo de su asociación con PD-L1 y PD-L228. Se encontró un ensayo con un solo brazo en fase I. En los resultados publicados inicialmente, Oaknin et al.23 incluyeron a pacientes con perfil MSI-H/dMMR. En una actualización de Oaknin et al.5, se establecieron 2 cohortes: la cohorte A1 (MSI-H/dMMR, n = 108) y la cohorte A2 (MMRp/MSS, n = 161). La TRO fue similar en ambas publicaciones: 42,3% (IC 95%: 30,6-54,6) en Oaknin et al.23 frente al 43,5% (IC 95%: 34,0-53,4) en la cohorte A15. En ambos artículos un comité central independiente evaluó la TRO. Por otro lado, la SLP fue de 8,1 meses (IC 95%: 3,0-18,0) en Oaknin et al.23 frente a 12,2 meses (sin datos del IC) en la publicación más reciente. No se alcanzó la mediana de SG en ninguno de los 2 estudios. Posteriormente, André et al.24 realizaron un ensayo fase I de un solo brazo en el que se incluyó a pacientes diagnosticados con diversos tumores sólidos. Este ensayo incluyó un análisis post hoc que presentaba los resultados desglosados por tipo de tumor. Un comité independiente determinó una TRO del 45,5% (IC 95%: 37,1-54,0) en 143 pacientes diagnosticados de CE con dMMR o POLE mutado. La mediana de la SLP fue de 6 (IC 95%: 4,1-18,0) meses y no se alcanzó la mediana de la SG (IC 95%: 25,7-NA).
Hasta el 93,9 y el 95,3% de los pacientes en los estudios de Oaknin et al.23 y Oaknin et al 5, respectivamente, experimentaron un AA. En los pacientes diagnosticados de CE y dMMR, los AA más frecuentes fueron diarrea (15,4 y 16,3% en los estudios de 2020 y 2022, respectivamente) y astenia (15,4 y 14,0%). Entre los AA de grado 3 o superior, la anemia fue la más frecuente en ambos estudios (2,9 y 3,9%). Un total del 23,1% de los pacientes de Oaknin et al.23 solicitó interrumpir el tratamiento debido a los AA. No obstante, en Oaknin et al.5 dichas interrupciones se produjeron en el 3,9% de los casos. No se registraron muertes en los grupos de dostarlimab.
El análisis de seguridad de André et al.24 incluyó a la población general sin diferenciar por tipo de tumor sólido. Los AA más frecuentes fueron diarrea (15,4%) y astenia (14,3%). Los AA de grado 3 o superior observados fueron la anemia (2,5%) y aumento de las transaminasas (1,9%). Las interrupciones del tratamiento se debieron a AA en el 6,9% de los pacientes. Se produjeron 2 muertes atribuidas al tratamiento, pero ninguna en la población con CE y dMMR.
NivolumabEl nivolumab es un anticuerpo monoclonal IgG4 que impide la interacción entre el receptor PD-1 y PD-L129. El estudio hallado fue un EC de fase II tipo basket, de un solo brazo y con varios tipos de tumores25. La mediana de seguimiento de los pacientes fue de 17,3 meses. Los resultados de eficacia obtenidos por la población global fueron: TRO = 36% (IC 90%: 23,5-49,5), mediana de SLP = 6,3 meses y mediana de SG = 17,3 meses (ambos resultados sin IC comunicados).
En cuanto a la seguridad, los AA más frecuentes fueron fatiga (40%), anemia (33%) y erupción cutánea (17%). Los AA de grado 3 o superior más frecuentes fueron anemia (18,4%), deshidratación (5,3%), fatiga (5,3%), erupción maculopapular (5,3%), sepsis (5,3%) e infecciones cutáneas (5,3%). No se informó de datos sobre reducciones del tratamiento, interrupciones o muertes debidas a AA.
AvelumabEl avelumab es un anticuerpo monoclonal de clase IgG1 que interactúa con el PD-L1 impidiendo su unión al PD-1 y al B7.130. Konstantinopoulos et al.26 realizaron un EC de fase II de un solo brazo con 2 cohortes. La población seleccionada se distribuyó según la presencia de mutaciones dMMR/POLE (n = 15) o MMRp/POLE sin mutaciones (n = 16). Las covariables primarias fueron la TRO y la SLP a los 6 meses. La SG también se midió como variable secundaria. Con una mediana de seguimiento de 18,6 meses, la TRO en la cohorte dMMR/POLE fue del 26,7% (IC 95%: 7,8-55,1). La SLP a los 6 meses fue del 40,0% (IC 95%: 16,3-66,7), mientras que la mediana fue de 4,4 (IC 95%: 1,7-NA). No se alcanzó la mediana de SG.
Respecto a la seguridad, el 71,0% de los pacientes presentaron al menos un AA. Los AA más frecuentes fueron fatiga (35,5%), seguido de náuseas (16%). Se registraron AA de grado 3 o superior en el 19,4% de los casos, siendo los más frecuentes: anemia (6,5%), diarrea (6,5%), bradicardia (3,2%), hipotiroidismo (3,2%), miositis (3,2%) y erupción acneiforme (3,2%). No se informaron de datos sobre reducciones del tratamiento, interrupciones o muertes debidas a AA.
Riesgo de sesgoDurvalumab presentó datos globales de una población, que incluía pacientes no tratados previamente y pacientes tratados previamente21. El tamaño de las muestras de los EC osciló entre 11 pacientes (régimen de pembrolizumab-lenvatinib, Makker et al.19) y 143 (dostarlimab)24. Los regímenes con los EC de tamaño de muestra más pequeños fueron la combinación de pembrolizumab y lenvatinib (n = 11)19, nivolumab (n = 13)25, avelumab (n = 15)26, pembrolizumab en monoterapia (n = 24)15 y durvalumab (n = 36)21. La mediana del seguimiento de los estudios osciló entre 6 meses (combinación de durvalumab y tremelimumab)22 y 42,6 meses (pembrolizumab)14. Todos los EC informaron del periodo de seguimiento.
Todos los estudios incluidos obtuvieron una valoración global de bajo riesgo de sesgo cuando se aplicó la herramienta de evaluación de Cochrane. La figura 2 muestra el análisis con la herramienta de evaluación del riesgo de sesgo.
DiscusiónLa eficacia de la monoterapia con pembrolizumab y la combinación de pembrolizumab más lenvatinib en pacientes con CE avanzado y metastásico con MSI-H/dMMR parece prometedora. Sin embargo, no es posible establecer un posicionamiento terapéutico riguroso con los EC evaluados. La monoterapia con pembrolizumab, con TRO del 58%, una mediana de SLP de 23,5 meses y una SG de 40 meses15, se situaría como la alternativa con mayor efecto numérico, a la espera de datos más maduros de EC mejor diseñados. La combinación de pembrolizumab más lenvatinib se evaluó en un estudio de mayor calidad (EC aleatorizado de fase III) con un seguimiento de 12,2 meses20. Este régimen mostró una TRO de 40% y una mediana de SLP de 10,7 meses, sin alcanzar una mediana de SG. También se han evaluado durvalumab y dostarlimab21,24. Tras un seguimiento de 19 meses, durvalumab mostró una TRO del 47% y una mediana de SLP de 8,3 meses, sin alcanzar una mediana de SG21. Estos datos tienen un sesgo significativo, pues provienen de una población heterogénea que incluía pacientes sin tratamiento previo. Con una mediana de seguimiento de 29,1 meses, dostarlimab alcanzó una TRO del 45,5% y una mediana de SLP de 6 meses, sin alcanzar una mediana de SG24. Nivolumab se evaluó en un ensayo de diseño tipo basket25. Este anticuerpo mostró una TRO del 36%, una mediana de SLP de 6,3 meses y una SG de 17,3 meses. El diseño de este EC combinó resultados de enfermedades muy heterogéneas, por lo que podemos extraer pocas conclusiones de sus datos. Por otro lado, avelumab presentó pobres resultados en pacientes con dMMR, con una TRO del 26,7% y una mediana de SLP de 4,4 meses26. En cuanto a la seguridad, los AA más frecuentes fueron fatiga (hasta el 40% de los pacientes con nivolumab)25, anemia (33% de los pacientes con nivolumab)25 y AA gastrointestinales (hasta el 16% de los pacientes experimentaron náuseas con avelumab26 y el 16,3% diarrea con dostarlimab5,23). La anemia fue el AA de grado 3 o superior más frecuente, especialmente con durvalumab (29% de los pacientes)21. Entre las combinaciones de inmunoterapia, pembrolizumab más lenvatinib pareció mostrar datos de eficacia numéricamente superiores en comparación con durvalumab más tremelimumab18–20,22. La ausencia de comparadores comunes impide confirmar estas diferencias numéricas a fin de realizar un posicionamiento terapéutico adecuado y fiable. Del mismo modo, la combinación de pembrolizumab más lenvatinib aún no ha demostrado una ventaja clara sobre la monoterapia con pembrolizumab en pacientes con MSI-H/dMMR16,20. De hecho, la TRO fue menor con el régimen combinado (40% frente a 58%). Los valores de SLP y SG estarían a favor de la monoterapia con pembrolizumab. No obstante, estos hallazgos son simples comparaciones numéricas. El diseño actual y la mediana de seguimiento de los EC no permiten realizar comparaciones rigurosas sobre la eficacia. Además, la combinación de pembrolizumab con lenvatinib muestra un perfil de seguridad peor, dado el mayor número de interrupciones del tratamiento respecto a la monoterapia16,20.
Algunos de los estudios diseñaron 2 cohortes basadas en la diferente capacidad de reparación de errores MS. Un tumor caracterizado como MSI-H podría considerarse como dMMR. Del mismo modo, podría pensarse que una neoplasia determinada como MSI-L o MSS podría evaluarse como MMRp. Sin embargo, el criterio para clasificar un tumor como MSS o MSI-L no está claramente definido6,7. En los EC que realizaron análisis según la reparación de MS, las poblaciones MSI-H/dMMR sugirieron mejores resultados con la inmunoterapia que las poblaciones MSS/MMRp. Los tumores MSI-H/dMMR se asocian con una mayor carga de neoantígenos tumorales, infiltración linfocitaria y mayor expresión de PD-1 y PD-L19. Esto conduce a una sobreexpresión de la respuesta inmunitaria. A pesar de ello, los pacientes con tumores MSS/MMRp también se pueden beneficiar de algunos regímenes de inmunoterapia en lugar de la quimioterapia, como se puede ver en el análisis de subgrupos de Makker et al20.
Los EC incluidos en esta revisión generalmente incluían una muestra pequeña de pacientes diagnosticados con CE y MSI. La menor probabilidad de encontrar pacientes con perfil MSI-H/dMMR dificulta la detección fiable de diferencias en la respuesta a los fármacos en comparación con la población MSS/MMRp31. Esto sería esencial para realizar un análisis de subgrupos correcto para cada una de las alternativas terapéuticas. La Agencia Europea de Medicamentos basa sus autorizaciones en los resultados de los EC en pacientes con MSI-H/dMMR. El 25 de febrero de 2021, el Comité de Medicamentos de Uso Humano (CHMP) emitió un dictamen favorable sobre dostarlimab como monoterapia para el tratamiento de pacientes adultos con MSI-H/dMMR que han progresado durante o después de un tratamiento previo con un régimen basado en platino32. El 24 de marzo de 2022, pembrolizumab recibió un dictamen favorable del CHMP para la misma indicación33.
Nuestra revisión incluyó CE tratados previamente con al menos una línea previa de regímenes basados principalmente en platino. Publicaciones recientes como Mirza et al.34 y Eskander et al.35 utilizaron dostarlimab y pembrolizumab, respectivamente, en combinación con quimioterapia en pacientes sin tratamiento previo. Mirza et al.34 incluyeron a 118 pacientes con dMMR: 53 casos recibieron dostarlimab más quimioterapia y 65 pacientes fueron asignados al grupo de quimioterapia. Los resultados en el grupo de dostarlimab más quimioterapia fueron superiores en términos de SG y SLP en comparación con el grupo de control. Eskander et al.35 realizaron un estudio similar al de Mirza et al.34, seleccionaron a 225 pacientes sin tratamiento previo con MSI-H/dMMR: 112 casos recibieron el régimen de pembrolizumab-quimioterapia y 113 pacientes recibieron quimioterapia. Tras 12 meses de seguimiento, no se alcanzó la mediana de SLP en el grupo de pembrolizumab más quimioterapia, en comparación con los 7,6 meses del grupo de control.
Las limitaciones de los EC son el pequeño tamaño de las muestras y la ausencia, en la mayoría de los estudios, de comparadores. Solo Rubinstein et al.22 y Makker et al.20 desarrollaron un diseño comparativo, y ninguno de ellos reportó de un comparador común. Los estudios de una sola rama dificultan la extrapolación de los resultados a la práctica clínica. La falta de aleatorización no permite ajustar el efecto de factores desconocidos relacionados con los beneficios. Además, el ajuste de algunos factores conocidos que influyen en los resultados tiene limitaciones. La falta de estratificación o la heterogeneidad de las poblaciones en los ensayos no aleatorizados pueden dar lugar a un sesgo significativo en las comparaciones indirectas. Por lo tanto, establecer comparaciones indirectas fiables requiere fármacos comparadores comunes a fin de que el posicionamiento terapéutico sea adecuado. Tanto las comparaciones indirectas ajustadas como los metaanálisis en red precisan comparadores comunes. Además, en algunos de los ensayos analizados no se han obtenido resultados maduros sobre variables como la SG. En otros EC ni siquiera se detallaron los datos de SG. Por otra parte, TRO es una variable subrogada que podría dar lugar a sesgos y se utilizó con frecuencia como variable primaria. Por lo tanto, algunos ensayos, como los de Oaknin et al.5 y Marabelle et al.16 incorporaron un comité independiente para evaluar la TRO y reducir la influencia subjetiva de los investigadores.
Los análisis de subgrupos deben diseñarse cuidadosamente. Se requiere un tamaño mínimo de muestra de 50 pacientes por grupo para evaluar los resultados de cada factor36. En nuestra revisión, solo encontramos 3 ensayos con más de 100 pacientes5,20,24. Para interpretar los resultados por subgrupos, sería aconsejable diseñar estudios comparativos más amplios, exclusivamente para la población de CE con MSI previamente tratada con quimioterapia con platino. De esta manera, se podrían desarrollar análisis de subgrupos dentro de estos EC que pudieran evaluar adecuadamente el impacto de biomarcadores como PD-1 o PD-L1. Hasta ahora, la descripción de resultados en literatura del contexto clínico abordado, teniendo en cuenta la expresión de PD-L1, es casi inexistente. Hay algunos casos en los que se han comunicado datos de baja calidad procedentes de poblaciones heterogéneas o de la mezcla de múltiples biomarcadores. André et al.24 presentaron TRO según el estado de biomarcadores en un análisis combinado de pacientes con tumores sólidos dMMR (no exclusivamente de nuestra población objetivo con CE). Los resultados se clasificaron según la carga mutacional tumoral (CMT) y el PD-L1: los tumores con CMT alta/PD-L1 alta tuvieron una TRO del 60,4%; los tumores con CMT baja/PD-L1 baja del 25,0%; los tumores con CMT alta/PD-L1 baja del 32,3% y los tumores con CMT baja/PD-L1 alta del 42,9%. Estos datos son difíciles de comparar con datos de otros ensayos.
La caracterización del perfil de MS en el CE podría ser importante para identificar qué pacientes pueden beneficiarse más de los tratamientos. Sin embargo, los ensayos comparativos de fase III son esenciales para posicionar correctamente los resultados de todas las alternativas terapéuticas. Pocos EC han mostrado datos maduros en SG. Se necesitan estudios con muestras más grandes, seguimientos más largos y mejores diseños, así como análisis de subgrupos adecuadamente diseñados basados en las diferencias en los mecanismos de reparación de MS.
Responsabilidades éticasLos autores declaran que se han cumplido todas las responsabilidades éticas necesarias en materia de autoría y publicación redundante (dado el diseño del estudio, no se requirió la protección de los sujetos de investigación, ya sean seres humanos o animales, ni consentimiento informado).
Los autores aceptan las responsabilidades definidas por el Comité Internacional de Editores de Revistas Médicas (disponibles en http://www.icmje.org/).
FinanciaciónLos autores declaran que el estudio fue financiado como proyecto de investigación para una de las Becas de 2023 de la Fundación Andaluza de Farmacia Hospitalaria de la Sociedad Andaluza de Farmacéuticos Hospitalarios.
Conflicto de interesesGil-Sierra Manuel David recibió honorarios de consultoría de Janssen Pharmaceutica y reembolso por asistencia a simposios de Pfizer para otros medicamentos contra el cáncer. El resto de los autores no presenta ningún conflicto de intereses que declarar.
Responsabilidad y cesión de derechosTodos los autores firmantes del manuscrito aceptan esta cláusula.
Los autores declaran explícitamente que el trabajo no se ha publicado anteriormente ni se está revisando en otro lugar. Los autores afirman que han seguido las instrucciones para los autores y las responsabilidades éticas, incluyendo que todos los autores firmantes cumplen los criterios de autoría y han declarado sus respectivos conflictos de intereses.
Los autores ceden, en caso de publicación, los derechos exclusivos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte, ya sea sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y, por extensión, a la SEFH. Se firmará una carta de cesión de derechos en el momento de la presentación del manuscrito a través del sistema de gestión de manuscritos en línea.
Declaración de contribución de autoría CRediTCristina Moreno-Ramos: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Funding acquisition, Formal analysis, Data curation, Conceptualization. Manuel David Gil-Sierra: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Funding acquisition, Formal analysis, Data curation, Conceptualization. María del Pilar Briceño-Casado: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Funding acquisition, Formal analysis, Data curation, Conceptualization.