la inmunoterapia ha surgido como alternativa terapéutica a la quimioterapia (CT) para el tratamiento perioperatorio de cáncer de pulmón no microcítico (CPNM) resecable. El objetivo es realizar un metaanálisis en red comparando la eficacia perioperatoria de las inmunoterapias en CPNM resecable, considerando la expresión tumoral de ligando 1 de muerte programada (PD-L1).
Métodose realizó una revisión en Pubmed® y en EMBASE® hasta el 17 de septiembre de 2024. Se incluyeron ensayos clínicos en fase III sobre las inmunoterapias perioperatorias (P-) para el CPNM resecable con un número mayor o igual a 50 pacientes. La variable seleccionada fue la supervivencia libre de progresión, según los diferentes niveles de expresión de PD-L1. El análisis estadístico usó métodos bayesianos. Se valoraron los modelos de efectos fijos o aleatorizados, usando el Criterio de Información de la Devianza (DIC). Un análisis de sensibilidad fue desarrollado para evaluar la influencia de estudios heterogéneos.
Resultadosse incluyeron 4 ensayos.Los esquemas inmunoterápicos con P-toripalimab, P-nivolumab, P-pembrolizumab y P-durvalumab fueron seleccionados.Solo P-toripalimab incluyó un ciclo de toripalimab + CT adyuvante. Las combinaciones perioperatorias restantes incluyeron el esquema de agente inmunoterápico + CT (4 ciclos) neoadyuvante, seguido de la inmunoterapia adyuvante. El comparador común fue placebo + CT neoadyuvante con el placebo en adyuvancia (P-placebo). P-toripalimab fue evaluado en una población con características heterogéneas. Se seleccionó el modelo de efectos fijos por diferencias irrelevantes entre los valores de DIC. P-toripalimab obtuvo la mayor magnitud de efecto en la supervivencia libre de progresión para la población con PD-L1 < 1% y 1–49% (tratamiento de referencia). No se observó beneficio de ninguna combinación inmunoterapéutica sobre P-placebo en CPNM resecable con expresión de PD-L1 < 1%.P-toripalimab fue estadísticamente superior a los demás regímenes (excepto P-pembrolizumab, HR = 1,6 [ICr 95%: 0,84–3,2]) para expresión de PD-L1 1–49%. Los esquemas inmunoterapéuticos fueron superiores a P-placebo para expresión de PD-L1 ≥ 50%. En el análisis de sensibilidad se mostraron resultados compatibles con el análisis primario.
Conclusionesel metaanálisis en red aporta evidencia fiable sobre la eficacia de la inmunoterapia perioperatoria en CPNM resecable según los niveles de expresión de PD-L1, pudiendo favorecer la competencia entre alternativas terapéuticas. Un análisis de sensibilidad respaldó estos resultados.
Immunotherapy has emerged as a therapeutic alternative to chemotherapy (CT) for perioperative treatment of resectable non-small cell lung cancer (NSCLC). The objective is to perform a network meta-analysis comparing the perioperative efficacy of immunotherapies in resectable NSCLC taking into account tumor expression of programmed death ligand 1 (PD-L1).
MethodA review was performed in Pubmed® and EMBASE® until September 17, 2024. Phase III clinical trials on perioperative immunotherapies (P-) for resectable NSCLC with ≥50 patients were included. The selected endpoint was progression-free survival (PFS) according to different levels of PD-L1 expression. The statistical analysis used Bayesian methods. Fixed- or random-effects models were assessed using deviance information criteria (DIC). A sensitivity analysis was developed to evaluate the influence of heterogeneous studies.
ResultsFour trials were included. Immunotherapeutic schemes with P-toripalimab, P-nivolumab, P-pembrolizumab and P-durvalumab were selected. Only P-toripalimab included a cycle of adjuvant toripalimab + CT. The remaining perioperative combinations contained the neoadjuvant immunotherapeutic agent + CT (4 cycles) regimen followed by adjuvant immunotherapy. The common comparator was neoadjuvant placebo + CT with adjuvant placebo (P-placebo). P-toripalimab was evaluated in a population with heterogeneous characteristics. Fixed effects model was selected for DIC values with irrelevant differences. P-toripalimab obtained greater magnitude of effect in PFS for populations with PD-L1 < 1% and 1–49% (reference treatment). No benefit of any immunotherapeutic combination over P-placebo was observed in resectable NSCLC with PD-L1 expression <1%. P-toripalimab was statistically superior to the other regimens [except P-pembrolizumab, HR = 1.6 (95%CrI: 0.84–3.2)] for PD-L1 expression 1–49%. Immunotherapeutic schemes were superior to p-placebo for PD-L1 expression ≥50%. Sensitivity analysis showed results compatible with the primary analysis.
ConclusionsOur network meta-analysis provides reliable evidence on the efficacy of perioperative immunotherapy in resectable NSCLC according to PD-L1 expression levels, and may favor competition between therapeutic alternatives. A sensitivity analysis supported these results.
El cáncer responsable de un mayor número de fallecimientos a nivel mundial es el cáncer de pulmón, con un 18,8% del total de muertes por cáncer1. El subtipo de cáncer de pulmón no microcítico (CPNM) constituye aproximadamente un 80–85% de los diagnósticos de cáncer de pulmón2. El 30% de los casos de CPNM pueden ser intervenidos mediante resección quirúrgica por detectarse en estadios tempranos3. La resección quirúrgica ha sido, hasta ahora, la intervención curativa principal en estos casos4. No obstante, más de un tercio de estos pacientes que reciben la cirugía presentan recurrencia5–7.
Históricamente, la quimioterapia adyuvante tras resección quirúrgica ha sido una opción terapéutica para aumentar la supervivencia de los pacientes con CPNM resecable8. Los esquemas con inhibidores de puntos de control inmunitario, principalmente aquellos que actúan sobre la proteína 1 de muerte celular programada (PD-1, del inglés programmed cell death protein 1) o el ligando 1 de muerte programada (PD-L1, del inglés programmed death ligand 1), fueron usados en un primer momento en CPNM avanzado o metastásico9,10. Posteriormente, este tipo de inmunoterapia también demostró beneficio como tratamiento de mantenimiento tras quimioterapia adyuvante en CPNM resecable11.
Otras investigaciones sugirieron un efecto positivo de las inmunoterapias neoadyuvantes para retrasar la progresión de la enfermedad12. Por ello, se desarrollaron ensayos clínicos que evaluaran el uso perioperatorio de la inmunoterapia en CPNM resecable. Este abordaje terapéutico consistió en emplear determinados fármacos (o combinaciones) antes y después de la intervención quirúrgica para valorar el beneficio clínico obtenido. En el estudio NADIM II se observó un incremento de la respuesta patológica completa al usar el esquema perioperatorio de nivolumab con quimioterapia, frente a quimioterapia13.
Tras esto, varios ensayos clínicos han valorado el uso perioperatorio de diferentes agentes inmunoterápicos en CPNM resecable14,15. Los resultados de eficacia obtenidos arrojan, por ahora, incrementos importantes de la supervivencia libre de progresión (SLP). No obstante, no se han diseñado estudios que comparen directamente unos regímenes inmunoterápicos con otros. Esto supone una limitación considerable para seleccionar aquellas alternativas terapéuticas más eficaces y eficientes. Los metaanálisis en red (NMA, del inglés network meta-analisys) son técnicas estadísticas que permiten comparar directa e indirectamente los efectos de varios tratamientos en un contexto clínico16. De esta manera, estas herramientas pueden facilitar el posicionamiento terapéutico ante la falta de datos de comparaciones directas de tratamientos inmunoterápicos perioperatorios en CPNM resecable.
Por otra parte, el desarrollo de NMA fiables requiere revisiones sistemáticas con criterios de selección de datos adecuados. El análisis por subgrupos permite evaluar los datos obtenidos por un tratamiento en diferentes poblaciones según una característica concreta17. Los niveles de expresión tumoral de PD-L1 han sido usados previamente como biomarcador predictor de respuesta a la inmunoterapia en CPNM18, por lo que la aplicación de los subgrupos según este factor en el contexto perioperatorio podría ser interesante. De esta manera, no se mezclarían poblaciones con un alto nivel de expresión tumoral de PD-L1 (con una posible mayor respuesta a la inmunoterapia) con poblaciones con niveles más bajos del biomarcador (con menor respuesta). El uso de resultados provenientes de estudios y poblaciones heterogéneas en un NMA podría desembocar en conclusiones erróneas, las cuales, a su vez, podrían influir negativamente en la toma de decisiones clínicas19. El objetivo es elaborar un NMA de eficacia de esquemas inmunoterápicos perioperatorios en CPNM resecable según los niveles de expresión de PD-L1.
MétodosRevisión sistemática de la literaturaSe aplicó la estrategia PICOS para desarrollar la pregunta de investigación20: la población, la intervención, el comparador, la variable de resultados y el diseño de estudio. Los pacientes diagnosticados con CPNM resecable con determinación de los niveles de expresión tumoral de PD-L1 fueron incluidos como población diana. La intervención seleccionada fueron esquemas perioperatorios (tanto en neoadyuvancia como adyuvancia), que incluyeran agentes inmunoterápicos. Cualquier comparador fue aceptado. La variable de resultados seleccionada fue la SLP. Se incluyeron los estudios con diseño comparativo en fase III con un tamaño muestral mayor de 50 pacientes de la población diana, ya que presentan suficiente madurez con potencia estadística para evitar conclusiones prematuras.
La búsqueda bibliográfica siguió las recomendaciones de la guía Preferred Reporting Items for a Systematic Review and Meta-analysis (PRISMA)21. Esta revisión se llevó a cabo en 2 bases de datos (PubMed® y EMBASE®) con fecha del 17 de septiembre de 2024. En PubMed® se aplicó el filtro «randomized controlled trial» con la siguiente estrategia de búsqueda: «perioperative non-small-cell lung cancer». En EMBASE® se aplicaron los filtros «study types: randomized controlled trial» y «publication types: article», con los descriptores de búsqueda: perioperative resectable non–small cell lung cancer OR (perioperative AND resectable AND non–small AND [cell/exp OR cell] AND [‘lung’/exp OR lung] AND [cancer/exp OR cancer]).
Cribado y criterios de selección de estudiosLa búsqueda sistemática fue realizada por 2 investigadores de forma independiente. En el proceso de cribado, los títulos y abstracts de los resultados de búsqueda fueron revisados para excluir las publicaciones que no cumplían los criterios de inclusión establecidos. En el proceso de elegibilidad, el texto completo de las publicaciones fue examinado. Posteriormente, se realizó un rastreo de citas. Cualquier incongruencia de inclusión o exclusión de los resultados de búsqueda fue solucionada mediante discusión de los 2 revisores con un tercero. Los resultados de búsqueda incluidos fueron aquellos acordes a los criterios PICOS descritos. Los resultados de búsqueda excluidos fueron aquellos que no cumplían con los criterios anteriores, así como los publicados en un idioma diferente del español o el inglés.
Extracción de datosLos siguientes datos fueron recogidos a partir de los ensayos clínicos seleccionados: la identificación del estudio con fecha de publicación, el esquema del brazo de intervención, el tratamiento comparador, la duración y los períodos de administración de tratamientos, la mediana de seguimiento de los pacientes, las características relevantes de la población (edad, estado funcional, estadio de enfermedad, histología, expresión tumoral de PD-L1, afectación de ganglios linfáticos), los tamaños muestrales, los valores de hazard ratio (HR) para la SLP y el intervalo de credibilidad (ICr) del 95%.
Riesgo de sesgoSe evaluaron posibles fuentes de sesgo relacionadas con la falta de homogeneidad entre los diseños de los ensayos clínicos incluidos, las características de las poblaciones reclutadas y los comparadores comunes del NMA. Se consideró el impacto de seguimientos prolongados en la identificación de eventos clínicos, así como la influencia de tamaños de muestra inadecuados en la precisión de los resultados. Se analizaron las diferencias en los perfiles de los pacientes reclutados, incluyendo variables como la edad, el estado funcional, el estadio de la enfermedad, la histología y la afectación de los ganglios linfáticos, debido a su potencial efecto en la calidad de los datos y la heterogeneidad de los resultados obtenidos. También se valoró la heterogeneidad en los esquemas que conforman los nodos del NMA por su relación con la incertidumbre de los resultados.
Metaanálisis en redSe elaboró un NMA con los resultados de la búsqueda sistemática mediante los HR de la SLP, así como los valores superiores e inferiores del ICr 95%. La red fue formada por conexión con el comparador común. El esquema de referencia para evaluar los resultados fue definido como aquel con mayor magnitud de efecto. Primero, se llevó a cabo un análisis primario incluyendo todos los estudios seleccionados. Posteriormente, se realizó un análisis de sensibilidad con una red sin aquellos estudios que, aunque cumplieran los criterios de inclusión establecidos, pudieran presentar cierta heterogeneidad y sesgos con respecto al resto de la red. El paquete GEMTC para R-Statistics®22 y el programa JAGS®23 fueron usados en el NMA, el cual se basó en métodos bayesianos que combinaron evidencias directas e indirectas. El ICr obtenido determinó que existe un 95% de probabilidad de que el parámetro real se encuentre entre los valores superiores e inferiores, según los datos y modelos usados por métodos bayesianos. Los modelos de efectos fijos y efectos aleatorizados fueron comparados mediante el criterio de información de la devianza (DIC, del inglés deviance information criterion). Se seleccionó el modelo que mejor se adaptó a la red, que fue definido como aquel con la puntuación más baja de DIC, estableciéndose un valor de 5 como diferencia mínima relevante entre las 2 alternativas24. En caso de no alcanzarse esta diferencia mínima, se seleccionó la opción que aportara unos datos más precisos. Además, la consistencia y heterogeneidad del NMA se analizaron mediante el estadístico Q25. I2 determinó qué proporción de variabilidad en los resultados se debió a la heterogeneidad26. Una heterogeneidad baja fue aceptada con un valor de I2 < 25%, heterogeneidad media cuando I2 = 25–50% y heterogeneidad elevada cuando I2 > 50%27. El modelo de efectos aleatorizados fue usado en caso de alta heterogeneidad28.
Por último, se llevó a cabo un análisis con los datos agregados de los esquemas con agentes inmunoterápicos en aquellos subgrupos de expresión de PD-L1 en los que no se observaron diferencias con la terapia estándar. Esta evaluación buscó valorar el efecto de la reducción de la potencia estadística al usar resultados por subgrupos con menor tamaño muestral que los resultados globales de los ensayos clínicos. Los cálculos fueron realizados a partir de los HR y las varianzas de sus logaritmos neperianos29.
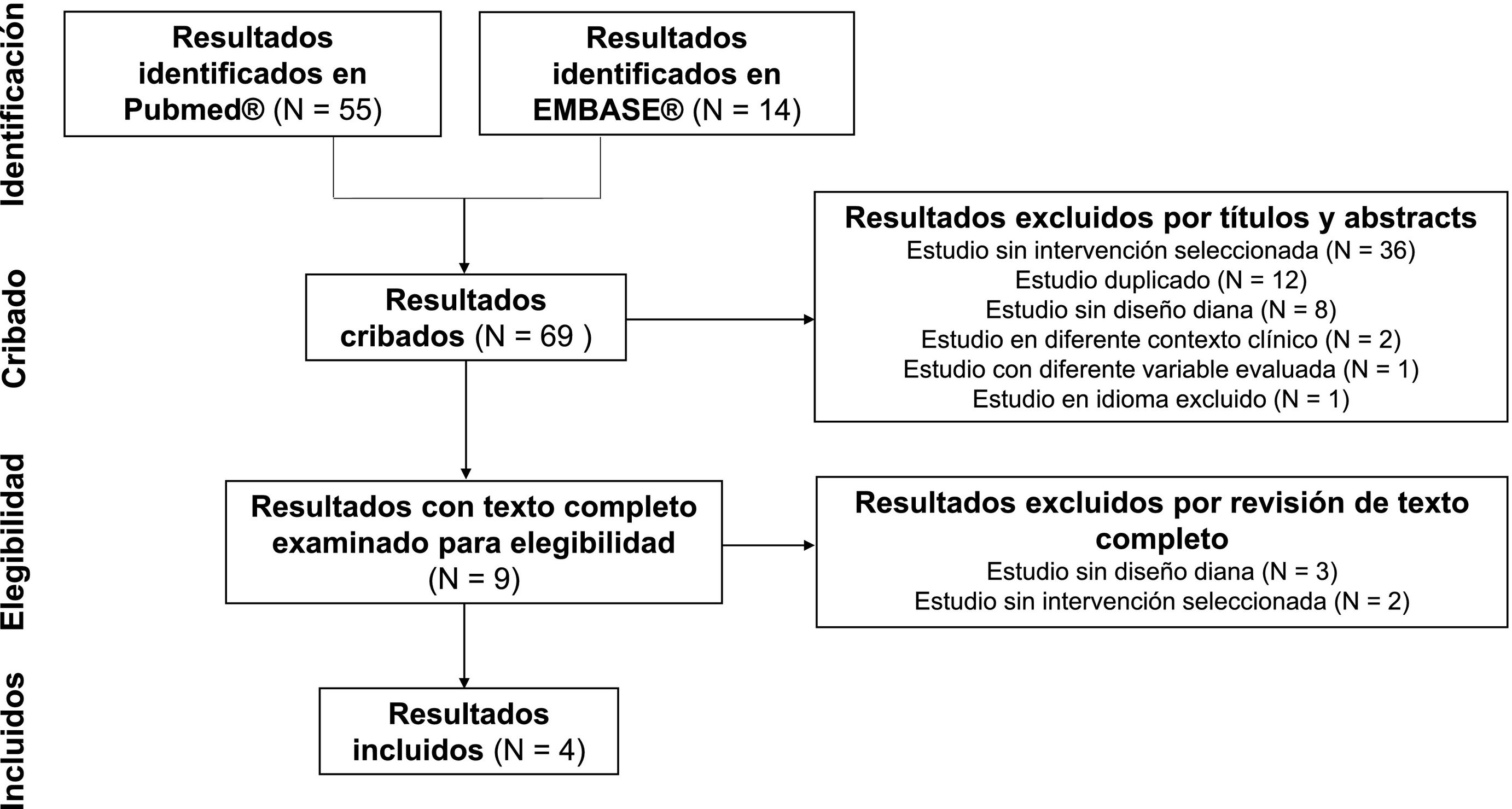
ResultadosRevisión sistemática de la literatura y selección de estudiosSe encontraron 69 resultados de búsqueda en las bases de datos PubMed® y EMBASE®. De este total, se excluyeron 65 resultados por los siguientes motivos: 38 estudios sin la intervención seleccionada, 12 publicaciones duplicadas, 11 estudios sin diseño diana, 2 estudios sobre diferentes contextos clínicos, uno con diferentes variables evaluadas y otro por usar un idioma excluido. En el rastreo de citas no se encontraron estudios que cumplieran los criterios de selección establecidos. Por tanto, se incluyeron 4 ensayos clínicos14,15,30,31. En la figura 1 se muestra la revisión sistemática desarrollada de acuerdo con las recomendaciones PRISMA.
Síntesis de los datosLas características de los tratamientos evaluados en los estudios y el seguimiento de los pacientes pueden consultarse en la tabla 1. Los esquemas seleccionados incluyeron el uso perioperatorio de durvalumab del estudio AEGEAN (P-durvalumab)15, pembrolizumab del ensayo KEYNOTE-671 (P-pembrolizumab)14, nivolumab del estudio CheckMate 77T (P-nivolumab)30 y toripalimab del ensayo Neotorch (P-toripalimab)31. Los tratamientos perioperatorios de los brazos de la intervención de los estudios englobaron 4 ciclos neoadyuvantes de la inmunoterapia más quimioterapia basada en platino, seguidos de cirugía y, posteriormente, el agente inmunoterápico en monoterapia como adyuvancia. Solo hubo una excepción, P-toripalimab. En este caso, se administraron 3 ciclos neoadyuvantes de toripalimab más quimioterapia basada en platino, seguidos de cirugía, y tras esto, otro ciclo adyuvante de toripalimab asociado a quimioterapia. Posteriormente, se administró toripalimab en monoterapia. Esta diferente distribución con el resto de ensayos también se vio reflejada en el brazo control del estudio Neotorch31, con 3 ciclos neoadyuvantes de placebo más quimioterapia basada en platino, y uno de esta combinación como adyuvancia tras cirugía. Todos los demás brazos control usaron la quimioterapia basada en platino asociada a placebo como 4 ciclos de neoadyuvancia. Los estudios seleccionados incluyeron pacientes con estado funcional ECOG 0–1 (del inglés, Eastern Cooperative Oncology Group) y los subgrupos de pacientes según expresión tumoral de PD-L1 fueron delimitados con los cortes <1%, 1–49% y ≥ 50%. Las diferencias más relevantes de las características de las poblaciones reclutadas en los ensayos fueron recogidas en la tabla 2.
Características de los tratamientos y seguimiento de los pacientes
| Estudio(autoría y año) | Esquema brazo intervención | Esquema brazo comparador | Posibilidad de quimioterapia con carboplatino | Duración de adyuvancia(días) | Inicio de adyuvancia(máximo de días desde cirugía) | Mediana de seguimiento de pacientes(meses) |
|---|---|---|---|---|---|---|
| Heymach et al. (2023)15 | Neoadyuvancia de 4 ciclos de quimioterapia basada en platino más durvalumab (1.500 mg) cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con durvalumab cada 4 semanas durante 12 ciclos | Neoadyuvancia de 4 ciclos de quimioterapia basada en platino más placebo cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con placebo cada 4 semanas durante 12 ciclos | Sí | 336 | Dentro de 70 días tras la cirugía o 21 días tras la radioterapia posoperatoria | 11,7 |
| Wakelee et al. (2023)14 | Neoadyuvancia de 4 ciclos de quimioterapia basada en platino más pembrolizumab (200 mg) cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con pembrolizumab cada 3 semanas durante 13 ciclos | Neoadyuvancia de 4 ciclos de quimioterapia basada en platino más placebo cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con placebo cada 3 semanas durante 13 ciclos | No | 273 | 84 | 25,2 |
| Cascone et al. (2024)30 | Neoadyuvancia de 4 ciclos de quimioterapia basada en platino más nivolumab (360 mg) cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con nivolumab cada 4 semanas durante un año | Neoadyuvancia de 4 ciclos de quimioterapia basada en platino más placebo cada 3 semanas, seguido de cirugía.Posteriormente, adyuvancia con placebo cada 4 semanas durante un año | Sí | 365 | 90 | 25,4 |
| Lu et al. (2024)31 | Neoadyuvancia de 3 ciclos de quimioterapia basada en platino más toripalimab (240 mg) cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con un ciclo de quimioterapia basada en platino más toripalimab (240 mg), seguido de toripalimab cada 3 semanas durante 13 ciclos | Neoadyuvancia de 3 ciclos de quimioterapia basada en platino más placebo cada 3 semanas, seguido de cirugía. Posteriormente, adyuvancia con un ciclo de quimioterapia basada en platino más placebo, seguido de placebo cada 3 semanas durante 13 ciclos | Sí | 294 | 28–56 | 18 |
Diferencias más relevantes en las características de las poblaciones reclutadas en los estudios incluidos
| Estudio(autoría y año) | Población mayor de 65 años (%) | Histologíaescamosa (%) | Histologíano escamosa (%) | Estadio de enfermedadIIIA-IIIB (%) | Afectación de ganglios linfáticos N2 (%) |
|---|---|---|---|---|---|
| Heymach et al. (2023)15 | No encontrado | 46,2–51,1 | 53,6–47,9 | 71,3–70,3 | 49,5–49,5 |
| Wakelee et al. (2023)14 | 44,3–46,5 | 43,1–43,2 | 56,9–56,8 | 70,3–69,7 | 42,3–46,8 |
| Cascone et al. (2024)30 | 55,5–56,9 | 50,7–50,8 | 49,3–49,1 | 63,8–64,2 | 39,7–39,2 |
| Lu et al. (2024)31 | 30,7–31,7 | 77,7–77,7 | 22,3–22,3 | 99,5–99 | 68,3–71,8 |
Cada celda presenta 2 números separados por un guion que describen los brazos intervención y control de cada estudio, con la siguiente distribución: porcentaje de la población del estudio con la característica especificada en el brazo intervención, porcentaje de la población del estudio con la característica especificada en el brazo control.
Los diseños de los ensayos clínicos incluidos fueron similares, con estratificación de aleatorización según el estadio de la enfermedad y la expresión tumoral de PD-L1. El estudio sobre el uso de P-durvalumab presentó el menor seguimiento en los pacientes15, con 11,7 meses. El esquema inmunoterápico con menor tamaño muestral fue P-toripalimab en el subgrupo con expresión de PD-L1 < 1% (N = 51) y 1–49% (N = 69)31. Sin embargo, el tamaño muestral más bajo fue reclutado por P-nivolumab en el subgrupo con expresión de PD-L1 ≥ 50% (N = 45)30.
Los pacientes reclutados en el ensayo Neotorch mostraron algunas diferencias con respecto a la población del resto de los estudios14,15,30,31. P-toripalimab fue usado aproximadamente en el 31% de los pacientes mayores de 65 años, mientras que esta subpoblación alcanzó el 45–55% de casos en el resto de estudios. El 99% de los pacientes reclutados para evaluar el efecto del P-toripalimab presentaron un estadio de enfermedad IIIA-IIIB, mientras que este estadio se encontró aproximadamente en el 64–70% de la población en los demás ensayos. Asimismo, la histología escamosa fue predominante en el estudio Neotorch con un 78% de los casos, mientras que esta proporción osciló sobre el 43–50% en el resto de estudios. Por otra parte, la histología no escamosa fue representada por un 22% de los pacientes tratados con P-toripalimab, mientras que esta subpoblación alcanzó el 49–56% de los pacientes tratados por el resto de esquemas. El 70% de los casos que recibieron P-toripalimab tenían afectación de ganglios linfáticos N2 frente al 39–49% de los otros estudios.
También se consideró como posible sesgo la diferente distribución perioperatoria de la combinación de la inmunoterapia más quimioterapia del estudio Neotorch con respecto al resto de tratamientos. Estas diferencias generaron cierta heterogeneidad en el nodo comparador común del NMA, que es el uso perioperatorio de placebo más quimioterapia basada en platino (P-placebo). Por otra parte, todos los regímenes perioperatorios incluyeron el uso de quimioterapia con carboplatino o cisplatino, excepto el P-pembrolizumab, el cual solo permitió terapia con cisplatino. Teniendo en cuenta las diferencias en la población reclutada y la distribución perioperatoria de los fármacos, se consideró el descarte del estudio Neotorch del NMA como análisis de sensibilidad.
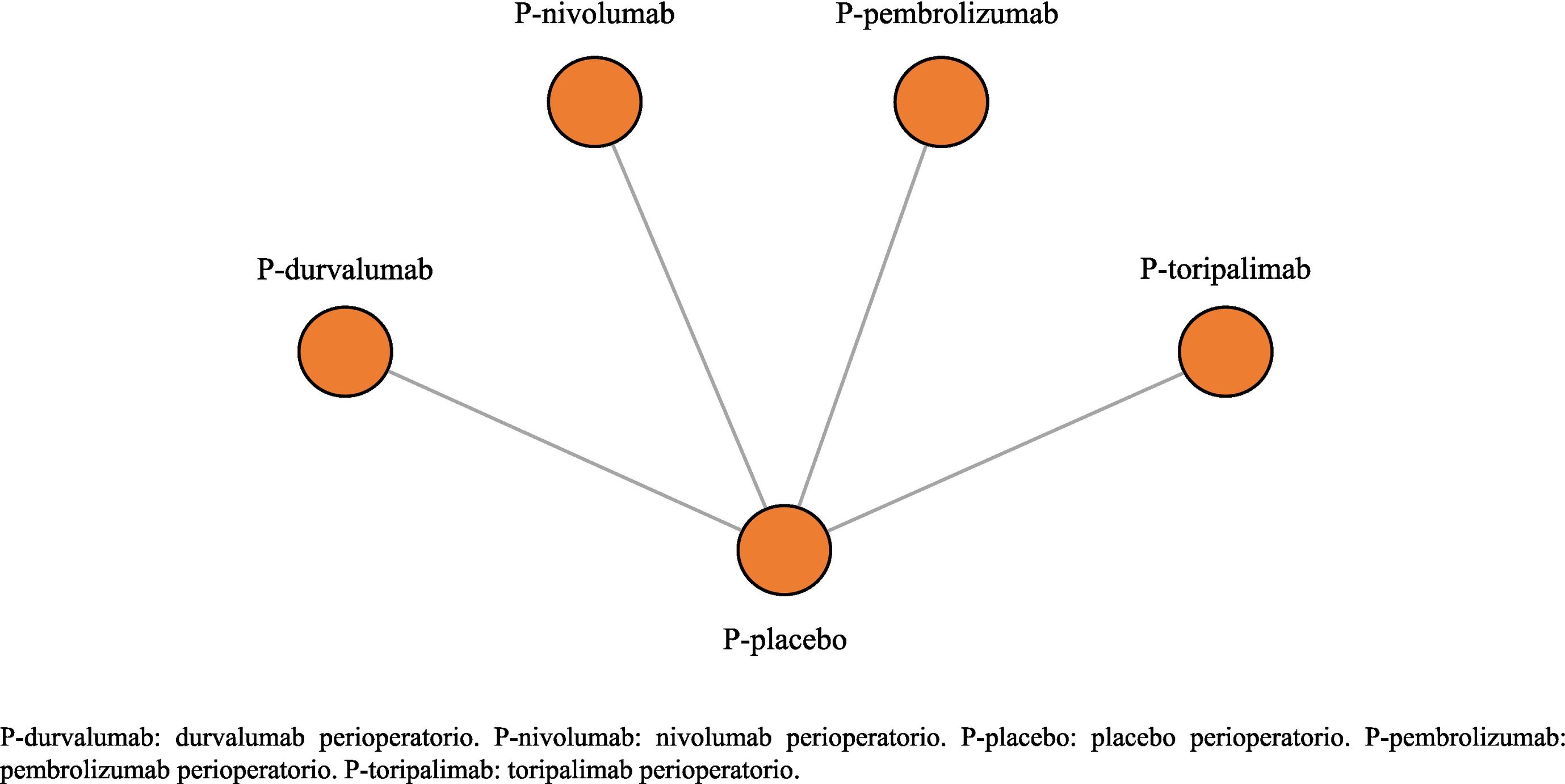
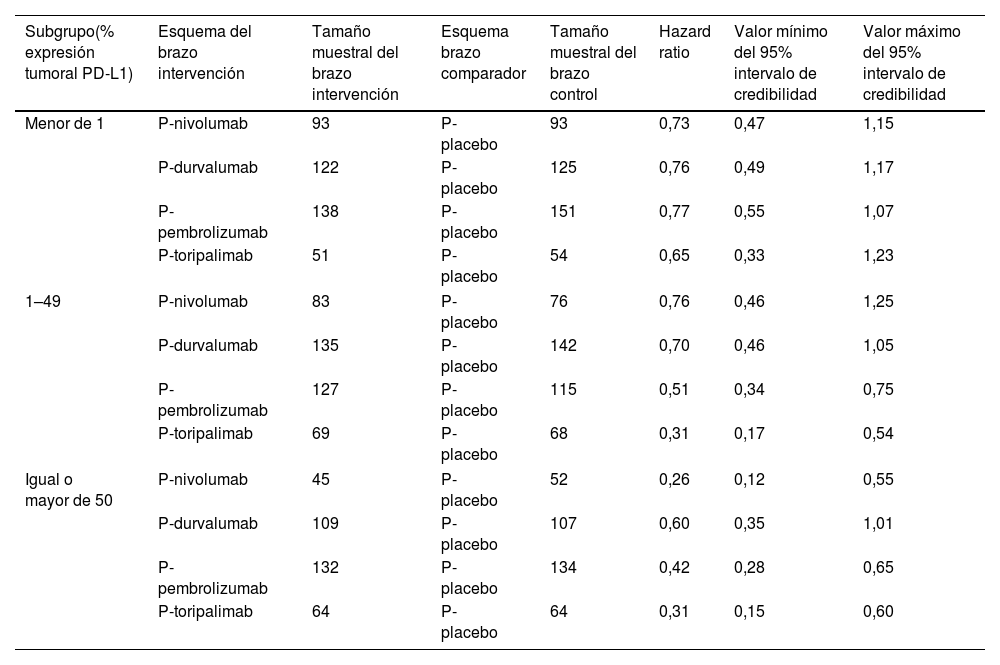
Análisis de los datosLa figura 2 representa la red del NMA. En la tabla 3 se muestran los tamaños muestrales y los valores de eficacia de los tratamientos, según la expresión de PD-L1 usados para desarrollar el NMA. El análisis primario incluyó todos los regímenes perioperatorios inmunoterápicos, mientras que el análisis de sensibilidad no incluyó a P-toripalimab31.
Tamaños muestrales y valores de la eficacia de los tratamientos según la expresión de ligando 1 de muerte programada
| Subgrupo(% expresión tumoral PD-L1) | Esquema del brazo intervención | Tamaño muestral del brazo intervención | Esquema brazo comparador | Tamaño muestral del brazo control | Hazard ratio | Valor mínimo del 95% intervalo de credibilidad | Valor máximo del 95% intervalo de credibilidad |
|---|---|---|---|---|---|---|---|
| Menor de 1 | P-nivolumab | 93 | P-placebo | 93 | 0,73 | 0,47 | 1,15 |
| P-durvalumab | 122 | P-placebo | 125 | 0,76 | 0,49 | 1,17 | |
| P-pembrolizumab | 138 | P-placebo | 151 | 0,77 | 0,55 | 1,07 | |
| P-toripalimab | 51 | P-placebo | 54 | 0,65 | 0,33 | 1,23 | |
| 1–49 | P-nivolumab | 83 | P-placebo | 76 | 0,76 | 0,46 | 1,25 |
| P-durvalumab | 135 | P-placebo | 142 | 0,70 | 0,46 | 1,05 | |
| P-pembrolizumab | 127 | P-placebo | 115 | 0,51 | 0,34 | 0,75 | |
| P-toripalimab | 69 | P-placebo | 68 | 0,31 | 0,17 | 0,54 | |
| Igual o mayor de 50 | P-nivolumab | 45 | P-placebo | 52 | 0,26 | 0,12 | 0,55 |
| P-durvalumab | 109 | P-placebo | 107 | 0,60 | 0,35 | 1,01 | |
| P-pembrolizumab | 132 | P-placebo | 134 | 0,42 | 0,28 | 0,65 | |
| P-toripalimab | 64 | P-placebo | 64 | 0,31 | 0,15 | 0,60 | |
No se encontraron diferencias relevantes entre el modelo de efectos fijos y el modelo de efectos aleatorizados en cada uno de los escenarios según el nivel de expresión tumoral de PD-L1. El valor DIC para el modelo de efectos fijos y el modelo de efectos aleatorizados fue de 7,98 y 8,03, respectivamente, en el análisis con la expresión tumoral de PD-L1 < 1%; 7,98 y 8 para PD-L1 con expresión 1–49%; 7,97 y 7,98 para expresión tumoral de PD-L1 ≥ 50%.
Considerando que las diferencias son inferiores al umbral de 5 puntos definido como diferencia mínima relevante, el modelo de efectos fijos fue seleccionado para proveer información más precisa. Los datos de consistencia no pudieron ser obtenidos por ausencia de evidencia indirecta entre los esquemas (red en forma de estrella). El I2 fue de 25% en todos los análisis según la expresión tumoral de PD-L1 (<1%, 1–49% y ≥ 50%) para el análisis primario. Teniendo en cuenta la baja heterogeneidad, se desechó completamente el uso del modelo de efectos aleatorizados.
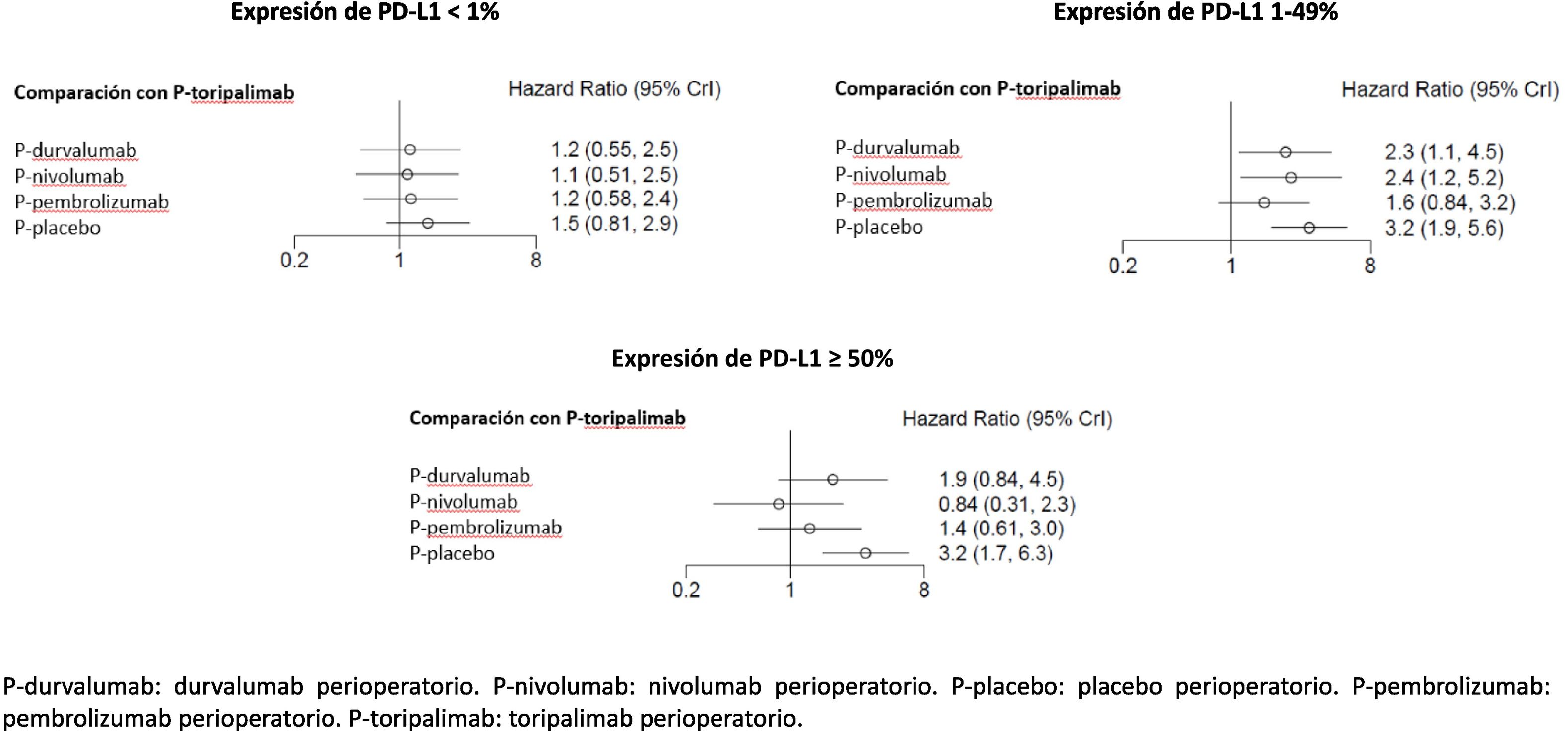
En el análisis primario, P-toripalimab fue seleccionado como el tratamiento de referencia por obtener la mayor magnitud de efecto en los escenarios de expresión tumoral de PD-L1 < 1% y 1–49%. Con respecto a este régimen, los valores de HR de las diferentes alternativas terapéuticas pueden consultarse en la figura 3.
En el análisis con niveles de PD-L1 < 1%, no se observaron diferencias estadísticamente significativas entre ninguno de los esquemas perioperatorios con agentes inmunoterápicos frente a P-placebo. En el escenario de expresión de PD-L1 de 1–49%, P-toripalimab no demostró ser superior a P-pembrolizumab. Sin embargo, se observó inferioridad estadísticamente significativa del resto de regímenes. En el análisis con niveles de expresión tumoral de PD-L1 ≥ 50%, las combinaciones perioperatorias con agentes inmunoterápicos mostraron beneficio frente a P-placebo.
Para el análisis primario, se calculó un HR = 0,74 (ICr 95%: 0,60–0,92) en la evaluación con los datos agregados de los esquemas con agentes inmunoterápicos frente a P-placebo en el subgrupo con expresión de PD-L1 < 1%, que fue el único escenario en el que no se observaron diferencias estadísticamente significativas de ninguno de los regímenes inmunoterápicos frente a P-placebo.
En el análisis de sensibilidad, el tratamiento de referencia fue P-nivolumab (con mejor HR en subgrupos con expresión PD-L1 < 1% y ≥ 50%). Con respecto a P-nivolumab, los valores de HR del resto de alternativas terapéuticas en el escenario de expresión de PD-L1 < 1% fueron: 1,0 (ICr 95%: 0,56–2) de P-durvalumab, 1,1 (ICr 95%: 0,6–1,9) de P-pembrolizumab y 1,4 (ICr 95%: 0,87–2,2) de P-placebo. En el análisis de niveles de PD-L1 de 1–49%: 0,67 (ICr 95%: 0,36–1,3) de P-pembrolizumab, 0,92 (ICr 95%: 0,48–1,7) de P-durvalumab y 1,3 (ICr 95%: 0,8–2,2) de P-placebo. En el escenario de expresión tumoral de PD-L1 ≥ 50%: 1,6 (ICr 95%: 0,68–3,8) de P-pembrolizumab, 2,3 (ICr 95%: 0,93–5,7) de P-durvalumab y 3,8 (ICr 95%: 1,8–8,1) de P-placebo.
Para el análisis de sensibilidad, se estimó un HR = 0,76 (ICr 95%: 0,60–0,95) en la evaluación con los datos agregados de los esquemas con agentes inmunoterápicos (excluyendo P-toripalimab) frente a P-placebo en el subgrupo con expresión de PD-L1 < 1%.
DiscusiónLos NMA permiten comparar directa e indirectamente esquemas terapéuticos en ausencia de estudios clínicos con comparaciones directas, lo cual es crucial en contextos como el del uso de las inmunoterapias perioperatorias en CPNM resecable. Los resultados de este NMA destacan la relevancia de considerar los niveles de expresión de PD-L1 como biomarcador clave para guiar las decisiones terapéuticas.
En los pacientes con expresión de PD-L1 de 1–49%, los esquemas perioperatorios que incluyen P-toripalimab y P-pembrolizumab demostraron un mayor beneficio en la SLP, lo que sugiere que estas combinaciones podrían posicionarse como opciones preferentes en este subgrupo. En los pacientes con PD-L1 ≥ 50%, todos los esquemas inmunoterápicos evaluados mostraron beneficio frente al uso exclusivo de quimioterapia, ofreciendo una mayor flexibilidad en la selección de alternativas terapéuticas. Sin embargo, no se observaron resultados favorables para la SLP para ninguno de los regímenes de la inmunoterapia perioperatoria en la población con expresión de PD-L1 < 1%, si se valoran individualmente. Esto plantea la necesidad de reevaluar la utilidad de estos tratamientos en esta población con datos más maduros, y actualmente podría justificar el enfoque en la quimioterapia estándar. Estos hallazgos subrayan la importancia de la personalización del tratamiento basada en biomarcadores. La plausibilidad biológica de estos datos es bastante sólida, considerando el mecanismo de acción de los agentes inmunoterápicos, ya que todos ellos actúan sobre la interacción de la unión de PD-L1 con su receptor32–35. Aquellos pacientes con una mayor expresión tumoral de PD-L1 podrían tener una mejor respuesta ante fármacos que actúan sobre esta diana terapéutica, mientras que la población con baja expresión de este biomarcador no obtendría un efecto mayor que si no recibiera estos tratamientos.
Por otra parte, la evaluación de los datos agregados de combinaciones con la inmunoterapia considera las limitaciones de potencia estadística de los datos de los subgrupos. Este análisis agregado sugiere un beneficio en la adición de la inmunoterapia perioperatoria a la quimioterapia en la población con PD-L1 < 1%. Esta presunta incongruencia con los resultados individuales de los esquemas por separado podría deberse a tamaños muestrales y eventos insuficientes al usar datos de los subgrupos, en lugar de resultados globales de ensayos clínicos. Por ello, no se debería descartar definitivamente el uso de la inmunoterapia perioperatoria en el CPNM resecable en la expresión de PD-L1 < 1%.
En el análisis de sensibilidad se mostraron resultados acordes al análisis primario. La combinación de la inmunoterapia-quimioterapia perioperatoria en los pacientes con CPNM resecable y expresión de PD-L1 elevada también reportó un efecto positivo para la SLP en el análisis de sensibilidad. Los agentes inmunoterápicos evaluados individualmente no aportaron beneficio en la población con baja expresión de PD-L1. No obstante, en la evaluación de los datos agregados de los esquemas inmunoterápicos en el subgrupo de menor expresión de PD-L1, se encontró beneficio en el análisis de sensibilidad. Este análisis de sensibilidad se desarrolló ante el descarte de P-toripalimab del NMA, por las diferencias en la población reclutada con respecto al resto de estudios, así como de una distribución diferente del último ciclo de la inmunoterapia asociada a la quimioterapia del brazo comparador del ensayo Neotorch31, que forma un nodo de la red de tratamientos. Esta heterogeneidad de características hace que fuera interesante (y necesaria) valorar la influencia del P-toripalimab en el NMA.
La revisión permitió señalar tanto las principales diferencias del estudio Neotorch31 con respecto al resto de estudios, como otras posiblemente menores. P-pembrolizumab incluyó exclusivamente regímenes de quimioterapia basados en cisplatino, y el P-durvalumab desarrolló el seguimiento de los pacientes más corto.
En lo que se refiere a las variables evaluadas en los ensayos, se seleccionó la SLP por varias razones. En primer lugar, no se han observado diferencias estadísticamente significativas para la supervivencia global (SG), entre los esquemas perioperatorios con o sin inmunoterapia, por tratarse de estadios tempranos de enfermedad, en los que los eventos de muerte son escasos14. Por lo tanto, serían necesarios estudios de mayor duración y tamaño muestral para llevar a cabo valoraciones fiables con datos más maduros de SG. En segundo lugar, la influencia en la SG de los tratamientos posteriores al contexto evaluado debe ser considerada cuidadosamente.
Nuestros criterios de selección de los estudios garantizaron la inclusión de ensayos clínicos fase III, con tamaños muestrales aceptables. Estos criterios de selección consideraron las recomendaciones de Gil-Sierra et al.17 sobre el análisis por subgrupos, ya que el presente NMA usó los datos poblacionales en función de los niveles de expresión de PD-L1. Teniendo en cuenta las limitaciones de los análisis por subgrupos, se desarrollaron comparaciones solo de aquellos estudios de mayor calidad científica y con tamaños muestrales adecuados.
Previamente, se han publicado algunos NMA sobre el uso perioperatorio de inmunoterapia en CPNM resecable. Mei et al. elaboraron un NMA con una búsqueda sistemática hasta agosto de 202336. Este trabajo se encuentra actualmente desactualizado, ya que no incluye ensayos publicados con posterioridad, como Cascone et al.30. Los autores de este NMA señalan a P-toripalimab como la alternativa terapéutica preferente en el subgrupo de los pacientes con expresión negativa de PD-L1 o P-nivolumab como el mejor tratamiento en población con alta expresión de este biomarcador. De hecho, establece unos rankings de los esquemas que evalúa. Estas priorizaciones de los esquemas no están basadas en un criterio estadístico sólido sobre una variable relevante.
A diferencia de Mei et al.36, este trabajo no encontró ningún criterio para establecer priorización entre las distintas combinaciones de agentes inmunoterápicos asociadas a la quimioterapia en pacientes con niveles de expresión de PD-L1 < 1% y PD-L1 ≥ 50%. Nuestra interpretación de datos se apoya en unos criterios estadísticos fiables, que descartan la aceptación de diferencias atribuibles al azar. Desde el punto de vista farmacoeconómico, así se favorece la competitividad de las alternativas terapéuticas y puede generar adquisiciones de fármacos a precios menores.
Otro NMA publicado con anterioridad al nuestro adolece de limitaciones similares a Mei et al.36. Chen et al. relacionaron P-toripalimab o P-nivolumab con un mayor beneficio 37. En este caso, los autores no elaboraron diferentes comparaciones en función del nivel de expresión de PD-L1. Desde nuestro punto de vista, esto supone una limitación importante a la hora de aplicar los resultados del NMA en la toma de decisiones clínicas para el CPNM resecable candidato a la inmunoterapia perioperatoria. El PD-L1 es un marcador contrastado que debe ser valorado escrupulosamente en el posicionamiento terapéutico de fármacos para CPNM. Este estudio evaluó los diferentes esquemas en varios escenarios, según el nivel de expresión de PD-L1, lo cual supone una ventaja en la personalización terapéutica. Además, en este NMA se observaron diferencias estadísticamente significativas en la SLP de P-toripalimab y de P-pembrolizumab con el resto de regímenes solo en el escenario con expresión de PD-L1 de 1–49%. En los demás escenarios, ningún esquema con agentes inmunoterápicos mostró superioridad con respecto al resto. Los resultados del análisis de sensibilidad del NMA respaldaron estos resultados.
Además de comparaciones entre los diferentes esquemas inmunoterápicos perioperatorios en el CPNM resecable, existen otros estudios que evalúan el efecto del tratamiento neoadyuvante y adyuvante. Recientemente, se han publicado trabajos que señalan la ausencia de beneficio al añadir el régimen adyuvante al neoadyuvante, con resultados similares entre el uso perioperatorio de inmunoterapia y su uso exclusivamente neoadyuvante38,39. Además, la adición de la inmunoterapia adyuvante puede generar un mayor número de eventos adversos y costes. Este tipo de estudios son complementarios del nuestro, facilitando el posicionamiento terapéutico de los diferentes esquemas.
Finalmente, podemos concluir que este trabajo es un NMA relevante y fiable de eficacia del uso perioperatorio de esquemas inmunoterápicos para el CPNM resecable, en el que P-toripalimab y P-pembrolizumab han mostrado un aumento de la SLP en los pacientes con PD-L1 de 1–49%, y no se han observado diferencias entre las combinaciones de inmunoterapia-quimioterapia en el resto de los subgrupos, por lo que se podría promover la competencia de las alternativas terapéuticas.
Responsabilidades éticasLos autores declaran que se han tenido en cuenta las instrucciones para autores y las responsabilidades éticas y, entre ellas, que todos los autores firmantes cumplen los requisitos de autoría y que todos han declarado sus respectivos conflictos de intereses.
Se cumplieron todas las responsabilidades éticas necesarias en lo referente a autoría y publicación redundante (la protección de personas y animales de investigación, así como el consentimiento informado no fueron necesarios por el diseño del estudio).
Todos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
FinanciaciónLos autores declaran que no recibieron financiación alguna.
Conflicto de interesesLos autores no han declarado ningún conflicto de intereses.
Declaración de contribución de autoría CRediTManuel David Gil-Sierra: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. María del Pilar Briceño-Casado: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Cristina Moreno-Ramos: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization.