Intrathecal chemotherapy is frequently used in clinical practice for treatment and prevention of neoplastic meningitis. Despite its widespread use, there is little information about practical aspects such as the volume of drug to be administered or its preparation and administration.
ObjectiveTo conduct a literature review about practical aspects of the use of intrathecal chemotherapy.
MaterialsSearch in PubMed/ Medline using the terms „chemotherapy AND intrathecal“, analysis of secondary and tertiary information sources.
ResultsThe most widely used drugs in intrathecal therapy are methotrexate and cytarabine, at variable doses. One of the aspects with higher variability among different studies is their potential combination with a glucocorticoid, the specific corticoid selected and its dose. The efficacy and toxicity of the different combinations have not been compared. Regarding preparation, it is worth highlighting the recommendation to adjust pH and osmolarity to the physiological range, with the aim of improving tolerability. The volume of administration can influence distribution, and recommendated range is between 5 and 12 mL. Overall, it is recommended to extract a similar volume of cerebrospinal fluid before administration. The position of the patient during and after administration can have an impact on distribution and toxicity; lateral decubitus or sitting position is recommended in the first case, and prone and/ or supine position in the second one. Most publications don't explain how the treatment has been prepared or administered, and the lack of standardization could affect results.
ConclusionsThere is a great variability in practice when using intrathecal chemotherapy, despite being an effective therapy, accepted by all international groups. This uncertainty is not li-mited to the drugs and doses administered, but it also includes the manner of preparation and the administration technique. The heterogeneity In clinical practice can Influence the efficacy and toxicity of this therapy.
La quimioterapia intratecal es utilizada frecuentemente, en la práctica clínica, para el tratamiento y prevención de la meningitis neoplásica. A pesar de su uso extendido, existe poca información acerca de aspectos prácticos tales como el volumen de fármaco a administrar o la forma de preparación y administración.
ObjetivoRealizar una revisión de la literatura acerca de aspectos prácticos de la utilización de la quimioterapia intratecal.
MaterialBúsqueda en PubMed/Medline utilizando los términos „chemotherapy AND intrathecal“, análisis de fuentes de información secundarias y terciarias.
ResultadosLos fármacos más utilizados en terapia intratecal son metotrexato y citarabina, con dosis variables. La asociación o no con un glucocorticoide, el corticoide concreto seleccionado y su dosis es uno de los aspectos con mayor variabilidad entre distintos estudios. No se han comparado la eficacia y toxicidad de las distintas combinaciones. En la preparación destaca la recomendación de ajustar pH y osmolaridad al rango fisiológico, con el objetivo de mejorar la tolerancia. El volumen de administración puede influir en la distribución, oscilando las recomendaciones entre 5-12 mL. En general, se aconseja extraer previamente un volumen de líquido cefalorraquídeo similar. La posición del paciente durante y tras la administración puede influir en la distribución y la toxicidad; se recomienda el decúbito lateral o la sedestación, en el primer caso, y el decúbito prono y/o supino, en el segundo. La mayoría de las publicaciones no indican cómo se ha preparado o administrado el tratamiento, y la falta de estandarización podría afectara los resultados.
ConclusionesExiste gran variabilidad en la práctica a la hora de utilizar la quimioterapia intratecal, a pesar de ser una terapia efectiva asumida por todos los grupos internacionales. La incertldumbre no se limita a los fármacos y dosis administradas, sino que se extiende a la forma de preparación de las mezclas y la técnica de administración. La heterogeneidad en la práctica clínica puede Influir en la efectividad y toxicidad de esta terapia.
The administration of intrathecal (IT) chemotherapy for the treatment and prevention of neoplastic infiltration in the central nervous system (CNS) is a widely extended practice that has demonstrated efficacy in different conditions. The use of such therapy for the prevention of CNS relapse in Acute Lymphoblastic Leukemia (ALL) in paediatric patients started in the 70s. The disease prognosis changed radically, because before the use of CNS prophylaxis, more than half of complete remissions induced by systemic chemotherapy would end up in CNS relapse1. IT chemotherapy has progressively displaced radiotherapy in this indication, given its similar efficacy with a more favourable profile of adverse effects2. Traditionally, the drugs used have been methotrexate and cytarabine, alone or in combination with glucocorticoids, in the called Triple Intrathecal Therapy (TIT). The use of liposomal cytarabine has been recently introduced, as well as monoclonal antibodies such as rituximab and trastuzumab for different indications. However, even though the use of IT chemotherapy is widely accepted by the scientific community, there is a great variability in practice, in aspects such as the specific drugs and doses used, the way of preparation (volume, type of disolvent, etc.), and the administration technique. The objective of this article is to review the information available about these practical aspects.
MethodsA search was conducted in Pubmed/Medline, using the free terms „chemotherapy AND intrathecal“. The most clinically relevant articles were selected for this review, based on the development or description of relevant practical aspects regarding the preparation and administration technique of the IT treatment. The search was complemented with the review of quotes included in the selected articles, and the analysis of secondary information sources.
ResultsTechnique for intrathecal administration of drugsIntrathecal administration consists in the direct injection of the drug into the CNS3. This way of administra-tion is occasionally necessary in order to achieve therapeutic concentrations in the CNS, which is protected by the blood-brain barrier (BBB). The blood-brain barrier is a complex structure formed by endothelial cells from the CNS capillary network, which prevents the free exchange of ions and organic molecules between the blood plasma and the nervous system4, thus protecting the CNS from potentially neurotoxic agents; but this also makes it difficult for some drugs to reach therapeutic concentrations.
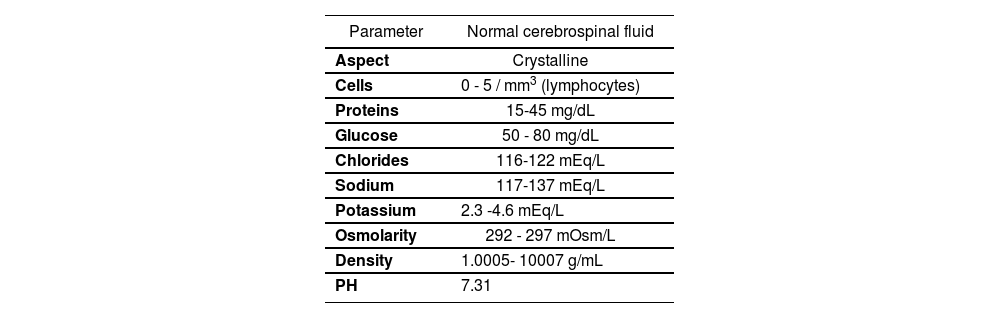
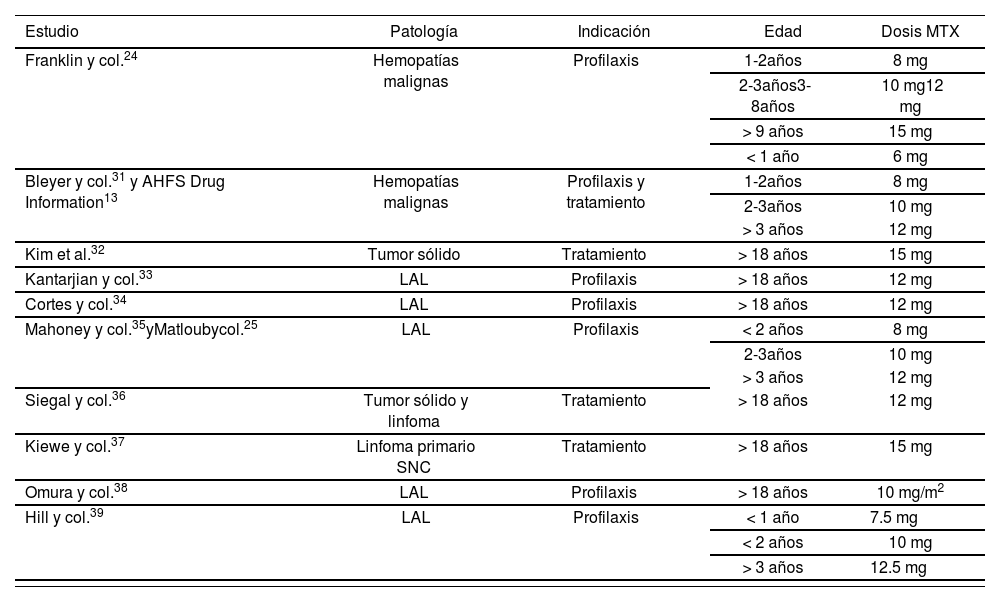
Cerebrospinal fluid (CSF) regulates the chemical environment of the CNS. The total volume of CSF in adults is 125-150 ml, with a formation and reabsorption rate of approximately 20 mUhour; therefore it is completely renewed 3 times per day. CSF secretion and reabsorption is balanced in the majority of healthy adults, in order to keep an intracranial pressure below 150 mmH20; an increase in intracranial pressure can entail severe complications. Normal CSF is clear, transparent and colourless. Its main physicochemical properties appear in Table 1.
Physicochemical properties of CSF
| Parameter | Normal cerebrospinal fluid |
|---|---|
| Aspect | Crystalline |
| Cells | 0 - 5 / mm3 (lymphocytes) |
| Proteins | 15-45 mg/dL |
| Glucose | 50 - 80 mg/dL |
| Chlorides | 116-122 mEq/L |
| Sodium | 117-137 mEq/L |
| Potassium | 2.3 -4.6 mEq/L |
| Osmolarity | 292 - 297 mOsm/L |
| Density | 1.0005- 10007 g/mL |
| PH | 7.31 |
CSF volume varies with age. The CSF volume in newborns is approximately 40-60 ml, and it undergoes a fast increase during the first years of life, so that the CSF volume in >3-year-old children is equivalent to that of adults.
Drug administration in the CNS can be conducted through two methods: into the lumbar thecal sac by lumbar puncture (LP), or directly into the lateral ventricle through a subcutaneous reservoir and ventricular catheter (Ommaya Reservoir)3.
Lumbar PunctureLumbar Puncture is an invasive technique for accessing the subarachnoid space, with diagnostic and therapeutic aims. The position of the patient is important for this procedure: they can be in lateral decubitus, which is the preferred position for adults, or seating position, which is the preferred position for children5.
Like any other invasive procedure, it can be painful; that is why a local anaesthetic can be used, such as subcutaneous mepivacaine or topical anaesthetic preparations6. In paediatric patients, it could be necessary to use pharmacological sedation. The SECIP (Spanish Society for Paediatric Intensive Care) recommends the administration of midazolam in combination with ketamine or fentanyl for this indication7.
When the LP is conducted as a diagnostic procedure, a specific amount of CSF will be extracted; it is recommended to restrict this to the lowest volume necessary, which is usually 6-8 mL in adults, 2-3 mL in newborns and infants, and 5-8 mL in children and adolescents. If the LP is conducted as a therapeutic procedure, the drug will be slowly introduced after extracting the relevant volume of CSF. It is recommended to conduct the administration over 3 to 5 minutes, approximately; moreover, a slower administration is recommended in patients with small brain ventricles or high intracranial pressure, in order to avoid headaches3,8.
There are no consistent data in scientific literature regarding the volume of drug dilution recommended for LP administration, or the CSF volume recommended for previous extraction. Overall, in order to prevent an increase in intracranial pressure when drugs are administered through the IT procedure, it is recommended not to modify the CSF volume. Therefore, it is recommended to extract, before IT administration, a CSF volume equivalent to the volume of chemotherapy to be instilled3,8,9.
Regarding the volume of the drug to be administered, Pui recommends that the cytostatic agent must be dissolved in at least 6 mL of fluid, in order to achieve its adequate distribution10. The British Columbia Cancer Agency (BCCA) recommendations also recommends 6 mL as the volume of IT drug administration for adults8. For children, different authors have described administration volumes ranging from 6 mL for <1-year-old to 12 mL for <3-year-old11,12. The AHFS Drug Information states that it is usual to extract a CSF volume similar as the one to be injected: from 5 to 15 mL13. In general, it is considered that a CSF volume of 7 to 10 mL must be extracted in adults, and a similar volume of intrathecal chemotherapy must be instilled3.
After drug administration, it is recommended that patients should stay at least 1 hour in prone position, in order to facilitate the penetration of the chemotherapy agent in the brain ventricles14. Other authors recommend staying from 1 to 12 hours in supine position, to avoid the risk of post-puncture headache15.
Some of the complications that can appear after LP, even if conducted for diagnosis, are: development of post-puncture headache, lower back pain, nerve root irritation, infections or haemorrhages, among others16.
Ommaya ReservoirThe Ommaya Reservoir is an intraventricular device, which is placed in the subcutaneous scalp tissue, with a catheter inserted in one of the lateral ventricles of the brain, and thus connected with CSF circulation. It is recommended for use in those patients who require frequent or prolonged CNS treatments or for those cases where LP would represent a difficult technique3.
Medications are injected with a syringe in the ventricular reservoir. The way of administration varies depending on the source. Some sources recommend the gradual extraction of 12 to 20 mL of CSF, at a rate <1-2 mL/ minute, with a syringe size <10 mL. After CSF extraction, the medication will be infused at a 1 mL/minute rate. Afterwards, approximately 10 mL of the previously extracted CSF will be re-infused, in order to clean the Ommaya needle and catheter3. Other sources recommend extracting a CSF volume similar to the volume of drug to be administered, and cleaning with 3-4 mL of 0.9% sodium chloride solution 0.9% after administration8.
The implantation of the Ommaya Reservoir exposes patients to a 5-10% risk of suffering complications, including haemorrhage, infection, and complications associated with device malfunctioning17.
Despite the risks associated with device implantation, the main advantage of the Ommaya Reservoir over LP, is a more homogeneous drug distribution in the subarachnoid space. The drug concentration in the ventricular CSF after LP administration is only 10% of that immediately achieved after the intraventricular administration of an equivalent dose of drug18. Moreover, various studies have demonstrated that the distribution in the brain ventricles of drugs administered through LP is influenced by the position after puncture; therefore, a >10 times higher reduction in concentration could occur if the patient does not stay lying down during 1 hour after administration14.
General characteristics of preparations for intrathecal administrationDrugs for IT administration must meet some requirements for their preparation and formulation, which are recommended according to CSF characteristics (Table 1). The nervous tissue is particularly sensitive to any physical or chemical aggression; and therefore, according to various authors, some factors such as pH, ionization level, or the presence of antibacterial agents during preparation, can be associated with the toxicity of the drug administered19. In general terms, solutions for IT administration must be9,20: sterile, apyrogenic, limpid, isoosmotic with CSF, with a pH close to the CSF's ph, and without preservatives.
Taking these characteristics into account, formulations for intrathecal use must be prepared in laminar flow cabinets, to ensure their sterility and avoid the presence of contaminating and pyrogenic agents. Besides, as stated by Gil and col., it is recommended to filter the preparation through a 0.22 membrane filter, to eliminate any potential particles generated during preparation9.
Regarding osmolarity and pH, Elliott B (EB) solution was marketed in U.S.A, during some years; it was indicated for the IT administration of cytarabine and methotrexate, and was comparable with CSF in terms of osmolarity (288 mOsm/L), pH (6.5 to 7), electrolytic composition and glucose contents. A lower incidence of adverse effects was described, associated with the IT administration of drugs prepared in this vehicle vs. 0.9% sodium chloride solution or sterile water for injection21. There is no solution with these characteristics currently in the market, but it is recommended that the osmolarity and pH of the preparations for intrathecal administration should be close to CSF values, with the objective of improving their tolerability.
In terms of the presence of preservatives, many of the multiple-dose formulations commonly used contain preservatives such as benzyl alcohol and methylparaben or propylparaben. There have been reports of adverse events caused by the intrathecal administration of benzyl alcohol, such as paraparesis, nerve root demyelination, and horsetail fibrosis22. There is lower experience with parabens, and no adverse events have been described associated with their intrathecal administration; however, there are reports of anaphylactic reactions secondary to their intravenous administration, and this risk, together with the few data available about their IT administration, avoid their IT administration. Thus, it is considered in practice that all drugs for IT administration should be preservative-free23; therefore, before the intrathecal administration of any medication, it should be confirmed that it does not contain preservatives, taking into account that different medicinal products of the same drug can have different formulations.
Intrathecal ChemotherapyThe drugs most traditionally used for intrathecal administration in neoplastic conditions in general, and specifically for haematological conditions, have been methotrexate, cytarabine, and glucocorticoids2,27; these drugs are often used in combination in the called TIT therapy. More recently, liposomal formulations of cytarabine28 have been introduced, and even monoclonal antibodies have been administered this way: rituximab for lymphoma29, and trastuzumab for brain metastasis in HER2+ breast cancer30.
MethotrexateThe pharmacokinetic of methotrexate (MTX) is different for IT administration and systemic administration. The elimination of MTX from the CSF depends mainly on the CSF flow (because there is no active transportation from CSF to blood, and MTX is not metabolized in the CSF); it has an initial elimination half-life (t1/2) of 4.5 hours, and a final t1/2 of 14 hours, and is reduced to sub-therapeutical concentrations 4 days after IT administration31.
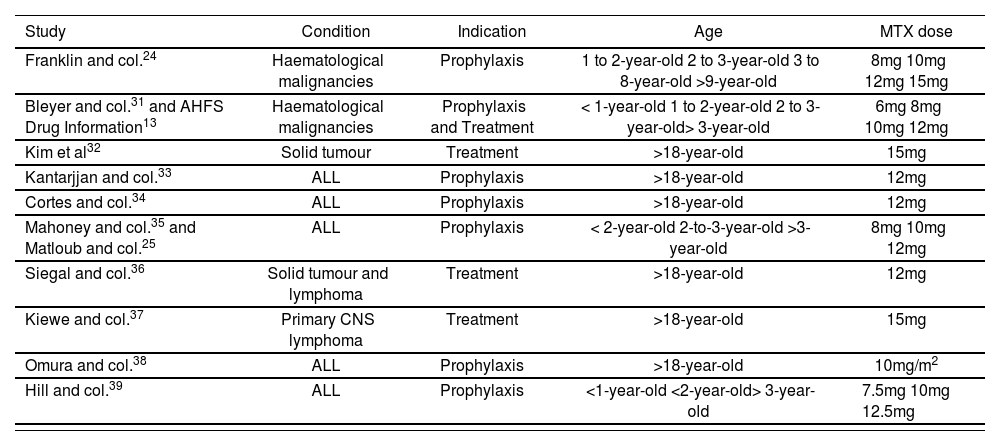
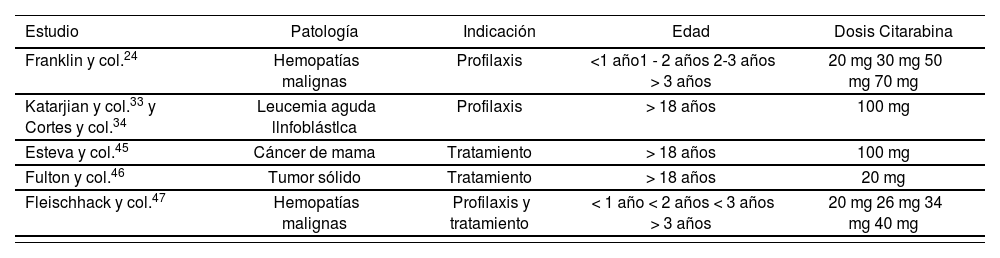
Even though IT MTX is widely used, its optimal dose has not been clearly established; but it has been demonstrated that dose calculation based on weight or body surface is inadequate. Bleyer and col. proved that the administration of IT MTX doses based on body surface increased neurotoxicity in adolescent and adult patients, because very high MTX concentrations were reached in the CSF31. The reason for this, as we have already mentioned, is that there is a fast increase in the CSF volume during the first years of life, and the volume in >3-year-old children is equivalent to the volume in adults. Therefore, it is clearly defined that the calculation of MTX doses must be conducted according to age31, but the IT MTX dose in different studies ranges generally from 10 to 15 mg 13,24,25,32,39 and is lower in <2-year-old patients (Table 2).
Intrathecal methotrexate doses in monotherapy used according to different authors
| Study | Condition | Indication | Age | MTX dose |
|---|---|---|---|---|
| Franklin and col.24 | Haematological malignancies | Prophylaxis | 1 to 2-year-old 2 to 3-year-old 3 to 8-year-old >9-year-old | 8mg 10mg 12mg 15mg |
| Bleyer and col.31 and AHFS Drug Information13 | Haematological malignancies | Prophylaxis and Treatment | < 1-year-old 1 to 2-year-old 2 to 3-year-old> 3-year-old | 6mg 8mg 10mg 12mg |
| Kim et al32 | Solid tumour | Treatment | >18-year-old | 15mg |
| Kantarjjan and col.33 | ALL | Prophylaxis | >18-year-old | 12mg |
| Cortes and col.34 | ALL | Prophylaxis | >18-year-old | 12mg |
| Mahoney and col.35 and Matloub and col.25 | ALL | Prophylaxis | < 2-year-old 2-to-3-year-old >3-year-old | 8mg 10mg 12mg |
| Siegal and col.36 | Solid tumour and lymphoma | Treatment | >18-year-old | 12mg |
| Kiewe and col.37 | Primary CNS lymphoma | Treatment | >18-year-old | 15mg |
| Omura and col.38 | ALL | Prophylaxis | >18-year-old | 10mg/m2 |
| Hill and col.39 | ALL | Prophylaxis | <1-year-old <2-year-old> 3-year-old | 7.5mg 10mg 12.5mg |
∗Abbreviations: ALL: Acute Lymphoblastic Leukemia; MTX: Methotrexate; CNS: Central Nervous System.
IT administration of MTX can cause acute, sub-acute or long-term neurotoxicity. The most frequent adverse effect is aseptic meningitis or chemical arachnoiditis, which appears approximately in 10% of the patients, though incidences of up to 50% have been described. Its characteristic symptoms are headache, nausea, and neck stiffness40. The concomitant administration of IT or oral corticosteroids can reduce the risk of its development. Geiser and col.21 observed, in a cohort of paediatric patients who received IT MTX, a lower frequency in the development of chemical meningitis symptoms in those patients for whom EB solution was used as vehicle; this was attributed to the pH of this solution, closer to the physiological pH of CSF than those of other vehicles used in this study.
There have also been reports of dizziness, convulsions, sub-acute encephalopathy or leukoencephalopathy40. Leukoencephalopathy can appear months or years after the administration of methotrexate, and the risk is higher for those patients who are receiving concomitant CNS radiation and high doses of IV MTX41.
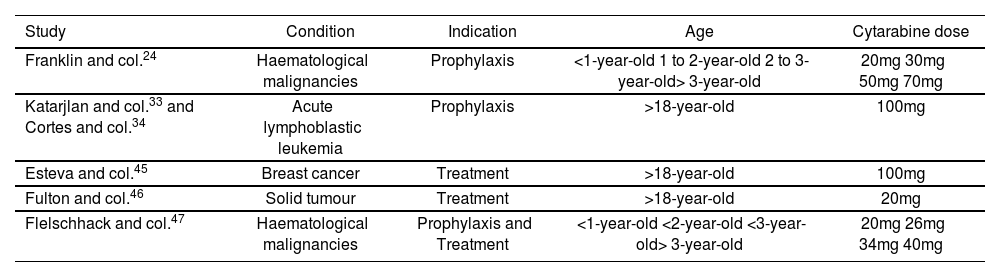
CytarabineThe pharmacokinetic data available for cytarabine were obtained by Zimm and col.42, who injected intra-ventricularly a single 30 mg dose of cytarabine (ARA-C) to seven patients with leukemic meningitis in complete remission. After the injection, a maximum ARA-C concentration >2000pmol/L was reached in the ventricular CSF, and a <1 pmol/L concentration was sustained during at least 24 hours. The ARA-C by IV administration is rapidly eliminated from plasma through the cytidine deaminase enzyme, which metabolizes ARA-C into uracil arabinoside; however, the concentration of the enzyme in the CSF is insignificant, and this metabolic pathway won't practically occur43. Moreover, the value of ARA-C clearance from the CSF (0.42 mL/minute) is similar to the CSF formation and reabsorption rate (0.35 mL/mi- nute), suggesting that ARA-C elimination from CSF is mainly due to CSF flow. The elimination of ARA-C from CSF is slower than from plasma, and clearance is eight times lower in CSF44. As MTX, there is no clearly established ARA-C dose, and its dose must be calculated also according to age rather than to body surface24,33,34,45,47 (Table 3).
Intrathecal cytarabine doses in monotherapy used in different studies
| Study | Condition | Indication | Age | Cytarabine dose |
|---|---|---|---|---|
| Franklin and col.24 | Haematological malignancies | Prophylaxis | <1-year-old 1 to 2-year-old 2 to 3-year-old> 3-year-old | 20mg 30mg 50mg 70mg |
| Katarjlan and col.33 and Cortes and col.34 | Acute lymphoblastic leukemia | Prophylaxis | >18-year-old | 100mg |
| Esteva and col.45 | Breast cancer | Treatment | >18-year-old | 100mg |
| Fulton and col.46 | Solid tumour | Treatment | >18-year-old | 20mg |
| Flelschhack and col.47 | Haematological malignancies | Prophylaxis and Treatment | <1-year-old <2-year-old <3-year-old> 3-year-old | 20mg 26mg 34mg 40mg |
The adverse effects described with the IT administration of ARA-C are: transverse myelopathy, aseptic meningitis, encephalopathy and convulsions; however, their development will be infrequent24,48,49.
Liposomal CytarabineA liposomal formulation (Depocyte®) has been developed in order to enable a lower frequency of IT ARA-C administration; this is a controlled release formulation for aqueous cytarabine, which is encapsulated in spherical and multivesicular particles called DepoFoam®, which present a longer half-life of CSF elimination. With this formulation, a two-phase elimination profile has been described, with a terminal stage t1/2 within 100 and 263 hours, for a dose range between 12.5 mg and 75 mg; on the other hand, standard-release cytarabine presents a terminal stage t1/2 of approximately 3.4 hours for 30mg doses50. After the IT injection, the liposomal particles containing the ARA-C will break down, and the lipids will enter the normal metabolic pathways of the body. In 2007, Phuphanich and col. studied the pharmacokinetics of Depocyte® by administering 2 intraventricular or intralumbar doses to 8 patients, separated by a 14- day interval, and taking samples at different points up to 14 days after administration. The concentration of free and encapsulated ARA-C in the ventricular and lumbar CSF varied from 0.01 to 1500pmol/L, and was detectable during 14 days post-dose. Systemic exposure to cytarabine was considered non-significant28.
The efficacy of IT liposomal cytarabine has been demonstrated in two controlled and randomized clinical trials, in patients with neoplastic meningitis associated with lymphoma and solid tumours vs. conventional IT cytarabine and IT methotrexate, respectively51-52. In the clinical trial conducted vs. conventional ARA-C, a higher response rate was observed in the liposomal cytarabine group; however, there were no statistically significant differences in duration of response, progression-free survival and overall survival. In the clinical trial conducted vs. MTX, progression-free survival was also similar with the two agents.
Opposite to methotrexate and standard-release cytarabine, the dose of liposomal cytarabine in adults has been defined as 50mg with IT administration, in a 5 mL volume; the dosing interval varies according to the treatment stage. The indication approved for Depocyte® by the Spanish Agency of Medicines and Medical Devices is the treatment of lymphomatous meningitis50.
The toxicity of liposomal cytarabine is relatively high, particularly when administered in association with other drugs which cross the BBB. In the M.D. Anderson Centre for Cancer Treatment, a study was conducted on adults diagnosed with ALL and treated with the Hyper- CVAD regimen, which includes high-dose IV MTX and ARA-C. The introduction of IT liposomal cytarabine was associated with a higher toxicity rate (16%), including encephalopathy, cauda equina syndrome, convulsions, and pseudotumor cerebri. The conclusion was that severe neurotoxicity could be caused by the concomitant administration of liposomal cytarabine and drugs that can cross the BBB or radiotherapy53. In the randomized clinical trial comparing the ARA-C liposomal and standard formulations, conducted by Glantz, the majority of the adverse effects were transitory. The only effect that appeared in over 10% of treatment cycles was headache, which was more frequent in the liposomal cytarabine group than in the traditional cytarabine group (27% vs. 2%). Chemical arachnoiditis appeared in 22% of patients treated with liposomal cytarabine vs. 13% of patients treated with the standard formulation52. In order to reduce the incidence of arachnoiditis, it is recommended to administer systemic dexamethasone during 5 days, initiating treatment on the same day of the IT injection.
GlucocorticoidsEven though intrathecal administration of glucocorticoids is common, its pharmacokinetics in the CNS has not been clearly documented. Balis and col54, studied the activity of dexamethasone and prednisolone in the CSF in a non-human primate model, after its intravenous and intraventricular administration. Both drugs are rapidly cleared from CSF after intraventricular administration; however, after intravenous administration, there is low penetration in the CSF due to the high binding to plasmatic proteins in both, though dexamethasone presents higher penetration due to its lower binding to plasmatic proteins (70% for dexamethasone vs. 90% for prednisolone).
IT glucocorticoids are mostly used in combination with ARA-C and MTX. This concomitant use has two objectives: increasing the effectiveness of IT therapy, and reducing the incidence of meningeal irritation23. There is wide evidence about the use of corticosteroids as part of intrathecal treatment in oncohaematology; in 1983, Muriel and col55, used IT methotrexate 12mg/m2 (maximum dose = 15 mg) and dexamethasone 14mg/m2, and in 1995, Gômez-Almaguer administered IT dexamethasone 5mg/m2 diluted in 5mL of 0.9% sodium chloride with MTX and ARA-C together in 8 patients with ALL and leukemic infiltration in their CNS; the cell count was reduced in CSF after the administration of combined intrathecal chemotherapy in all patients56. However, the use of corticosteroids with IT chemotherapy is not universal: its use, the one used, and its dose will vary according to the protocols of the different study groups. Overall, its use is more widespread for the treatment of paediatric patients than for adults.
The International Berlin-Frankfurt-Munster (BFM) Study Group57,58, in its protocols for ALL treatment in children, uses prednisolone as corticosteroid for IT administration, recommending doses that vary according to age: <1-year-old: 6mg, 1 year-old: 8 mg, 2-year-old: 10 mg, and >3-year-old: 12mg. Thus, the BFM Study Group recommends the use of prednisolone with MTX and ARA-C for prophylaxis and treatment of meningeal infiltration in ALL. This is also the corticosteroid used in the Japanese JALSG-ALL93 protocol for adults with ALL, with doses of 10mg59.
The Italian GIMEMA group has used IT MTX 12mg with methylprednisolone 40mg for ALL treatment in patients from 12 to 60-year-old60. The dose of 40mg of methylprednisolone for adult patients with ALL has also been used with MTX 15mg and ARA-C 40mg by the French LALA Group61, and in the GRAALL-2003 Protocol62.
In U.S.A., the use of intrathecal corticosteroids for ALL treatment in adult patients has not become widespread; thus, it is not included in the CALGB-8811 study63 or in the studies conducted by Katarjian33 and Rowe64, where IT MTX 15 mg, 12 mg and 12.5 mg is used for CNS prophylaxis, respectively. However, for paediatric patients with ALL, both the Pediatric Oncology Group and the Children's Oncology Group use hydrocortisone with MTX and ARA-C dosed according to age25,35. The protocols for treatment and prophylaxis of CNS infiltration in acute leukemia in children from the St. Jude's Children's Research Hospital also use hydrocortisone as part of the TIT therapy at 16 mg, 20 mg or 24 mg doses, based on age (<1 year-old, 2-3-year-old or >3-year-old, respectively)65.
The PETHEMA Group (Program for the Study and Treatment of Haematological Malignancies) and the Spanish Society of Paediatric Haematology and Oncology (SEHOP) indicate the use of hydrocortisone (HC) with ARA-C and MTX in the majority of their protocols for ALL treatment, recommending this dosing: <2 year- old: 10 mg, 2-3-year-old: 15 mg, >3-year-old: 20 mg66. However, other protocols from the PETHEMA Group have incorporated the use of dexamethasone. For example, Burkimab-13, widely used in Spain for the treatment of Burkitt Lymphoma in adult patients, indicates the use of MTX 15mg in combination with ARA-C 40 mg and dexamethasone 4 mg67 for prophylaxis and treatment of CNS infiltration. PETHEMA-LAL-07OLD also uses IT dexamethasone 4 mg with MTX and ARA-C68.
The toxicity of the intrathecal administration of glucocorticoids has not been studied yet by controlled studies; in fact, its use in combination with IT chemotherapy is associated with a reduction of the adverse effects, primarily the development of chemical arachnoiditis. However, the development of psychiatric adverse effects caused by the use of intrathecal corticosteroids has been described in various studies; it can be ranged from depressive syndromes to psychosis69. In the study conducted by Hitchins, where IT hydrocortisone was administered before the administration of IT chemotherapy, two unusual reactions were observed in two patients, who experienced headache, vomiting and confusion, in both cases after the administration using the Ommaya reservoir. These symptoms disappeared spontaneously a few hours after administration. When both patients were re-treated with IT hydrocortisone, they suffered the same reaction again; when the administration of IT hydrocortisone was removed from the rest of the administrations of IT chemotherapy, this reaction did not appear again when chemotherapy was administered alone. The authors did not find an explanation for these reactions70.
Monoclonal Antibodies: Rituximab and TrastuzumabThere has been recent research into the administration of two monoclonal antibodies; this represents an innovative targeted therapy for the treatment of leptomeningeal carcinomatosis: trastuzumab for HER2 positive breast cancer, and rituximab for the treatment of B-cell lymphoma.
Trastuzumab is highly effective in the treatment of breast cancer with HER2 overexpression; however, despite its efficacy, patients treated with trastuzumab and chemotherapy will experience an incidence of CNS metastasis ranging from 28% to 42%30. Stemmier and col. observed that the concentration of trastuzumab in the CSF after intravenous administration was 300 or 400 times lower than its concentration in plasma71; therefore, in order to achieve therapeutic concentrations of trastuzumab in the CSF, it has been considered to use IT administration. This drug has been used in series of cases, alone or in combination with intrathecal methotrexate or thiotepa, at doses between 12.5 and 25 mg administered with a frequency ranging from 3 days to 3 weeks. The most typical regimen used was 20-25 mg once a week, and all dosing regimens were well tolerated. With these regimens, there have been responses at CSF level and even an increase in survival without toxic effects30.
Rituximab is an anti-CD20 antibody; over 90% of B-Cell Non-Hodgkin lymphomas (NHL) and primary CNS lymphomas express the CD20 marker, but healthy brain tissue does not express it. Like trastuzumab, rituximab has a low penetration in the CSF; its concentration in CSF after systemic administration represents 0.1% of concentrations in blood serum. Rubenstein and col29, conducted a Phase I clinical trial on 10 patients with B-cell NHL and primary CNS lymphoma with neoplastic meningitis, who were administered rituximab through an Ommaya Reservoir, every week during the first week of the study, and then twice a week during 4 weeks. The doses used for rituximab were 10 mg, 25 mg and 50 mg, and toxic effects appeared with the 50 mg dosing (hypertension, nausea, vomiting and double vision). The median survival was 21 weeks, six patients experienced meningeal response, and two of the three patients with intraocular disease experienced a local response. The combination of liposomal cytarabine with IT rituximab was tested by Chamberlain and col. in 14 patients with lymphoma and relapsing neoplastic meningitis. Each patient was administered an induction regimen including 25 mg of IT rituximab twice a week and liposomal cytarabine every 14 days, during 4 weeks. A maintenance stage was then conducted, including 50 mg of liposomal cytarabine and two doses of rituximab 25 mg administered in the same week, every 4 weeks, until disease progression. After the induction regimen, 10 patients experienced partial neurological response, and received maintenance therapy. The probability of survival at 6 months was 29%, and toxic effects were moderate and expected, probably due to liposomal cytarabine72.
There is lack of information about the way in which monoclonal antibodies should be prepared and administered for intrathecal administration; logically, the requirements for preparation for intrathecal use must be considered, always in a sterile and apyrogenic setting, and using disolvents preservatives-free20. In the case of trastuzumab, only one of the publications explained how it had been prepared: the usual reconstitution process (1 50 mg in 7.2 ml water for injection; pH 6), and administration of the adequate volume (20 mg in 0.95 mL), without additional dilution73. For rituximab, one of the studies specified that it had been prepared by diluting rituximab with 0.9% sodium chloride solution on a 1:1 ratio for 10 and 25 mg doses, and without dilution for 50mg doses, and administered over 1 to 5 minutes72.
It has not been established if intraventricular or intralumbar administration has any influence on the results.
Intrathecal Triple ChemotherapyThe use of IT combination chemotherapy is a logical consequence, because it has been demonstrated that the use of combination systemic chemotherapy increases efficacy when compared vs. the individual administration of antineoplastic agents. That is why many research groups advocate for the use of TIT chemotherapy, which consists in administering methotrexate, cytarabine and a glucocorticoid in combination26. The use of these three agents in combination could have an additive or synergic effect for the prophylaxis and treatment of neoplastic meningitis.
In Spain, the use of TIT for the prophylaxis and treatment of the leukemic CNS involvement and certain NHLs is the most widespread practice, because it is the treatment indicated in the protocols promoted by the PETHEMA Group74 and SEHOP75. The habitual use of this strategy in adults is shown in the outcomes of the studies conducted by the QUIT (Spanish Registry of Patients receiving Intrathecal Chemotherapy)74-76.
The efficacy of TIT therapy vs. MTX monotherapy was comparable in the study conducted by the Southwest Oncology Group, which included paediatric patients diagnosed with ALL and active meningeal disease (complete response rate of 96% vs. 100%)27 In the CCG- 1952 clinical trial, children with standard-risk ALL were randomized to receive MTX alone (n=1018) or TIT (MTX, ARA-C and HC, n=1009) for prophylaxis of leukemic CNS involvement. Compared with IT MTX, TIT significantly reduced the risk of relapse in CNS (3.4%±1.0% vs. 5.9%±1.2%, p=0.004); however, the survival free of disease at 6 years was equivalent between both treatment groups (80.7%±1.9% vs. 82.5%±1.8%, p=0.3), due to a higher proportion of bone marrow and testicular relapses, which was associated with a significant reduction in overall survival (Survival at 6 years: TIT 90.3% vs. IT MTX 94.4%, p=0.01)25.
No direct comparisons have been published for the use of IT liposomal cytarabine vs. TIT therapy.
The adverse effects due to the use of TIT therapy are not qualitatively different from those previously described with IT MTX and ARA-C, and from the risks associated with the administration technique itself (LP or intraventricular). The most common adverse effects are headaches, nausea, vomiting and fever; more severe adverse effects will occur less frequently, such as chemical arachnoiditis, loss of vision, and leukoencephalopathy24,77.
As we have mentioned previously, the use of corticosteroids in combination with IT chemotherapy seems to have a beneficial effect on the profile of adverse events; because the risk of meningeal irritation, described with the IT administration of MTX and ARA-C in monotherapy, will be reduced with the concomitant IT administration of a corticosteroid78.
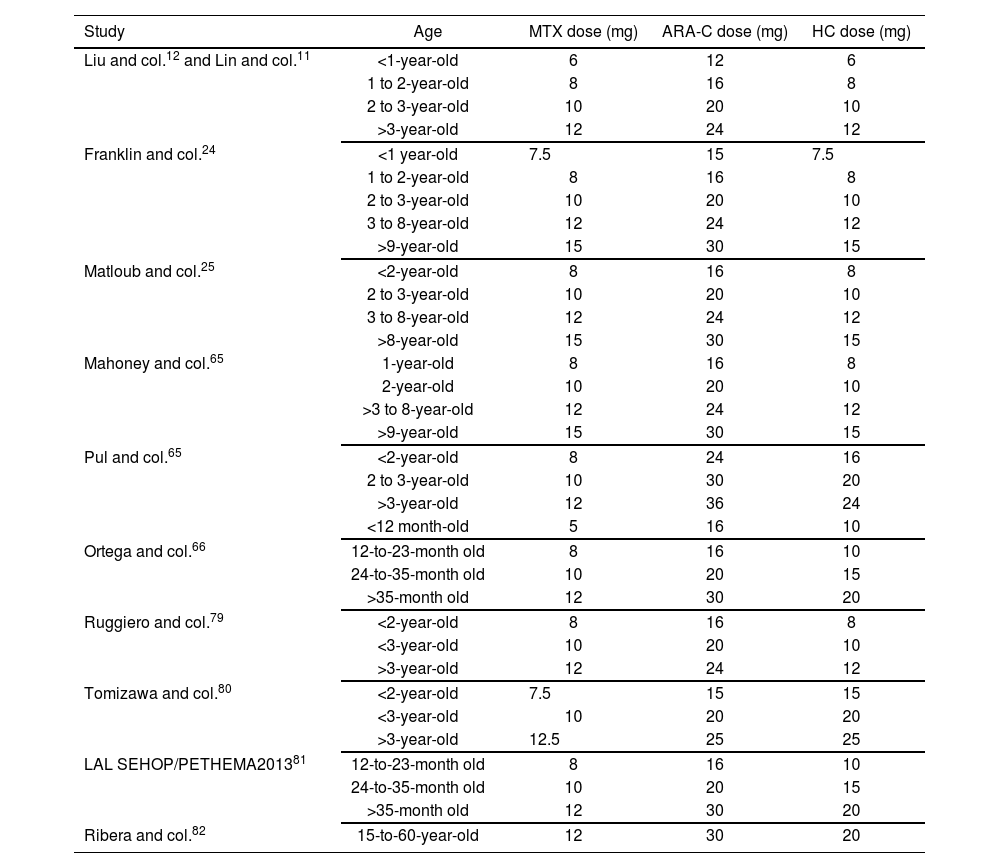
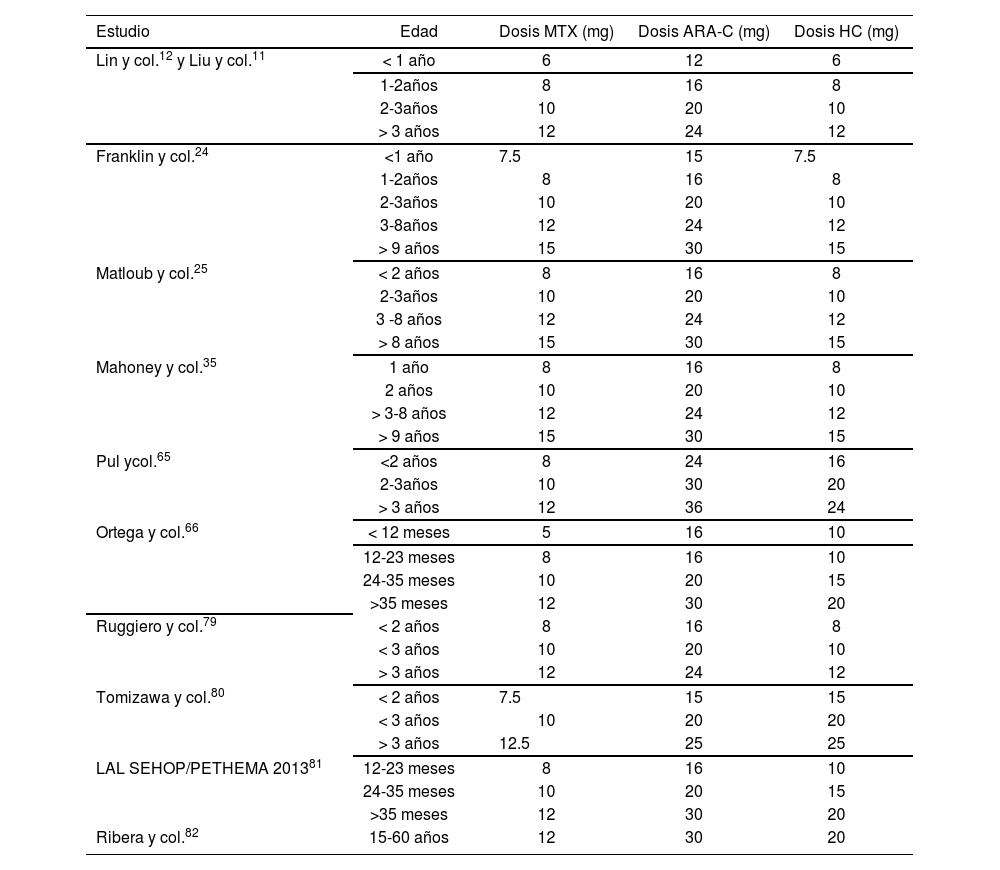
As well as the IT administration of drugs in monotherapy, the doses of TIT to be administered are not clearly defined. However, there is consensus regarding the need to calculate the dose based on age and not on body surface. The MTX, ARA-C and HC doses used in different studies11,12,24,25,35,64,65,79,82 are shown in Table 4.
Dose of Intrathecal Triple Chemotherapy (methotrexate, cytarabine and hydrocortisone) based on age, in different studies
| Study | Age | MTX dose (mg) | ARA-C dose (mg) | HC dose (mg) |
|---|---|---|---|---|
| Liu and col.12 and Lin and col.11 | <1-year-old | 6 | 12 | 6 |
| 1 to 2-year-old | 8 | 16 | 8 | |
| 2 to 3-year-old | 10 | 20 | 10 | |
| >3-year-old | 12 | 24 | 12 | |
| Franklin and col.24 | <1 year-old | 7.5 | 15 | 7.5 |
| 1 to 2-year-old | 8 | 16 | 8 | |
| 2 to 3-year-old | 10 | 20 | 10 | |
| 3 to 8-year-old | 12 | 24 | 12 | |
| >9-year-old | 15 | 30 | 15 | |
| Matloub and col.25 | <2-year-old | 8 | 16 | 8 |
| 2 to 3-year-old | 10 | 20 | 10 | |
| 3 to 8-year-old | 12 | 24 | 12 | |
| >8-year-old | 15 | 30 | 15 | |
| Mahoney and col.65 | 1-year-old | 8 | 16 | 8 |
| 2-year-old | 10 | 20 | 10 | |
| >3 to 8-year-old | 12 | 24 | 12 | |
| >9-year-old | 15 | 30 | 15 | |
| Pul and col.65 | <2-year-old | 8 | 24 | 16 |
| 2 to 3-year-old | 10 | 30 | 20 | |
| >3-year-old | 12 | 36 | 24 | |
| <12 month-old | 5 | 16 | 10 | |
| Ortega and col.66 | 12-to-23-month old | 8 | 16 | 10 |
| 24-to-35-month old | 10 | 20 | 15 | |
| >35-month old | 12 | 30 | 20 | |
| Ruggiero and col.79 | <2-year-old | 8 | 16 | 8 |
| <3-year-old | 10 | 20 | 10 | |
| >3-year-old | 12 | 24 | 12 | |
| Tomizawa and col.80 | <2-year-old | 7.5 | 15 | 15 |
| <3-year-old | 10 | 20 | 20 | |
| >3-year-old | 12.5 | 25 | 25 | |
| LAL SEHOP/PETHEMA201381 | 12-to-23-month old | 8 | 16 | 10 |
| 24-to-35-month old | 10 | 20 | 15 | |
| >35-month old | 12 | 30 | 20 | |
| Ribera and col.82 | 15-to-60-year-old | 12 | 30 | 20 |
Other studies and work groups have used TIT with dexamethasone, prednisone or methylprednisolone, as mentioned in the section for intrathecal glucocorticoids. The TIT therapy used by the BMF Study Group was: MTX <1-year-old: 6 mg, 1-year-old, 8 mg, 2-year-old, 10 mg, >3-year-old: 12 mg; for ARA-C, <1-year-old: 15 mg, 1-year-old: 20 mg, 2-year-old: 25 mg, >3-year-old: 30 mg; for prednisolone: <1-year-old: 6 mg, 1-year-old: 8 mg, 2-year-old: 10 mg, >3-year-old: 12 mg57,58. Combinations at variable doses have also been described for adult patients61,64,67,68.
There are no studies comparing the efficacy and/or toxicity of the different TIT preparations, and therefore there is uncertainty regarding the adequacy of combinations. In fact, there is no knowledge about the equivalent potential for different corticosteroids with IT administration, and the doses used in different protocols would not be equally potent, using the criteria typically accepted for systemic administration83.
As the lack of homogeneity in closing, the disolvent used and the administration volume are not described in almost any study; and according to various authors, these are factors that can have impact on tolerability to treatment and in the adequate distribution of the drug in the CSF12.
Of all the studies shown in Table 4, only Liu and col.12 and Lin and col.” have described the volume used, which varied according to age, and was in both studies: <1-year-old: 6 mL, 1-2-year-old: 8 mL, 2-3-year-old: 10 mL, and >3-year-old: 12 mL. Lin and col.11 stated that they had used the dilution volume adequate to increase the efficacy of TIT therapy, though there was no argument supporting this claim.
Sullivan and col., in a study comparing the efficacy and toxicity of TIT therapy vs. methotrexate and hydrocortisone, commented that the solvent used for preparation was EB solution, however the dilution volume was not named27. They also described that the IT administration of the 3 drugs was sequential: MTX was administered first, followed by HC and finally ARA-C27. This description of sequential administration is exceptional, because in the majority of the studies it is not stated whether the administration is conducted with the total mixture in one single syringe or in separated syringes for each agent and, in this case, the order for the administration.
Currently, the most accepted trend is to mix the three components in one single syringe, to facilitate IT administration and prevent excessive handling (connecting and disconnecting the catheter), thus reducing the risk for accidental contamination during administration.
The ALL SEHOP / PETHEMA 2013 paediatric protocol describes the preparation and administration of IT treatment. It states that the 3 cytostatic agents must be ad-ministered in the same syringe, and that doubly distilled water must be used for the reconstitution of cytarabine and hydrocortisone, which will be sterile, apyrogenic and preservatives-free; the volume will then be completed with 0.9% sodium chloride solution. This protocol recommends a pH and osmolarity for the preparation of 7.3 pH and a 300 mOsm/l, respectively81.
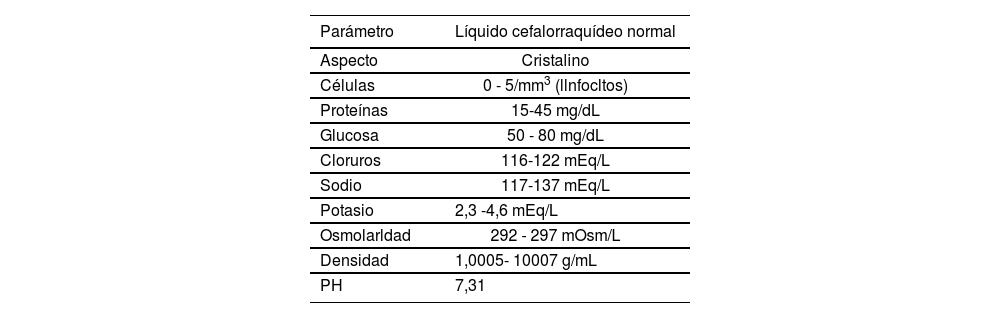
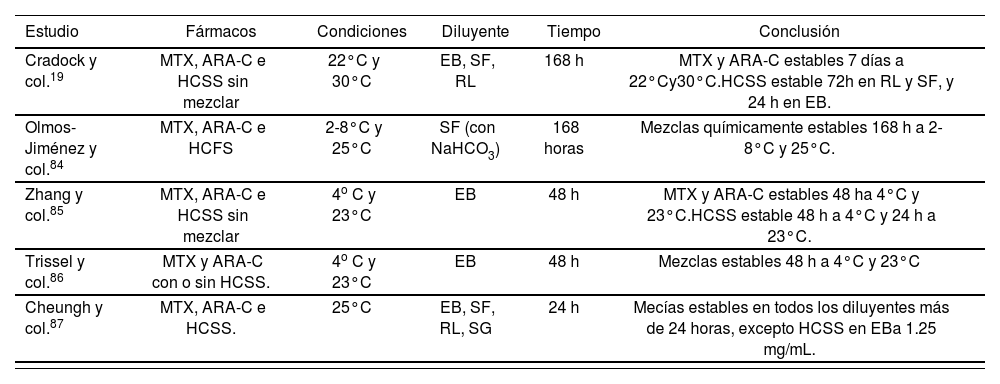
Besides the aspects considered, another important issue when using drug mixtures is to ensure the physicochemical stability of the final preparation. There are few stability studies for TIT preparations, and the majority have been conducted with EB solution. The most recently published study evaluates the stability of sodium methotrexate, cytarabine and hydrocortisone sodium phosphate in a 0.9% sodium chloride solution, with pH and osmolarity adjusted to values close to the CSF ph; the conclusion was that the TIT preparations evaluated were chemically stable during at least 7 days at room temperature (RT), and under refrigeration; however, the pH of the preparations was out of the physiological values of CSF at 5 days in the preparations stored with refrigeration, and at 2 days in those stored at RT84. The characteristics of the studies conducted'93,137 are shown in Table 5.
Summary of the stability studies for TIT
| Study | Drugs | Conditions | Disolvent | Study duration | Conclusion |
|---|---|---|---|---|---|
| Cradock and col.19 | MTX, ARA-C and HCSS not mixed | 22°C and 30°C | EB, SCh, RL | 168 hs. | MTX and ARA-C stable 7 days at 22°C and 30°C.HCSS stable 72 hs. in RL and SCh, and 24 hs. in EB. |
| Olmos-Jimenez and col.84 | MTX, ARA-C and HCSPh | 2-8°C and 25°C | SCh (with NaHCO3) | 168 hs. | Chemically stable mixtures for 168 hs at2-8°C and 25°C MTX and ARA-C stable 48 hs. |
| Zhang and col.85 | MTX, ARA-C and HCSS not mixed | 4°C and 23°C | EB | 48 hs. | at 4°C and 23°C.HCSS stable 48 hs. at 4°C and 24 hs. at 23°C |
| Trissei and col.86 | MTX and ARA-C with or without HCSS. | 4°C and 23°C | EB | 48 hs. | Preparations stable 48 hs. at 4°C and 23°C |
| Cheungh and col.87 | MTX, ARA-C and HCSS | 25°C | EB, SCh, RL, Dx | 24 hs. | Preparations stable in all disolvents >24 hs, except for HCSS in EB 1.25 mg/mL. |
Abbreviations: ARA-C: cytarabine: EB: Elliot B Solution; hs: hours; HCSPh: hydrocortisone sodium phosphate; HCSS: hydrocortisone sodium succinate; NaHCOy sodium bicarbonate; MTX: methotrexate; RL: ringer's Lactate; SCh: 0.9% sodium chloride; Dx: dextrose 5%.
There are few stability studies for TIT preparations with corticosteroids other than hydrocortisone. The Burkimab-13 protocol67, which indicates the use of TIT with methotrexate, cytarabine and dexamethasone, recommends administering dexamethasone in a separate syringe from methotrexate and cytarabine, due to the lack of evidence on the stability of this preparation, because there are no studies on the stability of TIT mixtures with dexamethasone as a corticosteroid. The same protocol recommends replacing dexamethasone by hydrocortisone, if it is preferred to administer the IT chemotherapy in one single syringe.
In 2012, D'Hont and col. conducted a stability study for ARA-C, MTX and methylprednisolone in 0.9% sodium chloride solution during 48 hours. The conclusion was that the preparation was stable up to 12 hours when stored at 5°C and protected from light88.
In 2014, the Ministry of Health, Social Services and Equality, together with the Spanish Society of Hospital Pharmacy, published guidelines for good practice in the preparation of medications in Hospital Pharmacy Units, where sterile preparations were classified according to a risk matrix. These guidelines classified the preparations for IT administration as high-risk preparations, and the following preparation requirements were defined: preparation in a laminar flow cabinet with controlled environment (clean room), and as storage requirements: a maximum storage time of 24 hours at RT and 3 days at a 2-8°C temperature39-90.
ConclusionsThere is a wide variability in practice when using IT chemotherapy, despite being an effective therapy, accepted by all international groups, particularly for the treatment of acute leukemia and Non-Hodgkin lymphomas. This variability and uncertainty is not limited to the drugs and doses administered, but it also includes the way of preparation and the administration technique.
FundingThe article does not require any funding.
Conflict of InterestsThere is no conflict of interests.
IntroducciónLa administración de quimioterapia intratecal (IT), para el tratamiento y prevención de la infiltración neoplásica en el sistema nervioso central (SNC), es una práctica ampliamente extendida que ha demostrado ser eficaz en distintas patologías. La utilización de dicha terapia para profilaxis de recaída en SNC, en leucemia aguda linfoblástica en pacientes pediátricos, comenzó en los años 70. El pronóstico de la enfermedad cambió de manera radical, ya que antes del uso de profilaxis en el SNC más de la mitad de las remisiones completas inducidas por quimioterapia sistémica terminaban en recaída en el SNC1. La quimioterapia vía IT ha desplazado progresivamente a la radioterapia en esta indicación, dada su eficacia similar con un perfil de efectos adversos más favorable2. Los fármacos tradicionalmente usados han sido metotrexato y citara- bina, solos o en combinación con glucocorticoides, en la denominada terapia triple intratecal (TIT). Recientemente se ha introducido el uso de citarabina liposomal, y anticuerpos monoclonales como rituximab y trastuzumab, usados en distintas indicaciones. Sin embargo, a pesar de que el uso de quimioterapia IT está ampliamente aceptado en la comunidad científica, existe mucha variabilidad en la práctica, en aspectos tales como los fármacos y dosis empleados, la forma de preparación (volumen, tipo de disolvente, etc.) y la técnica de administración. El objetivo del presente artículo es la revisión de la información disponible respecto a estos aspectos prácticos.
MétodosSe realizó una búsqueda en Pubmed/Medline utilizando los términos libres „chemotherapy AND intrathecal“. Los artículos clínicamente más relevantes fueron seleccionados para la realización de la revisión, en base al desarrollo o descripción de aspectos prácticos relevantes relacionados con la preparación y la técnica de administración del tratamiento IT. La búsqueda se complementó con la revisión de citas incluidas en los artículos seleccionados y con el análisis de fuentes de información secundarias.
ResultadosTécnica de administración intratecal de fármacosLa administración intratecal consiste en la inyección directa del fármaco en el SNC3. Esta forma de administración es necesaria, en ocasiones, para alcanzar concentraciones terapéuticas en el SNC, el cual se encuentra protegido por la barrera hematoencefálica (BHE). La BHE es una estructura compleja constituida por células endoteliales de la red capilar del SNC que impide el intercambio libre de iones y moléculas orgánicas entre el plasma sanguíneo y el tejido nervioso de este modo protege al SNC de agentes potencialmente neurotóxicos, pero también dificulta que algunos fármacos alcancen concentraciones terapéuticas4.
El liquido cefalorraquídeo (LCR) regula el entorno químico del SNC. El volumen total de LCR en adultos es de 125-1 50 mL, siendo la velocidad de formación y reabsorción aproximadamente de 20 mUhora, por lo que se renueva completamente 3 veces al día. La secreción y reabsorción del LCR permanece en equilibrio en la mayoría de los adultos sanos para mantener una presión intracraneal menor de 1 50 mmH20; un aumento de la presión intracraneal puede conllevar complicaciones graves. El LCR normal es claro, trasparente e incoloro. Sus principales propiedades fisicoquímicas se reflejan en la Tabla 1.
Propiedades Físico-Químicas del LCR
| Parámetro | Líquido cefalorraquídeo normal |
|---|---|
| Aspecto | Cristalino |
| Células | 0 - 5/mm3 (llnfocltos) |
| Proteínas | 15-45 mg/dL |
| Glucosa | 50 - 80 mg/dL |
| Cloruros | 116-122 mEq/L |
| Sodio | 117-137 mEq/L |
| Potasio | 2,3 -4,6 mEq/L |
| Osmolarldad | 292 - 297 mOsm/L |
| Densidad | 1,0005- 10007 g/mL |
| PH | 7,31 |
El volumen de LCR varía con la edad. El volumen de LCR en neonatos es aproximadamente 40-60 mL y sufre un rápido incremento durante los primeros años de vida, siendo el volumen de LCR en niños a partir de 3 años de edad equivalente al de los adultos.
La administración de fármacos en el SNC se puede realizar mediante dos métodos: dentro del saco de la teca lumbar mediante punción lumbar (PL) o directamente en el ventrículo lateral a través de un reservorio subcutáneo y un catéter ventricular (reservorio Ommaya)3.
Punción LumbarLa PL es una técnica invasiva para el abordaje del espacio subaracnoideo con fines tanto diagnósticos como terapéuticos. Para su realización es importante la posi-ción del paciente, el cual puede encontrarse en decúbito lateral o sedestación, prefiriéndose el decúbito lateral en adultos y la sedestación en niños5.
Como cualquier procedimiento invasivo, puede resultar doloroso, es por ello que se puede utilizar un anestésico local por vía subcutánea, como mepivacaína, o bien preparados anestésicos tópicos6. En los pacientes pediátricos puede ser necesario acudir a la sedación farmacológica. La SECIP (Sociedad Española de Cuidados Intensivos Pediátricos) recomienda en esta indicación la administración de midazolam combinado con ketamina o fentanilo7.
Cuando la PL se realiza con fines diagnósticos se realizará la extracción de una determinada cantidad de LCR, está cantidad se recomienda que esté restringida al menor volumen necesario que suele ser de 6-8 mL en adultos, 2-3 mL en recién nacidos y lactantes y 5-8 mL en lactantes, niños y adolescentes. Si la PL es terapéutica, tras haber retirado el volumen correspondiente de LCR se introducirá el fármaco de forma lenta. Se recomienda que la administración se realice aproximadamente durante 3-5 minutos; además en pacientes con ventrículos cerebrales pequeños o una presión intracraneal elevada se recomienda una administración más lenta para evitar la aparición de cefalea3,8.
En la literatura científica no existen datos consistentes del volumen de dilución de fármaco que se recomienda administrar mediante PL, ni del volumen de LCR que se recomienda extraer previamente. En general, para evitar el aumento de la presión intracraneal cuando se administran fármacos por vía IT, se recomienda no modificar el volumen de LCR. Por tanto, antes de administrar la mezcla IT, se recomienda extraer un volumen de LCR equivalente al volumen de quimioterapia que se va a instilar3,8,9.
Respecto al volumen de fármaco a administrar, Pui indica que, para que el agente citostàtico se distribuya correctamente, debe ser disuelto en una cantidad de fluido de cómo mínimo 6 mL10. Las recomendaciones de la British Columbia Cancer Agency (BCCA) indican tam-bien como volumen de administración de fármacos por vía IT 6 mL en adultos8. En niños, diversos autores describen volúmenes de administración que oscilan entre los 6 mL para menores de 1 año y los 12 mL a partir de los 3 años11,12. La AHFS Drug Information indica que es habitual extraer un volumen de LCR similar al que se va a inyectar: 5-15 mL13. En general, se considera que se debe extraer, en adultos, un volumen de LCR de 7 a 10 mL e instilar un volumen similar de quimioterapia intratecal3.
Tras la administración del fármaco, se recomienda que el paciente permanezca al menos 1 hora en decúbito prono para facilitar la penetración del agente quimio- terápico en los ventrículos cerebrales14. Otros autores recomiendan permanecer de 1 a 12 horas en decúbito supino para evitar el riesgo de aparición de cefalea post-punción15.
Entre las complicaciones que pueden aparecer por la PL, incluso con fines diagnósticos, se encuentra la aparición de cefalea post-punción, lumbalgia, irritación de raíces nerviosas, complicaciones infecciosas o hemorrá- gicas, entre otras16.
Reservarlo OmmayaEl reservorio Ommaya es un dispositivo intraventricular, que se coloca en el tejido subcutáneo del cuero cabelludo, provisto de un catéter insertado en uno de los ventrículos laterales del cerebro y conectado así con la circulación del LCR. Se recomienda utilizarlo en aquellos pacientes que precisen tratamientos frecuentes o prolongados del SNC o en aquellos en los que la PL suponga una técnica dificultosa3.
Los medicamentos se inyectan mediante una jeringa en el reservorio ventricular. El modo de administración varía según la fuente consultada. Algunas fuentes recomiendan extraer gradualmente aproximadamente 12-20 mL de LCR, a una velocidad de extracción no superior a 1-2 mL/min, en jeringas de un tamaño no superior a 10 mL. Tras la extracción del LCR se infundirá la medicación a un ritmo de infusión de 1 mL/min. A continuación, se reinfundirán aproximadamente 10 mL de LCR de los extraídos anteriormente para limpiar la aguja y el catéter Ommaya3. Otras fuentes recomiendan extraer un volumen de LCR similar al volumen que se va a administrar de fármaco y, tras su administración, limpiar con 3-4 mL de solución de cloruro sódico 0,9%8.
La colocación del reservorio Ommaya expone al paciente a un riesgo en torno al 5-10% de sufrir alguna complicación incluida hemorragia, infección y complicaciones asociadas al mal funcionamiento del dispositivo17.
A pesar de los riesgos asociados a la colocación del dispositivo, el reservorio Ommaya presenta como principal ventaja respecto a la PL la distribución más homogénea del fármaco en el espacio subaracnoideo. La concentración de fármaco en el LCR ventricular tras la administración mediante PL es solo una decima parte de la alcanzada de forma inmediata tras la administración intraventricular de una dosis de fármaco equivalente18. Además, diversos estudios han demostrado que la distribución en los ventrículos cerebrales de fármacos administrados mediante PL está influenciada por la posición tras la punción, pudiendo producirse una disminución de la concentración mayor de 10 veces si el paciente no permanece tumbado durante 1 hora tras la administración14.
Características generales de las preparaciones para administración por vía intratecalLos fármacos destinados a la administración IT deben reunir una serie de requisitos en cuanto a su preparación y formulación que se recomienda sea acorde a las características del LCR (Tabla 1). El tejido nervioso es especialmente sensible a cualquier agresión física o química y por ello, según diversos autores, factores como el pH, el grado de ionización o la presencia de agentes antibacterianos en la preparación pueden estar relacionados con la toxicidad del fármaco administrado19. En términos generales, las soluciones administradas por vía IT deberán ser9,20: estériles, apirógenas, límpidas, isoosmóticas con el LCR, con un pH próximo al del LCR y sin conservantes.
Teniendo en cuenta estas características, las formulaciones para uso intratecal se deben preparar en cabinas de flujo laminar para asegurar su esterilidad y evitar la presencia de agentes contaminantes y pirógenos. Además, como indican Gil y col., se recomienda filtrar la preparación a través de un filtro de membrana de 0,22 mieras, para eliminar posibles partículas originadas durante la preparación9.
Respecto a la osmolaridad y el pH, durante unos años estuvo comercializada en EEUU la solución de Elliott E> (EB), indicada para la administración IT de citarabina y metotrexato, que era comparable con el LCR en cuanto a osmolaridad (288 mOsm/L), pH (6,5-7), composición electrolítica y contenido en glucosa. Se ha descrito una menor incidencia de efectos adversos asociados a la administración IT de fármacos formulados en este vehículo, que en solución de cloruro sódico al 0,9% o agua estéril para inyectables21. Actualmente no existe comercializada ninguna solución que posea estas características, pero se recomienda que la osmolaridad y el pH de las mezclas administradas intratecalmente sean próximos a los valores del LCR, con el objetivo de mejorar la tolerancia de la preparación.
En cuanto a la presencia de conservantes, muchas de las formulaciones multidosis comúnmente usadas contienen conservantes, como alcohol bencílico y metil- parabenes o propilparabenes. Existen eventos adversos notificados por la administración intratecal de alcohol bencílico, tales como paraparesis, desmielinización de las raíces nerviosas y fibrosis de la cola de caballo22. Con los parabenes existe menos experiencia y no se han descrito eventos adversos derivados de su administración intratecal, pero sí se han descrito reacciones anafilácticas secundarias a su administración intravenosa; debido a este riesgo, junto con los escasos datos disponibles de su administración IT, no se recomienda su utilización. Así, se considera en la práctica que todos los fármacos administrados por vía IT deben estar libres de conservantes23, por lo que antes de la administración intratecal de cualquier medicamento se debe revisar que no contenga conservantes, teniendo en cuenta que diversas especialidades farmacéuticas de un mismo principio activo pueden diferir en su formulación.
Quimioterapia intratecalLos fármacos más utilizados clásicamente para administración intratecal, en patologías neoplásicas en general y hematológicas en particular, han sido el me- totrexato, la citarabina y los glucocorticoïdes2,27. En muchas ocasiones el metotrexato, la citarabina y los gluco- corticoides se utilizan conjuntamente en la denominada terapia TIT. Más recientemente se han introducido formulaciones liposomales de citarabina28 e, incluso, se han utilizado anticuerpos monoclonales administrados por esta vía: rituximab en linfoma29 y trastuzumab en metástasis cerebrales de cáncer de mama con sobreexpresión de HER230.
MetotrexatoLa farmacocinética del metotrexato (MTX) cuando se administra por vía intratecal es diferente a cuando se administra por vía sistémica. La eliminación de MTX del LCR depende principalmente del flujo del LCR (ya que no existe trasporte activo desde el LCR a la sangre y el MTX no se metaboliza en el LCR), teniendo una vida media (t1/2) de eliminación inicial de 4,5 horas y una t1/2 final de 14 horas, disminuyendo a concentraciones subterapéuticas en 4 días tras la administración IT31.
Aunque el uso de MTX IT está ampliamente extendido, la dosis óptima no ha sido claramente establecida; lo que sí ha sido demostrado es que el cálculo de la dosis basado en el peso o la superficie corporal es inapropiado. Bleyer y col. comprobaron que la administración de dosis de MTX IT en función de la superficie corporal aumentaba la neurotoxicidad en adolescentes y adultos, al alcanzar unas concentraciones de MTX muy elevadas en LCR31. Esto es debido a que, como ya hemos comentado, existe un rápido incremento del volumen de LCR durante los primeros años de vida, siendo en niños a partir de los 3 años equivalente al de los adultos. De este modo, se encuentra claramente definido que el cálculo de la dosis de MTX se debe realizar en función de la edad31, pero la dosis de MTX IT en los diferentes estudios varía generalmente de 10 a 15 mg13,24,27,32-39, siendo inferior en pacientes menores de 2 años (Tabla 2).
Dosis de metotrexato intratecal en monoterapia utilizada según diferentes autores
| Estudio | Patología | Indicación | Edad | Dosis MTX |
|---|---|---|---|---|
| Franklin y col.24 | Hemopatías malignas | Profilaxis | 1-2años | 8 mg |
| 2-3años3-8años | 10 mg12 mg | |||
| > 9 años | 15 mg | |||
| < 1 año | 6 mg | |||
| Bleyer y col.31 y AHFS Drug Information13 | Hemopatías malignas | Profilaxis y tratamiento | 1-2años | 8 mg |
| 2-3años | 10 mg | |||
| > 3 años | 12 mg | |||
| Kim et al.32 | Tumor sólido | Tratamiento | > 18 años | 15 mg |
| Kantarjian y col.33 | LAL | Profilaxis | > 18 años | 12 mg |
| Cortes y col.34 | LAL | Profilaxis | > 18 años | 12 mg |
| Mahoney y col.35yMatloubycol.25 | LAL | Profilaxis | < 2 años | 8 mg |
| 2-3años | 10 mg | |||
| > 3 años | 12 mg | |||
| Siegal y col.36 | Tumor sólido y linfoma | Tratamiento | > 18 años | 12 mg |
| Kiewe y col.37 | Linfoma primario SNC | Tratamiento | > 18 años | 15 mg |
| Omura y col.38 | LAL | Profilaxis | > 18 años | 10 mg/m2 |
| Hill y col.39 | LAL | Profilaxis | < 1 año | 7.5 mg |
| < 2 años | 10 mg | |||
| > 3 años | 12.5 mg |
∗Abreviaturas: LAL: Leucemia Aguda Linfoblástica; MTX: Metotrexato: SNC: Sistema Nervioso Central.
La administración de MTX IT puede producir neurotoxicidad aguda, subaguda o a largo plazo. El efecto adverso más común es la meningitis aséptica o aracnoi- ditis química que aparece aproximadamente en el 10% de los pacientes, aunque se han descrito incidencias de incluso el 50%; los síntomas característicos son cefalea, nauseas y rigidez de nuca40. La administración concomitante de corticoides IT u orales pueden reducir el riesgo de aparición. Geiser y col.21 observaron, en una cohorte de pacientes pediátricos que recibían MTX IT, que la frecuencia de aparición de síntomas de meningitis química en aquellos pacientes en los que se usaba como vehículo la solución de EB era menor, atribuyéndolo al pH cercano al fisiológico del LCR de esta solución, en comparación con el pH más alejado de los otros vehículos utilizados en este estudio.
También se ha descrito la aparición de vértigos, convulsiones, encefalopatía subaguda o leucoencefalopatía40. La leucoencefalopatía puede aparecer meses o años después de la administración de metotrexato, siendo mayor el riesgo en aquellos pacientes que reciben concomitantemente irradiación del SNC y dosis altas de MTX IV41.
CitarabinaLos datos farmacocinéticos disponibles para citara- bina, fueron obtenidos por Zimm y col.42 que inyectaron intraventricularmente una dosis única de citarabina (ARA-C) de 30 mg a siete pacientes con meningitis leucémica en remisión completa; tras la inyección se alcanzó una concentración máxima de ARA-C en LCR ventricular >200 pmol/L y se mantuvo una concentración >1 pmol/L durante al menos 24 horas. El ARA-C administrado IV es rápidamente eliminado del plasma mediante la enzima citidina desaminasa que metaboliza el ARA-C a uracil-arabinosido; sin embargo, en LCR la concentración del enzima es insignificante, no teniendo lugar prácticamente esta vía de metabolización43. Además el aclaramiento de ARA-C de LCR (0,42 mL/min) es un valor similar a la velocidad de formación y reabsorción del LCR (0,35 mL/min), sugiriendo que la eliminación de ARA-C del LCR es debida principalmente al flujo de éste. El ARA-C se elimina más lentamente del LCR que del plasma, siendo el aclaramiento ocho veces menor en LCR44. Al igual que ocurre con el MTX, no existe una dosis de ARA-C claramente establecida, debiéndose dosificar también en función de la edad en lugar de la superficie corporal24,33,34,45-47 (Tabla 3).
Dosis de citarabina intratecal en monoterapia utilizadas en diferentes estudios
| Estudio | Patología | Indicación | Edad | Dosis Citarabina |
|---|---|---|---|---|
| Franklin y col.24 | Hemopatías malignas | Profilaxis | <1 año1 - 2 años 2-3 años > 3 años | 20 mg 30 mg 50 mg 70 mg |
| Katarjian y col.33 y Cortes y col.34 | Leucemia aguda llnfoblástlca | Profilaxis | > 18 años | 100 mg |
| Esteva y col.45 | Cáncer de mama | Tratamiento | > 18 años | 100 mg |
| Fulton y col.46 | Tumor sólido | Tratamiento | > 18 años | 20 mg |
| Fleischhack y col.47 | Hemopatías malignas | Profilaxis y tratamiento | < 1 año < 2 años < 3 años > 3 años | 20 mg 26 mg 34 mg 40 mg |
Los efectos adversos que se han descrito con la administración de ARA-C IT son mielopatía transversa, meningitis aséptica, encefalopatía y convulsiones, aunque suelen aparecer con poca frecuencia24,48,49.
Citarabina LiposomalPara permitir una menor frecuencia de administración de ARA-C IT se ha desarrollado una formulación liposomal (Depocyte®); se trata de una formulación de liberación controlada de la citarabina acuosa que es encapsulada en unas partículas esféricas y multivesiculares llamadas DepoFoam®, presentando una vida media de eliminación en LCR más prolongada. Con esta formulación se ha descrito un perfil de eliminación bifásico con una t1/2 de fase terminal comprendida entre 100 y 263 horas, para un intervalo de dosis comprendido entre 12,5 mg y 75 mg, mientras que la citarabina de liberación convencional presenta una t1/2 de fase terminal de aproximadamente 3,4 horas para dosis de 30 mg50. Tras la inyección IT, las partículas liposomales que contienen el ARA-C se degradan y los lípidos entran en la vías meta- bólicas normales del organismo. En 2007, Phuphanich y col. estudiaron la farmacocinética de Depocyte® mediante la administración de 2 dosis, con un intervalo entre ambas de 14 días, por vía intraventricular o intralumbar a 8 pacientes, tomando muestras a diferentes tiempos hasta 14 días tras la administración. La concentración de ARA-C libre y encapsulada en el LCR ventricular y lumbar varió de 0,01 a 1500 µmol/l y fue detectable durante 14 días post-dosis. La exposición sistémica a la citarabina se consideró despreciable28.
La eficacia de la citarabina liposomal IT ha sido demostrada en dos ensayos clínicos controlados y alea- torizados, en pacientes con meningitis neoplásica asociada a linfoma y tumores sólidos, frente a citarabina convencional y metotrexato, respectivamente51,52. En el ensayo realizado frente a ARA-C convencional se observó una mayor tasa de respuesta en el brazo de citarabina liposomal, sin embargo, no se observaron diferencias estadísticamente significativas en la duración de la respuesta, supervivencia libre de progresión y supervivencia global. En el ensayo realizado frente a MTX la supervivencia libre de progresión fue también similar entre ambos grupos.
A diferencia del metotrexato y la citarabina de liberación estándar, la dosis de citarabina liposomal en adultos sí se encuentra definida, siendo 50 mg administrados vía IT, en un volumen de 5 mL; el intervalo posológico varía en función de la fase de tratamiento. La indicación aprobada por la agencia española del medicamento para Depocyte® es el tratamiento de la meningitis linfomatosa50.
La toxicidad de citarabina liposomal, principalmente cuando se administra asociada a otros fármacos que atraviesan la BHE, es relativamente elevada. En el centro para el tratamiento del cáncer M.D. Anderson, llevaron a cabo una experiencia en adultos diagnosticados de leucemia aguda linfoblástica (LAL) y tratados con el régimen Hiper-CVAD, que incluye dosis altas intravenosas de MTX y ARA-C. La introducción de citarabina liposomal IT, se asoció con un mayor porcentaje de neurotoxici- dad (16%) incluyendo encefalopatía, síndrome del pie equino, convulsiones y pseudotumor cerebri. Concluyeron que la neurotoxicidad grave podía ser debida a la administración concomitante de citarabina liposomal y fármacos que atraviesan la BHE o radioterapia53. En el ensayo clínico aleatorizado comparando la formulación de ARA-C liposomal frente a la convencional, realizado por Glantz, la mayoría de los efectos adversos fueron transitorios. El único efecto que ocurrió en más del 10% de los ciclos de tratamiento fue cefalea, la cual fue más frecuente en el brazo de citarabina liposomal que en el de la convencional (27% vs. 2%). La aracnoiditis química apareció en el 22% de los pacientes tratados con citarabina liposomal frente al 13% de los tratados con la formulación convencional52. Para disminuir la incidencia de aracnoiditis se recomienda administrar dexametasona vía sistémica durante 5 días, comenzando el tratamiento el mismo día de la inyección IT.
GlucocorticoidesAunque la administración de glucocorticoides intratecales es frecuente su farmacocinética en el SNC no está claramente documentada. Balis y col.54 estudiaron el comportamiento de dexametasona y prednisolona en el LCR, en un modelo primate no humano, tras su administración intravenosa e intraventricular. Tras la administración intraventricular ambos fármacos son aclarados rápidamente del LCR. Tras la administración intravenosa, la penetración en el LCR es baja debido al alto grado de unión a proteínas plasmáticas de ambos, aunque la dexametasona presenta una mayor penetración debido a su menor unión a proteínas plasmáticas (70% dexametasona versus 90% prednisolona).
Los glucocorticoides IT son usados principalmente en combinación con ARA-C y MTX. El uso concomitante tiene dos objetivos: aumentar la efectividad de la terapia IT y reducir la incidencia de irritación meníngea23. Existe una amplia evidencia del uso de corticoides como parte del tratamiento intratecal en oncohematología; ya en 1983 Muriel y col.55 usaron metotrexato 12 mg/m2 (dosis máxima=15 mg) y dexametasona 14 mg/m2 IT y en 1995, Gómez-Almaguer administró dexametasona IT 5 mg/m2, diluido en 5 mL de cloruro sódico 0,9% junto con MTX y ARA-C, en 8 pacientes con LAL e infiltración leucémica del SNC, reduciéndose el recuento celular en el LCR tras la administración de la quimioterapia intratecal combinada en todos los pacientes56. Sin embargo, el uso de corticoides junto con la quimioterapia IT no es universal, variando su utilización, el corticoide a utilizar y la dosis del mismo, según los protocolos de los diferentes grupos de estudio. En general, su uso se encuentra más extendido en el tratamiento de pacientes pediátricos que adultos.
El International Berlin-Frankfurt-Munster (BFM) Study Group57,58, en los protocolos de tratamiento de LAL en niños, utiliza como corticoide para administración IT la prednisolona, recomendando dosis que varían en función de la edad: <1 año: 6 mg, 1 año: 8 mg, 2 años: 10 mg y >3 años: 12 mg. Así, el BFM Study Group recomienda como profilaxis y tratamiento de la infiltración meníngea en LAL el uso de prednisolona junto con MTX y ARA-C. También es este el corticoide utilizado en el protocolo japonés JALSG-ALL93, en adultos con LAL, a dosis de 10 mg59.
El grupo italiano GIMEMA ha utilizado, en el tratamiento de la LAL en pacientes de 12 a 60 años, MTX 12 mg junto con metilprednisolona 40 mg IT60. La dosis de metilprednisolona 40 mg en pacientes adultos con LAL también ha sido utilizada junto con MTX 1 5 mg y ARA-C 40 mg por el French LALA Group61 y en el protocolo GRAALL-200362.
En EEUU, no se ha generalizado el uso de corticoides intratecales para el tratamiento de la LAL en adultos; así, no se incluyen ni en el estudio CALGB-881 163, ni en los dirigidos por Katarjian33 y Rowe64, utilizando para la profilaxis del SNC MTX IT 15 mg, 12 mg y 12,5 mg, respectivamente. Sin embargo, en pacientes pediátricos con LAL, tanto el Pediatric Oncology Group como el Children's Oncology Group sí utilizan hidrocortisona junto con MTX y ARA-C dosificada en función de la edad25,35. Los protocolos de tratamiento/profilaxis de la infiltración en SNC en leucemias agudas en niños del St. Jude Children's Research Hospital también utilizan hidrocortisona como parte de la terapia TIT a dosis de 16 mg, 20 mg o 24 mg en función de la edad (<1 año, 2-3 años o >3 años, respectivamente)65.
El grupo PETHEMA (Programa para el Estudio y Tratamiento de las Hemopatías Malignas) y la Sociedad Española de Hematología y Oncología Pediátricas (SEHOP) indican, en la mayoría de sus protocolos de tratamiento de LAL, el uso de hidrocortisona (HC) junto con ARA-C y
MTX, recomendando una dosificación: <2 años: 10 mg; 2-3 años: 15 mg; >3 años: 20 mg66. Otros protocolos del grupo PETHEMA han incorporado, sin embargo, el uso de dexametasona. Así, Burkimab-13, utilizado ampliamente en España para el tratamiento del linfoma de Burkitt en pacientes adultos, indica para la profilaxis y tratamiento de la infiltración del SNC, el uso combinado de MTX 15 mg junto con ARA-C 40 mg y dexametasona 4 mg67. También el PETHEMA-LAL-07OLD usa dexametasona 4 mg IT junto con MTX y ARA-C68.
La toxicidad de la administración intratecal de glu- cocorticoides no ha sido estudiada en estudios controlados, de hecho su uso combinado con quimioterapia IT se asocia a una disminución de los efectos adversos, principalmente la aparición de aracnoiditis química. Sí se encuentra descrito en diversos estudios, la aparición de efectos adversos psiquiátricos debidos al uso de corticoi- des intratecales, variando desde síndromes depresivos a psicosis69. En el estudio dirigido por Hitchins, en el que se administraba hidrocortisona IT previa a la administración de quimioterapia IT, se observaron dos reacciones inusuales en dos pacientes, que experimentaron cefalea, vómitos y confusión, ambos tras la administración mediante reservorio Ommaya. Los síntomas desaparecieron espontáneamente pocas horas tras la administración. Al retratar a ambos pacientes con hidrocortisona IT sufrieron de nuevo la misma reacción, eliminando la administración de hidrocortisona IT del resto de administraciones de quimioterapia IT y no apareciendo más esta reacción cuando se administraba sólo la quimioterapia. Los autores no encontraron una explicación a estas reacciones70.
Anticuerpos Monoclonales: Rituximab y TrastuzumabRecientemente ha sido investigada la administración de dos anticuerpos monoclonales, representando una terapia dirigida novedosa para el tratamiento de la carcinomatosis leptomeníngea: trastuzumab en el caso de cáncer de mama HER2 positivo y rituximab para el tratamiento en linfoma de células B.
El trastuzumab es altamente efectivo en el tratamiento de cáncer de mama con sobrexpresión del HER2, sin embargo, a pesar de su eficacia, los pacientes tratados con trastuzumab y quimioterapia experimentan una incidencia de metástasis en el SNC que varía del 28% al 42%30. Stemmler y col. observaron que la concentración en LCR de trastuzumab tras la administración intravenosa era 300 o 400 veces menor que la concentración plasmática71; por ello, para conseguir concentraciones terapéuticas de trastuzumab en LCR, se ha planteado el uso de trastuzumab IT El trastuzumab ha sido usado en series de casos, solo o en combinación con metotrexato o tiotepa intratecal, a dosis entre 12,5-25 mg administradas con una frecuencia que variaba de 3 días a 3 semanas. La pauta más empleada fue 20-25 mg semanalmente, siendo todas las pautas bien toleradas.
Con estas pautas se han registrado respuestas a nivel del LCR e incluso aumento de la supervivencia sin efectos tóxicos30.
El rituximab es un anticuerpo anti-CD20, más del 90% de los linfomas no Hodgkin (LNH) de células B y de los linfomas primarios en SNC expresan el marcador CD20 pero no lo expresa el tejido cerebral sano. Al igual que trastuzumab, el rituximab posee una baja penetración en LCR, siendo su concentración en LCR tras administración sistémica el 0,1% de las concentraciones séricas. Rubenstein y col.29 llevaron a cabo un ensayo fase I en 10 pacientes con LNH de células B y linfoma primario en SNC con meningitis neoplásica, a los que se les administró rituximab a través de un reservorio Ommaya, semanalmente en la primera semana de estudio y bisemanalmente durante 4 semanas. Se utilizaron dosis de rituximab de 10 mg, 25 mg y 50 mg, apareciendo efectos tóxicos con la dosis de 50 mg (hipertensión, náuseas, vómitos y dipoplía). La mediana de supervivencia fue de 21 semanas, seis pacientes experimentaron respuesta meníngea y dos de los tres pacientes con enfermedad infraocular experimentaron respuesta local. La combinación de citarabina liposomal junto con rituximab IT fue probada en 14 pacientes con linfoma y meningitis neoplásica recurrente por Chamberlain y col. Se le administró a cada paciente un régimen de inducción consistente en 25 mg de rituximab IT dos veces por semana y citarabina liposomal cada 14 días, durante 4 semanas. Se realizó una fase de mantenimiento consistente en 50 mg de citarabina liposomal y dos dosis de rituximab 25 mg administradas en la misma semana, cada 4 semanas, hasta progresión de la enfermedad. Después del régimen de inducción 10 pacientes experimentaron respuesta neurológica parcial y recibieron la terapia de mantenimiento. La probabilidad de supervivencia a los 6 meses fue del 29% y los efectos tóxicos fueron moderados y esperados, probablemente debidos a la citarabina liposomal72.
Existe poca información acerca del modo en el que debe realizarse la preparación y administración de los anticuerpos monoclonales cuando se van a administrar intratecalmente; lógicamente, se deben tener en cuenta los requisitos de las preparaciones para uso intratecal, preparándose siempre en condiciones de esterilidad y apirogeneicidad y usando diluyentes sin conservantes20. En el caso de trastuzumab, solo en una de las publicaciones se indicaba como se había preparado el trastuzumab: reconstituyéndolo de la forma habitual (150 mg en 7,2 mL API; pH 6) y administrando el volumen correspondiente (20 mg en 0,95 mL), sin dilución adicional73. Para el rituximab, en uno de los estudios se especificaba que la preparación se había realizado diluyendo el rituximab con solución de cloruro sódico 0,9% con una relación 1:1 para las dosis de 10 y 25 mg y sin diluir para las dosis de 50 mg y administrado en un tiempo de 1 a 5 minutos72.
No se ha establecido si la administración intraventricular o intralumbar tiene efectos sobre los resultados.
Quimioterapia Triple IntratecalEl uso de quimioterapia IT combinada es una consecuencia lógica, ya que está demostrado que el uso de quimioterapia sistémica combinada aumenta la efectividad cuando se compara con la administración de agentes antineoplásicos de forma individual. Así, muchos grupos de investigación abogan por el uso de la quimioterapia TIT que consiste en administrar de forma combinada metotrexato, citarabina y un glucocorticoide26. El uso de estos tres agentes combinados podría tener un beneficio aditivo o sinérgico para la profilaxis y el tratamiento de la meningitis neoplásica.
En España, el uso de la TIT para la profilaxis y tratamiento de la afectación leucémica del SNC y en determinados LNH es la práctica más extendida, debido a que es el tratamiento indicado en los protocolos de tratamiento promovidos por el grupo PETHEMA74 y SEHOP75. El uso habitual de esta estrategia en adultos queda reflejado en los resultados de los estudios del registro QUIT (Registro Español de Pacientes que Reciben Quimioterapia Intratecal)74-76.
La eficacia de la terapia TIT frente a MTX en monoterapia fue comparable en el estudio realizado por el Southwest Oncology Group donde se incluyeron pacientes pediátricos diagnosticados de LAL con enfermedad meníngea activa (tasa de respuesta completa 96% versus 100%)27. En el ensayo clínico CCG-1952, se aleatoriza- ron niños con LAL de riesgo estándar a recibir MTX sólo (n=1018) o TIT (MTX, ARA-C e HC, n=1009) como profilaxis de la afectación leucémica en SNC. Comparado con MTX IT, la TIT redujo significativamente el riesgo de recaída en SNC (3,4%±1,0% vs. 5,9%±1,2%, p=0,004); sin embargo, la supervivencia libre de enfermedad a los 6 años fue equivalente entre los dos grupos de tratamiento (80,7%±1,9% vs. 82,5%±1,8%, p=0,3), debido a un mayor porcentaje de recaídas medulares y testicula- res, lo cual se relacionó con una disminución significativa de la supervivencia global (Supervivencia a los 6 años: TIT 90,3% vs. MTX IT 94,4%; p=0,01)25.
No se han publicado comparaciones directas del uso de citarabina liposomal vía IT frente a la terapia TIT. Los efectos adversos debidos al uso de la terapia TIT no difieren cualitativamente de los que ocurren con MTX y ARA-C IT, descritos anteriormente, y de los riesgos asociados a la propia técnica de administración (PL o intraventricular). Los más comunes consisten en cefalea, náuseas, vómitos y fiebre; se presentan de forma menos común efectos adversos más graves, tales como aracnoi- ditis química, pérdida de visión y leucoencefalopatía24-77.
Como ya se ha comentado anteriormente, el uso de corticoides combinados con quimioterapia IT parece tener un efecto beneficioso sobre el perfil de eventos adversos, ya que el riesgo de aparición de irritación meníngea, descrito con la administración IT de MTX y ARA-C en monoterapia, disminuye al administrar concomitantemente un corticoide IT78.
Al igual que con la administración IT de los fármacos en monoterapia, las dosis de TIT a administrar no se encuentran claramente definidas. Sí existe unanimidad en que la dosis debe calcularse en función de la edad y no de la superficie corporal. Las dosis de MTX, ARA-C e HC utilizadas en diferentes estudios11,12,24,25,35,64,65,79-82 se muestran en la Tabla 4.
Dosis de quimioterapia triple intratecal (metotrexato, citarabina e hidrocortisona) en función de la edad, en diversos estudios
| Estudio | Edad | Dosis MTX (mg) | Dosis ARA-C (mg) | Dosis HC (mg) |
|---|---|---|---|---|
| Lin y col.12 y Liu y col.11 | < 1 año | 6 | 12 | 6 |
| 1-2años | 8 | 16 | 8 | |
| 2-3años | 10 | 20 | 10 | |
| > 3 años | 12 | 24 | 12 | |
| Franklin y col.24 | <1 año | 7.5 | 15 | 7.5 |
| 1-2años | 8 | 16 | 8 | |
| 2-3años | 10 | 20 | 10 | |
| 3-8años | 12 | 24 | 12 | |
| > 9 años | 15 | 30 | 15 | |
| Matloub y col.25 | < 2 años | 8 | 16 | 8 |
| 2-3años | 10 | 20 | 10 | |
| 3 -8 años | 12 | 24 | 12 | |
| > 8 años | 15 | 30 | 15 | |
| Mahoney y col.35 | 1 año | 8 | 16 | 8 |
| 2 años | 10 | 20 | 10 | |
| > 3-8 años | 12 | 24 | 12 | |
| > 9 años | 15 | 30 | 15 | |
| Pul ycol.65 | <2 años | 8 | 24 | 16 |
| 2-3años | 10 | 30 | 20 | |
| > 3 años | 12 | 36 | 24 | |
| Ortega y col.66 | < 12 meses | 5 | 16 | 10 |
| 12-23 meses | 8 | 16 | 10 | |
| 24-35 meses | 10 | 20 | 15 | |
| >35 meses | 12 | 30 | 20 | |
| Ruggiero y col.79 | < 2 años | 8 | 16 | 8 |
| < 3 años | 10 | 20 | 10 | |
| > 3 años | 12 | 24 | 12 | |
| Tomizawa y col.80 | < 2 años | 7.5 | 15 | 15 |
| < 3 años | 10 | 20 | 20 | |
| > 3 años | 12.5 | 25 | 25 | |
| LAL SEHOP/PETHEMA 201381 | 12-23 meses | 8 | 16 | 10 |
| 24-35 meses | 10 | 20 | 15 | |
| >35 meses | 12 | 30 | 20 | |
| Ribera y col.82 | 15-60 años | 12 | 30 | 20 |
Otros estudios y grupos de trabajo utilizan TIT con dexametasona, prednisona o metilprednisolona tal y como se ha comentado en el apartado de glucocorti- coides intratecales. Así en el BMF study group utilizaban como terapia TIT: MTX <1 año: 6 mg, 1 año: 8 mg, 2 años: 10 mg, >3 años: 12 mg.; ARA-C <1 año: 15 mg, 1 año: 20 mg, 2 años: 25 mg, >3 años: 30 mg; Prednisolo- na <1 año: 6 mg, 1 año: 8 mg, 2 años: 10 mg, >3 años: 12 mg57,58. En adultos también se han descrito combinaciones con dosis variables61,64,67,68
No existen estudios que comparen la efectividad y/o toxicidad de las diferentes mezclas TIT, por lo que existe incertidumbre respecto a la idoneidad de las combinaciones. De hecho, se desconoce la equipolencia de los distintos corticoides administrados por vía IT y las dosis utilizadas en distintos protocolos no serían equipolentes usando los criterios habitualmente aceptados para la vía sistémica83.
Además de la falta de homogeneidad en las dosis, el disolvente utilizado y el volumen de administración no se describen en prácticamente ningún estudio, siendo factores que según diversos autores pueden influir en la tolerancia al tratamiento y en la correcta distribución del fármaco en el LCR12.
De los estudios citados en la Tabla 4, sólo Liu y col.12 y Lin y col.” describieron el volumen utilizado, que varió en función de la edad y fue en ambos estudios: <1 año: 6 mL, 1 -2 años: 8 mL, 2-3 años: 10 mL y >3 años: 12 mL. Lin y col.” indicaron que habían utilizado un volumen de dilución adecuado para aumentar la eficacia de la terapia TIT, aunque sin argumentar esta afirmación.
Sullivan y col., en un estudio en el que compararon la eficacia y toxicidad de la terapia TIT frente a metotrexato e hidrocortisona, sí indicaron que el diluyente utilizado para la preparación fue la solución de EB, aunque no se indicó el volumen de dilución27. También describen que la administración de los 3 fármacos vía IT fue secuen- cial, administrando primero MTX, luego HC y por último ARA-C27. Esta descripción de la administración secuencial es excepcional, ya que en la mayoria de los estudios no se describe si la administración se realiza con la mezcla total en una sola jeringa o en jeringas separadas para cada agente y, en este caso, en que orden se realiza la administración.
Actualmente, la tendencia mas aceptada es a realizar la mezcla de los tres componentes en una sola jeringa, para facilitar la administración IT y evitar manipulaciones (conexiones y desconexiones del catéter) reduciendo así el riesgo de contaminación accidental durante la administración.
El protocolo pediátrico LAL SEHOP/PETHEMA 2013 describe la forma de preparación y administración del tratamiento IT. Se indica que se deben administrar los 3 citostáticos en la misma jeringuilla y que para la reconstitución de citarabina e hidrocortisona se utilizará agua bidestilada, estéril, apirógena y sin conservantes, completando el volumen con solución de cloruro sódico 0,9%. Este protocolo recomienda un pH de la mezcla de 7,3 y una osmolaridad de 300 mOsm/l81.
Además de los aspectos considerados, otro aspecto importante cuando se utilizan mezclas de fármacos, es que se debe garantizar la estabilidad físico-química de la mezcla resultante. Los estudios de estabilidad de mezclas TIT son escasos, habiéndose realizado la mayoría en la solución de EB. El estudio más recientemente publicado, donde se evalua la estabildad de metotrexato sódico, citarabina e hidrocortisona fosfato sódico en solución de cloruro sódico 0,9% con ajuste de pH y osmolaridad a valores cercanos a los del LCR, concluía que las mezclas TIT evaluadas eran químicamente estables durante al menos 7 días a temperatura ambiente (TA) y bajo refrigeración; sin embargo el pH de las mezclas se alejaba de los valores fisiológicos de LCR a los 5 días en las mezclas conservadas refrigeradas y a los 2 días en las conservadas a TA84. Las características de los estudios realizados19,84,87 se muestran en la Tabla 5.
Resumen de los estudios de estabilidad de TIT
| Estudio | Fármacos | Condiciones | Diluyente | Tiempo | Conclusión |
|---|---|---|---|---|---|
| Cradock y col.19 | MTX, ARA-C e HCSS sin mezclar | 22°C y 30°C | EB, SF, RL | 168 h | MTX y ARA-C estables 7 días a 22°Cy30°C.HCSS estable 72h en RL y SF, y 24 h en EB. |
| Olmos-Jiménez y col.84 | MTX, ARA-C e HCFS | 2-8°C y 25°C | SF (con NaHCO3) | 168 horas | Mezclas químicamente estables 168 h a 2-8°C y 25°C. |
| Zhang y col.85 | MTX, ARA-C e HCSS sin mezclar | 4o C y 23°C | EB | 48 h | MTX y ARA-C estables 48 ha 4°C y 23°C.HCSS estable 48 h a 4°C y 24 h a 23°C. |
| Trissel y col.86 | MTX y ARA-C con o sin HCSS. | 4o C y 23°C | EB | 48 h | Mezclas estables 48 h a 4°C y 23°C |
| Cheungh y col.87 | MTX, ARA-C e HCSS. | 25°C | EB, SF, RL, SG | 24 h | Mecías estables en todos los diluyentes más de 24 horas, excepto HCSS en EBa 1.25 mg/mL. |
Abreviaturas: ARA-C: citarabina, EB: solución de Elliott B, h: horas, HCFS: hldrocortlsona fosfato sódico, HCSS: hldrocortlsona succlnato sódico, NaHCOp bicarbonato sódico, MTX: metotrexato, RL: ringer lactato, SF: suero fisiológico 0,9%, SG: suero glucosado 5%.
Los estudios de estabilidad de mezclas TIT, con corti- coides diferentes a la hidrocortisona, son prácticamente inexistentes. Así en el protocolo Burkimab-1 367, donde se indica el uso de TIT con metotrexato, citarabina y dexametasona, se recomienda administrar la dexame- tasona en una jeringa separada de metotrexato y citarabina por la falta de evidencia sobre la estabilidad de esta mezcla, ya que no existen estudios de estabilidad de mezclas TIT con dexametasona como corticoide. El mismo protocolo recomienda, si se prefiere administrar la quimioterapia IT en una sola jeringa, sustituir la dexametasona por hidrocortisona.
En 2012, D'Hondt y col., llevaron a cabo un estudio de estabilidad de ARA-C, MTX y metilprednisolona en solución de cloruro sódico 0,9% durante 48 horas. Concluyeron que la mezcla era estable hasta 12 horas cuando se conservaba a 5°C y protegida de la luz88.
En 2014, el Ministerio de Sanidad, Servicios Sociales e Igualdad junto con la Sociedad Española de Farmacia Hospitalaria, publicaron una guía de buenas prácticas de preparación de medicamentos en servicios de farmacia hospitalaria en la que se clasificaban las preparaciones estériles según una matriz de riesgo. En esta guía se clasificaban las preparaciones para administración IT como preparación de alto riesgo y se definían como requisitos de preparación su elaboración en cabina de flujo laminar con entorno controlado (sala blanca), y como requisitos de conservación, un tiempo de conservación máximo de 24 horas a TA y 3 días a temperatura entre 2-8°C89-90.
ConclusionesExiste gran variabilidad en la práctica al utilizar la quimioterapia IT, a pesar de ser una terapia efectiva, asumida por todos los grupos internacionales, especialmente en el tratamiento de las leucemias agudas y los linfomas no Hodgkin. La variabilidad e incertidumbre no se limita a los fármacos y dosis administradas, sino que se extiende a la forma de preparación de las mezclas y la técnica de administración.
FinanciaciónEl trabajo no requiere financiación.
Conflicto de interesesNo existe conflicto de intereses.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas