REVISIONES
SISTEMA DE LIBERACION TRANSDÉRMICO DE FENTANILO: UNA NUEVAFORMA DE ANALGESIA ONCOLOGICA
FENTANYL TRANSDERMAL RELEASE SYSTEM: A NEW FORM OF ONCOLOGICANALGESIA
Navarro Ruiz, A.,Licenciado en Farmacia, Especialista enFarmacia Hospitalaria, Farmacéutico Adjunto;
Borrás Blasco, J.,Licenciado en Farmacia, ResidenteIII;
Martínez Ramírez, M.,Licenciado en Farmacia,Residente II;
González Delgado, M.,Licenciada en Farmacia,Especialista en Farmacia Hospitalaria, Jefa delServicio.
Servicio de Farmacia. Hospital General Universitario deElche.
Correspondencia:
Andrés Navarro Ruiz.
Servicio de Farmacia.
Hospital General Universitario de Elche.
Partida Huertos y Molinos, s/n.
03202 Elche.
E-mail: anavarroru@nexo.es
Fecha derecepción: 30-6-99
Resumen:
Una de lasprincipales complicaciones asociada al cáncer es el dolor.Durante mucho tiempo el tratamiento se ha realizado mediante elempleo de analgésicos opiáceos, como la morfina. Enlos últimos años, y debido a los efectos adversosmás frecuentes de la morfina (estreñimiento,depresión respiratoria, etc.), se han desarrollado nuevasformas de tratamiento del dolor oncológico, como elfentanilo en forma de parches transdérmicos.
Esta nuevaforma farmacéutica se encuentra enclavada en el tercerescalón de la escala analgésica de la OMS, seadministra mediante técnicas no invasivas y presentanumerosas ventajas frente a la vía parenteral. Una altaaceptación por parte del paciente, un intervaloposológico elevado, una administración relativamentecómoda y sencilla los hacen adecuados en pacientes con dolorcrónico canceroso que no pueden ser tratados con morfinaoral, si bien hay que tener precaución y aumentar la dosislentamente por los problemas que plantea lasobredosificación. La disminución delestreñimiento frente a la morfina oral y laadministración cada setenta y dos horas incrementa lacalidad de vida de los pacientes y facilita el cumplimiento de lapauta analgésica.
A pesar deque los datos disponibles hasta ahora no son concluyentes y laausencia de estudios de coste efectividad frente a morfina oral deliberación retardada, el parche de fentanilo puede ocupar enun futuro inmediato un lugar estratégico en la terapia deldolor oncológico, sustituyendo a la administraciónparenteral de morfina y en aquellos pacientes en los que pordiversas causas no resulte recomendable o no es posible laadministración oral de la misma, considerada hasta elmomento de elección en este tipo de terapia.
Palabras clave:
Fentanilo.Analgesia. Dolor oncológico. Morfina. Sistemas deliberación transdérmica.
Summary:
One of themain complications of cancer is pain. Its treatment has long beenopiate analgesics like morphine, but common adverse effects(constipation, respiratory depression) have lead to the developmentof new forms of treatment for oncologic pain, such as transdermalfentanyl patches.
This newpharmacological form is classified on the third step of the WHOanalgesic scale, is administered noninvasively, and has manyadvantages compared with parenteral administration. It is wellaccepted by patients, has a long dosing interval, and is relativelycomfortable and easy to administer, properties that make itsuitable for patients with chronic cancer pain who cannot betreated withoral morphine. However, care should be taken to increase the doseslowly because of potential overdosing. The decreased incidence ofconstipation compared with oral morphine and 72-hour administrationinterval enhance patients' quality of life and facilitatecompliance with analgesic guidelines.
Althoughavailable data are inconclusive and studies of the product's costeffectiveness compared with slow-release oral morphine are needed,fentanyl patches may soon play a strategic role in the treatment ofoncologic pain. They are useful as a replacement for parenteralmorphine administration and for the treatment of patients whoshould not, or cannot, receive oral treatment, which is consideredthe best form of administration in this type oftreatment.
Keywords:
Fentanyl.Analgesia. Oncologic pain. Morphine. Transdermal releasesystems.
FarmHosp 2000;24(2):64-73
INTRODUCCIÓN
Una de lasprincipales complicaciones asociada al cáncer es el dolor.Aproximadamente un 55% de los pacientes ambulatoriosoncológicos lo padecen (1), incrementándose esteporcentaje hasta el 90% en el caso de los pacientes con tumores enestadios avanzados (2). En el control del dolor oncológicoel empleo de analgésicos opiáceos como la morfinamediante las vías habituales de administración, oral,subcutánea e intramuscular ha sido y es prácticahabitual con excelentes resultados. No obstante, la dificultad dela administración parenteral en el paciente ambulatoriofundamentalmente y los efectos adversos atribuibles a la morfinacomo el estreñimiento y la depresión respiratoria,entre otros, han motivado la investigación y desarrollo denuevos analgésicos opiáceos presentados bajo formasfarmacéuticas de dosificación innovadoras queimplican, asimismo, nuevas vías de administración.Dentro de este grupo los parches transdérmicos (3), formafarmacéutica que emplea una vía de absorciónalternativa, la percutánea, presentan algunas ventajasterapéuticas frente a las vías clásicas deadministración de fármacos:
-- Se evitan lasvariaciones de absorción y metabolismo que aparecen aladministrar fármacos por vía oral.
-- Se mejora labiodisponibilidad de ciertos medicamentos al obviar el efecto deprimer paso.
-- Permite lautilización de fármacos de semivida biológicamuy baja.
-- Reduce laposibilidad de que se produzcan importantes variaciones en ladosis.
-- Proporcionaun régimen terapéutico con excelenteaceptación por parte del paciente.
El fentanilo esun potente agonista opiáceo de los receptores µ conactividad analgésica que, gracias a su bajo peso molecular,gran potencia --80 veces más potente que la morfina (4)-- ylipofilia cumple las condiciones necesarias para considerarlo comoun fármaco adecuado para su administración por lavía transdérmica (5-8). El fentanilo presentado bajola forma farmacéutica denominada sistema terapéuticotransdémico (STT-fentanilo) es una especialidadfarmacéutica estupefaciente que se encuentra registrada enEspaña con el nombre comercial de Durogesic® (JanssenFarmacéutica). Existen comercializadas tres dosis queliberan, respectivamente, de 25, 50 y 100 µg de fentanilo ala hora durante setenta y dos horas. Se presenta en un envase decinco parches transdérmicos al PVP (año 1999) de7.998, 14.374 y 24.786 pesetas, respectivamente, porenvase.
FARMACOCINÉTICA
La formafarmacéutica del parche de fentanilo es el sistematerapéutico transdérmico (STT). Incluye una membranade liberación sostenida que reduce la variabilidadinterindividual en aproximadamente un 50% frente a otros sistemasde administración transdérmica clásicos (5, 9)y un promotor percutáneo, el etanol, con un factor depromoción de 500 (9). Gracias a estos dos componentes el STTlibera el fármaco a un flujo constante durante setenta y doshoras. La penetración transdérmica de fentanilo essimilar en toda la superficie corporal, aunque se debe tener encuenta, en primer lugar, las diferencias interindividuales de cadapaciente (10), y en segundo lugar que la cantidad de fentaniloliberado es proporcional a la superficie del parche. Laabsorción percutánea del fentanilo se realizamediante un proceso cinético de orden cero (deliberación sostenida), depositándose en un reservoriopor debajo de la zona cutánea donde se aplica el parche,desde donde accede a la circulación sistémica deforma sostenida y constante, hasta alcanzar concentracionesplasmáticas significativas una vez transcurridas dos horastras la aplicación (11). No obstante, la absorciónpercutánea del fentanilo puede verse afectada por distintosfactores intrínsecos propios de la barrera cutáneacomo son la temperatura de la piel y el flujo sanguíneoperiférico. Distintos estudios han demostrado que estosfactores no afectan significativamente la absorcióntransdérmica del fármaco en un paciente contemperatura normal (9, 12), pero al tratarse de un procesotemperatura corporal-dependiente en pacientes con fiebre laabsorción percutánea del fentanilo se incrementa enun tercio, por lo que debería vigilarse la posibleaparición de toxicidad. En estos casos se debe ajustar ladosis de fentanilo. Otro factor que afecta la absorciónpercutánea del fentanilo es el ejercicio físico.Durante el mismo se incrementa de una manera notable el flujosanguíneo cutáneo, que se traduce en un incrementodel paso de fentanilo desde su reservorio en la dermis hacia lacirculación sistémica. Otros factores que afectan laabsorción percutánea son una excesivahidratación y la oclusión de la zona deaplicación del STT-fentanilo; en ambos casos se incrementala absorción percutánea (7, 13, 14).
Labiodisponibilidad del fármaco es aproximadamente del 92%(15), que indica que el fentanilo no es degradado por la flora y elmetabolismo cutáneo (16). Se distribuye en tejidos y zonasde naturaleza grasa del organismo del mismo modo que lo hacen otrassustancias de naturaleza lipófila (17, 18). Su unióna proteínas plasmáticas es de aproximadamente un79-87% (19) y se metaboliza a nivel hepático mediante unproceso de N-dealquilación, no presentando metabolitosactivos en proporción adecuada para ser consideradosefectivos en clínica. Su principal vía deeliminación es la renal (20).
Laliberación percutánea de fentanilo desde elSTT-fentanilo determina unas concentraciones séricas que vanaumentando gradualmente hasta alcanzar un valor constante entre lasdoce a veinticuatro horas de su administración,permaneciendo constantes a lo largo del períodoposológico normal de tres días. Portenoy et al (21)realizaron un estudio en el que se valoraba cuánto tiempoera necesario para alcanzar el estado estacionario tras laadministración de cinco dosis de STT-fentanilo en pacientesoncológicos con dolor crónico. Los resultados delestudio indican que es en la segunda aplicación del parche,una vez formado el reservorio de fentanilo dentro de la zonacutánea contigua al parche, cuando se alcanza el estadoestacionario, permaneciendo los niveles constantes a lo largo detodo el tratamiento. Este comportamiento farmacocinético, encuanto a la cinética de eliminación del fentanilo yla absorción percutánea del mismo, puede variar porlas características individuales del paciente (22-26). Lavida media cuando se administra transdérmicamente es detrece a veinticinco horas (27), mientras que es de seis a ochohoras cuando se administra por vía intravenosa (15, 28).Este dato es importante, puesto que va a ser mucho másdifícil revertir los efectos tóxicos asociados a unaposible intoxicación cuando el fentanilo se administra porvía transdérmica respecto a la parenteral. Porúltimo, cabe resaltar que la edad del paciente no afecta altiempo de obtención de niveles plasmáticosterapéuticos estables (estado estacionario) de fentanilo(29, 30). En un estudio preliminar realizado en niños se haobservado que los parámetros farmacocinéticosestimados son similares a los de los adultos (31).
ADMINISTRACIÓN Y DOSIFICACIÓN
Los parchestransdérmicos de fentanilo se aplican por encima de lacintura en una zona de piel sin pelo. El vello debe ser cortado, noafeitado, para evitar microheridas en la piel que puedan afectar ala posterior absorción. La piel debe ser lavadaúnicamente con agua y meticulosamente secada (no debelimpiarse con jabón, alcohol o lociones que pudieran irritarla piel, lo que favorecería la absorción, rompiendola cinética de orden cero). Una vez acondicionada la piel sedestapa el parche y se pone presionando durante treinta segundossobre la zona de administración. Finalmente secomprobará que los bordes del STT-fentanilo han quedadoadheridos a la piel.
En pacientesgeriátricos, caquécticos o debilitados que presentanalteraciones farmacocinéticas (disminución delaclaramiento, pérdida de masa muscular, etc.) ytambién en pacientes a los que nunca se les han administradoopiáceos, la dosis inicial no debe ser superior a 25µg/h. En aquellos pacientes que han recibido yaanalgésicos opiáceos la dosis de fentanilo debecalcularse en función de la tolerancia opiáceadesarrollada por ellos. La dosificación en pacientes contolerancia a opiáceos debe realizarse siguiendo estospasos:
-- Se calculacuáles son las necesidades analgésicas del pacientepara las siguientes veinticuatro horas.
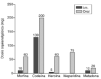
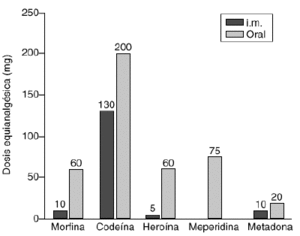
-- Se transformael valor del opiáceo empleado en el valorequianalgésico de morfina oral siguiendo la figura 1 (32).
Figura 1.--Potencia equianalgésica de los agentesopiáceos. Todas las dosis intramusculares y orales seconsideran equianal gésicas a 10 mg de morfinaintramuscular.
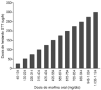
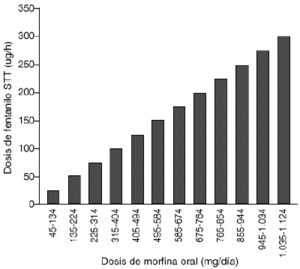
-- Se transformael valor de morfina oral o subcutánea en el de STT-fentanilosiguiendo la figura 2 (32).
Figura 2.--Dosis (µg/h) recomendada de STT-fentaniloequivalentes a la dosis mg/día de morfina oral.
En los ensayosclínicos realizados la determinación inicial de ladosis STT-fentanilo fue adecuada en aproximadamente el 50% de lospacientes, mientras que el resto necesitaron incrementar la dosis.Durante la dosificación inicial se puede combinar la dosisde STT-fentanilo con morfina oral o s.c. El fabricante recomiendapor lo menos tres días de administración conjunta deambas pautas analgésicas, ya que se considera que el estadoestacionario de fentanilo se alcanza a partir de la segundaaplicación del parche. El posterior incremento de dosis defentanilo se debe basar en las necesidades de analgesia delpaciente. Existen estudios en la bibliografía donde latitulación de la dosis se realiza mediante laadministración de dosis de fentanilo por víaintravenosa. De este modo se consigue alcanzar másrápidamente el estado estacionario y el tiempo hasta obtenerun control de la analgesia es menor (33, 34).
En el caso deretirada del tratamiento con STT-fentanilo se debe hacer lentamentey con una disminución progresiva de la dosificacióncon el fin de evitar el síndrome de abstinencia aopiáceos relacionado con una dependencia física y nopsicológica del paciente. Ahmedzai et al (35) describen 45casos en los que el síndrome de abstinencia aparece a lospocos días de retirar la morfina oral, presentando lospacientes cuadros frecuentes de dolor abdominal, agitación ysíntomas gripales. En todos los casos el control del dolorse restableció una vez finalizado el período deabstinencia.
ENSAYOSCLINICOS SOBRE EL TRATAMIENTO DEL DOLOR CRONICO ONCOLOGICO CONSTT-FENTANILO
El uso delSTT-fentanilo en el tratamiento del dolor en pacientesoncológicos ha sido evaluado en distintos ensayosclínicos frente al estándar, la morfina oral. En latabla 1 se presenta el resumen detodos ellos (revisión de Medline años 1966-1999) (33,35-52). Los ensayos encontrados no son ciegos, lo cual es uninconveniente a la hora de obtener resultados concluyentes, enespecial en patologías tan subjetivas como es el dolorcrónico. Obviamente no pueden realizarse ensayos controladosfrente a placebo por razones éticas, pero sí frenteal estándar, la morfina oral, utilizando técnicas deenmascaramiento que permitan mantener oculta la asignaciónaleatoria. No es el caso de ninguno de los ensayos revisados, loque compromete la validez de los mismos.
Tabla 1. Resumen de los ensayos clínicoscomparativos de STT-fentanilo y morfina administrada por víaoral | ||||||
| Ensayo | Número pacientes | Duración (días) | Control del dolor Gradosatisfacción | Efectos secundarios | Comparación vs | Ajuste de dosis morfina oral |
| Slover, 1992(36). | 5 | 28 | Efectivo. Mejora del apetito y del carácter frente a morfinaoral. | Menor estreñimiento con el STT-fentanilo. | = | |
| Levy et al,1992 (37). | 6 | 55 | Efectivo. | Similares a los de la morfina oral. | = | A las dos semanas se duplicó la dosis y a las cuatro se latriplicó la dosis. Al final del estudio la dosis media de240 µg/h. |
| Herbst yStrause, 1992 (38). | 11 | 28 | Efectivo. | Similares a los de la morfina oral. | = | |
| Maves yBarcellos, 1992 (39). | 10 | 28 | Efectivo. Bueno. | Similares a los de la morfina oral. | = | |
| Korte y Morant,1994 (40). | 20 | 28 | Efectivo. | Se realiza el ajuste de dosis diariamente según lasnecesidades del paciente. La dosis de fentanilo aumentóprogresivamente en las dos primera semanas de ensayo. | ||
| Zech y Lehman,1995 (33). | 70 | Efectivo. | Similares a los de la morfina oral. | = | La dosis de fentanilo se ajusta mediante la administraciónde fentanilo i.v. y a partir de ahí se añaden losparches necesarios. | |
| Simonds, 1995(41). | 39 | 84 (5-365) | Efectivo. | |||
| Donner et al,1996 (42). | -- | Efectivo. El 94,7% de pacientes prefieren recibir STT-fentanilo defentanilo frente al uso de morfina oral. | Similares a los de la morfina oral, pero menorestreñimiento. Tres pacientes sufrieron síndrome deabstinencia. | = | Uso conversión de morfina oral a STT-fentanilo en ratio100:1. | |
| Korte et al,1996 (43). | 39 | Efectivo. Más aceptado que morfina. Bueno. | Similares a los de la morfina oral, pero menorestreñimiento. | = | Adición de un nuevo parche durante las 48 horas inicialescaso de aparecer dolor. | |
| Hammack et al,1996 (44). | 35 | 7 | Efectivo. El 59% de pacientes muy satisfechos; 6% de pacientesinsatisfechos. | Similares a los de la morfina oral. | Disminuyó el dolor en un 24-29% e incrementó lashoras de sueño en un 25%. | |
| Leelanuntaki,1996 (45). | Efectivo. | Menores a los producidos por la morfina oral. | ||||
| Grond et al,1997 (46). | 50 | 66 (5-535) | Efectivo. Dolor en inicio de tratamiento 45%, en fase detitulación 19% y a lo largo del estudio 15%. | Similares a los de la morfina oral. Tres pacientes sufrierondepresión respiratoria. | La determinación de las necesidades de fentanilo i.v.produjo un menor período de dolor al inicio del tratamientocon STT-fentanilo. | Se usó la titulación con fentanilo i.v. para ver lasnecesidades del paciente, convirtiendo luego estos mg i.v. defentanilo en dosis de STT-fentanilo en µg/h. |
| Woodroffe yHays, 1997 (47). | 44 | 2-384 | Efectivo. | Similares a los de la morfina oral. El 17% de pacientes seretiraron del estudio por efectos secundarios. | 80% de pacientes obtuvieron buena analgesia. Muy buenasatisfacción por su simpleza y período deadministración. | Dosis de STT-fentanilo entre 25-300 µg/h, recibiendo morfinasubcutánea. |
| Wong et al,1997 (48). | 40 | Efectivo. | Similares a los de la morfina oral. | Pero el STT-fentanilo es mejor en pacientes con vómitos,disfagia y náusea grave. | ||
| Ahmedzai yBrooks, 1997 (35). | 202 | Efectivo. No existen diferencias en la calidad de vida, aunque lospacientes prefieren el STT-fentanilo vs a la morfinaoral. | Disminuye el estreñimiento, pero se produce un aumento deproblemas de sueño. | STT-fentanilo proporciona buen control del dolor con menorsedación y estreñimiento al producido por la morfinaoral. | ||
| Yeo et al, 1997(49). | 14 | 14 | Efectivo para el 43%. | Dos pacientes desarrollaron náuseas importantes, lo que lesretiró del ensayo. | Principal problema es la dificultad de ajustar la dosis deinicio. | |
| Donner et al,1998 (50). | 51 | 158 (15-855) | Efectivo. | Similares a los de la morfina oral, pero menorestreñimiento. | Se considera medicación alternativa en el escalón IIIdel protocolo de la OMS en el control del dolor delcáncer. | Se incrementó la dosis de STT-fentanilo a lo largo deltratamiento por el curso del cáncer. |
| Payne et al,1998 (51). Aleatorizado. | 504 | Efectivo. Pacientes más satisfechos con elSTT-fentanilo. | Menores efectos secundarios con el STT-fentanilo. | Produce mejor control de la intensidad de dolor y menorafectación sobre el sueño de lospacientes. | ||
| Sloan et al,1998 (52). | 53 | 58 | Efectivo. El 63% de los pacientes prefieren elSTT-fentanilo. | El 17% abandonaron el ensayo por distintos efectos secundarios(náuseas, vómitos, rash cutáneo). | Es efectivo, seguro y bien tolerado. | La dosis de morfina oral de 189 mg se tradujo en una dosis deSTT-fentanilo de 58 µg/h y al final del tratamiento fue de169 µg/h. |
Los ensayosincluyeron a un total de 958 pacientes. En todos ellos la eficaciadel STT fentanilo es comparable a la morfina oral. Ahmedzai et al(35) administran morfina oral durante quince días yposteriormente cambian a STT-fentanilo durante el mismoperíodo de tiempo. No se encontraron cambios significativosen el control de los síntomas relacionados con el dolorcanceroso crónico entre las dos opciones y sí unamejora significativa de la calidad de vida del paciente con lautilización de STT-fentanilo. Hammack (44), Ahmedzai (35) yPayne (51) concluyen resultados similares en relación a lamejora de la calidad del sueño. La aceptación delSTT-fentanilo fue superior al uso de morfina oral en lamayoría de los estudios. En la valoración de laeficacia del parche frente a la morfina oral existen variosestudios que recogen la preferencia de los pacientes quepreviamente habían recibido morfina oral a recibirSTT-fentanilo. Esta preferencia oscila entre el 61-95% (39, 53). Eluso de los STT-fentanilo para el control del dolor crónicooncológico parece mejorar también las relaciones delpaciente con su entorno familiar (33, 35).
Un aspectonegativo recogido en la mayoría de los ensayos fue elinadecuado control de la analgesia los primeros días detratamiento, originado por la mayor dificultad para alcanzar latitulación de la dosis con la utilización delSTT-fentanilo.
TOLERANCIA YEFECTOS ADVERSOS EN PACIENTES CANCEROSOS
El fentaniloadministrado de forma intravenosa tiene una semivida deeliminación relativamente corta de aproximadamente seis aocho horas, mientras que la administracióntransdérmica proporciona una semivida que excede en muchoscasos las veinticuatro horas. Esta larga semivida deeliminación puede dificultar la reversión de efectosadversos.
Los efectosadversos que se pueden esperar con este tratamiento son casi losmismos que los producidos por los derivadosopiáceos:
-- El másgrave asociado a la terapia con STT-fentanilo es ladepresión respiratoria, que en los ensayos revisados oscilaalrededor de un 2% de los pacientes tratados (6).
--Aparición de estreñimiento. En este caso laincidencia fue ligeramente inferior que con la morfina oral (35,42, 43, 50, 54, 55). La causa de esta diferencia la encontramos enque la relación entre dosis analgésica yantidiarreica en la morfina es mucho menor que en el fentanilo, porlo que a dosis equianalgésicas con la morfina se produce unamayor disminución de la motilidad gastrointestinal que conel fentanilo.
--Aparición de eritema y prurito en el punto deaplicación, aunque parece ser que esta reacción esdebida al plástico o al adhesivo (56-59). El eritema fuetransitorio y afectó a un 3% de los pacientes (35, 40,54).
--Aparición de náuseas y vómitos. Este efectoadverso aparece con similar incidencia en los pacientes tratadoscon morfina oral (54, 60), si bien existen estudios en los que haydiferencias significativas entre uno y otro a favor delSTT-fentanilo (48, 55).
--Aparición de somnolencia. Los estudios comparativos delSTT-fentanilo y la morfina oral no son concluyentes, existiendoestudios con resultados a favor del uso de STT-fentanilo y otros afavor del uso de la morfina oral.
-- Otros efectosadversos pero de menor frecuencia (1-2%) fueron la apariciónde anorexia, sudoración, problemas urinarios, sequedad deboca, flatulencia, distensión abdominal, bradicardia,temblor, agitación, síncope, vértigo, estupory faringitis.
INTOXICACION
Serealizó una búsqueda en Medline (1966-1999) de casosgraves de toxicidad asociados a la utilización delSTT-fentanilo.
Hasta enero de1994 la FDA había recogido un total de 50 casos de muerteaparecidos durante el tratamiento con parches transdérmicosde fentanilo, de los cuales 34 se debieron a la patología debase del paciente. De los 16 restantes, la FDA sóloasoció cuatro al empleo de los parches.
Las altasconcentraciones de fármaco que se almacenan en el parche,junto con una mala manipulación del mismo, pueden llevar ala sobredosificación e intoxicación del paciente.Sabemos que entre el 28 y el 84%
de la dosis inicial permanece en el parche tras la retirada delmismo al paciente que lo ha llevado durante tres días (61).Aplicando los valores farmacocinéticos del fentanilo(volumen de distribución de 4 l/kg), junto con la dosispotencialmente mortal del mismo, que varía según latolerancia del individuo a los opiáceos, llegamos a laconclusión que la cantidad de fármaco remanente en unparche puede superar en gran medida la dosis mortal para unapersona.
La potencia delfentanilo (80 veces superior a la morfina) puede provocar laaparición de intoxicaciones accidentales o dependencias yabusos en personas especialmente predispuestas. Se han descritocasos de personas que han ingerido intencionadamente el parche oque se han inyectado por vía intravenosa su contenido(62-68). De todo ello se deduce que se debe establecer un especialcontrol sobre el uso de esta forma farmacéutica delfentanilo, así como de la eliminación del mismo unavez utilizado.
ASPECTOSFARMAECONOMICOS
Lasúltimas mejoras tecnológicas que se vienen aplicandoen la terapia del dolor encarecen los tratamientos y loseguirán haciendo cada vez más en los próximosaños. En una valoración económica de lostratamientos del dolor no sólo debe considerarse los costesde adquisición del medicamento, sino también elequipamiento empleado, así como el tiempo utilizado por elpersonal sanitario en la preparación, administracióny adiestramiento del paciente o de sus cuidadores en lastécnicas empleadas en cada caso. Teniendo en cuenta losaspectos citados hemos comparado los costes diarios deadquisición del STT-fentanilo de 100 µg/h frente a: 1)la dosis equivalente de morfina oral administrada como morfina deliberación retardada cada doce horas (~360 mg/24 h), y 2) ladosis equivalente de morfina parenteral (~60 mg/24 h) administradamediante las técnicas más comúnmente empleadasen la Unidad de Cuidados Paliativos del hospital para la víaparenteral: vía subcutánea con o sin sistema continuode infusión. Los datos se recogen en la tabla 2.
Tabla 2. Coste en pesetas/día de la morfina oral (360mg/24 h), morfina subcutánea (60 mg/24 h), morfina eninfusor de veinticuatro horas (60 mg/24 h) y STT-fentanilo 100µg/h (2,4 mg/24 h) | |||||
| Costespesetas/día | |||||
| Adquisiciónmedicamento | Tiempopreparación/administración | Equipamiento | Coste directototal/día | ||
| Minutos | Pesetas | ||||
| Morfina oral, 360 mg/24 h (3 cáp. de 100 mg y 1cáp. de 60 mg) | 426 | 3 | 63 | -- | 489 |
| Morfina subcutánea, 60 mg/24 h (6 amp. de 10mg) | 312 | 20 | 420 | .8817 | 749 |
| Morfina en infusor de veinticuatro horas, 60 mg/24 h (6amp. de 10 mg) | 312 | 20 | 420 | 6.850 | 7.582 |
| STT-fentanilo, 100 µg/h (2,4 mg/24 h) (1 par che de100 µg) | 1.652 | 2 (6 min/3días) | 42 | -- | 1.694 |
Se hanconsiderado los costes de adquisición del medicamento a PVP(año 1999) según las presentaciones utilizadas encada caso: cápsula de morfina de liberación gradual,ampolla de cloruro mórfico al 1% y STT-fentanilo de 100µg/h.
Lavaloración del tiempo necesario para la preparación,administración y adiestramiento se ha realizado considerandoque en todo momento es el personal de enfermería el queinterviene (en atención domiciliaria parte del tiempo esreemplazado por el personal que cuida al paciente). Los tiemposmedidos han sido: tres minutos/día para laadministración oral, veinte minutos/día para laparenteral y dos minutos/día para la administracióndel parche de fentanilo (realmente el tiempo utilizado fue de seisminutos, pero hay que tener en cuenta que el parche se administracada tres días). Los costes del material fungiblebásico utilizado se han obtenido del Departamento deSuministros del hospital, cuya gestión de compras se realizaa través de la Unidad Central Logística (Central deCompras) de la Administración Sanitaria Autonómica.El coste total del equipamiento necesario para laadministración subcutánea de morfina con y sinsistema de infusión continua se obtiene considerando que elmaterial se renueva cada diez días, excepto cuando seutiliza un infusor (uno por día) (tabla 3).
Tabla 3. Coste de adquisición del material sanitarioutilizado en la administración de morfinaparenteral | |
| Artículo | Precio unidad(año 1999) en pesetas |
| Guantes | 4 |
| Infusor 24 horas | 6.848 |
| Palomilla | 11 |
| Jeringa | 5 |
| Aguja hipodérmica | 2 |
| Apósito tipo Op-site | 150 |
| Apósito | 20 |
El coste directototal por día es de 489 pesetas para la morfina oral, 749pesetas para la subcutánea, 7.582 para laadministración con infusor de veinticuatro horas y de 1.694pesetas para el STT-fentanilo. En la valoración comparativano se ha incluido ni el tiempo utilizado por la enfermeríapara la suplementación analgésica durante elperíodo inicial de titulación, el coste de dichossuplementos hasta alcanzar la analgesia adecuada. Se trata de unaspecto que puede ser importante considerar en algunos pacientes,por lo que debería ser evaluado en estudios posterioresdiseñados para conocer el coste-efectividad delSTT-fentanilo frente a la morfina oral de liberaciónretardada.
DISCUSION
Ventajas delos parches de fentanilo frente a la morfina
--Administración mediante técnicas no invasivas, lo quesupone una ventaja frente a la vía parenteral demorfina.
-- Se evita elefecto de primer paso hepático.
-- Cuando elSTT-fentanilo se administra a dosis adecuadas se consiguenconcentraciones plasmáticas constantes que evitan elinconveniente de la administración repetida de la morfinaoral. El que no existan niveles pico y valle plasmáticoprobablemente ocasione una disminución de los efectosadversos y tóxicos debido a los picos sanguíneos delos opiáceos convencionales.
-- Laadministración del STT-fentanilo es simple y cómoda,se puede realizar en casa del paciente con un intervaloposológico de setenta y dos horas, reduciendo los problemaspsicológicos asociados a una dosificación másfrecuente de morfina. Al administrarse en intervalos de tresdías el paciente tiene menos presente su enfermedad. Todoesto hace que sea una forma farmacéutica ideal para personasimpedidas o no cooperantes (niños, ancianos, etc.) o que notoleren la administración de analgésicosopiáceos por vía oral (por presencia devómitos, baja absorción intestinal o enfermedadesintestinales en general) y presenten dificultad para el accesovenoso.
-- Laaplicación del parche sobre la piel, además defavorecer la adherencia al tratamiento, parece ocasionar un menornúmero de efectos adversos, fundamentalmente en el caso delestreñimiento, mejorando la calidad de vida delpaciente.
-- ElSTT-fentanilo podría resultar coste-efectivo cuando seconsidera la administración de opiáceos através de infusor. Los costes directos de suadministración son superiores a la administraciónoral de morfina y frente a la subcutánea, aunque en estasituación la diferencia es menor y la valoración dela calidad de vida del paciente y sus cuidados sería unfactor a tener en cuenta.
Inconvenientes de los parches de fentanilo frente a lamorfina
-- El retraso enalcanzar la analgesia frente al dolor durante el período detitulación de la dosis. Actualmente se soluciona usandofentanilo por vía intravenosa durante la fase inicial oadministrando suplementos de otros analgésicos en elperíodo inicial de tratamiento. En el futuro este problemapodrá subsanarse con el desarrollo y comercializacióninmediata de una nueva formulación de fentaniloabsorción rápida a través de la mucosa oral--oral transmucosal fentanyl citrate (OTFC)--. Esta nueva formafarmacéutica permitirá paliar los picos de dolor queaparecen en el período de titulación de la dosis conSTT-fentanilo (69, 70).
-- A dosis deSTT-fentanilo elevadas se precisa cubrir áreas muy extensasde la piel --280 cm2 parauna dosis de 700 µg/h (40).
-- Una ampliavariabilidad de la absorción percutánea pasiva, pesea que en los STT-fentanilo se ha reducido bastante.
-- Su vida media(trece a veinticinco horas) puede ocasionar problemas en lareversión de posibles efectos tóxicos.
-- La mismafacilidad y comodidad que supone la administración de estosparches puede ser un inconveniente por la facilidad con la que sepuede suspender el tratamiento por desprendimiento accidental ointencionado del mismo. Por otra parte, la pauta cada setenta y doshoras puede ocasionar errores por olvido en relación aldía en el que el parche debe ser sustituido.
-- Las altasdosis remanentes en los parches de fentanilo retirados cada tresdías a los pacientes pueden ocasionar problemas de toxicidadgraves si no se garantiza su eliminaciónadecuada.
-- Los costesdirectos de la administración del STT-fentanilo sonsuperiores a la morfina oral retardada considerada como tratamientoestándar.
A pesar de quelos datos disponibles hasta ahora no son concluyentes, elSTT-fentanilo puede ocupar en un futuro inmediato un lugarestratégico en la terapia del dolor oncológico enaquellos pacientes con intolerancia a la vía oral y quepresenten dificultad para el acceso venoso. Se precisan ensayosmejor diseñados para concluir una eficacia comparable ymenor toxicidad de los STT-fentanilo. En los pacientes que toleranla vía oral de morfina la administración de lafórmula de liberación retardada tiene unos costesinferiores a los STT-fentanilo, considerándose deelección frente a los mismos. Sería necesariorealizar estudios de coste-efectividad que compararan ambasalternativas, fundamentalmente cuando la administración defentanilo de absorción rápida (OTFC) estécomercializada.
BIBLIOGRAFIA
1.Cleeland CS,Gonin R, Hatfield AK, Edmonson JH, Blurn RH, Stewart JA, et al.Pain and its treatment in outpatients with metastatic cancer. NEngl J Med 1994;330:592-6.
2. Jacox A,Carr DB, Payne R. Clinical Practice Guidelines (No. 9): managementof Cancer Pain, vol 1. Rockville, MD: Agency for Health Care Policyand Research; 1994.
3. Zech DF,Grond SU, Lynch J, Dauer HG, Stollenwerk B, Lehmann KA. Transdermalfentanyl and initial dose-finding with patient-controlled analgesiain cancer pain. A pilot study with 20 terminally ill cancerpatients. Pain 1992;50:293-301.
4. Cherny NJ,Chang V, Frager G, Ingham JM, Tiseo PJ, Popp B, et al. Opioidpharmacotherapy in the management of cancer pain: a survey ofstrategies used by pain physicians for the selection of analgesicdrugs and routes of administration. Cancer 1995;76:1283-93.
5. Hwang SS,Nichols KC, Southan M. Transdermal permeation: physiological andphysicochemical aspects. En: Lehman KA, Zech D, eds. Transdermalfentanyl: a new approach to prolonged pain control, 1.a ed.Berlín: Springler-Verlag; 1991:1-7.
6. JanssenPharmaceutica. Durogesic (fentanyl transdermal system) fullprescribing information; 1999.
7. Sebel PS,Barrett CW, Kirk CJ, Heykants J. Transdermal absorption of fentanyland sufentanil in man. Eur J Clin Pharmacol1987;32:529-31.
8. Enck RE. Themanagement of large fungating tumors (malignant ulceration). Am JHosp Palliat Care 1990; 7:11-2.
9. Gupta SK,Southam M, Gale R, Hwang SS. System functionality andphysicochemical model of fentanyl transdermal system. J PainSymptom Manage 1992; 7:S17-26.
10. Roy SD,Flynn GL. Transdermal delivery of narcotic analgesics: pH,anatomical, and subject influences on cutaneous permeability offentanyl and sufentanil. Pharm Res 1990;7:842-7.
11. Plezia PM,Kramer TH, Linford J, Hameroff SR. Transdermal fentanyl:pharmacokinetics and preliminary clinical evaluation.Pharmacotherapy 1989;9:2-9.
12. Rung GW,Riemody S. The effect of skin temperature on transdermal fentanyltherapy (abstract). Anaesth Analg 1993;76:S363.
13. Loth H.Skin permeability. Methods Find Exp Clin Pharmacol1989;11:155-64.
14. Ridout G,Santus GC, Guy RH. Pharmacokinetic considerations in the use ofnewer transdermal formulations. Clin Pharmacokinet1988;15:114-31.
15. Varvel JR,Shafer SL, Hwang SS, Coen PA, Stanski DR. Absorptioncharacteristics of transdermally administered fentanyl.Anesthesiology 1989;70:928-34.
16.Fiset P,Haack C, Shafer SL. Bioavility and absorption rate of transdermalfentanyl (abstract). Anesthesiology 1991;75:A326.
17. Hess R,Herz A, Friedel K. Pharmacokinetics of fentanyl in rabbits in viewof the importance for limiting the effect. J Pharmacol Exp Ther1971;179:474-84.
18. Hess R,Stiebler G, Herz A. Pharmacokinetics of fentanyl in man and therabbit. Eur J Clin Pharmacol 1972;4:137-41.
19. Mather LE.Clinical pharmacokinetics of fentanyl and its newer derivatives.Clin Pharmacokinet 1983;8:422-46.
20. McClain DA,Hug CC Jr. Intravenous fentanyl kinetics. Clin Pharmacol Ther1980;28:106-14.
21. PortenoyRK, Southam MA, Gupta SK, Lapin J, Layman M, Inturrisi CE, et al.Transdermal fentanyl for cancer pain. Repeated dosepharmacokinetics. Anesthesiology 1993;78:36-43.
22. Varvel JR,Shafer SL, Hwang SS, Coen PA, Stanski DR. Absorptioncharacteristics of transdermally administered fentanyl.Anesthesiology 1989;70:928-34.
23. Scott JC,Stanski DR. Decreased fentanyl and alfentanil dose requirementswith age. A simultaneous pharmacokinetic and pharmacodynamicevaluation. J Pharmacol Exp Ther 1987;240:159-66.
24.Reilly CS,Wood AJJ, Wood M. Variability of fentanyl pharmacokinetics in man.Anaesthesia 1984; 40:837-43.
25. Hanna MH,Wodding S. A study to examine the repeat dose pharmacokinetics ofTTS (fentanyl) using repeated 72-hour applications for a 6 dayperiod in patients with cancer pain or intractable pain requeringopoid therapy. Janssen Research Fundation, data of file. Trialnumber FEN-GBR-008.
26. Durcan TG,Sockalingham MH, Hanna M. Pharmacokinetic study of repeated 72 hourapplications of TTS-fentanyl. [Abs. A457]. Br J Anaesth 1995;74:S139.
27. Bell SD,Goldburg ME. Comparison of single patch multi-day versus multiplepatch single day TTS fentanyl. Can J Anaesth1989;36:S116-7.
28. Holley FO,Van-Steenis C. Postoperative analgesia with fentanyl:pharmacokinetics and pharmacodynamics of constant-rate i.v. andtransdermal delivery. Br J Anaesth 1988;60:608-13.
29. Esteve M,Levron JC, Flaisler B. Does aging modify pharmacokinetics oftransdermal fentanyl? [abstract]. Anesthesiology1991;75:A705.
30. ThompsonJP, Bower S, Rowbotham DJ. Perioperative pharmacokinetics oftransdermal fentanyl in young and elderly patients. British PainSociety Meeting: Nottingham; 1996.
31. Collins JJ,Dunkel IJ, Gupta SK, Inturrisi CE, Lapin J, Palmer LN, et al.Transdermal fentanyl in children with cancer pain: feasibility,tolerability, and pharmacokinetic correlates. J Pediatr1999;134:319-23.
32. Jeal W,Benfield P. Transdermal fentanyl. A review of its pharmacologicalproperties and therapeutic efficacy in pain control. Drugs1997;53:109-38.
33. Zech DF,Lehmann KA. Transdermal fentanyl in combination with initialintravenous dose titration by patient-controlled analgesia.Anticancer Drugs 1995;6:44-9.
34. Fudin J,Toledo-Binette C, Kupiak DM, Johnston KR, Smith HS. Quicker dosageadjustment for transdermal fentanyl. Am J Health Syst Pharm 1997;54:87-8. Published erratum appears in Am J Health Syst Pharm1997;54:1552.
35. Ahmedzai S,Brooks D. Transdermal fentanyl versus sustained-release oralmorphine in cancer pain: preference, efficacy, and quality of life.The TTS-Fentanyl Comparative Trial Group. J Pain Symptom Manage1997;13:254-61.
36. Slover R.Transdermal fentanyl: clinical trial at the University of ColoradoHealth Sciences Center. J Pain Symptom Manage1992;7:S45-7.
37. Levy MH,Rosen SM, Kedziera P. Transdermal fentanyl: seeding trial inpatients with chronic cancer pain. J Pain Symptom Manage1992;7:S48-50.
38. Herbst LH,Strause LG. Transdermal fentanyl use in hospice home-care patientswith chronic cancer pain. J Pain Symptom Manage1992;7:S54-7.
39. Maves TJ,Barcellos WA. Management of cancer pain with transdermal fentanyl:phase IV trial, University of Iowa. J Pain Symptom Manage 1992;7:S58-62.
40. Korte W,Morant R. Transdermal fentanyl in uncontrolled cancer pain:titration on a day-to-day basis as a procedure for safe andeffective dose finding - a pilot study in 20 patients. Support CareCancer 1994; 2:123-7.
41. SimmondsMA. Transdermal fentanyl: clinical development in the UnitedStates. Anticancer Drugs 1995; 6:35-8.
42. Donner B,Zenz M, Tryba M, Strumpf M. Direct conversion from oral morphine totransdermal fentanyl: a multicenter study in patients with cancerpain. Pain 1996;64:527-34.
43. Korte W, DeStoutz N, Morant R. Day-to-day titration to initiate transdermalfentanyl in patients with cancer pain: short and long-termexperiences in a prospective study of 39 patients. J Pain SymptomManage 1996;11:139-46.
44. Hammack JE,Mailliard JA, Loprinzi CL, Rospond RM, O'Fallon JR, Wilwerding MB,et al. Transdermal fentanyl in the management of cancer pain inambulatory patients: an open-label pilot study. J Pain SymptomManage 1996;12:234-40.
45.Leelanuntakit S. Management of cancer-related pain withtransdermal fentanyl. J Med Assoc Thai 1996; 79:341-6.
46. Grond S,Zech D, Lehmann KA, Radbruch L, Breitenbach H, Hertel D.Transdermal fentanyl in the long-term treatment of cancer pain: aprospective study of 50 patients with advanced cancer of thegastrointestinal tract or the head and neck region. Pain1997;69:191-8.
47. WoodroffeMA, Hays H. Fentanyl transdermal system. Pain management at home.Can Fam Physician 1997;43:268-72.
48. Wong JO,Chiu GL, Tsao CJ, Chang CL. Comparison of oral controlled-releasemorphine with transdermal fentanyl in terminal cancer pain. ActaAnaesthesiol Sin 1997;35:25-32.
49. Yeo W, LamKK, Chan AT, Leung TW, Nip SY, Johnson PJ. Transdermal fentanyl forsevere cancer-related pain. Palliat Med 1997;11:233-9.
50. Donner B,Zenz M, Strumpf M, Raber M. Long-term treatment of cancer pain withtransdermal fentanyl. J Pain Symptom Manage1998;15:168-75.
51. Payne R,Mathias SD, Pasta DJ, Wanke LA, Williams R, Mahmoud R. Quality oflife and cancer pain: satisfaction and side effects withtransdermal fentanyl versus oral morphine. J Clin Oncol 1998;16:1588-93.
52. Sloan PA,Moulin DE, Hays H. A clinical evaluation of transdermal therapeuticsystem fentanyl for the treatment of cancer pain. J Pain SymptomManage 1998;16:102-11.
53. Donner B,Zenz M. Transdermal fentanyl: a new step on the therapeutic ladder.Anticancer Drugs 1995; 6:39-43.
54. Zech DF,Grond SU, Lynch J, Dauer HG, Stollenwerk B, Lehmann KA. Transdermalfentanyl and initial dose-finding with patient-controlled analgesiain cancer pain. A pilot study with 20 terminally ill cancerpatients. Pain 1992;50:293-301.
55. SlappendelR, Lako SJ, Crul BJP. Gastrointestinal side effects diminishesafter switch over from morphine to transdermal fentanyl [abstractno. P1004]. Ann Oncol 1994;5:S200.
56. Southam MA.Transdermal fentanyl therapy: system design, pharmacokinetics andefficacy. Anticancer Drugs 1995;6:S29-34.
57. Lehmann KA,Einnolf C, Eberlein HJ, Nagel R. Transdermal fentanyl for thetreatment of pain after major urological operations. A randomizeddouble-blind comparison with placebo using intravenouspatient-controlled analgesia. Eur J Clin Pharmacol1991;41:17-21.
58. Caplan RA,Ready LB, Oden RV, Matsen FA, Nessly ML, Olsson GL. Transdermalfentanyl for postoperative pain management. A double-blind placebostudy. JAMA 1989;261:1036-9.
59. VanBastelaere M, Rolly G, Abdullah NM. Postoperative analgesia andplasma levels after transdermal fentanyl for orthopedic surgery:double-blind comparison with placebo. J Clin Anesth1995;7:26-30.
60. Miser AW,Narang PK, Dothage JA, Young RC, Sindelar W, Miser JS. Transdermalfentanyl for pain control in patients with cancer. Pain1989;37:15-21.
61. MarquardtKA, Tharratt RS. Inhalation abuse of fentanyl patch. J Toxicol ClinToxicol 1994;32:75-8.
62. FlannaganLM, Butts JD, Anderson WH. Fentanyl patches left on dead bodies,potential source of drug for abusers. J Forensic Sci1996;41:320-1.
63. EdinboroLE, Poklis A, Trautman D, Lowry S, Backer R, Harvey CM. Fatalfentanyl intoxication following excessive transdermal application.J Forensic Sci 1997;42:741-3.
64. Hardwick WEJr, King WD, Palmisano PA. Respiratory depression in a childunintentionally exposed to transdermal fentanyl patch. South Med J1997; 90:962-4.
65.Klockgether-Radke A, Hildebrandt J. Opioid intoxication.Inappropriate administration of transdermal fentanyl. Anaesthesist1997;46:428-9.
66. Kramer C,Tawney M. A fatal overdose of transdermally administered fentanyl.J Am Osteopath Assoc 1998;98:385-6.
67. Yerasi AB,Butts JD. Disposal of used fentanyl patches. Am J Health Syst Pharm1997;54:85-6.
68. Newshan G.Heat-related toxicity with the fentanyl transdermal patch. J PainSymptom Manage 1998; 16:277-8.
69. Farrar JT,Cleary J, Rauck R, Busch M, Nordbrock E. Oral transmucosal fentanylcitrate: randomized, double-blinded, placebo-controlled trial fortreatment of breakthrough pain in cancer patients. J Natl CancerInst 1998;90:611-6.
70. Christie JM,Simmonds M, Patt R, Coluzzi P, Busch MA, Nordbrock E, et al. Dosetitration, multicenter study of oral transmucosal fentanyl citratefor the treatment of breakthrough pain in cancer patientsusing transdermal fentanyl for persistent pain. J Clin Oncol1998;16:3238-45.