ORIGINALES
TERAPIA ANTIRRETROVIRAL: DETECCIÓN DE REACCIONES ADVERSAS MEDICAMENTOSAS A PARTIR DEL DIAGNÓSTICO DE INGRESO HOSPITALARIO
Fobelo Lozano, M. J., Licenciada en Farmacia, FIR II;Gómez Bellver, M. J.,Doctora en Farmacia, Especialista en Farmacia Hospitalaria, Farmacéutica Adjunta;Miguel del Corral, M.,Licenciada en Farmacia, Especialista en Farmacia Hospitalaria, Jefe de Servicio.
Servicio de Farmacia. Hospital Universitario de Valme. Sevilla.
Correspondencia: M.a José Fobelo Lozano. Servicio de Farmacia. Hospital Universitario de Valme. Ctra. Sevilla-Cádiz, s/n. 41014 Sevilla.
Parte de este estudio fue presentado como comunicación oral en el XXLIII Congreso de la Sociedad Española de Farmacia Hospitalaria celebrado en Granada. Octubre de 1998.
Fecha de recepción: 11-5-99
Palabras clave:
Síndrome de inmunodeficiencia adquirida (SIDA). VIH. Antirretroviral. Reacción adversa. Ingreso hospitalario.
Resumen:
Debido a la reciente y continua incorporación de fármacos antirretrovirales al arsenal terapéutico utilizado en el tratamiento de pacientes VIH+ es conveniente desarrollar sistemas de farmacovigilancia para conocer con precisión el perfil de seguridad de estos medicamentos.
Objetivo. La detección y el seguimiento de las reacciones adversas a fármacos antirretrovirales que obligan al ingreso hospitalario del paciente.
Método. Identificación de los pacientes VIH+ en tratamiento antirretroviral a lo largo de 1997 y 1998, cuyo motivo de ingreso ha sido la aparición de un posible efecto adverso a este tipo de fármacos mediante revisión de las historias clínicas.
La relación de causalidad reacción adversa-fármaco se determina aplicando el algoritmo de Naranjo.
Resultados. Se han detectado un total de 15 reacciones adversas producidas por seis fármacos antirretrovirales diferentes. Hepatitis tóxica ha sido la reacción adversa más frecuente. Indinavir es el fármaco que ha producido un mayor número de reacciones adversas.
ANTIRETROVIRAL THERAPY: DETECTION OF ADVERSE DRUG REACTIONS FROM HOSPITAL ADMISSION DIAGNOSES
Key words:
Acquired immunodeficiency syndrome (AIDS). HIV. Antiretroviral. Adverse reaction. Hospitalization.
Summary:
Due to the continuous incorporation of antiretroviral medications into the therapeutic arsenal for the treatment of HIV+ patients, drug surveillance systems should be developed in order to know the precise safety profile of these medications.
Objective. The detection and follow-up of adverse reactions of antiretroviral drugs that require patient hospitalization.
Method. Identification of HIV+ patients on antiretroviral treatment throughout 1997 and 1998 hospitalized for a possible adverse reaction to this type of medication using medical records.
The causal relation between the adverse reaction and drug was determined using the Naranjo algorithm.
Results. A total of 15 adverse reactions produced by different antiretroviral drugs were detected. Toxic hepatitis was the most frequent adverse reaction. Indinavir produced the largest number of adverse reactions.
INTRODUCCIÓN
De acuerdo con las recomendaciones del Consejo Asesor Clínico (CAC) del Plan Nacional sobre el SIDA (1), el tratamiento de infección por el virus de la inmunodeficiencia humana (VIH) ha ido evolucionando hacia la utilización de asociaciones de tres o más fármacos que han supuesto mejores resultados clínicos, virológicos e inmunológicos, con una disminución en la morbi y mortalidad de los pacientes VIH+ y mejora de su calidad de vida (2-5).
En el manejo de estas combinaciones la aparición de reacciones adversas medicamentosas (RAMs) e interacciones es un aspecto importante a tener en cuenta ya que pueden originar una disminución en la eficacia del tratamiento. Estos inconvenientes afectan principalmente a la calidad de vida del paciente, pudiendo favorecer el incumplimiento terapéutico y la inducción de resistencias víricas a los diferentes fármacos (6-9).
El hecho de que estos medicamentos sean de utilización reciente hace conveniente el establecimiento de programas de farmacovigilancia que permitan conocer exactamente los resultados de toxicidad a largo plazo y de esta forma intentar optimizar su manejo terapéutico (10).
El objetivo del presente trabajo ha sido realizar la identificación, valoración y seguimiento de aquellas reacciones adverdas a fármacos AR, según la clasificación de la OMS (11), y que suponen el ingreso hospitalario del paciente.
MÉTODO
Los pacientes del estudio pertenecen al área sanitaria del Hospital Universitario de Valme y son todos aquellos VIH+ en tratamiento con fármacos AR.
La identificación de las posibles RAMs producidas por fármacos AR que causaron ingreso hospitalario y su posterior evaluación se ha realizado de forma retrospectiva a lo largo de veinticuatro meses (de 1 de enero de 1997 a 31 de diciembre de 1998).
El número de historia clínica de todos los pacientes cuyo motivo de ingreso hospitalario estuvo relacionado con una posible RAM a fármacos antivirales se ha obtenido a partir del sistema de codificación al alta (código de clasificación ICD-9-CM correspondiente al capítulo de reacciones adversas: E 931).
Con el fin de unificar la información se ha elaborado una hoja de recogida que incluía datos demográficos, clínicos y farmacológicos del paciente necesarios para la valoración de la posible RAM.
Posteriormente se han revisado todas las historias clínicas cuya codificación al alta coincide con RAM a fármacos antivirales, descartando aquellas en las que el medicamento responsable no fue un antirretroviral, sino otro agente antivirásico.
Para valorar la RAM y establecer la causalidad entre el posible fármaco responsable y la reacción detectado hemos aplicado el algoritmo de Naranjo (12).
RESULTADOS
Durante los años 1997 y 1998 se han contabilizado un total de 598 pacientes que han estado en algún momento en tratamiento extrahospitalario con fármacos AR: 388 hombres (64,9%) y 210 mujeres (35,1%).
Las RAMs detectadas a fármacos antirretrovirales han supuesto un total de 12 ingresos hospitalarios y correspondieron a nueve hombres y tres mujeres con edades comprendidas entre treinta y cincuenta y nueve años.
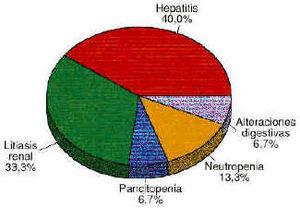
La figura 1 recoge las RAMs causantes de dichos ingresos: dos casos de neutropenia, seis de hepatitis tóxica, cinco de litiasis renal, un caso de pancitopenia y un caso de alteraciones digestivas importantes.
Figura 1.--Porcentaje de RAMs causa de ingreso hospitalario para cada fármaco antirretroviral.
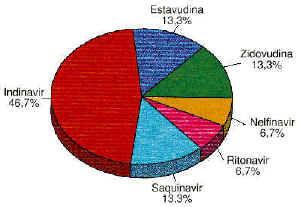
De los fármacos AR comercializados en nuestro país, seis de ellos han estado relacionados con las RAMs detectadas en este estudio. En la figura 2 se expresa el porcentaje de participación de los diferentes fármacos implicados.
Figura 2.--Porcentaje de RAMs detectadas.
La tabla 1 contiene información sobre el perfil farmacoterapéutico y clínico de los pacientes.
| Tabla 1. Reacciones adversas a fármacos antirretrovirales causa de ingreso hospitalario | |||||
| Edad/ sexo | Estadio VIH | Tratamiento AR; dosis (duración) | RAM | Fármaco implicado | Estancia hospitalaria (días) |
| 47/V | C3 | Crixivan®; 800 mg/8 h (188 días). Zerit 40®; 40 mg/12 h (188 días). | Neutropenia. | Estavudina (Zerit®) | 24 |
| 37/V | C3 | Videx 100®; 200 mg/12 h (3 días). Zidovudina®; 250 mg/12 h (18 días). | Neutropenia. Intolerancia digestiva. | Zidovudina Didanosina (Videx®) | 30 |
| 31/M | C3 | Epivir®; 150 mg/12 h (82 días). Invirase®; 600 mg/8 h (82 días). Zerit 30®; 30 mg/12 h (82 días). | Hepatitis tóxica. | Saquinavir (Invirase®) | 11 |
| 34/V | C3 | Crixivan 400®; 800 mg/8 h (220 días). Hivid®; 0,75 mg/8 h (264 días). Zidovudina®; 250 mg/12 h (264 días). | Hepatitis tóxica. Litiasis renal (hidronefrosis). | Indinavir (Crixivan®) | 9 |
| 36/V | C3 | Epivir®; 150 mg/12 h (30 días). Zerit 30®; 30 mg/12 h (30 días). | Hepatitis tóxica. | Estavudina (Zerit®) | 9 |
| 33/V | B2 | Crixivan 400®; 800 mg/8 h (202 días). Epivir®; 150 mg/12 h (202 días). Zerit 40®; 40 mg/12 h (202 días). | Litiasis renal. | Indinavir (Crixivan®) | 1 |
| 39/V | B2 | Crixivan 400®; 800 mg/8 h (53 días). Epivir®; 150 mg/12 h (165 días). Zidovudina®; 250 mg/12 h (165 días). | Litiasis renal (microhematuria). Pancitopenia. | Indinavir (Crixivan®) Zodivudina | 10 |
| 30/V | B3 | Crixivan®; 800 mg/8 h (266 días). Zerit 40®; 40 mg/12 h (845 días). Epivir®; 150 mg/12 h (845 días). | Litiasis renal (oligoanuria). | Indinavir (Crixivan®) | 8 |
| 59/V | C3 | Crixivan®; 800 mg/8 h (15 días). Zidovudina®; 250 mg/12 h (409 días). Epivir®; 150 mg/12 h (409 días). | Hepatitis tóxica. Litiasis renal (polaquiuria, nicturia). | Indinavir (Crixivan®) | 19 |
| 38/M | B3 | Viracept®; 250 mg/8 h (28 días). Zerit 40®; 40 mg/12 h (831 días). Epivir®; 150 mg/12 h (831 días). | Hepatitis tóxica. | Nelfinavir (Viracept®) | 8 |
| 37/M | B3 | Invirase®; 600 mg/8 h (761 días). Zerit 40®; 40 mg/12 h (761 días). Epivir®; 150 mg/12 h (761 días). | Hepatitis tóxica. | Saquinavir (Invirase®) | 20 |
| 33/V | C3 | Norvir®; 600 mg/12 h (11 días). Epivir®; 150 mg/12 h (13 días). Zerit 40®; 40 mg/12 h (13 días). | Alteraciones GI (hiperemesis, deposiciones diarreicas líquidas). | Ritonavir (Norvir®) | 52 |
A partir de estos datos la aplicación del algoritmo de Naranjo estableció la imputabilidad de:
-- «Probable», para trece de las RAMs a los fármacos correspondientes.
-- «Posible», para las dos RAMs restantes (paciente con alteración renal previa que sufre litiasis por indinavir y paciente con hiperemesis y diarrea relacionada con ritonavir; también se sospecha que puede presentar una gastroenteritis por Salmonella spp., aunque no queda confirmado).
La resolución de la RAM supuso la recuperación favorable de todos los pacientes. En todos los casos se retiró el medicamento implicado durante el ingreso del paciente. Tras su recuperación, el fármaco fue sustitudio por otro agente AR en nueve de los casos. No se sustituyó ni se reintrodujo otro fármaco en cinco casos. En el caso que resta, el fármaco responsable de la RAM volvió a introducirse en el tratamiento AR del paciente.
En la tabla 1 también se indican los días de estancia hospitalaria para cada uno de los ingresos, con una suma total de doscientos un días. Esta estancia hospitalaria constituye un 8% del total de ingresos hospitalarios producidos por los pacientes VIH+ en tratamiento con fármacos AR durante el período de estudio.
La revisión de las historias clínicas también ha permitido la detección de otros efectos no deseables que aun siendo menos graves o derivados de la RAM principal hay que tenerlos en cuenta ya que disminuyen el estado y calidad de vida del paciente y podrían ser causa de incumplimiento terapéutico; tal es el caso de intoleran-
cia digestiva relacionada con didanosina, microhematuria, hidronefrosis, nicturia, oligoanuria y poliaquiuria desarrolladas en casos de administración de indinavir.
En la tabla 2 se especifica la incidencia de reaciones adversas causa de ingreso hospitalario para cada uno de los fármacos implicados.
Tabla 2. Incidencia de RAMs causa de ingreso hospitalario en fármacos antirretrovirales | ||||
| Total de pacientesen tratamiento | Indicencia | |||
| 1997 | 1998 | 1997 | 1998 | |
| Zidovudina | 223 | 176 | 1:116 | 0 |
| Estavudina | 141 | 202 | 1:70 | 0 |
| Indinavir | 79 | 185 | 1:26 | 1:92 |
| Saquinavir | 105 | 202 | 1:105 | 1:202 |
| Ritonavir | 17 | 27 | 0 | 1:27 |
| Nelfinavir | 0 | 54 | 0 | 1:54 |
DISCUSION
La detección, seguimiento y comunicación de reacciones adversas medicamentosas es una función necesaria y obligatoria tras la comercialización de un nuevo medicamento. En la actualidad se conoce el beneficio clínico que están produciendo las nuevas terapias combinadas con fármacos AR en pacientes VIH+; sin embargo, para establecer la relación beneficio/riesgo es necesario preguntar cuáles pueden ser los problemas derivados de la administración conjunta de este tipo de fármacos. Según Moore et al (13) las reacciones adversas a los inhibidores de la transcriptasa inversa análogos de nucleósidos ocurren de forma frecuente, y aunque se obtengan respuestas clínicas favorables obligan a la retirada del fármaco implicado.
Durante nuestro estudio el 2% de los pacientes VIH+ en tratamiento AR han presentado RAMs lo suficientemente importantes como para originar su ingreso hospitalario. Las RAMs detectadas se han desglosado de acuerdo con el grupo AR al que pertenece el fármaco sospechoso.
Análogos de nucleósidos
Las reacciones adversas causa de ingreso hospitalario detectadas a zidovudina (AZT) han sido dos: neutropenia y pancitopenia. Desde su comercialización este fármaco ha producido alteraciones hematológicas tales como granulocitopenia, anemia, trombocitopenia, aumento del volumen corpuscular medio y pancitopenia. La incidencia de estos efectos es variable y depende del estadio de la infección VIH (en nuestro caso los dos pacientes implicados en RAMs relacionadas con zidovudina se encontraban en estadio C3 y B2 de la infección). Tras la supresión del fármaco las reacciones suelen ser reversibles, aunque en algunos casos se necesitan medidas correctoras (14-22).
Las RAMs detectadas a estavudina han sido neutropenia y hepatotoxicidad.
Las alteraciones a nivel hematológico para este fármaco no están claramente definidas como ocurre en el caso del AZT. Según Skowron (23) no se ha descrito una relación dosis dependiente entre estavudina y sus efectos tóxicos hematológicos. Otros autores no incluyen este tipo de reacciones adversas en el perfil tóxico de dicho fármaco (20, 21, 24-26). Por otra parte parece ser que la aparición de anemia es un efecto más frecuente que la neutropenia y trombocitopenia (27). En el caso identificado el paciente presentaba en el momento del ingreso un nivel de neutrófilos del 5,7%, aumentando de forma progresiva hasta un 46,4% al alta hospitalaria; una vez que se produjo la recuperación del paciente, estavudina fue incluida de nuevo en el tratamiento AR.
La hepatotoxidad relacionada con estavudina está descrita como una elevación de los nieles séricos de las transaminasas e incluso como la aparición de colelitiasis, ictericia y acidosis láctica, preferentemente en pacientes con factores predisponentes (21, 23-25, 27, 28). En el caso detectado la sintomatología desarrollada fue de este tipo y como antecedentes personales del enfermo se identificó alcoholismo crónico.
De todas las RAMs identificadas en este estudio, los casos debidos a neutropenia (desarrollados tras la administración de zidovudina y estavudina) presentaron las estancias hospitalarias más prolongadas, probablemente por el mayor riesgo de complicaciones consecuencia de la inmunosupresión severa de los pacientes.
El mecanismo responsable, mayoritariamente, de los efectos adversos a nivel hematológico de AZT y estavudina parece ser la acción directa del fármaco sobre las células madre de la médula ósea y el posible déficit vitamínico del paciente, produciéndose a nivel celular una disminución de la actividad energética mitocondrial (16, 25).
Inhibidores de la proteasa
En nuestro estudio, indinavir es el fármaco AR con una incidencia de reacciones adversas más elevada, principalmente a nivel renal. Desde el inicio de su utilización en la terapéutica se han descrito casos de nefrolitiasis con o sin hematuria en un 4-5% de los pacientes tratados con dicho fármaco (24, 29-32). La aparición de cálculos renales se debe a que la solubilidad de indinavir es pH dependiente (28). Así, cuando el pH urinario se alcaliniza (pH = 6), indinavir se hace menos soluble y forma cristales. Relacionado con esta reacción adversa, y aunque no hayan supuesto ingreso del paciente, se han detectado mediante notificación directa y de forma continua a lo largo de estos dos años la aparición de cólicos nefríticos relacionados con indinavir que han supuesto la retirada del fármaco y su sustitución por otro inhibidor de la proteasa (generalmente nelfinavir). Este sistema de farmacovigilancia se ha desarrollado mediante comunicación interna entre el hospital de día de infecciosos y el servicio de farmacia.
Además, indinavir ha producido hepatotoxicidad en dos casos que se han manifestado en forma de colelitiasis y citolisis. Esta sintomatología está descrita en menos de un 2% de los pacientes en tratamiento con dicho fármaco. Aunque la alteración de los niveles plasmáticos de enzimas hepáticas y el aumento de bilirrubina plasmática sí es algo más frecuente (10-15%), se necesitan más datos que determinen con mayor exactitud la incidencia y severidad de este tipo de efecto adverso (32).
En cuanto a saquinavir, se han producido dos ingresos hospitalarios de colestasis, coluria, ictericia, prurito e hiperbilirrubinemia. La hepatotoxicidad registrada para este fármaco está recogida en la literatura científica en forma de ictericia, elevación de enzimas hepáticas, hepatomegalia y hepatoesplenomegalia (33).
Los efectos adversos gastrointestinales más frecuentes en el perfil tóxico de ritonavir son náuseas, vómitos, diarrea, dolor abdominal, constipación, dispepsia, flatulencia, etc., en un porcentaje que oscila entre el
2-26%. Para disminuir la aparición de estos desórdenes es recomendable aumentar de forma progresiva y diaria la dosis de ritonavir hasta alcanzar el valor deseado. La retirada del fármaco debida a estos efectos gastrointestinales se ha producido en algunas ocasiones, pero en general no se consideran reacciones de carácter grave (34). El caso detectado en nuestro estudio representa un ejemplo de la disminución de la calidad de vida del paciente relacionado con la administración de fármacos AR, que en esta ocasión obligó a su ingreso hospitalario por la aparición de vómitos incoercibles y persistentes, así como deposiciones diarreicas líquidas.
El último fármaco inhibidor de la proteasa del VIH aprobado en nuestro país ha sido nelfinavir. Se ha detectado una hepatitis colestásica en un paciente que estuvo en tratamiento con este fármaco durante un mes. Dicho paciente había desarrollado previamente una hepatitis que se relacionó con saquinavir y en el momento de su ingreso hospitalario presentaba como antecedentes personales hepatitis crónica por el virus tipo C. Por ello se puede indicar que dicho fármaco ha agravado el estado en el que se encontraba previamente el paciente.
Tras una búsqueda exhaustiva en la literatura científica hasta marzo del presente año no se ha encontrado ningún caso de hepatotoxicidad relacionada con nelfinavir (21, 31, 35, 36). Sin embargo, existen estudios (37, 38) en los que se ha descrito hepatotoxidad como reacción adversa frecuenta relacionado con la utilización de terapias con alta eficacia (HAART), sobre todo en aquellos pacientes VIH+ coinfectados con el virus de hepatitis C, lo cual podría explicar la aparición de esta RAM a nelfinavir.
Según la bibliografía, los efectos adversos más frecuentes descritos para este fármaco han sido: diarrea (>= 32%), náuseas, dolor de cabeza y fatiga (10-20%), falta de concentración, exantema (10%), astenia (¾ 5%), alteraciones de la coagulación, hiperlipemia, hiperglucemia y distribución anormal de la grasa corporal como ocurre con otros inhibidores de la proteasa. Aproximadamente un 5% de los pacientes en tratamiento con nelfinavir tienen que suspenderlo por la aparición de alguno de estos efectos (35).
Como era de esperar, de acuerdo a la bibliografía disponible hasta el momento, indinavir ha sido el fármaco AR que ha producido un mayor número de ingresos hospitalarios en los años 1997-1998. El conocimiento de la incidencia de esta RAM, así como de los factores que potencian la aparición de la misma y el mecanismo que la produce, facilita la toma de medidas adecuadas orientadas a la disminución de la aparición de dicho efecto adverso.
Dada la complejidad de la terapia farmacológica utilizada en los pacientes VIH+ es conveniente establecer programas de farmacovigilancia que faciliten el conocimiento de los efectos adversos relacionados con dichos tratamientos, así como de aquellos factores que de algún modo potencian su aparición. De esta forma se facilita la disminución de la aparición de reacciones adversas previsibles, con la consiguiente mejora de la calidad de vida del paciente y del manejo terapéutico de estos medicamentos.
BIBLIOGRAFIA
1.Tratamiento antirretroviral, 4.a ed. Madrid: Recomendaciones del Consejo Asesor Clínico del Plan Nacional sobre el SIDA; 1997.
2.Stover J, Way P. Projecting the impact of AIDS on mortality. AIDS 1998;12(suppl 1):S29-39.
3.Palella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA, et al. Declining morbidity and mortality among patients with advanced human inmunodeficiency virus infection. N Engl J Med 1998;338:853-60.
4.Lipsky JJ. Antiretroviral drug for AIDS. Lancet 1996; 348:800-3,
5.Carpenter CC, Fisch MA, Hammer SM, Hirsch MS, Jacobsen DM, Katzenstein DA, et al. Antiretroviral therapy for HIV infection in 1997. Updated recommendations of the International AIDS Society-USA panel. JAMA 1997;277:1962-9.
6.Wainberg MA, Friedland G. Public Health Implications of Antiretroviral Therapy and HIV Drug Resistance. JAMA 1998;279:1977-83.
7.Hirsch MS, Conway B, D''Aquila RT, Johnson VA, Brun Vezinet F, Clotet B, et al. Antiretroviral drug resistance testing in adults with HIV infection: implications for clinical management. International AIDS Society-USA Panel. JAMA 1998;279:1984-91.
8.Guidelines for theuse of Antiretroviral Agents in HIV-Infected Adults and Adolescents. Bethesda: Department of Health and Human Services; 1997.
9. Fätkenheuer G, Theisen A, Rockstroh J, Grabow T, Wicke C, Becker K, et al. Virological treatment failure of protease inhibitor therapy in an unselected cohort of HIV-infected patients. AIDS 1997;11: F113-6.
10.Moreno A. Necesidad de los estudios de farmacovigilancia. Indufarma 1995;18:25-30.
11. Laporte JR, Tognomi G. Principios de epidemiología del medicamento, 2.a ed. Barcelona: Masson-Salvat Medicina; 1993.
12.Naranjo CA, Busto U. A method for estimating the probability of adverse reactions. Clin Pharmacol Ther 1981;30:239-45.
13.Moore RD, Fortgang I, Keruly J, Chaisson RE. Adverse events from drug therapy for human immunodeficiency virus disease. Am J Med 1996;101:34-40.
14.Richman DD. The toxicity of azidothymidine (AZT) in the treatment of patients with AIDS and AIDS-related complex. A double-blind, placebo-controlled trial. N Engl J Med 1987;317:192-7.
15.Langtry HD, Campoli-Richards DM. Zidovudine. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy. Drugs 1989; 37:408-50.
16.Israel DS, Plaisance KI. Neutropenia in patients infected with human immunodeficiency virus. Clin Pharm 1991;10:268-79.
17.Valencia E. Azidothymidine in the treatment of patients with human immunodeficiency virus infection and persistent generalized adenopaties. Ann Intern Med 1992;9:531-7.
18. Biedma D, et al. Clinical experience with zidovudine in patients with acquired immunodeficiency syndrome. Analysis of 117 cases. Grupo Andaluz para el Estudio de las Enfermedades Infecciosas. Rev Clín Esp 1992;191:187-92.
19.Rachlis A, Fanning MM. Zidovudine toxicity: clinical features and management. Drug Saf 1993;8:312-20.
20.Reynolds JEF, Parfitt K, Parsons AV, Sweetman SC, eds. Martinale The Extra Pharmacopoeia, 31.a ed. London: Royal Pharmaceutical Society; 1996.
21. Medicamentos para la infección por el virus de la inmunodeficiencia humana. Med Lett Drugs Ther (ed. esp.) 1998;20:5-10.
22.Drugdex® Editoriral Staff. Drugdex® Information System. Micromedex Inc. Denver, Colorado (Vol. 98, 1998). Drug Evaluation Monograph of zidovudine.
23.Skowron G. Biologic effects and safety of stavudine. Overview of phase I and II clinical trials. J Infect Dis 1995;17(suppl II):S113-7.
24.Drugdex® Editorial Staff. Drugdex® Information System. Micromedex Inc. Denver Colorado (Vol. 98, 1998). Clinical reviews of AIDS.
25.Brinkman K, ter Hofstede HJM, Burger DM, Smeitink JAM, Koopmans PP. Adverse effects of reverse transcriptase inhibitors: mitochondrial toxicity as common pathway. AIDS 1988;12:1735-44.
26.Kimberly A, Struble, Pratt D, Gitterman SR. Toxicity of antiretroviral agents. Am J Med 1997;102:65-7.
27.Drugdex® Editorial Staff. Drugdex® Information System. Micromedex Inc. Denver, Colorado (Vol. 98, 1998). Drug Evaluation Monograph of Estavudine.
28. Salinas C, Arias MJ, Fernández D. Efectos adversos de los antirretrovirales. Farm Clin 1996;13:328-36.
29.Deeks SG, Smith M, Holodniy M, O''Kahn J. HIV-1 protease inhibitors. A review for clinicians. JAMA 1997;277:145-53.
30.Karen T, Jeffrey D, Seymour R. Indinavir nephropathy. N Engl J Med 1997;336:138-9.
31.Kakuda T, Struble K, Piscitelli S. Protease inhibitors for the treatment of human immunodeficiency virus infection. Am J Health Syst Pharm 1998;55:233-54.
32.Drugdex® Editorial Staff. Drugdex® Information System. Micromedex Inc. Denver, Colorado (Vol. 98, 1998). Drug Evaluation Monograph of Indinavir.
33.Drugdex® Editorial Staff. Drugdex® Information System. Micromedex Inc. Denver, Colorado (Vol. 98, 1998). Drug Evaluation Monograph of Saquinavir.
34.Drugdex® Editorial Staff. Drugdex® Information System. Micromedex Inc. Denver, Colorado (Vol. 98, 1998). Drug Evaluation Monograph of Ritonavir.
35.Drugdex® Editorial Staff. Drugdex® Information System. Micromedex Inc. Denver, Colorado (Vol. 98, 1998). Drug Evaluation Monograph of Nelfinavir.
36.Jarvis B, Faulds D. Nelfinavir. A review of its therapeutic efficacy in HIV infection. Drugs 1998;56:147-67.
37. Rodríguez Rosado R, García Samaniego J, Soriano V. Hepatotoxicity after introduction of active antiretroviral therapy. AIDS 1998;12:1256.
38. Karras A, Rabian C, Zylberberg H, Hermine O, Duchatelle V, Durand F, et al. Severe anoxic hepatic necrosis in an HIV-1 hepatitis C virus-co-infected patient starting antiretroviral triple combination therapy. AIDS 1998;12:827-9.