describir la efectividad y seguridad de las indicaciones off-label de olaparib en pacientes con genes de recombinación homóloga alterados y tumores sólidos diferentes a los autorizados.
Métodose trata de un estudio unicéntrico, observacional y retrospectivo que incluye a pacientes tratados con olaparib para uso off-label. Las principales variables fueron las características de los pacientes, las terapias previas, la respuesta al tratamiento, la supervivencia libre de progresión, la supervivencia global y los efectos adversos.
Resultadosse incluyeron un total de 6 pacientes. Todos los pacientes tenían metástasis y recibieron 3 o más líneas de tratamiento previo. Las localizaciones tumorales primarias y las mutaciones fueron colangiocarcinoma intrahepático mutado en partner and localizer of BRCA2 (PALB2), adenocarcinoma pulmonar de células no pequeñas mutado en ataxia telangiectasia (ATM), cáncer colorrectal con mutación somática en el breast cancer protein 2 (sBRCA2), tumor neuroendocrino de mama con mutación germinal en BRCA2 (gBRCA2), ampuloma con mutación gBRCA2 y tumor neuroendocrino pancreático gBRCA2. Al final del estudio, un paciente seguía recibiendo olaparib y presentaba más de 25 meses de respuesta estable sostenida a la enfermedad. No se observaron nuevas toxicidades además de las incluidas en la información del producto.
Conclusionesexisten pocos estudios publicados sobre el uso de olaparib en pacientes que albergan variantes patogénicas distintas del breast cancer gene, como PALB2 y ATM, y afecciones distintas de las autorizadas, como tracto digestivo, neuroendocrino y pulmón. Se necesitan más investigaciones para evaluar la eficacia de olaparib en estos pacientes.
To describe the effectiveness and safety of olaparib off-label indications in patients with impaired homologous recombination genes and solid tumors different than those authorized.
MethodsA single-center, observational and retrospective study including patients treated with olaparib for off-label use. The main variables were patient characteristics, prior therapies, response to therapy, progression-free survival, overall survival and adverse events.
ResultsA total of 6 patients were included. All patients had metastases and received 3 or more lines of prior treatment. The primary tumor locations and mutations were partner and localizer of BRCA2 (PALB2) intrahepatic cholangiocarcinoma, ataxia telangiectasia mutated (ATM) non-small cell lung adenocarcinoma, somatic breast cancer gene (sBRCA2) colorectal cancer, germinal breast cancer gene 2 (gBRCA2) breast neuroendocrine tumor, gBRCA2 ampullary cancer and gBRCA2 pancreatic neuroendocrine tumor. At the end of the study, one patient was still receiving olaparib showing more than 25 months of sustained stable disease response. No novel toxicities were observed besides those included in the product information.
ConclusionsThere is limited published evidence on the use of olaparib in patients harboring pathogenic variants other than breast cancer genes, like PALB2 and ATM and conditions different than those authorized such as digestive tract, neuroendocrine and lung tumors. Further research is to assess the efficacy of olaparib in these patients.
La recombinación homóloga (HR, por sus siglas en inglés) es uno de los mecanismos de reparación de daños en el ácido desoxirribonucleico (ADN), responsable específicamente de reparar roturas en la doble hélice. Dicho proceso está regulado por una serie de genes, siendo los más conocidos el gen del cáncer de mama 1 (BRCA1) y el gen del cáncer de mama 2 (BRCA2). No obstante, existen otros genes implicados en la HR, tales como el gen mutado en la ataxia telangiectasia (ATM); el gen productor de la proteína asociada a BRCA2 (PALB2); el gen de anemia de Fanconi del grupo de complementación A (FANCA); la histona desacetilasa 2 (HDAC2), y la cinasa de punto de control 2 (CHEK2). Cuando estos genes relacionados con la HR (HRRg, por sus siglas en inglés) están dañados, se pueden detectar y emplear como predictores de respuesta a algunos tipos de terapias, como aquellas basadas en agentes de reticulación del ADN, como el cisplatino o el carboplatino, que pueden eliminar las células tumorales dañando su ADN e impidiendo su división. Además, cuando la HR está dañada, la enzima poli-adenosín difosfato (ADP)-ribosa-polimerasa (PARP) actúa como mecanismo de reparación alternativo. De este modo, cuando la PARP es inhibida in vitro, se induce la apoptosis celular de manera condicionada a la presencia de alguna deficiencia en los HRRg1. Olaparib es el primer inhibidor de PARP (PARPi) aprobado, y actualmente está indicado para el cáncer de ovario con mutación somática (s) o germinal (g) en BRCA1/2, así como para el cáncer de mama con mutación gBRCA1/2; el cáncer de páncreas con mutación gBRCA1/2; el cáncer de próstata con mutación somática o germinal en BRCA1/2; y el cáncer de endometrio con reparación de desajustes (mismatch repair) competente2. Cabe mencionar que se han investigado otras indicaciones no autorizadas en diferentes localizaciones, en un ensayo clínico tipo basket3. Otro estudio analizó el uso innovador de olaparib en mutaciones en genes relacionados con la HR diferentes al BRCA, como el gen PALB2 o ATM4. El objetivo del presente estudio es describir la eficacia y seguridad del uso de olaparib fuera de indicación.
MétodosSe realizó un estudio unicéntrico, observacional y retrospectivo. Los criterios de inclusión fueron haber recibido olaparib fuera de indicación para tumores que no fueran de ovario, mama, próstata o páncreas. Se excluyó a los pacientes evaluados para recibir tratamiento para el cáncer de ovario, mama, próstata o páncreas que hubieran recibido terapia previa con PARPi en el contexto de un ensayo clínico. Asimismo, se excluyó a los pacientes pediátricos. En nuestro centro, el proceso de toma de decisiones sobre la administración de tratamientos fuera de indicación se inicia previa solicitud por parte del facultativo al servicio de farmacia. Así, el farmacéutico oncológico elabora un informe en el que se detalla la evidencia disponible en la literatura científica respaldando el uso de olaparib, indicando su coste económico según la duración prevista del tratamiento en cada paciente. Posteriormente, el informe es evaluado por una comisión para el uso especial de fármacos, compuesta por farmacólogos clínicos, oncólogos médicos, internistas y farmacéuticos, en representación de la dirección del hospital. El tratamiento se aprueba en función de la idoneidad de administrar olaparib fuera de indicación, teniendo en cuenta factores clínicos como el tipo de tumor, el perfil molecular y los tratamientos previos. Aun cuando el uso del fármaco esté autorizado, la comisión para el uso especial de fármacos considerará que su uso está fuera de indicación cuando este aún no ha sido aprobado por las autoridades sanitarias de Cataluña, lo cual explica el elevado número de pacientes que no cumplía los criterios de inclusión, según la base de datos del servicio de farmacia (fig. 1).
En el periodo de análisis, se incluyó a aquellos pacientes que iniciaron tratamiento con olaparib entre junio de 2019 y abril de 2022. Se recogieron datos de seguimiento hasta octubre de 2024. Se revisaron las siguientes variables: edad, sexo, localización del tumor primario, presencia de metástasis, carga mutacional del tumor (TMB), estado funcional del Eastern Cooperative Oncology Group (ECOG), historial de tratamientos, tiempo transcurrido entre la última terapia con platino y olaparib, mejor respuesta a terapia con platino, efectos secundarios y alteraciones analíticas. La TMB se calculó como el número de variantes no sinónimas detectadas y validadas por megabase, en la muestra analizada mediante secuenciación de próxima generación (NGS, por sus siglas en inglés) dirigida al panel de genes relacionados con el cáncer. Tras realizar la validación interna de nuestra prueba Ilumina®, se estableció un valor de corte de ≥ 13 Muts/Mb para indicar una TMB alta (equivalente a 10 Muts/Mb en la prueba FoundationOne CDx®). La respuesta, evaluada mediante pruebas de imagen, se determinó siguiendo los Criterios de Evaluación de Respuesta en Tumores Sólidos (RECIST v.1.1)5. La supervivencia libre de progresión (SLP) se definió como el tiempo transcurrido entre el inicio de la terapia con olaparib y la evidencia clínica y radiológica documentada de progresión de la enfermedad. La supervivencia global (SG) se definió como el tiempo transcurrido entre el inicio de la terapia con olaparib y la fecha de fallecimiento. Los eventos adversos (EA) se evaluaron conforme a los Criterios Terminológicos Comunes para Eventos Adversos (CTCAE) v5.06. Se extrajeron datos de la historia clínica electrónica (SAP®) de los pacientes, así como del programa de dispensación para pacientes ambulatorios (Silicon®). Las variables cualitativas se presentan como proporciones. El análisis estadístico se realizó empleando métodos descriptivos, debido al pequeño tamaño de la muestra y la naturaleza exploratoria del estudio.
ResultadosTras revisar las peticiones para el uso fuera de indicación de olaparib en nuestro centro, se incluyó a 5 mujeres y a un hombre. Se excluyeron 42 pacientes que no cumplían los criterios de inclusión, por presentar tumores dentro de la indicación terapéutica, como tumores de ovario, mama o páncreas, que no estaban sujetos a análisis. No se excluyó posteriormente a ninguno de los pacientes. Se administró olaparib a aquellos pacientes con evidencia de la presencia de al menos un HRRg mutado o ante la ausencia de tratamientos estándar alternativos, y tras haber recibido 3 o más líneas previas de tratamiento.
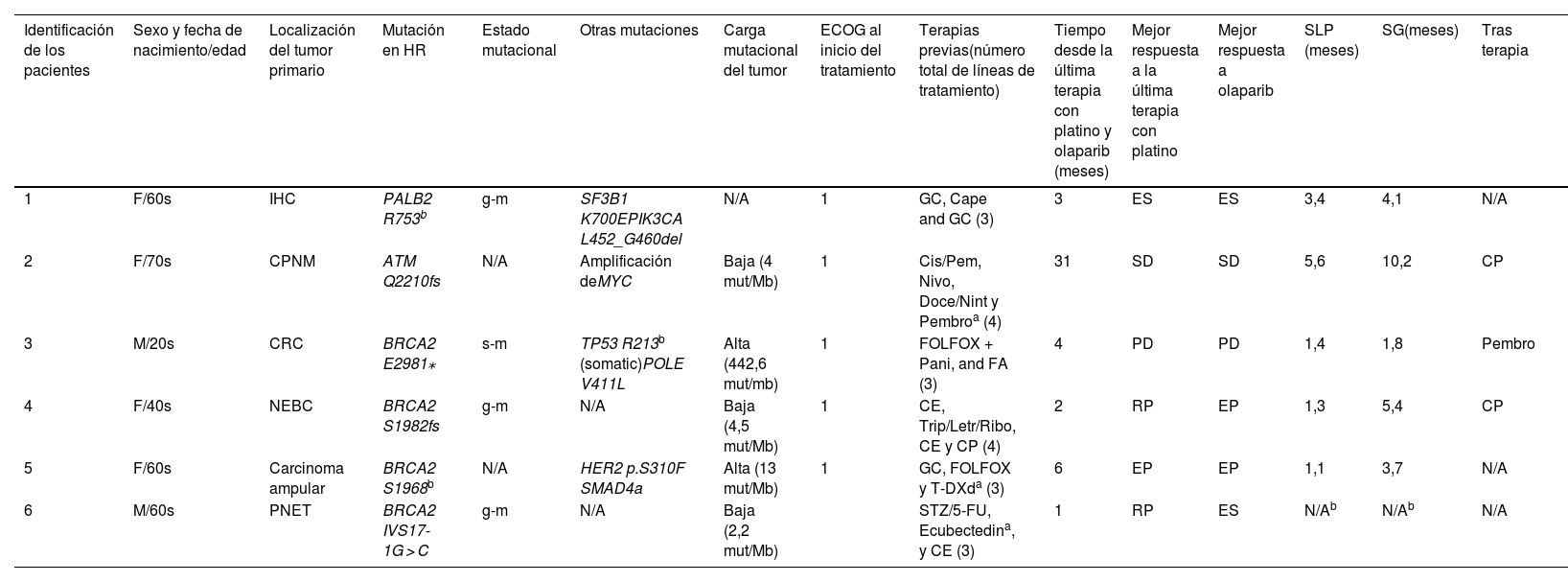
Las localizaciones y mutaciones del tumor primario fueron: colangiocarcinoma intrahepático con la variante patogénica (VP) gPALB2 (paciente 1); adenocarcinoma pulmonar no microcítico con VP ATM (paciente 2); cáncer colorrectal wild-type con el gen homólogo B1 del oncogén vírico del sarcoma murino v-Raf (BRAF) wild-type (paciente 3); tumor neuroendocrino de mama con VP gBRCA2 (paciente 4); carcinoma ampular con VP BRCA2 (paciente 5); y tumor neuroendocrino de páncreas con VP gBRCA2 (paciente 6). La mayoría de los genes HRR presentaban una mutación germinal, a excepción de un paciente, que tenía una mutación somática, y otro en el que no se determinó el tipo de mutación. Se realizó la prueba FoundationOne CDx® a 2 de los 6 pacientes, mientras que los 3 restantes fueron analizados con la prueba Ilumina®. Se observó una TMB alta en 2 de los pacientes y baja en los otros 3. No se detectó deficiencia de recombinación homóloga (HRD, por sus siglas en inglés), excepto en el paciente 3, en el que la prueba de detección de focos nucleares de la proteína RAD51 fue negativa.
La totalidad de los pacientes presentaban metástasis y habían recibido al menos 3 líneas previas de tratamiento. Anteriormente a la terapia con olaparib, 3 pacientes habían recibido tratamiento en el contexto de un ensayo clínico. En la mayoría de los pacientes, la dosis inicial de tratamiento fue un comprimido de 300 mg cada 12 h (5/6), frente a uno de los pacientes, que inició tratamiento con una cápsula de 400 mg cada 12 horas. Los pacientes mostraron la siguiente respuesta a la última línea de quimioterapia con platino: respuesta parcial (RP) 2/6; enfermedad estable (ES) 2/6; y progresión de enfermedad (PE) 2/6. Con respecto a la terapia con olaparib, la mejor respuesta global en 3 pacientes fue ES, mientras que los otros 3 desarrollaron PE. Entre los pacientes que no respondieron al tratamiento con olaparib, 2/3 (pacientes 3 y 5) habían presentado anteriormente PE tras la terapia con platino, mientras que 1/3 (paciente 4) había mostrado RP al tratamiento anterior con platino. Al corte de datos, un paciente seguía recibiendo olaparib, habiendo mantenido ES durante más de 25 meses (tabla 1).
Características de los pacientes.
| Identificación de los pacientes | Sexo y fecha de nacimiento/edad | Localización del tumor primario | Mutación en HR | Estado mutacional | Otras mutaciones | Carga mutacional del tumor | ECOG al inicio del tratamiento | Terapias previas(número total de líneas de tratamiento) | Tiempo desde la última terapia con platino y olaparib (meses) | Mejor respuesta a la última terapia con platino | Mejor respuesta a olaparib | SLP (meses) | SG(meses) | Tras terapia |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F/60s | IHC | PALB2 R753b | g-m | SF3B1 K700EPIK3CA L452_G460del | N/A | 1 | GC, Cape and GC (3) | 3 | ES | ES | 3,4 | 4,1 | N/A |
| 2 | F/70s | CPNM | ATM Q2210fs | N/A | Amplificación deMYC | Baja (4 mut/Mb) | 1 | Cis/Pem, Nivo, Doce/Nint y Pembroa (4) | 31 | SD | SD | 5,6 | 10,2 | CP |
| 3 | M/20s | CRC | BRCA2 E2981⁎ | s-m | TP53 R213b (somatic)POLE V411L | Alta (442,6 mut/mb) | 1 | FOLFOX + Pani, and FA (3) | 4 | PD | PD | 1,4 | 1,8 | Pembro |
| 4 | F/40s | NEBC | BRCA2 S1982fs | g-m | N/A | Baja (4,5 mut/Mb) | 1 | CE, Trip/Letr/Ribo, CE y CP (4) | 2 | RP | EP | 1,3 | 5,4 | CP |
| 5 | F/60s | Carcinoma ampular | BRCA2 S1968b | N/A | HER2 p.S310F SMAD4a | Alta (13 mut/Mb) | 1 | GC, FOLFOX y T-DXda (3) | 6 | EP | EP | 1,1 | 3,7 | N/A |
| 6 | M/60s | PNET | BRCA2 IVS17-1G > C | g-m | N/A | Baja (2,2 mut/Mb) | STZ/5-FU, Ecubectedina, y CE (3) | 1 | RP | ES | N/Ab | N/Ab | N/A |
ATM: ataxia telangiectasia mutada; BRCA2: proteína 2 del cáncer de mama; Cape: capecitabina; CCR: cáncer colorrectal; CE: carboplatino/etopósido; Cis/Pem: cisplatino/pemetrexed; CMNE: cáncer neuroendocrino de mama; CP: carboplatino/paclitaxel; CPNM: cáncer de pulmón no microcítico; Doce/nint: docetaxel/nintedanib; ECOG: Eastern Cooperative Oncology Group; ES: enfermedad estable; EP: enfermedad progresiva; F: femenino; FA: FOLFIRI/aflibercept; FOLFOX: fluorouracilo/folinato cálcico/oxaliplatino; GC: gemcitabina/cisplatino; g-m: con mutación en la línea germinal; HER2: receptor 2 del factor de crecimiento epidérmico humano; HR: recombinación homóloga; IHC: colangiocarcinoma intrahepático; M: masculino; MYC: oncogén de mielocitomatosis; N/A: no aplicable; NET: tumor neuroendocrino pancreático; Nivo: nivolumab; PALB2: proteína asociada a BRCA2; Pani: panitumumab; pembro: Pembrolizumab; PIK3CA: gen de la subunidad catalítica p110α de la fosfatidilinositol-3-quinasa; POLE: Subunidad catalítica épsilon de la ADN polimerasa; RP: respuesta parcial; SF3B1: subunidad 1 del factor de empalme 3b; SG: supervivencia global; SLP: supervivencia libre de progresión; s-m: con mutación somática; SMAD4a: dominio de motivo alfa estéril que contiene 4A; STZ/5-FU: estreptozocina/5-fluoruracilo; TP53: proteína tumoral p53; T-DXd: trastuzumab-deruxtecan; Trip/Letr/Ribo: triptorelina/letrozol/ribociclib.
Se comunicaron EA de cualquier grado en 4/6 pacientes, sin que ninguno alcanzara el G3 o superior. Los EA comunicados fueron: astenia G1 (2/6) y G2 (1/6); anemia G1 (1/6) y G2 (1/6), náuseas y vómitos G1 (1/6) y G2 (1/6) y mucositis G2 (1/6). Se requirió una interrupción de la dosis debido a efectos adversos y una reducción temporal de la dosis a 300 mg/12 h durante 6 días y un día de descanso por semana.
DiscusiónEn el presente estudio, analizamos los resultados clínicos de pacientes que recibieron terapia con olaparib para localizaciones y mutaciones tumorales poco comunes. La falta de respuesta a terapia previa con platino se asoció a peores resultados (pacientes 3 y 5).
Los tumores con deficiencias en HR, como mutaciones en BRCA, suelen mostrar sensibilidad tanto a terapias con platino como a PARPi, aunque las mutaciones secundarias que reparan la mutación BRCA1/2 pueden inducir resistencia a tratamiento7,8. Aun así, algunos pacientes resistentes a terapia con platino siguen respondiendo a los PARPi, lo que evidencia la complejidad de la relación entre la sensibilidad al platino y la eficacia de los PARPi9,10.
En 2015, Kauffman et al. realizaron un estudio tipo basket para evaluar el uso de olaparib en pacientes con la mutación germinal BRCA1/2 en diferentes localizaciones. Aunque la mayoría de los pacientes habían recibido un diagnóstico de cáncer de ovario, mama, páncreas o próstata, también existía un grupo de 12 pacientes con tumores del conducto biliar (4), pulmón (3), vejiga (2), colorrectal (1), esófago (1) y útero (1). El 58,3% de pacientes de este último grupo mantuvo ES durante más de 8 meses3. El mismo año, Mateo et al. evaluaron el uso de olaparib en el cáncer de próstata metastásico con defectos en DDR, con mutaciones en otros genes distintos a BRCA. De los 49 pacientes evaluados, 16 mostraron respuesta, presentando el 88% de ellos mutaciones en HRRg, concretamente, en BRCA, ATM, PALB2, FANCA y HDAC24.
La inhibición de PARP podría ser efectiva en tumores con mutaciones en otros HRRg, en localizaciones tumorales para los que este tratamiento aún no ha sido aprobado o documentado. Nuestro programa de ensayos clínicos a gran escala nos permitió realizar el cribado de un panel de genes en pacientes para los que no existían alternativas terapéuticas, con el objeto de detectar VP en genes relacionados con la HR que se puedan tratar con terapia dirigida, en el contexto de un ensayo clínico o de uso fuera de indicación. La Agencia Europea del Medicamento (EMA) ha aprobado el uso de olaparib en el cáncer de ovario, mama, próstata, páncreas y endometrio2. No se observaron señales de seguridad diferentes a las incluidas en la ficha técnica del producto.
En un estudio en 13.599 pacientes, el colangiocarcinoma fue el tipo de tumor más común con alteraciones en PALB211, y varios casos con mutaciones en BRCA mostraron respuesta a la terapia PARPi. Dicha respuesta incluye respuestas parciales y remisiones a largo plazo, lo que sugiere que los pacientes con mutaciones en BRCA2 podrían beneficiarse de la terapia con PARPi, especialmente cuando se administra en combinación con tratamientos como pembrolizumab12–16. Este es el primer estudio realizado para evaluar la eficacia y seguridad del tratamiento con olaparib en pacientes con colangiocarcinoma intrahepático con mutación en PALB2.
Se han obtenido resultados clínicos contradictorios relacionados con el uso de PARPi en tumores con mutaciones en ATM17. Así, mientras que en el estudio PROfound18 se observaron beneficios de olaparib en el cáncer de próstata con mutaciones en ATM, BRCA1 o BRCA2, en otros estudios como JAVELIN BRCA/ATM19, se obtuvieron resultados clínicos deficientes en los tumores con mutaciones en ATM, lo que derivó en la interrupción anticipada del estudio debido a las bajas tasas de respuesta20,21.
La mala respuesta del paciente 3 al tratamiento podría deberse a una mutación en el gen que produce la proteína tumoral somática p53 (TP53), que está relacionado con la resistencia a los PARPi, así como a una alteración en la subunidad catalítica épsilon de la ADN polimerasa (POLE), que provoca una elevada carga tumoral22. Las mutaciones en el gen TP53 resultan en una sobreexpresión de RAD51, reduciendo con ello la sensibilidad a los PARPi, al permitir vías alternativas de reparación del ADN23. Aunque las alteraciones en el gen POLE suelen aumentar la sensibilidad a inmunoterapia24, el paciente no respondió a terapia con pembrolizumab, probablemente debido al avanzado estadio de su enfermedad.
Con respecto a la cohorte de carcinoma ampular, el 18% de los pacientes albergaba mutaciones patogénicas en BRCA2, ATM, RAD50, así como en la MutY ADN glicosilasa25. Sin embargo, no existe evidencia sobre los resultados clínicos de la terapia PARPi en pacientes con este tipo de tumores. Un ensayo clínico en el que se evaluó el uso de rucaparib en tumores con deficiencias en HR, entre los que se incluía el carcinoma ampular, fue interrumpido debido a un cambio en las prioridades en el desarrollo de fármacos26.
En línea con la magnífica respuesta mostrada por el paciente 6, en un estudio de caso reciente se observó una respuesta de 17 meses a terapia de mantenimiento con olaparib, en un paciente con NET con gBRCA2 (Ki67 62%), tras recibir inmunoterapia combinada con quimioterapia con platino27. Otro paciente con un tumor neuroendocrino pulmonar metastásico con mutación en la cinasa 12 dependiente de ciclina mostró una respuesta parcial durante 5 meses al tratamiento con olaparib en combinación con paclitaxel, como tercera línea de tratamiento.
Las limitaciones del estudio son las inherentes a cualquier estudio retrospectivo individual observacional. Otra limitación es el pequeño tamaño de la muestra: 6 pacientes con características heterogéneas, tanto en términos de ubicación del tumor como de mutaciones. Todos los pacientes presentaban enfermedad metastásica y habían recibido al menos 3 líneas previas de tratamiento, lo que podría influir en la respuesta al tratamiento con olaparib, ya que los pacientes que han recibido muchas líneas previas de tratamiento suelen presentar enfermedades más resistentes. Además, solo 2 de los 6 pacientes mostraron respuesta parcial a terapia previa con platino. Aunque existen casos en la literatura en los que la respuesta a tratamiento con PARPi era independiente de la respuesta previa a la terapia con platino, esta no es la tónica general.
Únicamente existe evidencia sobre los efectos del olaparib y de PARPi en tumores con mutaciones en el gen BRCA, por lo que se desconocen sus efectos en tumores con mutaciones en otros genes, como PALB2 y ATM, y en otras localizaciones, como el tubo digestivo, el sistema neuroendocrino y el pulmón. En el presente estudio, describimos el uso de olaparib fuera de indicación en 6 pacientes con mutaciones en genes relacionados con la HR, en localizaciones tumorales poco frecuentes. Los resultados obtenidos muestran una seguridad adecuada, similar a la observada en estudios anteriores, lo que abre la vía a futuras investigaciones sobre la eficacia y seguridad de olaparib en pacientes con HRRg mutado en nuevos sitios tumorales.
Aportación a la literatura científicaEste estudio analiza el uso de olaparib en tumores con mutaciones en HRRg diferentes a las variantes BRCA y a las localizaciones tumorales para las que esta terapia ha sido autorizada.
Los resultados obtenidos pueden facilitar la evaluación de los efectos del olaparib en estos pacientes por parte de los farmacéuticos clínicos y los oncólogos médicos, teniendo en cuenta la respuesta a terapia con platino, las mutaciones o las líneas de tratamiento recibidas.
Responsabilidades éticasEl estudio se realizó con ajuste a los principios de la Declaración de Helsinki y fue aprobado por el Comité de Ética Institucional del Hospital Universitari Vall d'Hebron, con el código EOM (AG) 057/2024 (6338), con exención de la obligación de obtener consentimiento informado, debido a la naturaleza retrospectiva del estudio.
FinanciaciónLos autores declaran que el presente proyecto no recibió financiación. El tratamiento y las pruebas realizadas a los pacientes fueron financiadas por el Servicio Catalán de Salud.
Conflicto de interesesHéctor Carlos Garcia-Diaz es consultor de Daiichi Sankyo. Mara Cruellas ha sido ponente invitada en Roche, Novartis; tasas de congreso, desplazamiento y alojamiento financiadas por Lilly, Palex Medical. Enriqueta Felip es miembro del consejo consultor de Abbvie, Amgen, AstraZeneca, Bayer, Beigene, BMS, Eli Lilly, F. Hoffmann-La Roche, Gilead, GSK, Janssen, Merck Serono, MSD, Novartis, Peptomyc, Pfizer, Regeneron, Sanofi, Takeda, Daiichi Sankyo; Junta Directiva: Grifols; asistencia a reuniones y viajes patrocinados por AstraZeneca Janssen, Roche. Teresa Macarulla es consultor o asesor en: Amgen, Servier, Incyte, Sanofi, AstraZeneca, Taiho, Celgene, Eisai. Financiación del estudio: Celgene, AstraZeneca, BeiGene, Incyte. Ponencias patrocinadas: AstraZeneca, Incyte, Servier, Roche, Eisai. Maria J Carreas ha actuado como ponente invitado y participado en consejos consultivos o recibido financiación para desplazamiento de Boehringer Ingelheim, Ipsen Pharma, Lilly, and Roche. El resto de autores no tiene nada que declarar.
Presentaciones anterioresEste trabajo fue presentado parcialmente en una comunicación oral en el Simposio Internacional de Especialistas en Farmacia Oncológica en marzo de 2023 en Sevilla (España).
Declaración de contribución de autoría CRediTHéctor Carlos García-Díaz: Writing – review & editing, Writing – original draft, Methodology, Investigation, Formal analysis, Conceptualization. María Larrosa-Garcia: Validation, Investigation, Conceptualization. Javier Gómez-Alonso: Validation, Investigation. Mara Cruellas: Validation, Supervision. Enriqueta Felip: Validation, Supervision. Teresa Macarulla: Validation, Supervision. Anna Farriols: Validation, Supervision. Maria J. Carreras: Validation, Supervision, Investigation, Conceptualization.