Validar las asociaciones, encontradas previamente en tres cohortes de pacientes del Hospital General Universitario Gregorio Marañón, entre los polimorfismos rs1128503, rs2032582 y rs1045642 del gen ABCB1 con síndrome manopie y diarrea en pacientes de cáncer colorrectal tratados con regímenes que contenían capecitabina y 5-Fluorouracilo, respectivamente, y entre los polimorfismos rs2297595 del gen DPYD con nauseas/vómitos, rs11615 ERCC1 y neutropenia, y rs28399433 CYP2A6 y neutropenia en pacientes de cáncer colorrectal tratados con FOLFOX o XELOX en adyuvancia.
MétodoSe incorporaron al estudio pacientes de cáncer colorrectal tratados con regímenes quimioterápicos que contenían capecitabina (n = 157), 5-fluorouracilo (n = 99) y pacientes tratados en adyuvancia con XELOX o FOLFOX (n = 83). Los pacientes participantes fueron reclutados en el Hospital Universitario Doce de Octubre y en el Hospital General Universitario Gregorio Marañón tras firmar consentimiento informado. Se extrajo ADN a partir de muestras de sangre. Los genotipados se realizaron mediante SNaPshot. Se realizaron tablas de contingencia para analizar las asociaciones entre genotipos y reacciones adversas.
ResultadosNinguna de las asociaciones previamente identificadas fue replicada en la cohorte de validación.
ConclusionesLos estudios farmacogenéticos con un tamaño muestral limitado deben ser validados en cohortes más numerosas, a ser posible en estudios multicéntricos, reduciendo al máximo las variables y nunca deben ser utilizados en clínica sin validar.
To validate the associations previously found in three cohorts of patients from the General University Hospital Gregorio Marañón, between the polymorphisms rs1128503, rs2032582 and rs1045642 of the ABCB1 gene and the hand-foot syndrome and diarrhea in colorectal cancer patients treated with chemotherapy regimes containing Capecitabine and 5-Fluorouracil, respectively, and between the polymorphisms rs2297595 of the DPYDgene and nausea/vomiting, rs11615 of ERCC1 and neutropenia, and rs28399433 CYP2A6 and neutropenia, in colorectal cancer patients treated with FOLFOX or XELOX as adjuvant therapy.
MethodColorectal cancer patients treated with chemotherapy regimes, containing Capecitabine (n = 157), 5-Fluorouracil (n = 99) were included in the study, as well as patients treated with XELOX or FOLFOX (n = 83) as adjuvant therapy. The patients included were recruited from the Doce de Octubre University Hospital and from the Gregorio Marañón General University Hospital, and signed the informed consent form. DNA was obtained from blood samples. Genotyping was carried out with SNaPshot. Contingency tables were created for analyzing the associations between the genotypes and the adverse reactions.
ResultsNone of the associations previously identified was replicated in the validation cohort.
ConclusionsPharmacogenetic studies with a limited sample size must be validated with bigger cohorts, if possible by means of multicentre studies, reducing the variables to the maximum and should never be used in clinical practice without validation.
El cáncer colorrectal (CCR) es la segunda causa de muerte por tumores en el mundo desarrollado, con más de 608.700 muertes estimadas en el 20081. En España hubo un total de 13.433 fallecidos en ese mismo año, lo cual representa un 14% de todas las muertes por cáncer2. Una parte importante de los pacientes de CCR son tratados con quimioterapia, bien de forma adyuvante tras cirugía, para evitar recidivas de la enfermedad, o bien en presencia del tumor. La quimioterapia aplicada en el CCR es muy variada y puede dar lugar a múltiples combinaciones de fármacos3. Entre ellos tenemos las fluoropirimidinas como base del tratamiento, entre las que se encuentra el 5-fluorouracilo (5-FU), o su profármaco capecitabina, que se suelen administrar en combinación con oxaliplatino (FOLFOX, XELOX, respectivamente) o con irinotecan (FOLFIRI, XELIRI, respectivamente)4. Además en casos de enfermedad metastásica estas combinaciones suelen ir acompañadas de un anticuerpo monoclonal como cetuximab, panitumumab o bevacizumab. Sin embargo, y a pesar de la mejora en la efectividad de estos tratamientos, cerca del 50% de los pacientes a los que se administra la quimioterapia en estadio avanzado no responden a la misma. Otro problema importante es la toxicidad provocada por estos fármacos, que puede conducir a desestimar líneas de tratamiento reduciendo las posibilidades de curación, o a provocar disminuciones y/o retrasos de dosis que hacen peligrar la eficacia5. Además, las reacciones adversas afectan a la calidad de vida de los pacientes y tienen también importantes repercusiones económicas. Las reacciones adversas a medicamentos son la 4a causa de muerte en EEUU. Un análisis con 1.219 pacientes con CCR que recibieron 5-FU, mostró que aproximadamente el 31-34% tuvo toxicidad grado 3-4, y que el 0,5% sufrió toxicidad letal6. Aunque capecitabina es un profármaco de 5-FU, existen diferencias significativas en cuanto a su perfil de toxicidad. Mientras que la toxicidad hematológica se asocia con más frecuencia a 5-FU, efectos adversos como diarrea, náuseas y vómitos, y síndrome mano-pie (SMP) están más asociados al tratamiento con capecitabina7. Esquemas quimioterápicos que contengan irinotecan pueden conducir a toxicidades graves, fundamentalmente mielosupresión y diarrea8. En cuanto al oxaliplatino, el efecto adverso más común es la neurotoxicidad, que puede perdurar en el tiempo después de la suspensión del fármaco9.
La farmacogenética estudia los factores genéticos que influyen en la variabilidad interindividual en la respuesta a medicamentos, tanto en la eficacia como en la toxicidad. En el caso de la farmacogenética en oncología se ha avanzado bastante en los últimos años y uno de los tumores con más resultados en esta área ha sido el CCR10,11. Varias son las asociaciones claramente establecidas en farmacogenética del CCR y reacciones adversas. Se ha demostrado que en pacientes tratados con irinotecan, la presencia del alelo *28 del gen de la uridina difosfato-glucuronosiltransferasa (UGT1A1 *28) aumenta 7 veces las probabilidades de tener diarrea y neutropenia grados 3-4, y esto se predice con un 86% de positi-vos12,13. Otra evidencia se refiere a la relación entre toxicidad grave al tratamiento con 5-FU en pacientes con variantes del gen de la dihidropirimidina dehidrogenasa (DPYD), fundamentalmente el alelo *2A14.
Nuestro grupo ha contribuido a este campo identificando varios polimorfismos genéticos asociados a determinadas reacciones adversas a la quimioterapia en pacientes con CCR15-17. Describimos cómo polimorfismos del gen ABCB1 se encontraban asociados a neutropenia moderada-grave (rs1128503) y a síndrome mano-pie (SMP) (rs1128503, rs2032582 y rs1045642) en pacientes de CCR tratados con regímenes de quimioterapia que contenían capecitabina, y a diarrea moderada-grave (rs1045642) en pacientes tratados con regímenes que contenían 5-FU15. Así, el hecho de ser homocigoto mutante o heterocigoto para estos tres polimorfismos de secuencia única (SNPs) en ABCB1 supuso una menor probabilidad de padecer neutropenia y SMP grado 2-5 en pacientes tratados con regímenes que contenían capecitabina en comparación con los homocigotos salvajes CC; por el contrario, estos últimos estuvieron expuestos a un menor riesgo de desarrollar diarrea grado 2-5 frente a esquemas basados en 5-FU15. Para limitar el efecto de las distintas combinaciones de tratamientos y estadios del tumor se realizó posteriormente un estudio que incluía pacientes con un tratamiento más homogéneo (FOLFOX/XELOX en adyuvancia) y en el que los SNPs rs11615 en ERCC1 y rs28399433 en CYP2A6 (gen que codifica para la proteína CYP2A6, involucrada en la conversión de tegafur a 5-FU) se asociaron de una forma estadísticamente significativa con el desarrollo de neutropenia17. La variante rs2297595 en DPYD se asoció al desarrollo de náuseas y vómitos grado 3-5 en esta misma población17.
El objetivo del presente estudio es validar estos posibles marcadores farmacogenéticos de toxicidad (rs1128503, rs2032592 y rs1045642 en ABCB1, rs11615 en ERCC1, rs28399433 en CYP2A6 y rs2297595 en DPYD) en una nueva cohorte de pacientes de CCR frente a tratamientos basados en 5-FU o capecitabina, y frente a los esquemas FOLFOX/XELOX en adyuvancia con el fin de que puedan ser utilizadas en un futuro cercano como medio para decidir la terapia más adecuada para cada paciente.
MétodoPacientes y diseño del estudioSe reclutaron pacientes procedentes de los Servicios de Oncología Médica tanto del Hospital General Universitario Gregorio Marañón como del Hospital Universitario Doce de Octubre en el periodo comprendido entre febrero de 2011 y diciembre de 2012. Estos pacientes fueron incorporados al estudio tanto de forma prospectiva como retrospectiva. Los pacientes debían cumplir los criterios de ser mayores de edad, estar diagnosticados de cáncer de colon o recto, y estar recibiendo o haber recibido quimioterapia basada en 5-FU o capecitabina, o los esquemas FOLFOX/XELOX en adyuvancia. Los criterios de exclusión fueron: tener una puntuación ECOG performance status (PS) mayor de 2, insuficiencia renal aguda (menos de 400 ml de producción de orina al día), diagnosticado de insuficiencia hepática aguda o crónica, y tener un tiempo de seguimiento inferior a 2 meses, siempre y cuando el paciente no hubiera presentado algún efecto adverso grave en dicho periodo. Ninguno de los pacientes incluidos en la cohorte de validación formó parte a la vez de las cohortes exploratorias de los estudios previos. El resultado de las determinaciones genéticas no modificó un ningún caso el tratamiento recibido por los pacientes. La cohorte exploratoria estuvo formada exclusivamente por pacientes del Hospital General Universitario Gregorio Marañón, mientras que la cohorte de validación fue completada, mayoritariamente, con pacientes del Hospital Universitario Doce de Octubre.
El estudio se llevó a cabo según lo establecido en la Declaración de Helsinki y fue aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario Gregorio Marañón y el del Hospital Universitario Doce de Octubre. Se obtuvo el consentimiento informado de todos los pacientes. Se siguieron los protocolos establecidos en el Hospital General Universitario Gregorio Marañón y en el Hospital Universitario Doce de Octubre para acceder a los datos de las historias clínicas con fines de investigación y divulgativos para la comunidad científica.
Muestra de estudioSe extrajeron 3-4 ml de sangre total de cada paciente en tubos conteniendo EDTA. Dichos tubos fueron conservados a -80° C.
Métodos de ensayoSe aisló el ADN genómico de todos los pacientes mediante el HighPure PCR template preparation kit (Roche), a partir de 200 l de sangre y la concentración de ADN se determinó en un espectrofotómetro Nanodrop 1000 (Thermo Scientific, MA, USA). El ADN fue preservado a -20° C hasta su utilización.
Los polimorfismos rs1128503, rs2032592 y rs1045642 en ABCB1, rs2297595 en DPYD, rs28399433 en CYP2A6, y rs11615 en ERCC1 se determinaron mediante la técnica de SNaPshot, tal y como se ha descrito por GonzálezHaba y cols.15. Los polimorfismos estudiados y los oligonucleótidos empleados se detallan en la tabla 1.
Polimorfismos analizados y oligonucleótidos utilizados en SNaPshot
| Gen (SNP) | ID dbSNP | Oligo | Primer Forward |
|---|---|---|---|
| ABCB1 C1236T | rs1128503 | FRSNaPshot | CCTGACTCACCACACCAATGTATCCTGTGTCTGTGAATTGCCGCCCACTCTGCACCTTCAGGTTCAG |
| ABCB1 G2677T/A | rs2032582 | FRSNaPshot | TAGTTTGACTCACCTTCCCGGGGCTATAGGTTCCAGGCTTGGACAAGCACTGAAAGATAAGAAAGAACTAGAAGGT |
| ABCB1 C3435T | rs1045642 | FRSNaPshot | CATGCTCCCAGGCTGTTTATGTAACTTGGCAGTTTCAGTGTGACTCGATGAAGGCATGTATGTTGGCCTCCTTTGCTGCCCTCAC |
| DPYD A496G | rs2297595 | FRSNaPshot | CAATCGAGCCAAAAAGGAAGCCCTCTAGGTGGGAGTAGGGAAATTTTAACCATGACAATTGATTTCCCCGTAGGTATTCAAAGCA |
| CYP2A6 T-48G | rs28399433 | FRSNaPshot | CCTGCACCTCTGATTTGGATCCTGCTGAGGGTTTTAGTGGATCAGCCAAAGTCCATCCCTCTTTTTCAGGCAGTA |
| ERCC1 Asn118Asn | rs11615 | FRSNaPshot | TCCAGAACACTGGGACATGATCCCTATTGATGGCTTCTGCAGGGGCAATCCCGTACTGAAGTTCGTGCGCAA |
SNP: Del inglés «Single Nucleotide Polymorphism»; ID: Identificador; ABCB1: Casete de unión a ATP B1; DPYD: Dihidropirimidina dehidrogenasa; CYP2A6: Citocromo P450 2A6; ERCC1: Proteína de reparación por escisión del grupo de complementación cruzada 1.
Se estudiaron las posibles asociaciones de los siguientes polimorfismos con reacciones adversas a la quimioterapia: rs1128503 en ABCB1 (neutropenia-SMP/capecitabina), rs2032592 en ABCB1 (SMP/capecitabina), rs1045642 en- ABCB1 (SMP/Capecitabina; diarrea/5-Fluorouracilo), rs2297595 en DPYD(Nauseas-vómitos/FOLFOX-XELOX), rs28399433 en CYP2A6 (neutropenia/FOLOFX-XELOX), y rs11615 en ERCC1 (neutropenia/FOLFOX-XELOX). Los pacientes fueron clasificados en dos grupos en función del grado de toxicidad desarrollada («no toxicidad» 0-1, y «toxicidad moderada-grave» 2-5) siguiendo los criterios Common Terminology Criteria for Adverse Events (CTCAE) v.3.0 para las siguientes reacciones adversas: neutropenia, SMP, diarrea, y náuseas y vómitos, excepto en el análisis que incluía pacientes tratados con los regímenes FOLFOX/XELOX en adyuvancia que se estudió «toxicidad grave», es decir considerando grados 3-5 en los análisis estadísticos. Esta diferencia es debida a que se ha intentado reproducir los resultados utilizando exactamente los mismos criterios que se emplearon en los trabajos originales. Los datos de toxicidad recogidos en ambos hospitales fueron tomados de manera homogénea.
Para los estudios de asociación entre polimorfismos y toxicidad se utilizaron tablas de contingencia y se calculó el test exacto de Fisher, considerando valores de p < 0,05 como estadísticamente significativos.
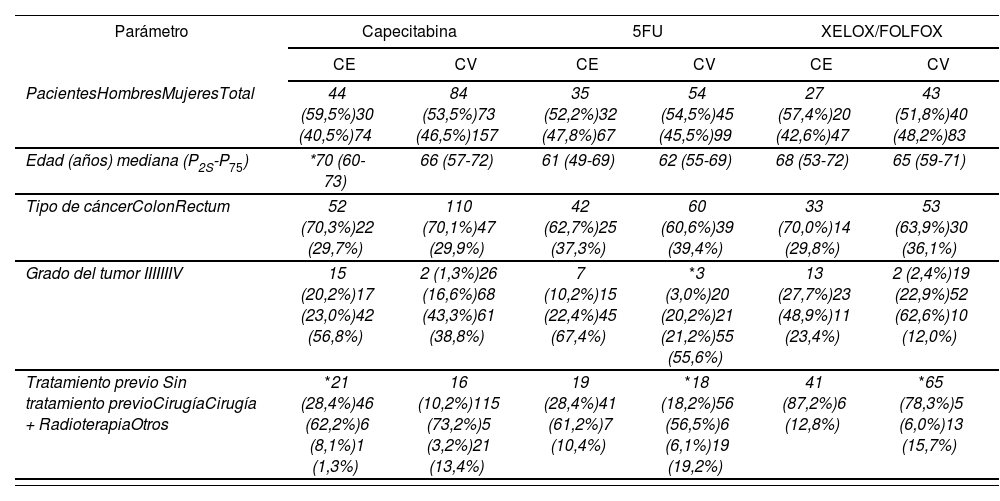
ResultadosPara validar las asociaciones identificadas por nuestro grupo en dos trabajos previos entre efectos adversos a la quimioterapia y variaciones genéticas se reclutaron tres grupos de pacientes diagnosticados de cáncer colorrectal: 157 pacientes tratados con regímenes quimioterápicos que contenían capecitabina, 99 pacientes tratados con regímenes que contenían 5-FU y un tercer grupo de 83 pacientes tratados en adyuvancia con FOLFOX o XELOX. Las características basales de cada una de estas tres cohortes de validación fue comparada con las cohortes de exploración de los trabajos originales, que estaban formadas por 74, 67 y 47 pacientes para tratamiento basados en capecitabina, 5-FU y FOLFOX/XELOX, respectivamente. En líneas generales, las características basales de los pacientes incluidos en cada cohorte de validación fueron muy similares a las de la equivalente cohorte exploratoria (Tabla 2). Sin embargo, en los tres tratamientos analizados el tratamiento previo resultó estadísticamente significativo entre las cohortes de exploración y las de validación. Por otro lado, en los pacientes tratados con quimioterapia que contenía capecitabina la cohorte exploratoria tenía una edad al diagnóstico mayor que en la cohorte de validación (70 versus 66). Finalmente, también se encontraron diferencias en el grado de tumor en los pacientes tratados con esquemas que contenían 5-FU.
Características basales de los pacientes
| Parámetro | Capecitabina | 5FU | XELOX/FOLFOX | |||
|---|---|---|---|---|---|---|
| CE | CV | CE | CV | CE | CV | |
| PacientesHombresMujeresTotal | 44 (59,5%)30 (40,5%)74 | 84 (53,5%)73 (46,5%)157 | 35 (52,2%)32 (47,8%)67 | 54 (54,5%)45 (45,5%)99 | 27 (57,4%)20 (42,6%)47 | 43 (51,8%)40 (48,2%)83 |
| Edad (años) mediana (P2S-P75) | *70 (60-73) | 66 (57-72) | 61 (49-69) | 62 (55-69) | 68 (53-72) | 65 (59-71) |
| Tipo de cáncerColonRectum | 52 (70,3%)22 (29,7%) | 110 (70,1%)47 (29,9%) | 42 (62,7%)25 (37,3%) | 60 (60,6%)39 (39,4%) | 33 (70,0%)14 (29,8%) | 53 (63,9%)30 (36,1%) |
| Grado del tumor IIIIIIIV | 15 (20,2%)17 (23,0%)42 (56,8%) | 2 (1,3%)26 (16,6%)68 (43,3%)61 (38,8%) | 7 (10,2%)15 (22,4%)45 (67,4%) | *3 (3,0%)20 (20,2%)21 (21,2%)55 (55,6%) | 13 (27,7%)23 (48,9%)11 (23,4%) | 2 (2,4%)19 (22,9%)52 (62,6%)10 (12,0%) |
| Tratamiento previo Sin tratamiento previoCirugíaCirugía + RadioterapiaOtros | *21 (28,4%)46 (62,2%)6 (8,1%)1 (1,3%) | 16 (10,2%)115 (73,2%)5 (3,2%)21 (13,4%) | 19 (28,4%)41 (61,2%)7 (10,4%) | *18 (18,2%)56 (56,5%)6 (6,1%)19 (19,2%) | 41 (87,2%)6 (12,8%) | *65 (78,3%)5 (6,0%)13 (15,7%) |
CE: Cohorte exploratoria; CV: Cohorte de validación; 5FU: 5-fluorouracilo; XELOX: Capecitabina y oxaliplatino; FOLFOX: 5-fluoruracilo y oxaliplatino. *P valor < 0,05.
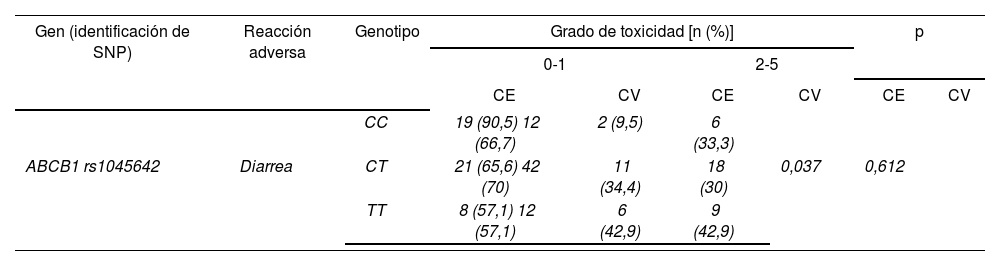
En los pacientes tratados con regímenes quimioterápicos que contenían 5-FU no se observó una asociación estadísticamente significativa entre el polimorfismo rs1045642 en ABCB1 y diarrea grados 2-5 (p = 0,612). Los pacientes homocigotos TT para este polimorfismo, al igual que lo obtenido en la cohorte exploratoria, presentaron mayor probabilidad de desarrollar diarrea moderada-grave (42,9%) que el resto de genotipos (30% CT y 33,3% CC), pero no se mantuvo la gradación que se observó en la primera cohorte y que apuntaba a un efecto del alelo variante T para este polimorfismo en el incremento del riesgo de diarrea (Tabla 3).
Tablas de contingencia para la asociación entre ABCB1 rs1128503 y diarrea grado ≥ 2 en el grupo de pacientes tratados con regímenes quimioterápicos basados en 5-FU
| Gen (identificación de SNP) | Reacción adversa | Genotipo | Grado de toxicidad [n (%)] | p | ||||
|---|---|---|---|---|---|---|---|---|
| 0-1 | 2-5 | |||||||
| CE | CV | CE | CV | CE | CV | |||
| CC | 19 (90,5) 12 (66,7) | 2 (9,5) | 6 (33,3) | |||||
| ABCB1 rs1045642 | Diarrea | CT | 21 (65,6) 42 (70) | 11 (34,4) | 18 (30) | 0,037 | 0,612 | |
| TT | 8 (57,1) 12 (57,1) | 6 (42,9) | 9 (42,9) | |||||
CE: Cohorte exploratoria; CV: Cohorte de validación; ABCB1: Casete de unión a ATP B1.
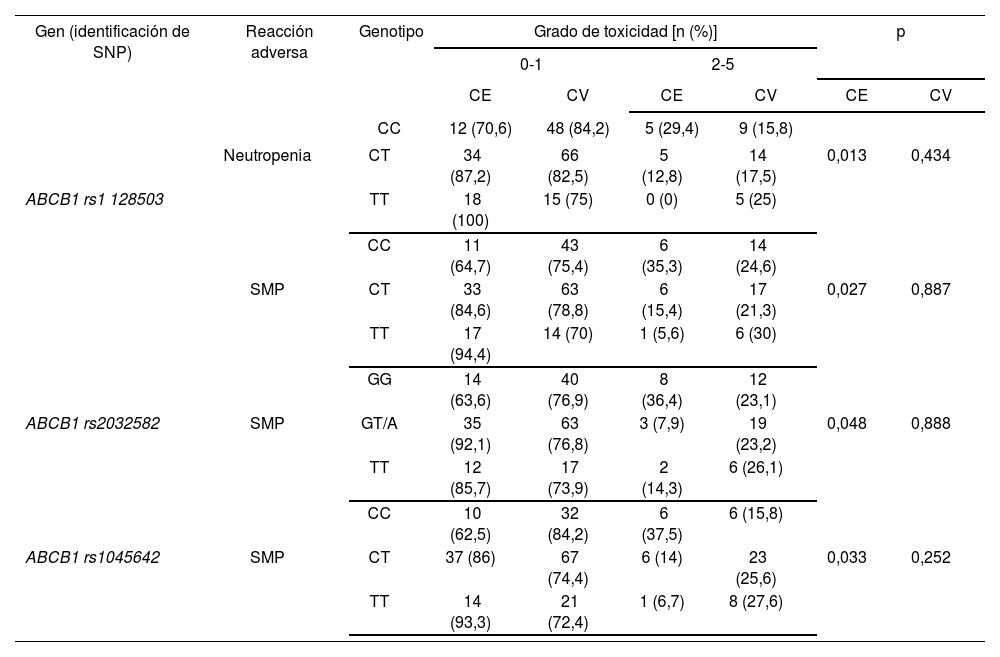
Tampoco se mantuvo estadísticamente significativa en la cohorte de validación ninguna de las asociaciones obtenidas previamente entre los tres polimorfismos en el gen ABCB1 y efectos adversos al tratamiento basado en capecitabina (Tabla 4). En la cohorte exploratoria el alelo T para los polimorfismos rs1128503, rs2032592 y rs1045642 en ABCB1 resultó ser un marcador de baja probabilidad de desarrollar neutropenia y SMP moderado-grave. Sin embargo, estos hallazgos no pudieron ser confirmados en la nueva cohorte de pacientes. No se obtuvo ninguna asociación en el desarrollo de SMP moderado-grave frente a esquemas basados en capecitabina y los polimorfismos ABCB1 rs1 128503 (p = 0,887), rs2032592 (p = 0,888), o rs1045642 (p = 0,252), ni de neutropenia moderada-grave y el polimorfismo ABCB1 rs1128503 (p = 0,434) (Tabla 4).
Tablas de contingencia para las asociaciones entre ABCB1 rs1128503, rs2032582 y rs1045642 y efectos adversos grado ≥ 2 en el grupo de pacientes tratados con regímenes quimioterápicos basados en capecitabina
| Gen (identificación de SNP) | Reacción adversa | Genotipo | Grado de toxicidad [n (%)] | p | ||||
|---|---|---|---|---|---|---|---|---|
| 0-1 | 2-5 | |||||||
| CE | CV | CE | CV | CE | CV | |||
| CC | 12 (70,6) | 48 (84,2) | 5 (29,4) | 9 (15,8) | ||||
| Neutropenia | CT | 34 (87,2) | 66 (82,5) | 5 (12,8) | 14 (17,5) | 0,013 | 0,434 | |
| ABCB1 rs1 128503 | TT | 18 (100) | 15 (75) | 0 (0) | 5 (25) | |||
| CC | 11 (64,7) | 43 (75,4) | 6 (35,3) | 14 (24,6) | ||||
| SMP | CT | 33 (84,6) | 63 (78,8) | 6 (15,4) | 17 (21,3) | 0,027 | 0,887 | |
| TT | 17 (94,4) | 14 (70) | 1 (5,6) | 6 (30) | ||||
| GG | 14 (63,6) | 40 (76,9) | 8 (36,4) | 12 (23,1) | ||||
| ABCB1 rs2032582 | SMP | GT/A | 35 (92,1) | 63 (76,8) | 3 (7,9) | 19 (23,2) | 0,048 | 0,888 |
| TT | 12 (85,7) | 17 (73,9) | 2 (14,3) | 6 (26,1) | ||||
| CC | 10 (62,5) | 32 (84,2) | 6 (37,5) | 6 (15,8) | ||||
| ABCB1 rs1045642 | SMP | CT | 37 (86) | 67 (74,4) | 6 (14) | 23 (25,6) | 0,033 | 0,252 |
| TT | 14 (93,3) | 21 (72,4) | 1 (6,7) | 8 (27,6) | ||||
CE: Cohorte exploratoria; CV: Cohorte de validación; SMP: Síndrome Mano-Pie; ABCB1: Casete de unión a ATP B1.
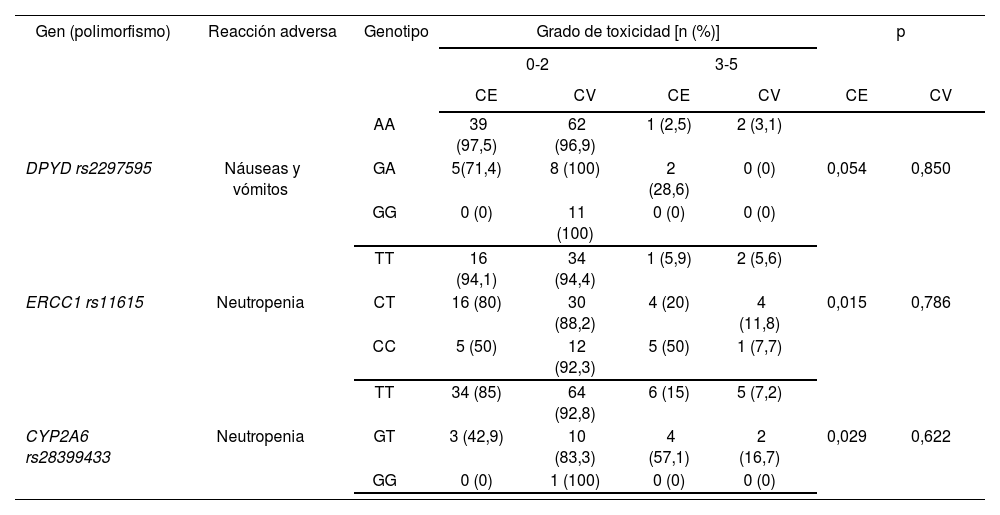
En cuanto a las asociaciones entre reacciones adversas graves al tratamiento adyuvante FOLFOX o XELOX y los SNPs rs2297595 en DPYD, rs11615 en ERCC1 y rs28399433 en CYP2A6 tampoco se obtuvieron asociaciones estadísticamente significativas (Tabla 5). La asociación obtenida previamente entre rs2297595 DPYDy náuseas y vómitos (p = 0,054) no se confirmó en la nueva cohorte independiente (p = 0,850). Coincidiendo con los resultados obtenidos previamente, los pacientes homocigotos para la variante T del polimorfismo rs11615 en ERCC1 presentaron menor probabilidad de desarrollar neutropenia grave (5,6%) que los pacientes con los genotipos CT y CC (11,8 y 7,7%, respectivamente), aunque la asociación no fue estadísticamente significativa (p = 0,786). En cuanto al polimorfismo rs28399433 en CYP2A6, fueron los pacientes heterocigotos GT aquéllos que presentaron un mayor riesgo de neutropenia grave a lo largo del tratamiento en ambas cohortes de pacientes, pero la asociación no se mantuvo estadísticamente significativa en la cohorte de validación (p = 0,622).
Tablas de contingencia para las asociaciones entre DPYD rs2297595, ERCC1 rs11615y CYP2A6 rs28399433 y efectos adversos grado ≥ 3 en el grupo de pacientes tratados con los esquemas en adyuvancia FOLFOX/XELOX
| Gen (polimorfismo) | Reacción adversa | Genotipo | Grado de toxicidad [n (%)] | p | ||||
|---|---|---|---|---|---|---|---|---|
| 0-2 | 3-5 | |||||||
| CE | CV | CE | CV | CE | CV | |||
| AA | 39 (97,5) | 62 (96,9) | 1 (2,5) | 2 (3,1) | ||||
| DPYD rs2297595 | Náuseas y vómitos | GA | 5(71,4) | 8 (100) | 2 (28,6) | 0 (0) | 0,054 | 0,850 |
| GG | 0 (0) | 11 (100) | 0 (0) | 0 (0) | ||||
| TT | 16 (94,1) | 34 (94,4) | 1 (5,9) | 2 (5,6) | ||||
| ERCC1 rs11615 | Neutropenia | CT | 16 (80) | 30 (88,2) | 4 (20) | 4 (11,8) | 0,015 | 0,786 |
| CC | 5 (50) | 12 (92,3) | 5 (50) | 1 (7,7) | ||||
| TT | 34 (85) | 64 (92,8) | 6 (15) | 5 (7,2) | ||||
| CYP2A6 rs28399433 | Neutropenia | GT | 3 (42,9) | 10 (83,3) | 4 (57,1) | 2 (16,7) | 0,029 | 0,622 |
| GG | 0 (0) | 1 (100) | 0 (0) | 0 (0) | ||||
CE: Cohorte exploratoria; CV: Cohorte de validación; DPYD: Dihidropirimidina dehidrogenasa; CYP2A6: Citocromo P450 2A6; ERCC1: Proteína de reparación por escisión del grupo de complementación cruzada 1.
La identificación de biomarcadores predictivos de toxicidad a los regímenes quimioterápicos utilizados en el tratamiento del CCR podría ayudar a seleccionar la mejor opción terapéutica para cada paciente y así minimizar la aparición de reacciones adversas graves a la quimioterapia en estos pacientes10. Sin embargo, a pesar de que hay una gran variedad de artículos que muestran asociaciones entre variantes génicas y reacciones adversas a la quimioterapia en CCR, éstas a menudo no se replican en otros estudios, lo cual dificulta la aplicación clínica de la farmacogenética18. En trabajos anteriores, encontramos varios polimorfismos asociados de una manera estadísticamente significativa a determinadas reacciones adversas a la quimioterapia en pacientes con CCR del Hospital General Universitario Gregorio Marañón (Madrid). Por lo anteriormente comentado, el objetivo del trabajo fue validar los resultados obtenidos en una nueva cohorte de pacientes, esta vez mayoritariamente atendidos en un hospital diferente (Hospital Universitario Doce de Octubre, Madrid) antes de estudiar su aplicación clínica. En nuestros trabajos iniciales se describieron por primera vez, asociaciones de polimorfismos en genes como ABCB1 y efectos adversos a 5-fluorouracilo y capecitabina15. Otros polimorfismos, como el rs28399433 en el gen CYP2A6, eran relacionados por primera vez con un efecto adverso concreto, en este caso neutropenia17, aunque previamente había sido descrita la relación de este polimorfismo con la transformación de tegafur a 5-FU19.
Los resultados, sin embargo, no han podido ser más desalentadores, ya que ninguna de las siete asociaciones estudiadas pudo ser confirmada. Probablemente, la razón fundamental de esta falta de replicación es el bajo número de pacientes incluidos en los estudios exploratorios, limitación apuntada ya en los trabajos originales15,17. Dada la naturaleza de las variables principales que determinan el tamaño muestral (porcentaje de pacientes con el efecto adverso y frecuencia del alelo menos frecuente), éste está a menudo infraestimado en los trabajos de farmacogenética, como claramente ocurre en nuestros trabajos originales. Aunque este dato es muy variable se ha estimado que el número de casos requeridos para analizar un único polimorfismo requiere una n de 496 (para odds ratio > 2, 5% de menor frecuencia alélica en un estudio caso-control bajo la asunción de un 5% de prevalencia del caso y con un completo desequilibrio de ligamiento, permitiendo un 5% de error α), mientras que si se analizan 500.000 SNP el tamaño muestral asciende hasta 1.20620.
Además, el caso del tratamiento en CCR es especialmente complicado ya que la mayoría de tratamientos no son monoterapia sino que se administra una combinación de varios fármacos4. Esto unido a disminuciones y retrasos de dosis a menudo sin un criterio fijo (criterio médico, reacciones adversas, petición del paciente…) son factores que podría estar alterando los resultados. El estudio de pacientes en tratamiento adyuvante perseguía disminuir esta variabilidad, pero aún así los resultados no han podido validar las observaciones originales, lo que demuestra las limitaciones de este tipo de estudios.
Si además tenemos en cuenta que en los estudios de asociación en farmacogenética no estudiamos un único SNP sino un número muy variable de ellos la aplicación de correcciones estadísticas mediante análisis multivariantes se hace imprescindible, aunque a menudo no se realizan en estudios farmacogenéticos21. En nuestro caso, las 3 asociaciones (rs11615 en ERCC1 y neutropenia, rs28399433 en CYP2A6 y neutropenia, y rs2297595 en DPYD y nauseas/vómitos) analizadas en la cohorte de exploración de pacientes en tratamiento adyuvante presentaron una significación estadística en un análisis multivariante17, corrigiendo, al igual que otros autores, por sexo y PS22,23. A pesar de esto, ninguna de estas asociaciones fue replicada en la cohorte de validación, demostrando el importante peso en los resultados finales de todos los factores de variabilidad mencionados anteriormente: tratamiento, tamaño muestral, dosis, etc.
Las distintas cohortes de exploración y validación utilizadas han reflejado características basales diferentes de manera estadísticamente significativas. Esto hace que los resultados tengan que ser tomados con cautela, principalmente el dato del grupo tratado con capecitabina donde la mediana de edad en la cohorte de validación fue cuatro años menor que la de la cohorte de exploración. Sin embargo, dado que lo que analizamos tiene que ver con la toxicidad al tratamiento, tanto el grado del tumor como el tratamiento previo que recibió el paciente son características que podrían afectar mucho a la respuesta al fármaco, pero no a las reacciones adversas. Estas variaciones pueden ser debidas a las distintas formas de prescribir tratamientos que se dan entre hospitales, ya que las cohortes de exploración están compuestas exclusivamente por pacientes del Hospital General Universitario Gregorio Marañón y las de validación lo están principalmente por pacientes del Hospital Universitario Doce de Octubre. El estudio, por lo tanto asumía que estas diferencias se podían dar y que si las asociaciones se validaban el resultado era más robusto. Y esto no ha sido así.
Muy recientemente se ha demostrado la complejidad de llevar a cabo estudios retrospectivos de biomarcadores, de tal manera que se puede perder una asociación si la población de estudio es heterogénea, tal y como ocurre en el caso de CYP2D6 y tamoxifeno en cáncer de mama24. Nuestro estudio fue prospectivo/retrospectivo, por lo que se añade otro factor de variabilidad en los resultados.
Todo ello demuestra que el camino hacia la aplicación de determinaciones farmacogenéticas en general, y en CCR en particular, pasa ineludiblemente por la validación de estas pruebas con grandes tamaños muestrales debido a las múltiples variables que normalmente se analizan y reducen el tamaño muestral de cada subgrupo, con tratamientos y estadios de enfermedad lo más uniformes posibles y preferentemente con estudios prospectivos.
En conclusión, ninguna de las asociaciones entre variaciones genéticas (rs1128503, rs2032592 y rs1045642 en
ABCB1, rs11615 en ERCC1, rs28399433 en CYP2A6 y rs2297595 en DPYD) y reacciones adversas a la quimioterapia en pacientes de CCR obtenidas previamente por nuestro grupo fue confirmada en una nueva cohorte de pacientes, mayoritariamente tratados en otro hospital. Pese a ello, sería necesario analizar estas asociaciones en una cohorte más amplia de pacientes, todos ellos con el mismo tratamiento y dosis perfectamente establecidas, antes de desechar su posible utilidad en la predicción de toxicidad a regímenes quimioterápicos a nivel clínico.
AgradecimientosEl trabajo ha sido financiado por la Fundación Española de Farmacia Hospitalaria (Beca Ruiz-Jarabo 2012) y por el Instituto de Salud Carlos III (PI12/00056).
Validation of genetic polymorphisms associated to the toxicity of chemotherapy in colorectal cancer patients