La colangitis esclerosante primaria (CEP) es una enfermedad hepática rara y progresiva con elevada morbimortalidad donde un porcentaje alto de los pacientes presenta de forma concomitante enfermedad inflamatoria intestinal (EII), más frecuentemente colitis ulcerosa (CU). No existe un tratamiento eficaz para la CEP y los pacientes son habitualmente refractarios a las diferentes líneas de tratamiento, por lo que su manejo puede suponer un desafío para los clínicos1. Se han relacionado cambios en la respuesta y señalización inmunitaria con la composición de la flora bacteriana del colon, que junto con otros factores como la predisposición hereditaria o la homeostasis biliar pueden tener un papel importante en el desarrollo de esta enfermedad. La vancomicina oral es un antibiótico hasta ahora utilizado en la colitis pseudomembranosa que apenas se absorbe sistémicamente y actúa modificando la microbiota intestinal, disminuyendo las poblaciones bacterianas que se encuentran aumentadas típicamente en pacientes con CU2. Por otro lado, también existe una limitada evidencia hasta el momento de la normalización de las enzimas hepáticas alteradas en estos pacientes con el uso de la vancomicina oral.
A continuación, presentamos el caso de un paciente pediátrico diagnosticado de CEP asociado a EII refractario a múltiples líneas de tratamiento, al que se le asocia en su tratamiento el uso de vancomicina oral.
Descripción del casoUn varón de 13 años con diagnóstico de pancolitis ulcerosa y CEP. Debutó a los 6 años de EII, a raíz de un estudio de gastritis antral, hiperplasia nodular linfoide e hipertransaminasemia. No se obtuvo respuesta con distintos inmunomoduladores (ácido 5-aminosalicilíco, azatioprina, mercaptopurina), comenzando con la terapia biológica un año después, utilizando como primera línea adalimumab (antifactor de necrosis tumoral α). Debido a fallo secundario, se cambió a infliximab, al cual también dejó de responder al cabo de casi 3 años. Es entonces cuando se sustituyó por vedolizumab (antiintegrina α4β7), tramitándose como uso fuera de indicación. Posteriormente, en 2021 se solicitó al servicio de farmacia la fórmula magistral de tacrólimus 2 mg en supositorios, por brote y refractariedad a tratamientos previos. Finalmente, se optó por un uso fuera de indicación con ustekinumab (anti-IL12/23) en ese mismo año.
En cuanto a la CEP, diagnosticado en 2019, aunque no se conoce la etiología exacta, se realizaron también en 2021 las pruebas de autoinmunidad siendo el paciente HLA B8 positivo, lo que se ha asociado a mayor susceptibilidad de la enfermedad, obteniéndose también un patrón de heterocigosidad DR3 y DR2 que se relaciona con un peor pronóstico de la enfermedad1. Como tratamiento, se instauró ácido ursodesoxicólico a dosis de 30 mg/kg/día, dosis altas que han demostrado mejorar el proceso inflamatorio, los parámetros analíticos y retrasar la progresión de la fibrosis3.
En una revisión rutinaria en febrero de 2022, presentó hemograma normal, pero con calprotectina > 2.000, continuando con un elevado número de deposiciones diarreicas. En marzo, acudió a urgencias por cuadro febril compatible con una infección del tracto urinario (ITU) y en ese mismo mes, acudió de nuevo a las urgencias del hospital con una peor evolución clínica, teniendo diversos parámetros analíticos alterados: gamma-glutamil transferasa (GGT), calprotectina y proteína C reactiva (PCR).
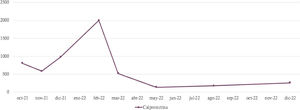
Se decidió iniciar el tratamiento con vancomicina oral a dosis de 50 mg/kg/día, la cual se dispensó desde el servicio de farmacia en forma de cápsulas de 125 mg, con una pauta de 375 mg/6 horas. Con la combinación de ustekinumab y vancomicina, evolucionó de 8 deposiciones líquidas con sangre diarias a 2 deposiciones formes al día, tras 18 días de tratamiento. Desde entonces, se mantiene entre una y 2 deposiciones formes al día, sin sangre ni dolor abdominal, y además se ha conseguido mantener la mejoría clínica, mejorar la calprotectina (fig. 1) y normalizar el resto de parámetros analíticos desde la introducción de vancomicina en marzo de 2022 (tabla 1).
Evolución de los parámetros analíticos
| Parámetro (valor de referencia) | Octubre 2021 | Noviembre2021 | Diciembre 2021 | Febrero 2022 | Marzo 2022 | Mayo 2022 | Agosto 2022 | Diciembre 2022 |
|---|---|---|---|---|---|---|---|---|
| Hb (13–16 g/dl) | 9,8 | 9,6 | 8,4 | 11,3 | 11,3 | 13 | 13,8 | 13,9 |
| Leucocitos (4,5–13,5 x 10E3/mcl) | 15,9 | 23,78 | 17,36 | 26,63 | 15,84 | 10 | 8,72 | 7,41 |
| Plaquetas (150–450 10E3/mcl) | 802 | 1.180 | 980 | 522 | 498 | 492 | 455 | 416 |
| VSG (0–10 mm) | 77 | 20 | 31 | 35 | 7 | 6 | 7 | 5 |
| PCR (<0,5 mg/dl) | 3,06 | <0,3 | 1,21 | 1,18 | 11,42 | <0,30 | <0,30 | <0,30 |
| AST (5–45 U/L) | 92 | 26 | 18 | 26 | 38 | 25 | 24 | 27 |
| Alanina aminotransferasa (5–44 U/l) | 136 | 51 | 19 | 46 | 33 | 33 | 19 | 22 |
| GGT (0–30 U/l) | 331 | 168 | 90 | 166 | 80 | 66 | 43 | 33 |
| Fosfatasa Alcalina (40–390 U/l) | 445 | 177 | 136 | 157 | 175 | 271 | 331 | 405 |
| Calprotectina (<40 μg/g negativo) | 807 | 582 | 981 | >2.000 | 521 | 138 | 175 | 262 |
AST: aspartato aminotransferasa; GGT: gamma-glutamil transferasa; Hb: Hemoglobina; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Existe una experiencia limitada en el uso de la vancomicina oral en los niños con CEP. El primer estudio, publicado en 1998, demostró que mejoraba los síntomas gastrointestinales y los niveles de las enzimas hepáticas en 3 niños; sin embargo, tuvieron recurrencias y alteración de los parámetros analíticos una vez que se discontinuó el tratamiento4.
Un estudio más reciente, publicado en 2021, evaluó la eficacia de vancomicina en 21 niños que no respondieron al tratamiento convencional y demostró que un 81% de los pacientes normalizó niveles de aspartato aminotransferasa (AST) y GGT tras su uso. Seis pacientes que mostraron una respuesta completa se clasificaron según el índice SCOPE (Sclerosing Cholangitis Outcomes in Pediatrics) como riesgo bajo o medio, ninguno como alto riesgo, lo que sugiere que los pacientes que logran una respuesta bioquímica son aquellos con una actividad de la enfermedad más leve5. Otro estudio tuvo resultados similares, donde se muestra que un índice SCOPE bajo al inicio del tratamiento fue un predictor independiente de respuesta6.
Davies et al. mostraron los resultados de tratar a 14 niños con CEP-EII hasta normalizar transaminasas y velocidad de sedimentación globular (VSG). Cuando se suspendió el tratamiento con vancomicina, hubo recurrencia de la clínica y aumento de las enzimas hepáticas. Aquellos que fueron retratados, nuevamente tuvieron una normalización de la función hepática. Siete pacientes se mantuvieron en tratamiento a largo plazo con un rango de 4 a 56 meses, manteniendo niveles normales y estando clínicamente asintomáticos6. En estos estudios, no se han observado efectos secundarios ni complicaciones infecciosas a largo plazo5,7.
La vancomicina oral se absorbe pobremente en el tracto gastrointestinal y el mecanismo por el cual produce una mejora a nivel de los parámetros bioquímicos no está definido. Hay estudios en los que se describe un efecto inmunomodulador sobre los linfocitos T8–10. Por otro lado, se postula que se puede deber a su efecto antimicrobiano sobre los patógenos gastrointestinales no conocidos o sobre la flora normal que causan reacciones inmunológicas anormales después de la migración al hígado7.
Como conclusión, nuestro caso refleja, al igual que los estudios previamente publicados, la efectividad de vancomicina oral en niños con CEP que además tengan EII, pero se necesita más evidencia científica que corrobore el uso seguro y estandarizado a largo plazo. En nuestro paciente, la combinación de vancomicina y ustekinumab para CEP-EII han conseguido normalizar el perfil hepático, así como la inflamación y la actividad de la enfermedad.
FinanciaciónNinguna.
AutoríaCristo Yared Pérez Martin y Jenifer González Chávez han participado en el concepto, diseño, obtención de datos, preparación y edición del manuscrito.
José Ramón Alberto Alonso ha participado en el concepto, diseño, búsqueda de la literatura, estudios clínicos y la obtención de datos.
María Pilar Díaz Ruiza, Marta Suárez González y Javier Merino Alonso participaron en la revisión del manuscrito.
Todos los autores son garantes del manuscrito.
Conflicto de interesesNo hay conflicto de intereses.
Responsabilidad y cesión de derechosTodos los autores aceptamos la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (disponible en http://www.icmje.org/).
Los autores cedemos, en el supuesto de publicación, de forma exclusiva los derechos de reproducción, distribución, traducción y comunicación pública (por cualquier medio o soporte sonoro, audiovisual o electrónico) de nuestro trabajo a Farmacia Hospitalaria y por extensión a la SEFH. Para ello se firmará una carta de cesión de derechos en el momento del envío del trabajo a través del sistema online de gestión de manuscritos.