En el abordaje inicial del infarto de miocardio sin elevación del segmento ST (NSTEMI), se suele incluir el tratamiento antitrombótico. La duración, momento de inicio del tratamiento y elección de tratamiento farmacológico dependerá de una serie de factores relacionados con el procedimiento y con el paciente, teniendo siempre en cuenta tanto el riesgo de isquemia como el riesgo de hemorragia1.
El tratamiento estándar para estos pacientes consiste en la terapia antiagregante plaquetaria doble (TAPD) con un inhibidor de la cicloxigenasa y un inhibidor del receptor del difosfato de adenosina (ADP), seguida de terapia antiplaquetaria única.
Los inhibidores del receptor del ADP se clasifican en 2 grupos, diferenciados según su estructura: las tienopiridinas (clopidogrel y prasugrel) y las no tienopiridinas (ticagrelor). Ticagrelor y clopidogrel son inhibidores potentes de P2Y12 y son el tratamiento de elección en los pacientes con NSTEMI1.
La púrpura trombótica trombocitopénica (PTT) es una complicación multisistémica rara y grave, con una incidencia anual de 6 casos por cada millón de habitantes, a menudo relacionada con una deficiencia congénita o adquirida de la enzima ADAMTS13, asociada a la degradación del factor von Willebrand (vWF)2. Existen casos de PTT adquirida asociada a tratamientos farmacológicos (como ticlopidina y clopidogrel), infecciones, embarazo, cáncer, etc3.
Presentamos el primer caso documentado de exacerbación de un episodio de PTT en un paciente que estaba recibiendo TAPD tras un NSTEMI. El paciente comenzó con un episodio inicial de PTT mientras recibía tratamiento con ticagrelor. Este cuadro se exacerbó tras reiniciar la TAPD con clopidogrel.
Informe del casoPresentamos el caso de un paciente de más de 60 años, obeso, exfumador, sin antecedentes de interés, que ingresó en el hospital con NSTEMI, enfermedad arterial coronaria de la arteria coronaria descendente anterior revascularizada con un stent y dilatación de la raíz aórtica. Se estableció un diagnóstico de hipertensión arterial, diabetes tipo 2 y dislipidemia. Al no haberse producido complicaciones durante los 3 días de ingreso, se le dio el alta con la siguiente medicación: 20 mg de omeprazol una vez al día por vía oral, 100 mg de ácido acetilsalicílico (AAS) una vez al día por vía oral, 90 mg ticagrelor 2 veces al día por vía oral, 2,5 mg de bisoprolol 2 veces al día por vía oral, 80 mg de atorvastatina una vez al día por vía oral, 5 mg/1.000 mg de empagliflozina/metformina oral 2 veces al día, 20 mg/10 mg de enalapril/lercanidipino por vía oral una vez al día, nitroglicerina en caso de dolor en el pecho y 75 mg de deflazacort en pauta descendente.
Transcurrida una semana desde el alta, el paciente se presentó en el servicio de urgencias debido a la presencia de parestesias en el miembro superior izquierdo, hemiparesia izquierda y afasia, por lo que fue ingresado en la unidad de cuidados intensivos (UCI).
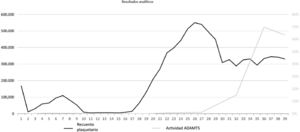
La tomografía computarizada craneal (TAC) no mostró hallazgos isquémicos o hemorrágicos. El hemograma mostró una trombocitopenia grave (11.000 plaquetas/μl), hemoglobina 12,4 g/dl, lactato deshidrogenasa 1761 U/l y actividad ADAMTS13 < 0,2% (fig. 1). Dichos resultados llevaron al diagnóstico de PTT con afectación neurológica.
Se sospechó que esta complicación podría estar relacionada con la administración de ticagrelor, por lo que se suspendió al ingreso, manteniendo únicamente la terapia antiplaquetaria con AAS. Se inició terapia diaria de recambio plasmático y corticoterapia intravenosa.
Tres días después, tras un leve aumento del recuento de plaquetas (65.000 plaquetas/μl) (fig. 1), el paciente fue trasladado a planta y se reinició la TAPD, sustituyendo el ticagrelor por clopidogrel. Transcurridos 5 días desde el inicio del tratamiento con clopidogrel, la afectación neurológica del paciente empeoró y disminuyó el recuento de plaquetas a 15.000 plaquetas/μl. Se suspendió el tratamiento con clopidogrel y se reingresó al paciente en la UCI, manteniéndose el tratamiento con corticoterapia intravenosa y terapia de intercambio plaquetario e iniciándose tratamiento intravenoso con rituximab. Seis días después de la introducción de clopidogrel, el recuento plaquetario alcanzó unos niveles mínimos de 5.000 plaquetas/μl.
Cuando se observó que el paciente era refractario al tratamiento establecido, se inició el tratamiento intravenoso con caplacizumab y se continuó por vía subcutánea durante 30 días, hasta que se observó una evolución favorable. Se recuperó el recuento de plaquetas, no produciéndose eventos hemorrágicos o trombóticos, lo que permitió la suspensión de la terapia de recambio plasmático tras 16 sesiones, del tratamiento con rituximab tras 3 dosis semanales y de la corticoterapia intravenosa a los 53 días.
A las 7 semanas de hospitalización, el paciente se estabilizó, las alteraciones neurológicas fueron mejorando gradualmente, el recuento plaquetario alcanzó 331.000 plaquetas/μl y la actividad ADAMTS13 llegó al 63,5% (fig. 1). Se le dio el alta y se reinició su tratamiento habitual. Durante el periodo de seguimiento, no se produjeron otros eventos adversos (EA) o complicaciones y la actividad de ADAMTS13 se incrementó al 101% a las 10 semanas del alta.
DiscusiónLas guías de práctica clínica recomiendan la administración de TAPD tras un NSTEMI, independientemente de la realización o no de un procedimiento invasivo. La TAPD tiene efectos beneficiosos, al reducir los eventos trombóticos relacionados con la revascularización y el infarto de miocardio agudo. Las complicaciones isquémicas y hemorrágicas influyen considerablemente en la evolución de los pacientes con NSTEMI, así como en el riesgo general de muerte4.
La PTT es una enfermedad potencialmente mortal, con una tasa de mortalidad de entre el 10 y el 20%, a pesar de la recepción de tratamiento de primera línea5. Aunque se solía pensar que la fase aguda de la PTT se caracterizaba por la aparición de fiebre, trombocitopenia, anemia hemolítica microangiopática, trastornos neurológicos e insuficiencia renal, se ha observado que menos del 10% de los pacientes presenta esta péntada. Recientemente, esta definición de PTT se ha completado con la presencia de una deficiencia grave de actividad de la enzima ADAMTS13, específica de la PTT3,4.
El ticagrelor es último inhibidor de P2Y12 aprobado en el mercado. Se diferencia del clopidogrel y del prasugrel en su estructura (dado que se trata de una ciclopentil-triazolopirimidina), en su mecanismo de acción, que es reversible y en su farmacodinámica, que no requiere metabolización tras su absorción para la inhibición de la agregación plaquetaria1.
En la base de datos de farmacovigilancia de la Organización Mundial de la Salud (VigiBase®), se han documentado 15 casos de PTT asociados al uso de ticagrelor y 447 asociados al clopidogrel6. Las guías clínicas para el manejo de la TAPD y de NSTEMI no mencionan la PTT como un posible evento adverso asociado a los inhibidores de P2Y12, ni describen su manejo.
No existe un consenso sobre el tratamiento de los pacientes que desarrollan PTT como un evento adverso asociado a la terapia con inhibidores de P2Y127. Se ha documentado un caso de PTT en un paciente tratado con AAS, con antecedentes de PTT asociada al clopidogrel8; sin embargo, no se ha publicado ningún caso de PTT asociado a los inhibidores de P2Y12 en los pacientes con antecedentes de PTT. Algunos autores recomiendan reiniciar la TAPD una vez recuperada la trombocitopenia inicial7; sin embargo, en nuestro paciente, el episodio de PTT se exacerbó tras reiniciarla.
Aunque aún se desconoce el mecanismo por el cual los inhibidores de P2Y12 participan en el desarrollo de PTT aguda, algunos autores los han relacionado con una reacción a la ticlopidina mediada por un mecanismo inmune, habiendo sido el resto asociados al daño o estimulación del endotelio, provocando una secreción del cWF. En este caso, la baja actividad de ADAMTS13 sugiere la mediación de un mecanismo inmune, lo que contrasta con la hipótesis de otros autores9. Así mismo, revela que la PTT inducida por el ticagrelor podría estar mediada por varios mecanismos, en lugar de únicamente por el daño endotelial. Son necesarios más estudios para dilucidar el mecanismo subyacente.
Aplicando el algoritmo de Naranjo, existe una asociación probable entre los 2 fármacos y los EA, con una puntuación de 5 para el ticagrelor y 6 para el clopidogrel, lo que descarta el reinicio de estas terapias10.
En conclusión, describimos la exacerbación de un episodio previo de PTT en un paciente que estaba recibiendo tratamiento con inhibidores de P2Y12. El paciente desarrolló PTT al recibir ticagrelor, una reacción poco descrita en la literatura, y posteriormente, tras reiniciar la TAPD con clopidogrel experimentó una exacerbación de la PTT, siendo esta una asociación más ampliamente conocida.
Consentimiento informadoEl paciente firmó un consentimiento informado, adjunto al presente informe de caso.
FinanciaciónEste estudio no recibió financiación alguna del sector público, privado o de organizaciones sin ánimo de lucro.
Conflicto de interesesLos autores enumerados en el manuscrito no tienen filiaciones o están implicado en ninguna organización o entidad con intereses financieros o no financieros en relación al tema o materiales abordados en este manuscrito.
Declaración de autoríaTodos los autores cumplen los criterios de autoría de la ICMJE.L. Macía-Rivas estuvo implicada en la concepción del estudio, así como en la totalidad del proceso. I. Maray participó en el desarrollo de la idea, realizó la revisión de la literatura, contribuyó a la redacción del artículo, y aprobó la versión final del manuscrito. C. L. Fernández-Laguna, C. Álvarez-Asteinza and A. Lozano-Blázquez participaron en la revisión del manuscrito.