analizar y describir las concentraciones de eculizumab y el bloqueo del complemento en los pacientes con síndrome hemolítico urémico atípico (SHUa) y glomerulopatía C3, y definir un margen terapéutico donde se alcance una alta probabilidad de conseguir eficacia terapéutica.
Métodosestudio observacional, ambispectivo y multicéntrico que incluyó pacientes adultos y pediátricos diagnosticados de SHUa y glomerulopatía C3 desde septiembre de 2020 hasta octubre de 2022 en 5 hospitales de España. Eculizumab se administró a las dosis recomendadas por la ficha técnica. Se determinaron las concentraciones pre y posdosis de eculizumab, así como del bloqueo de la vía clásica del complemento (CH50). Se recogieron variables sociodemográficas, analíticas y clínicas, y se calcularon los parámetros farmacocinéticos. Para establecer el punto de corte de las concentraciones de eculizumab que predecían el bloqueo del complemento se realizó un análisis de curvas ROC (Receiver Operating Characteristic). Se utilizó el test de Kruskal-Wallis para contrastar las diferencias en distintos parámetros según las concentraciones de eculizumab.
Resultadosse incluyeron 25 pacientes, 19 adultos (76,0%) y 6 pediátricos (24,0%), con edades medianas de 43,4 (RIC 35,7-48,8) y 10,1 (RIC 9,6-11,3) años, respectivamente. De ellos, 22 (88,0%) pacientes fueron diagnosticados con SHUa y 3 (12,0%) con glomerulopatía C3. Se determinaron un total de 111 concentraciones de eculizumab. Las concentraciones predosis y posdosis medias detectadas durante la fase de mantenimiento fueron 243,8 (SD 240,6) μg/ml y 747,4 (SD 444,3) μg/ml, respectivamente. Se observó un aumento del bloqueo del complemento a mayores concentraciones predosis (p=0,002) y una disminución de la creatinina sérica a mayores concentraciones tanto pre como posdosis (p=0,001 y p=0,017, respectivamente). Mediante curvas ROC se determinó que una concentración predosis >149,0 μg/ml es óptima para conseguir el bloqueo del complemento, con un AUC de 0,87 (0,78-0,95). Finalmente, se observó una elevada variabilidad interindividual (48,9% CV), con una menor variabilidad intraindividual (11,9% CV) en el aclaramiento de eculizumab.
Conclusionesel presente estudio reporta concentraciones supraterapéuticas de eculizumab en pacientes con SHUa y define unas concentraciones superiores a las descritas en ficha técnica para conseguir el bloqueo del complemento, incitando así a la personalización del tratamiento con eculizumab.
The objective of the study was to analyze and describe the concentrations of eculizumab and the complement blockade in patients with atypical hemolytic uremic syndrome (aHUS) and C3 glomerulopathy, and to define a therapeutic margin where there is a high probability of achieving therapeutic efficacy.
MethodsObservational, ambispective and multicenter study that included adult and pediatric patients diagnosed with aHUS and C3 glomerulopathy from September 2020 to October 2022 in five hospitals in Spain. Eculizumab was administered at the doses recommended by the data sheet according to the European Medicines Agency (EMA). Pre-dose and post-dose concentrations of eculizumab were determined, as well as blockade of the classical complement pathway (CH50). Sociodemographic and clinical data were collected, and pharmacokinetic parameters were calculated. To establish the cut-off point for eculizumab concentrations that predicted complement blockade, Receiver Operating Characteristic (ROC) curve analysis was performed. Lastly, the Kruskal-Wallis test was used to contrast the differences in different parameters according to eculizumab concentrations.
ResultsTwenty-five patients were included, 19 adults (76.0%) and 6 pediatrics (24.0%), with median ages of 43.4 (IQR 35.7-48.8) and 10.1 (IQR 9.6-11.3) years, respectively. Of these, 22 (88.0%) patients were diagnosed with aHUS and 3 (12.0%) with C3 glomerulopathy. A total of 111 eculizumab concentrations were determined. Mean pre-dose and post-dose concentration values detected during the maintenance phase were 243.8 (SD 240.6) μg/mL and 747.4 (SD 444.3) μg/mL, respectively. Increased complement blockade was observed at higher pre-dose concentrations (p=0.002) and decreased serum creatinine at both higher pre- and post-dose concentrations (p=0.001 and p=0.017, respectively). Using ROC curves, it was determined that a pre-dose concentration >149.0 μg/mL was optimal to achieve complement blockade, with an AUC of 0.87 (0.78-0.95). Finally, high inter-individual (48.9% CV) with low intra-individual variabilities (11.9% CV) in eculizumab clearance were observed.
ConclusionsThe present study reports supratherapeutic concentrations of eculizumab in patients with aHUS, and defines higher concentrations than those described in the data sheet to achieve blockade, thus encouraging the personalization of treatment with eculizumab.
El síndrome hemolítico urémico atípico (SHUa) es una forma rara de microangiopatía trombótica (MAT) resultante de una desregulación de la vía alternativa del complemento a nivel de la superficie de la membrana endotelial, provocando una activación incontrolada del complemento1.
Las manifestaciones clínicas del SHUa se caracterizan por la triada de anemia hemolítica no autoinmune, trombocitopenia y fracaso renal agudo (FRA), aunque pueden existir complicaciones sistémicas extrarrenales con afectación de diferentes órganos como el hígado, el pulmón, el corazón, el intestino y el sistema nervioso central2,3. De un 50 a 60% de los pacientes con SHUa, la desregulación es debido a mutaciones en los genes que codifican para proteínas reguladoras de la vía alternativa del complemento, como factor H, factor I, factor B, C3, trombomodulina y proteína cofactor de membrana (MCP), favoreciendo la activación persistente del complejo C5b-9 o complejo de ataque a la membrana (CAM) y provocando daño endotelial1,4. La desregulación también puede deberse a anticuerpos frente a proteínas del complemento, como el factor H, descrito más frecuentemente en los pacientes pediátricos (de 25 a 50%) frente a adultos (de 5 a 10%)3,5.
La glomerulopatía C3, incluyendo la enfermedad por depósitos densos (EDD) y glomerulonefritis C3 (GNC3), es una enfermedad renal debida a una hiperactivación de la vía alternativa del complemento, desencadenando la formación de depósitos glomerulares con predominio de proteína C3. Esta desregulación puede deberse a mutaciones en las proteínas reguladoras o a la presencia de autoanticuerpos frente a estas. El factor nefrítico C3 (FNC3) es el autoanticuerpo presente con mayor frecuencia en esta enfermedad. Las manifestaciones clínicas comunes a los 2 subtipos de glomerulopatía C3 son la presencia de micro o macrohematuria, con diferentes grados de proteinuria, asociado a un deterioro progresivo de la función renal6.
Eculizumab (Soliris®) es un anticuerpo monoclonal humanizado recombinante dirigido específicamente a la proteína del complemento C5, impidiendo su escisión por la C5 convertasa en C5a (anafilotoxina proinflamatoria) y C5b y bloqueando la formación del CAM, responsable de la lisis celular7. En el SHUa, eculizumab permite alcanzar una rápida respuesta manifestada con la normalización de los parámetros de hematológicos y una mejoría de la función renal[8,9]. Aunque la evidencia es más limitada, eculizumab ha demostrado ser también una opción de tratamiento en la glomerulopatía C3, evidenciándose en algunos pacientes una reducción de la proteinuria y una mejoría o estabilización de la función renal10–12.
Hasta el momento, la monitorización de la eficacia de eculizumab se determina, principalmente, mediante biomarcadores de hemólisis (haptoglobina y LDH), recuento plaquetario, marcadores de la función renal, actividad hemolítica del complemento (CH50) y los niveles circulantes del componente C3. Aunque los datos de su farmacocinética (PK) y farmacodinamia (PD) son limitados, algunos estudios publicados relacionan concentraciones de eculizumab con biomarcadores representativos de la actividad del complemento, como CH50, que mide la función completa de la vía clásica del complemento13,14.
Según la ficha técnica de eculizumab, concentraciones séricas predosis o valle de 50 a 100 μg/ml son suficientes para lograr una inhibición prácticamente completa de la actividad del complemento terminal y concentraciones bajas sostenidas de C5 libre7. No obstante, existe cierta controversia en relación a este margen terapéutico, ya que varios estudios han reportado concentraciones superiores8,9,13,15–17. Además, los estudios farmacocinéticos realizados muestran el impacto de determinadas covariables en la farmacocinética de eculizumab, como el peso y las concentraciones de C5b913,15. Dada la existencia de una alta variabilidad interindividual en el perfil farmacocinético de eculizumab, el objetivo del presente estudio ha sido analizar y describir las concentraciones de eculizumab y el bloqueo del complemento en los pacientes con SHUa y glomerulopatía C3, y definir un margen terapéutico donde se alcance una alta probabilidad de conseguir eficacia terapéutica.
MétodosCohorte de pacientesEstudio observacional, ambispectivo y multicéntrico realizado desde septiembre de 2020 hasta octubre de 2022. Los 25 pacientes descritos en este estudio fueron diagnosticados con SHUa o glomerulonefritis C3 y recibieron tratamiento en los hospitales Universitari Vall d’Hebron (HUVH, Barcelona), Hospital Universitario Gregorio Marañón (Madrid), Hospital Universitario Miguel Servet (Zaragoza), Hospital Doctor Peset (Valencia) y Complejo Hospitalario Universitario de Santiago (Santiago de Compostela). Eculizumab se administró a las dosis recomendadas por la ficha técnica según la EMA (material suplementario 1)7.
Recolección de muestras de sangreSe extrajeron las muestras de sangre mediante venopunción (de 3 a 5 ml en los pacientes pediátricos y de 10 ml en los pacientes adultos). Se obtuvo la fracción sérica (para todas las determinaciones de complemento excepto C5b9s) y el plasma (para la determinación de C5b9s), que se separó por centrifugación (10 minutos, de 1.800 a 2.000 g a temperatura ambiente) en un plazo inferior a 4 horas tras la extracción. Se realizaron 2 alícuotas de cada muestra de suero y plasma que fueron conservadas en el congelador entre -80°C y -20°C hasta la determinación, estableciendo un tiempo de conservación de 8 meses según Passot et al.18. Se incluyeron a los pacientes de forma: a) prospectiva (Ecu-prosp), a partir del primero de agosto de 2021, y de estos, los que iniciaron el tratamiento con eculizumab se incluyeron durante la fase de inducción (Ecu-prosp-ind), y los que ya estaban en mantenimiento, durante la fase de mantenimiento (Ecu-prosp-mant). Antes de agosto de 2021 los pacientes se incluyeron de forma retrospectiva (Ecu-retrosp). Así, en los pacientes del grupo Ecu-prosp-ind, la muestra se extrajo en el momento previo a la administración de la dosis (predosis) y una hora después (posdosis, con el objetivo de simplificar la extracción en el hospital de día y reducir la estancia del paciente en el centro fuera de la práctica asistencial) en las semanas 3 (CI2.1 y CI2.2), 5 (CI3.1 y CI3.2), 15 (CI4.1 y CI4.2), 29 (CI5.1 y CI5.2) y 55 (CI6.1 y CI6.2). En los pacientes del grupo Ecu-prosp-mant, se realizaron 4 extracciones (predosis y posdosis) en 2 momentos cualesquiera del tratamiento, según criterio del investigador (CM1.1, CM1.2, CM2.1 y CM2.2). En los pacientes del grupo Ecu-retrosp, únicamente se pudo disponer de concentraciones predosis. En todos los pacientes se determinó el bloqueo de la actividad de la vía clásica del sistema de complemento (CH50).
Determinación de concentraciones de eculizumabSe resume en el material suplementario 2 la determinación de las concentraciones de eculizumab y del sistema del complemento (CH50, sC5b9 y C3).
Otras variables recogidasSe resume en el material suplementario 3 las otras variables recogidas en el estudio.
Parámetros farmacocinéticosEn aquellos pacientes en los que se disponía de concentraciones pre y posdosis en estado estacionario se determinó el volumen de distribución (Vd), el aclaramiento (CL), la constante de eliminación (k) y la semivida (t1/2) mediante las fórmulas:
Siendo CSSmax la concentración posdosis (μg/ml); CSSmin, la concentración predosis (μg /ml); Tau, el intervalo de dosificación (en días); k, la constante de velocidad de eliminación de primer orden (en días-1) y Vd, el volumen de distribución (en litros), asumiendo una cinética monocompartimental, según lo reportado por otros autores19,20. Finalmente, se calculó la variabilidad intra e interindividual. Para el cálculo de la variabilidad intraindividual era necesario que los pacientes tuvieran más de una determinación.
Análisis estadísticoLas variables continuas se describieron mediante la mediana y rango intercuartílico (RIC) o media y desviación estándar (SD) e intervalo de confianza del 95% (IC 95%), y las variables categóricas se describieron mediante frecuencia y porcentajes. Las variables continuas se compararon mediante la prueba t o la prueba de Wilcoxon, y las variables categóricas mediante la prueba de chi-cuadrado o la prueba exacta de Fisher, según correspondiera. Para establecer el punto de corte de las concentraciones que predecía el bloqueo del complemento se realizó un análisis de curvas ROC (Receiver Operating Characteristic). El índice de Youden ha sido utilizado para seleccionar el mejor punto de corte. Por último, se aplicó la prueba de Kruskal-Wallis (ANOVA no paramétrico) para contrastar las diferencias en distintos parámetros según las concentraciones de eculizumab. Todos los valores de p se basaron en una hipótesis bilateral, y se consideró un error tipo I (p <0,05). Los análisis estadísticos fueron realizados con R 4.2.2.
ResultadosCohorte de pacientesSe incluyeron 25 pacientes, 19 adultos (76,0%) y 6 pediátricos (24,0%), con edades medianas de 43,4 (RIC de 35,7 a 48,8) y 10,1 (RIC de 9,6 a 11,3) años, respectivamente. De ellos, 22 (88,0%) pacientes fueron diagnosticados de SHUa y 3 (12,0%) de glomerulopatía C3, todos tratados con eculizumab. Las características basales de los pacientes se describen en el material suplementario 4.
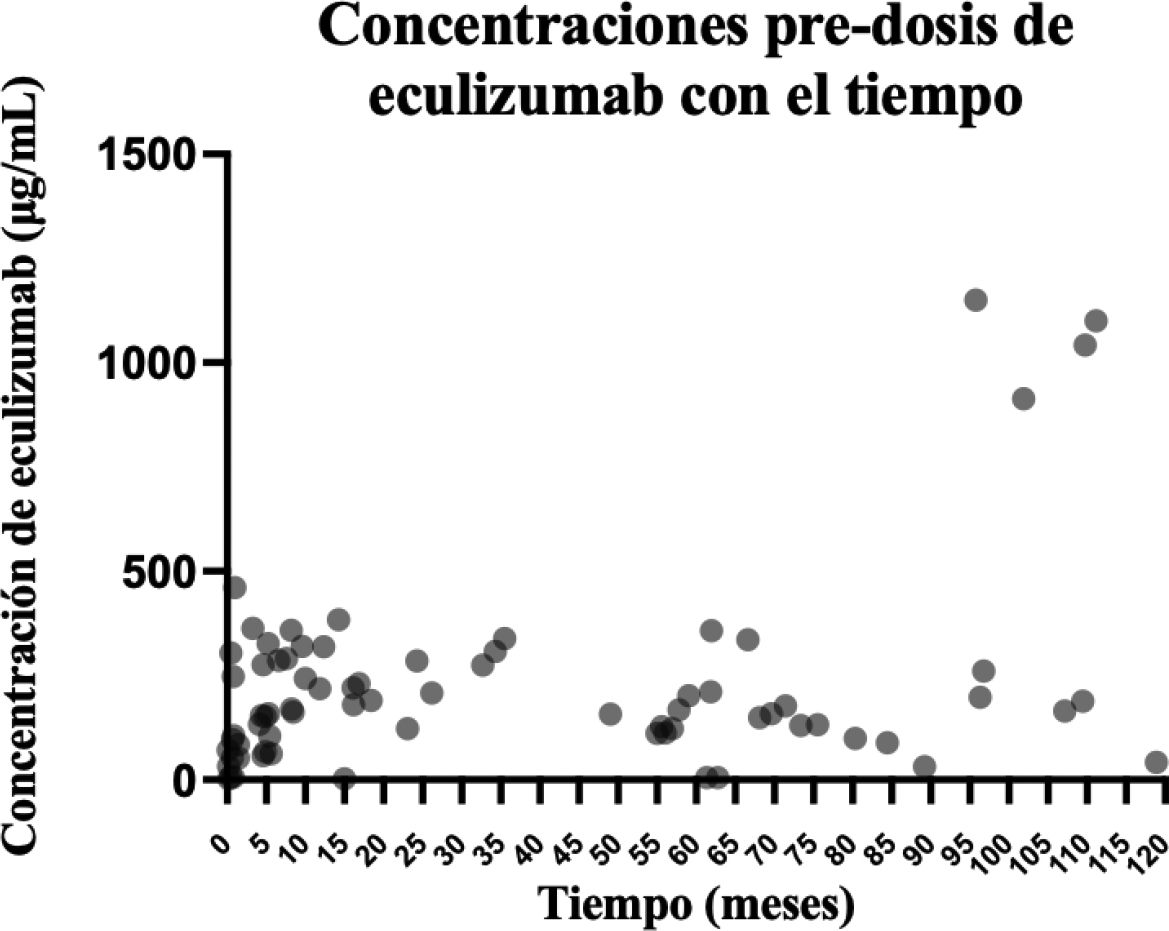
Concentraciones de eculizumabLas concentraciones predosis de eculizumab, medidas en los 25 pacientes incluidos, se muestran en la figura 1. Se incluyeron 3 (12,0%) pacientes retrospectivamente, 13 (52,0%) prospectivamente y 9 (36,0%) tanto retrospectiva como prospectivamente. Se determinaron un total de 111 concentraciones de eculizumab; 11 concentraciones predosis y 5 concentraciones posdosis durante la fase de inducción, y 59 concentraciones predosis y 36 concentraciones posdosis durante la fase de mantenimiento. Los valores de concentración predosis y posdosis medios fueron 115,6 (SD 143,3) μg/ml y 472,9 (SD 273,0) μg/ml en la fase de inducción y 243,8 (SD 240,6) μg/ml y 747,4 (SD 444,3) μg/ml durante la fase mantenimiento. En la fase de inducción, las concentraciones de eculizumab aumentaron gradualmente con cada intervalo de 2 semanas en un promedio de 90,5 (IC del 95 %: 50,3-157,0) μg/ml.
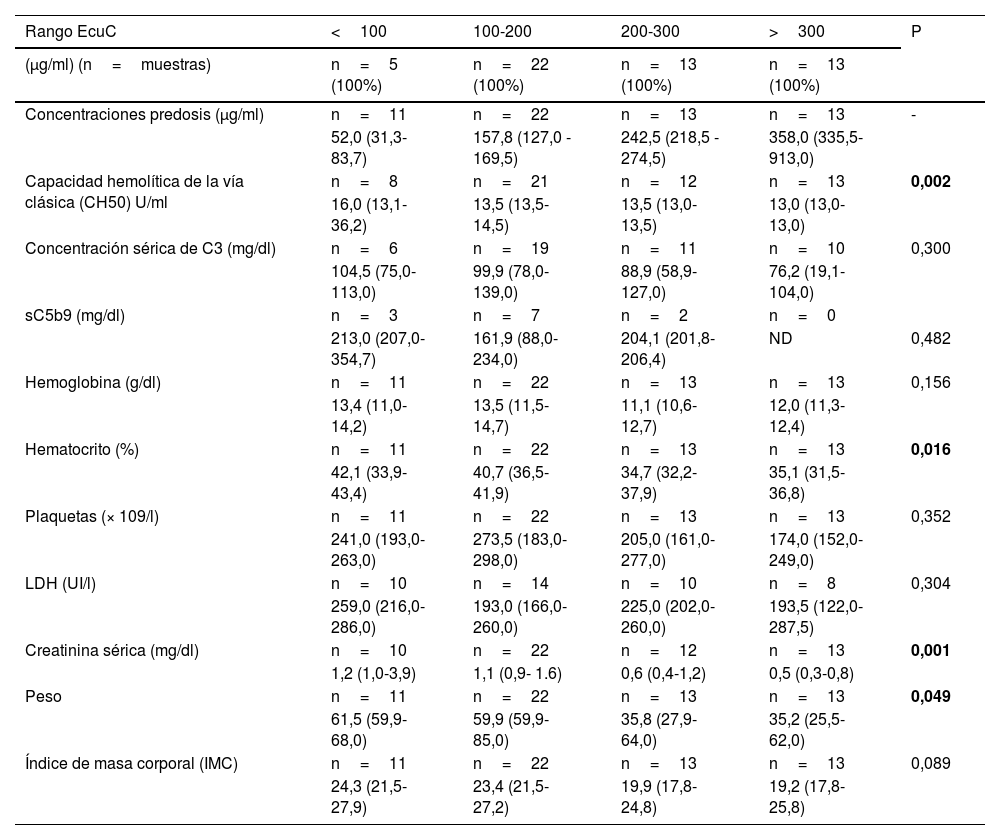
Relación de las concentraciones de eculizumab con otros parámetros analíticosLas concentraciones pre y posdosis de eculizumab, separados por rangos de concentración, y su relación con otros parámetros analíticos se muestran en las tablas 1 y 2, respectivamente. Teniendo en cuenta las concentraciones predosis, se observó un aumento del bloqueo del complemento a mayores concentraciones (p=0,002). Además, el hematocrito disminuyó significativamente a mayores concentraciones de eculizumab (p=0,016), así como la creatinina sérica (menor creatinina a mayores concentraciones, p=0,001) y el peso corporal de los pacientes (p=0,049).
Relación entre las concentraciones predosis de eculizumab y otros parámetros analíticos (fase de mantenimiento)
| Rango EcuC | <100 | 100-200 | 200-300 | >300 | P |
|---|---|---|---|---|---|
| (μg/ml) (n=muestras) | n=5 (100%) | n=22 (100%) | n=13 (100%) | n=13 (100%) | |
| Concentraciones predosis (μg/ml) | n=11 | n=22 | n=13 | n=13 | - |
| 52,0 (31,3-83,7) | 157,8 (127,0 - 169,5) | 242,5 (218,5 - 274,5) | 358,0 (335,5-913,0) | ||
| Capacidad hemolítica de la vía clásica (CH50) U/ml | n=8 | n=21 | n=12 | n=13 | 0,002 |
| 16,0 (13,1-36,2) | 13,5 (13,5-14,5) | 13,5 (13,0-13,5) | 13,0 (13,0-13,0) | ||
| Concentración sérica de C3 (mg/dl) | n=6 | n=19 | n=11 | n=10 | 0,300 |
| 104,5 (75,0-113,0) | 99,9 (78,0-139,0) | 88,9 (58,9-127,0) | 76,2 (19,1-104,0) | ||
| sC5b9 (mg/dl) | n=3 | n=7 | n=2 | n=0 | |
| 213,0 (207,0-354,7) | 161,9 (88,0-234,0) | 204,1 (201,8-206,4) | ND | 0,482 | |
| Hemoglobina (g/dl) | n=11 | n=22 | n=13 | n=13 | 0,156 |
| 13,4 (11,0-14,2) | 13,5 (11,5-14,7) | 11,1 (10,6-12,7) | 12,0 (11,3-12,4) | ||
| Hematocrito (%) | n=11 | n=22 | n=13 | n=13 | 0,016 |
| 42,1 (33,9-43,4) | 40,7 (36,5-41,9) | 34,7 (32,2-37,9) | 35,1 (31,5-36,8) | ||
| Plaquetas (× 109/l) | n=11 | n=22 | n=13 | n=13 | 0,352 |
| 241,0 (193,0-263,0) | 273,5 (183,0-298,0) | 205,0 (161,0-277,0) | 174,0 (152,0-249,0) | ||
| LDH (UI/l) | n=10 | n=14 | n=10 | n=8 | 0,304 |
| 259,0 (216,0-286,0) | 193,0 (166,0-260,0) | 225,0 (202,0-260,0) | 193,5 (122,0-287,5) | ||
| Creatinina sérica (mg/dl) | n=10 | n=22 | n=12 | n=13 | 0,001 |
| 1,2 (1,0-3,9) | 1,1 (0,9- 1.6) | 0,6 (0,4-1,2) | 0,5 (0,3-0,8) | ||
| Peso | n=11 | n=22 | n=13 | n=13 | 0,049 |
| 61,5 (59,9-68,0) | 59,9 (59,9-85,0) | 35,8 (27,9-64,0) | 35,2 (25,5-62,0) | ||
| Índice de masa corporal (IMC) | n=11 | n=22 | n=13 | n=13 | 0,089 |
| 24,3 (21,5-27,9) | 23,4 (21,5-27,2) | 19,9 (17,8-24,8) | 19,2 (17,8-25,8) |
CH50: capacidad hemolítica de la vía clásica; EcuC: concentraciones de eculizumab; IMC: índice de masa corporal; ND: no disponible.
Relación entre las concentraciones postdosis de eculizumab y otros parámetros analíticos (fase de mantenimiento)
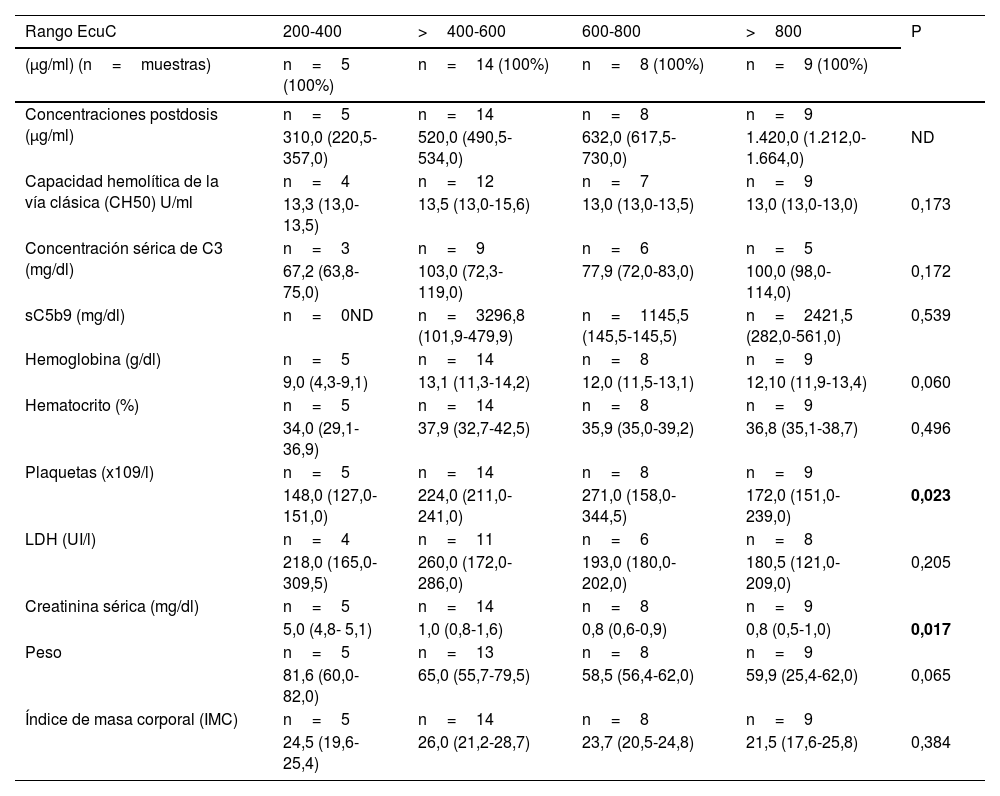
| Rango EcuC | 200-400 | >400-600 | 600-800 | >800 | P |
|---|---|---|---|---|---|
| (μg/ml) (n=muestras) | n=5 (100%) | n=14 (100%) | n=8 (100%) | n=9 (100%) | |
| Concentraciones postdosis (μg/ml) | n=5 | n=14 | n=8 | n=9 | |
| 310,0 (220,5-357,0) | 520,0 (490,5-534,0) | 632,0 (617,5-730,0) | 1.420,0 (1.212,0-1.664,0) | ND | |
| Capacidad hemolítica de la vía clásica (CH50) U/ml | n=4 | n=12 | n=7 | n=9 | |
| 13,3 (13,0-13,5) | 13,5 (13,0-15,6) | 13,0 (13,0-13,5) | 13,0 (13,0-13,0) | 0,173 | |
| Concentración sérica de C3 (mg/dl) | n=3 | n=9 | n=6 | n=5 | |
| 67,2 (63,8-75,0) | 103,0 (72,3-119,0) | 77,9 (72,0-83,0) | 100,0 (98,0-114,0) | 0,172 | |
| sC5b9 (mg/dl) | n=0ND | n=3296,8 (101,9-479,9) | n=1145,5 (145,5-145,5) | n=2421,5 (282,0-561,0) | 0,539 |
| Hemoglobina (g/dl) | n=5 | n=14 | n=8 | n=9 | |
| 9,0 (4,3-9,1) | 13,1 (11,3-14,2) | 12,0 (11,5-13,1) | 12,10 (11,9-13,4) | 0,060 | |
| Hematocrito (%) | n=5 | n=14 | n=8 | n=9 | |
| 34,0 (29,1-36,9) | 37,9 (32,7-42,5) | 35,9 (35,0-39,2) | 36,8 (35,1-38,7) | 0,496 | |
| Plaquetas (x109/l) | n=5 | n=14 | n=8 | n=9 | |
| 148,0 (127,0-151,0) | 224,0 (211,0-241,0) | 271,0 (158,0-344,5) | 172,0 (151,0-239,0) | 0,023 | |
| LDH (UI/l) | n=4 | n=11 | n=6 | n=8 | |
| 218,0 (165,0-309,5) | 260,0 (172,0-286,0) | 193,0 (180,0-202,0) | 180,5 (121,0-209,0) | 0,205 | |
| Creatinina sérica (mg/dl) | n=5 | n=14 | n=8 | n=9 | |
| 5,0 (4,8- 5,1) | 1,0 (0,8-1,6) | 0,8 (0,6-0,9) | 0,8 (0,5-1,0) | 0,017 | |
| Peso | n=5 | n=13 | n=8 | n=9 | |
| 81,6 (60,0-82,0) | 65,0 (55,7-79,5) | 58,5 (56,4-62,0) | 59,9 (25,4-62,0) | 0,065 | |
| Índice de masa corporal (IMC) | n=5 | n=14 | n=8 | n=9 | |
| 24,5 (19,6-25,4) | 26,0 (21,2-28,7) | 23,7 (20,5-24,8) | 21,5 (17,6-25,8) | 0,384 |
CH50: capacidad hemolítica de la vía clásica; EcuC: concentraciones de eculizumab; IMC: índice de masa corporal; ND: no disponible.
Teniendo en cuenta las concentraciones postdosis, la creatinina sérica también mostró diferencias estadísticamente significativas (p=0,017), así como las plaquetas (a mayor concentración, mayor recuento de plaquetas, p=0,023), aunque a partir de concentraciones superiores a 800 μg/ml no se observa este aumento.
No se observaron diferencias estadísticamente significativas en ninguno de los casos con la concentración de C5b9.
Efectos adversos y duración del tratamiento con eculizumabEn relación a los efectos adversos con el tratamiento con eculizumab, únicamente se observó una reacción infusional en uno de los pacientes.
En el momento del análisis de los datos, se había retirado el tratamiento con eculizumab a 13 pacientes (52,0%). Los motivos de retirada fueron: falta de beneficio (5), progresiva mejoría clínica (4), fallecimiento por otra causa (2), necesidad de cuidados paliativos (1) y cambio a ravulizumab (1). La duración media del tratamiento en los pacientes a los que se les retiró fue de 11,4 meses (1,9-111,2 meses). Doce (48,0%) pacientes continúan con eculizumab, tras 83,7 (11,1-122,2) meses de tratamiento.
Inhibición del complementoLas características de los pacientes separados en función de si en algún momento del tratamiento con eculizumab lograron la inhibición completa del complemento, es decir, obtuvieron valores de CH50 indetectables21 (en este caso, y teniendo en cuenta el límite de detección de la técnica utilizada, CH50 ≤ 13,49 %) se describen en el material suplementario 5.
Mediante curvas ROC determinamos que concentraciones predosis de eculizumab superiores a 149,0 μg/ml son óptimas para conseguir el bloqueo del complemento, presente en 40 (67,8%) de las muestras, con un AUC de 0,87 (0,78-0,95) y una sensibilidad y especificidad del 80,6 y 78,9%, respectivamente (material suplementario 6). En 5 muestras no se pudo determinar la inhibición del complemento.
Parámetros farmacocinéticosLos parámetros farmacocinéticos se pudieron calcular en 15 pacientes (todos adultos con SHUa excepto un paciente con glomerulopatía C3) y en 10 de ellos se pudo calcular, además, la variabilidad intraindividual. La mediana del aclaramiento fue de 8,7 (6,4-11,2) ml/h, el volumen de distribución de 3,6 (2,2-5,3) litros y la semivida de 12,3 (10,8-13,0) días. Además, observamos una elevada variabilidad interindividual en el aclaramiento de eculizumab (48,9% CV), con una menor variabilidad intraindividual (11,9% CV). Al analizar los parámetros farmacocinéticos del único paciente con glomerulopatía C3 en el que se pudieron calcular, se observó que el aclaramiento fue de 11,9 ml/h, el volumen de distribución de 2,2 litros y la semivida de 5,4 días.
DiscusiónEl presente estudio analiza y describe las concentraciones de eculizumab en pacientes con SHUa y glomerulopatía C3, al mismo tiempo que define un potencial margen terapéutico para conseguir eficacia terapéutica, es decir, el bloqueo total del complemento. Se observa, además, una sobreexposición al fármaco en la mayoría de los pacientes con SHUa, considerando el margen terapéutico de concentración predosis objetivo de 50-100 μg/ml, descrito en la ficha técnica7.
En relación con las concentraciones de eculizumab, estas son superiores en la mayoría de los pacientes a las consideradas dentro del margen terapéutico según ficha técnica7. Este hallazgo ha sido reportado previamente también por otros autores, Gatault et al. reportaron que 8 de los 9 pacientes incluidos presentaban concentraciones predosis medias de eculizumab por encima de 100 μg/ml y 5 por encima de 300 μg/ml[13]. En el estudio piloto de Reiss et al. observaron que las concentraciones predosis de eculizumab fueron superiores a 100 μg/ml en todos los pacientes, presentando elevada variabilidad intraindividual16. En el estudio de Volokhina et al. observaron que en los 11 pacientes estudiados las concentraciones detectadas fueron 36-459 μg/ml (n=27) y 40-772 μg/ml (n=90) durante las fases de inducción y de mantenimiento, respectivamente17. Greenbaum et al. observaron que las concentraciones predosis de eculizumab de los 22 pacientes estudiados fueron generalmente >50 μg/ml (tanto en inducción como en mantenimiento), y los valores de posdosis fueron <700 μg/ml[9]. Finalmente, Passot et al. observaron que todos los 40 pacientes estudiados presentaron concentraciones de eculizumab ≥100 μg/ml, con rangos de concentraciones entre 124 ± 9 y 1.065 ± 121 μg/ml15.
Con nuestros datos, al relacionar las concentraciones con el bloqueo del complemento en fase de mantenimiento, también observamos que estas podrían ser algo superiores a las definidas, con un cut-off de 149,0 μg/ml. Jodele et al. destacaron que la actividad de CH50 medida en suero enriquecido con un aumento de concentración de eculizumab mostró una meseta de inhibición de CH50 para eculizumab a concentraciones superiores a 30 μg/ml[20], y en el estudio de Volokhina et al. observaron que en todas las muestras con concentraciones de eculizumab ≥50 μg/ml se observaba un bloqueo del complemento adecuado (CH50 ≤ 12%)17.
En el presente estudio observamos una relación inversa entre las concentraciones de eculizumab y el efecto del peso. Otros autores como Gatault et al. también reportaron esta relación inversa, siendo el peso el principal factor determinante de la variabilidad interindividual observada13. Además, a menor peso de los pacientes, presentaban un menor aclaramiento del fármaco, así como una mayor semivida, efecto reportado a menudo también con otros anticuerpos22.
En relación con los estudios genéticos, se ha descrito que los pacientes con mutaciones en MCP y CFI presentan un mejor pronóstico que aquellos con variantes patogénicas en el gen CFH, siendo estas últimas las descritas con una mayor frecuencia4. Los haplotipos en homocigosis de los genes CFH (CFH tgtgt) y MCP (MCPggaac) han demostrado estar relacionados con un mayor riesgo de SHUa23. Sin embargo, hasta el momento, no se ha evaluado el impacto de la farmacogenética en la exposición y los parámetros farmacocinéticos de eculizumab. En nuestra cohorte, en el 29,4% de pacientes se confirmó la presencia de variantes patogénicas en el estudio genético del complemento, afectando a los genes CFH, MCP y CFI. Además, un 70,6% presentaba uno o más polimorfismo de riesgo de SHUa en los genes CFH y/o MCP, 7 de ellos en homocigosis.
Respecto a las otras variables estudiadas, se observó una relación inversa entre la creatinina sérica y las concentraciones de eculizumab, tanto pre como posdosis, mostrando una posible mejoría de la disfunción renal. Se observó una disminución del hematocrito a mayores concentraciones de eculizumab, destacando que las concentraciones óptimas para la normalización del hematocrito se encontraban entre 100 y 200 μg/ml. Este mismo fenómeno se observó en la hemoglobina y el recuento de plaquetas, aunque sin significación estadística. No obstante, podría plantearse como un posible efecto adverso relacionado con concentraciones elevadas de eculizumab (siendo, tanto la anemia como la trombocitopenia, reacciones adversas notificadas en los ensayos clínicos).
Teniendo en cuenta las concentraciones posdosis, se observó una relación directa entre las plaquetas y las concentraciones posdosis, mostrando una potencial mejoría de las manifestaciones hematológicas de la enfermedad a mayores concentraciones (en este caso, posdosis) de eculizumab. En concordancia con lo observado con las concentraciones predosis, no se evidencia mejoría desde el punto de vista hematológico en el rango superior de concentraciones (>800 μg/ml), lo que iría a favor de un rango óptimo de concentraciones algo inferior (400-600 μg/ml para hemoglobina y hematocrito y 600-800 μg/ml para el recuento de plaquetas). En relación con sC5b-9, no se observaron diferencias estadísticamente significativas, ni con concentraciones pre ni posdosis, supuestamente por el bajo número de pacientes a los que se les solicitó. Volokhina et al. reportaron que en 2 pacientes con concentraciones inicialmente altas de sC5b-9 las concentraciones de eculizumab se encontraron por debajo del margen terapéutico objetivo una semana tras la primera infusión17. Jodele et al. observaron que los pacientes con concentraciones más altas del complejo sC5b-9 antes del tratamiento presentaban un aclaramiento inicial más rápido de eculizumab20. Curiosamente, un estudio reciente indicó que eculizumab es capaz de unirse a sC5b-9 in vitro, lo que sugiere que parte del fármaco se puede depurar en un complejo con sC5b-9 en la primera infusión24. En el estudio de Fakhouri et al., concentraciones elevadas de sC5b-9 al suspender eculizumab se asociaron de forma independiente con el riesgo de recaída de SHUa25. SC5b-9 ha demostrado permanecer detectable en una proporción significativa de pacientes a pesar del bloqueo óptimo de C5, por razones poco claras, pudiendo implicar la escisión de C5 a través de vías independientes de la C5 convertasa24,26–29.
Finalmente, observamos una elevada variabilidad interindividual (48,9%) pero una baja variabilidad intraindividual (11,9% CV) en el aclaramiento de eculizumab. Ter Avest et al. observaron una variabilidad intraindividual más elevada del 34,4%, que justificaron por variaciones en la cantidad de C5 disponible debido, por ejemplo, a infecciones30. En relación a los parámetros farmacocinéticos, la mediana del aclaramiento de los pacientes incluidos en el estudio fue de 8,7 (6,4-11,2) ml/h, el volumen de distribución de 3,6 (2,2-5,3) litros y la semivida de 12,3 (10,8-13,0) días, valores similares a los descritos en la ficha técnica de eculizumab7.
Este estudio presenta algunas limitaciones. Primero, el número de pacientes con glomerulopatía C3 es muy reducido, dificultando la posibilidad de obtener conclusiones en esta población. Aún así, se consideró que el fármaco podría presentar un comportamento similar al de los pacientes con SHUa. Segundo, el límite inferior de detección de la técnica utilizada para la determinación del bloqueo del complemento es de 13,49 %, mientras que en otros estudios se reporta del 10%; sin embargo, ambos límites permiten diferenciar entre valores óptimos o subóptimos del bloqueo del complemento con el uso de eculizumab. Y, tercero, no fue posible disponer de más muestras en tiempos diferentes a los pre y posdosis, lo que hubiera facilitado la caracterización de la farmacocinética de eculizumab, así como la determinación de las variabilidades inter e intraindividual. No obstante, esto facilitó la inclusión de un mayor número de pacientes, ya que no hubo prácticamente más intervenciones de las derivadas de la propia actividad asistencial.
En conclusión, el presente estudio describe la farmacocinética de eculizumab en los pacientes con SHUa y glomerulopatía C3 y analiza las concentraciones óptimas para conseguir el bloqueo del complemento, siendo estas superiores a las descritas en la ficha técnica. Para determinar completamente la eficacia del tratamiento con eculizumab, se deben desarrollar modelos farmacocinéticos poblacionales o algoritmos para personalizar el tratamiento, considerando tanto las concentraciones de eculizumab como el bloqueo del complemento por CH50, así como el peso y las concentraciones de sC5b9. La optimización de la posología de eculizumab en base a la monitorización farmacocinética debe acompañarse de un seguimiento clínico estrecho, garantizando así la eficacia y seguridad del tratamiento.
Responsabilidades éticasEl protocolo del estudio fue aprobado por el CEIm del Hospital Universitari Vall d’Hebron (código de protocolo EPA(AG)01/2020(5579).
FinanciaciónEste trabajo se ha llevado a cabo con la ayuda de la Fundación Española de Farmacia Hospitalaria (FEFH) y la Sociedad Española de Farmacia Hospitalaria (SEFH) a través la convocatoria de ayudas para Grupos de Trabajo 2020–2021.
AutoríaLa concepción y el diseño del trabajo fue realizado por Marta Miarons, Alba Pau Parra y Natalia Ramos; la selección de pacientes y recogida de datos fue realizado por Alba Pau Parra, Natalia Ramos, Silvia Manrique-Rodríguez, Monica Climente, Laura García Quintanilla, Ángel Escolano y Marta Miarons; el análisis y la interpretación de los datos fue realizado por Alba Pau Parra, Janire Perurena-Prieto y Marta Miarons; la escritura del artículo fue realizada por Alba Pau Parra y Marta Miarons. Todos los autores revisaron, contribuyeron en mejorar el manuscrito y aprobaron la versión final del mismo para su publicación.
Conflicto de interesesNo constan conflictos de intereses.
Aportación a la literatura científicaEl presente estudio describe la farmacocinética del eculizumab en los pacientes con SHUa y glomerulopatía C3 y reporta que, en la mayoría de los pacientes, se observan concentraciones superiores a las descritas, con unas concentraciones predosis >149,0 μg/ml como potencialmente óptimas para conseguir el bloqueo del complemento.
Además, se observa un aumento del bloqueo del complemento a mayores concentraciones predosis y una disminución de la creatinina sérica a mayores concentraciones tanto pre como posdosis. Finalmente, se describe una elevada variabilidad interindividual y una menor variabilidad intraindividual en el aclaramiento de eculizumab.