El objetivo del estudio es aportar información toxicológica mediante el ensayo HET-CAM, de los colirios de Fluconazol y Voriconazol elaborados de manera habitual en los Servicios de Farmacia para el tratamiento de las queratitis fúngicas.
MétodosEstudio experimental en el que se ensaya la potencial toxicidad ocular del colirio de voriconazol 10 mg/ml y fluconazol 2 mg/ml mediante el método Hen s Egg Test-Chorioallantoic Membrane (HET-CAM). Los resultados se fundamentan en la observación de los posibles procesos dañinos que pudiesen ocurrir en los vasos sanguíneos de la membrana corioalantoidea del embrión de pollo durante un tiempo de contacto de 300 segundos, calculándose posteriormente el índice de irritación (IS, Irritation Score).
Resultados y conclusionesSe obtienen IS nulos para ambas muestras, no mostrando por tanto indicios de irritación aguda apreciables, considerándose por tanto aptos para su utilización desde el punto de vista toxicológico.
The objective of the study is to provide toxicological information through the HET-CAM test of Fluconazole and Voriconazole eye drops prepared commonly in Pharmacy Services for the treatment of fungal keratitis.
MethodExperimental Study. The ocular toxicity of topical voriconazole 10 mg/ml and fluconazole 2 mg/ml were evaluated by the hen’s egg test (HET) on the chorioallantoic membrane (CAM). The effects on blood vessels were based on its behavior during 300 seconds and processes that may occur at each time, then we calculated the irritation index (is, irritation score).
Results and conclusionsBoth eye drops, voriconazol and fluconazole have been proven to be safe, since the IS that we obtained was zero for both samples and did not present significant signs of irritation. Therefore, these eyedrops are considered suitable for ocular use from a toxicological point of view.
Las queratítis fúngicas son patologías de extrema gravedad, difícil tratamiento y que en ocasiones pueden llegar a comprometer la visión de manera irreversible1. Actualmente, en España no se comercializan colirios antifúngicos para cubrir dicha indicación, por lo que este vacio se cubre mediante la preparación de fórmu- las magistrales oftálmicas a nivel hospitalario, reformulando medicamentos comerciales parenterales, que no están diseñados ni adaptados a la vía ocular.
Existen numerosos estudios sobre la efectividad, estabilidad y utilización de las formulaciones magistrales oftálmicas2,3, sin embargo no existen estudios sistemáticos de toxicidad de las mismas. El conocimiento de las formulaciones desde el punto de vista toxi- cológico es fundamental para comprobar la seguridad y para disponer de la información adecuada para la toma de decisiones farmacoterapeuticas4.
Se entiende por irritación ocular, las lesiones oculares como consecuencia de la aplicación de una sustancia de ensayo en la superficie anterior del ojo, y que son totalmente reversibles en los 21 días siguientes a la aplicación5.
El ensayo de Draize es un método «in vivo» que se ha utilizado durante años para evaluar los efectos oculares que aparecen por la exposición aguda de los compuestos sobrelamucosaocular delconejo, mediante la observación de las reacciones que ocurren a nivel de córnea, iris y conjuntiva6. Desde su introducción este ensayo fue criticado, tanto por razones éticas como científicas, lo que estimuló la búsqueda de nuevas alternativas basadas fundamentalmente en la reducción del número de animales a utilizar, en el refinamiento de la metodología y en el remplazamiento por métodos en los que no se utilicen animales para la investigación7.
Existen principalmente tres tipos de métodos alternativos «in vitro», los organotípicos, los basados en funciones celulares y ensayos de citotoxicidad y los fundamentados en modelos de tejido humano.
El método Hen s Egg Test-Chorioallantoic Membrane (HET-CAM), en un método alternativo clasificado dentro de los organotípicos que utiliza la membrana corioalantoide| (CAM) de huevos embrionados de pollo. Es utilizado en la industria para identificar el potencial irritante y/o para cuantificar el índice de irritación de materiales durante la investigación8,9.
El objetivo del estudio es aportar información toxicológica mediante el ensayo HET- CAM, de los colirios de Fluconazol y Voriconazol elaborados de manera habitual en los Servicios de Farmacia para el tratamiento de las queratitis fúngicas.
Material y métodoPreparación de los coliririosCon el fin de obtener preparaciones estériles, los colirios se han elaborado de acuerdo con las recomendaciones para la preparación aséptica, en campana de flujo laminar horizontal10.
La preparación del colirio de voriconazol al 1% se ha hecho mediante la reconstitución directa del vial de Vfend® (200 mg de voriconazol y Sulfobutiléter betaciclodextrina sódica), con 19 ml de agua para inyección para obtener 20 ml de una solución voriconazol 10 mg/ml11. El colirio de fluconazol 2 mg/ml, se obtiene directamente de la presentación intravenosa del Fluconazol® Normon 2 mg/ml (excipientes: Cloruro de sodio y Agua para preparaciones inyectables)12.
Previo envasado en frasco topacio, se realiza la filtración estéril de cada uno de los colirios a través de un filtro de 0,22 micras de tamaño de poro.
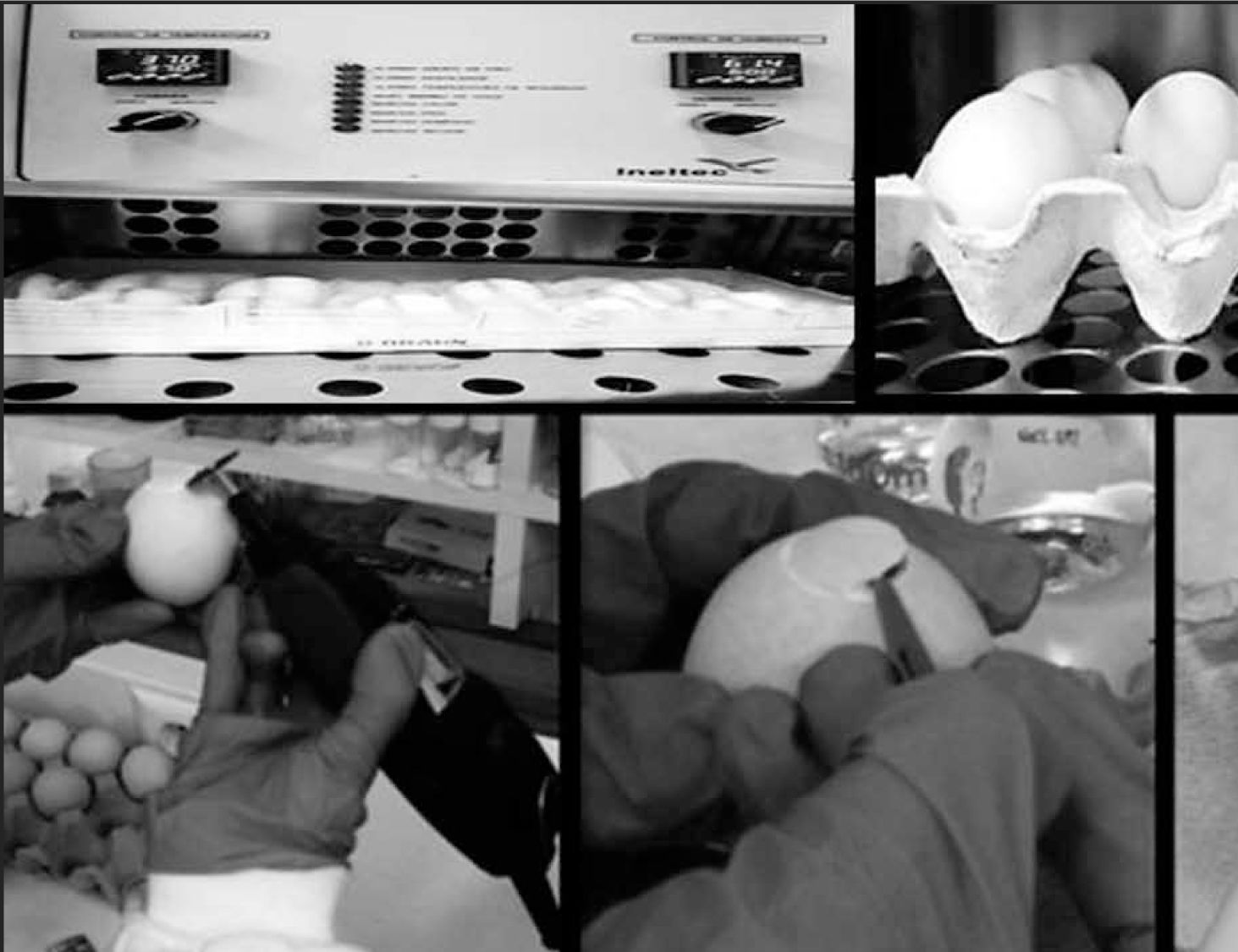
Desarrollo del métodoPara el desarrollo del ensayo HET-CAM se necesitan huevos de pollos broiler fecundados con un peso entre 50-60 g. Estos se introducen en una cámara climática a 38,0 ± 0,5° C y 70% de humedad relativa (Ineltec, modelo CC SR 0150, Barcelona) y al noveno día de la incubación se realiza la apertura del huevo cortando la cáscara hacia el lado donde está situada la cámara de aire.
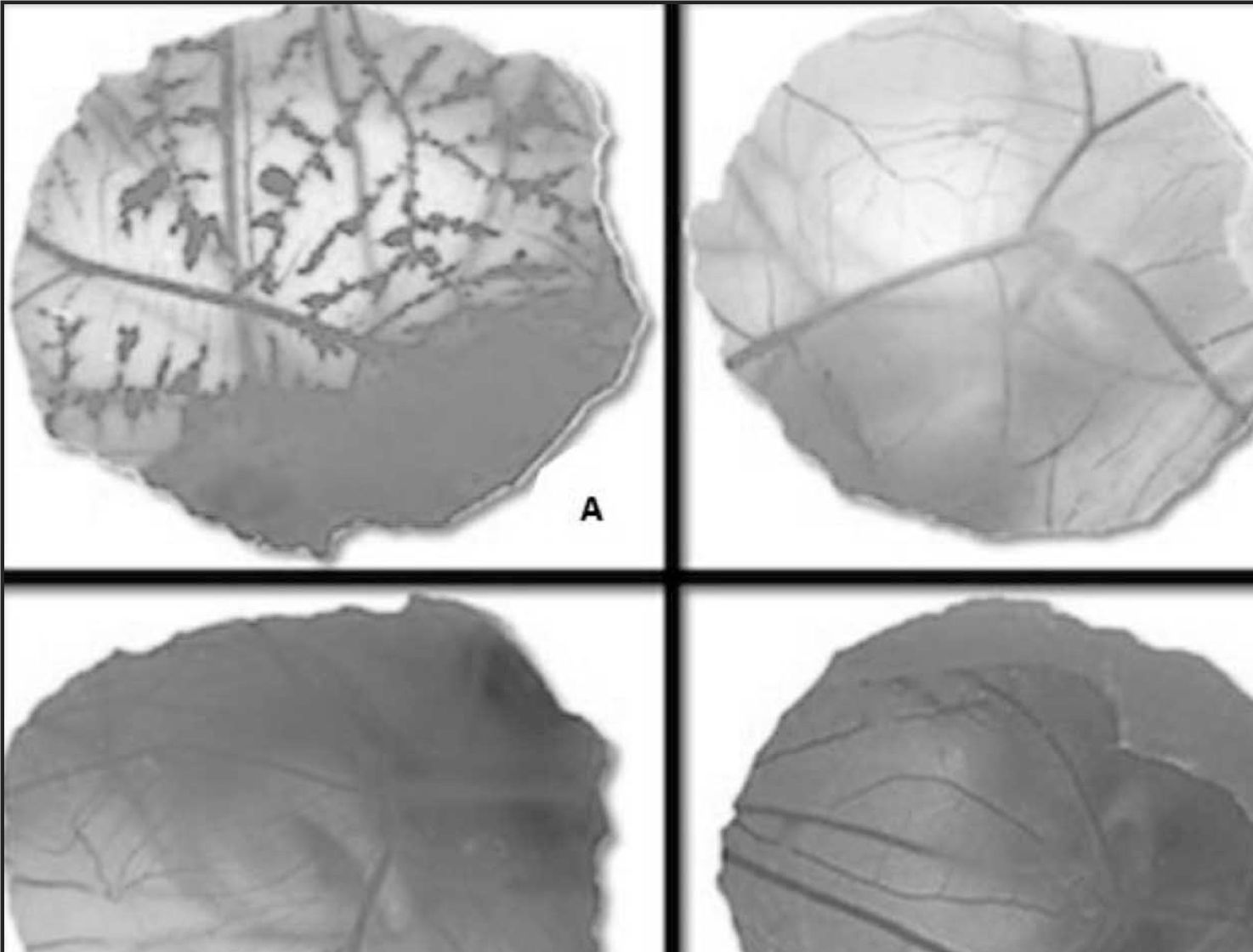
Posteriormente se retira la membrana interior dejando al descubierto la CAM y se depositan 300 microlitros de la sustancia a testar en cada uno de los huevos (Control positivo NaOH 0,1N, Control negativo NaCl 0,9% y los Colirios de Voriconazol y Fluconazol) (Fig. 1)13,14.
A continuación se observa el comportamiento de los vasos sanguíneos durante un tiempo de contacto de 300 segundos, determinando el tiempo de aparición de cada uno de los tres puntos finales (hemorragia —sangrado de los vasos—, lisis —desintegración de los vasos— y coagulación —desnaturalización de las proteínas intra y extracelulares—). En función de los tiempos medidos se calcula el Indice de Irritación (IS, irritation score) mediante la ecuación siguiente: IS = [(301 -tiempo de hemorragia)/300) x 5] + [(301 - tiempo de lisis)/300) x 7] + [(301 - tiempo de coagulación)/300) x 9].
Si en el IS, se alcanzan puntuaciones entre 0 y 0,9 se considera la sustancia como no irritante, ente 1 y 4,9 como ligeramente irritante, entre 5 y 9,9 moderadamente irritante y de 10 a 21 como severamente irritante.
Para cada una de las sustancias se ha utilizado un huevo diferente, realizando cada uno de los ensayos de manera independiente y por triplicado. El cálculo se realiza como la media de la suma de las puntuaciones individuales de todos los puntos finales en cada uno de los replicados (Tabla 1).
Procedimiento detallado del desarrollo experimental
| Deben utilizarse 3 huevos por grupo (control positivo, control negativo y sustancia test). | |
| 1. | Seleccionar huevos broiler frescos (no mayores de 7 días), limpios, fértiles, 50-60 g. |
| 2. | Colocar los huevos en la incubadora a 37°C y 60% de humedad y girar los huevos 5 veces/día hasta el día 8. |
| 3. | El día 8, colocar los huevos con la parte ancha hacia arriba en la incubadora durante un día más y no volver a girar. |
| 4. | Sacar los huevos de la incubadora el día 9 para realizar el ensayo. |
| 5. | Hacer un pequeño agujero en la cáscara del huevo por la parte ancha (donde se encuentra la cámara de aire) con un Dremel |
| 300 equipado con un disco cortante (México). Debe tenerse mucho cuidado para no dañar la membrana interna. Si se | |
| produjera sangrado, el huevo debe desecharse. | |
| 6. | Humedecer completamente la membrana interna con 0,9% NaCl. Colocar de nuevo el huevo en la incubadora, durante un |
| tiempo máximo de 30 minutos. | |
| 7. | Sacar el huevo de la incubadora y decantar el 0,9% NaCl. Retirar cuidadosamente la membrana con unas pinzas. |
| 8. | Tratamiento del huevo: |
| - Control positivo: añadir 300 µl 0,1 N NaOH. | |
| - Control negativo: añadir 300 µl 0,9% NaCl. | |
| 9. | Muestra: añadir 300 µl. |
| 10. | Observación durante 5 minutos (300 s) de los procesos: |
| - Hemorragia (sangrado desde los vasos). | |
| - Lisis vascular (desintegración de los vasos sanguíneos). | |
| - Coagulación (desnaturalización de proteínas intra- y extra-vaculares). | |
El IS del control positivo ha sido de 17, observándose hemorragia a los 22 segundos, lisis a los 45 segundos y coagulación a los 67 segundos. El IS es de cero para el control negativo, al igual que para las muestras del Colirio de Fluconazol 2 mg/ml y del Colirio de Voriconazol 10 mg/ml, pudiendo por tanto clasificar a los colirios antifungicos motivo de estudio como sustancias no irritantes (Fig. 2).
Conclusiones y discusiónEl Real Decreto 16/201216, ofrece apoyo legislativo a los servicios de farmacia para las operaciones de remanipulación y transformación de medicamentos. Con el objeto de garantizar que las preparaciones sean adecuadas para el uso al que están destinadas y que no supongan ningún riesgo para el paciente, se deben establecer unos requisitos, que garanticen la no toxicidad de estos preparados.
En la elaboración de una nueva formulación oftálmica, una práctica habitual es la determinación de parámetros estrechamente relacionados con los fenómenos de toxicidad e irritación, como son el control del pH y osmolaridad, siendo los valores extremos nocivos para la superficie corneal17, pero existen otros factores inherentes a los principios activos o excipientes que pueden desencadenar fenómenos de irritación o de toxicidad celular. Por ello para garantizar que las preparaciones no supongan riesgos, es necesario que se pongan en marcha una serie de estudios toxicológicos sencillos y específicos que sirvan como garantía de inocuidad de los productos elabo- rados. Dentro de estos podría englobarse el HET-CAM.
No obstante deben tenerse en cuenta las limitaciones de esta metodología. Así, la valoración de la capacidad de un producto para causar irritación ocular utilizando el método HET-CAM, presenta la limitación de la subjetividad del observador a la hora de detectar la aparición de los efectos adversos. Por otra parte también se debe tener en cuenta que el método que nos ocupa es incapaz de detectar la posible reversibilidad que pueden darse in vivo, de algunos de los tres fenómenos que se determinan18. De acuerdo con los resultados del ensayo HET-CAM, los colirios de voriconazol y fluconazol formulados en el Servicio de Farmacia para el tratamiento de las queratitis fúngicas no muestran indicios de irritación aguda apreciables, siendo en principio, aptos para su utilización desde el punto de vista toxicológico. Sin embargo, hay que tener en cuenta que el estudio se realiza tras una administración única de los productos por lo que esta metodología sólo informa de la irritación aguda de los componentes, pero no tiene en cuenta la posible aparición de efectos irritantes crónicos tras su administración de manera repetida. Por lo tanto la información que se obtienen del ensayo HET-CAM es parcial, por lo que no puede considerarse un ensayo determinante en la evaluación final de riesgo en sentido de clasificación o etiquetado de medicamentos15 sino que debe utilizarse de forma complementaria con otros métodos de estudio que permitan completar la información toxicológica.
A pesar de ello, este método por su rapidez, sensibilidad y sencilla puesta en marcha en los Servicios de Farmacia19, puede suponer un importante punto de partida en los estudios de toxicidad de las formulaciones oftálmicas hospitalarias, sirviendo de apoyo en la toma de decisiones cuando se valora elaborar nuevas formulaciones o cuando se quiere asegurar la inocuidad de las ya existentes.
Analysis of ocular toxicity of fluconazole and voriconazole eyedrops using HET CAM