la primera terapia dirigida en oncología, el imatinib, revolucionó el tratamiento de la leucemia mieloide crónica (LMC) e impulsó la investigación de terapias dirigidas para diversos tipos de cáncer. La LMC es el resultado de una translocación cromosómica que forma el gen de fusión BCR-ABL1. Asciminib ha sido aprobado recientemente para pacientes de tercera línea, refractarios o intolerantes. La remisión sin tratamiento es alcanzable con una respuesta molecular profunda (DMR) sostenida y este enfoque podría incorporarse a los modelos farmacoeconómicos.
Objetivosestablecer un modelo de coste-eficacia que compare asciminib con los inhibidores de la tirosina cinasa de tercera generación aprobados (bosutinib y ponatinib), centrándose en la consecución de la remisión libre de tratamiento. Además, se evalúa el impacto presupuestario de la incorporación de asciminib como alternativa terapéutica.
Métodoseste modelo se basa en una cadena de Markov con 7 estados. La condición para alcanzar la remisión libre de tratamiento es permanecer durante 5 años en el estado DMR. La eficacia del modelo se midió en años de vida ajustados por calidad y los costes incluidos en el análisis del caso base se basan en España. Se realizó un análisis probabilístico (PSA) y determinístico (DSA) para evaluar la variabilidad del modelo. Se evaluaron 2 modelos independientes comparando asciminib frente a bosutinib y asciminib frente a ponatinib.
Resultadosasciminib, en comparación con ponatinib, es una alternativa que ahorra costes, ya que la eficacia es similar entre las alternativas y asciminib tiene un coste inferior de 30.275 €. Asciminib mostró 4,33 años de vida ajustados por calidad (AVAC) más y un mayor coste (203,591 €) que bosutinib, resultando en una RCEI de 47.010,49 € por AVAC. El PSA muestra que los parámetros con mayor influencia en la variabilidad del modelo fueron la probabilidad de transición a fase acelerada y las probabilidades de alcanzar respuesta molecular mayor y DMR. El análisis determinístico informa de que el coste del fármaco tiene una gran influencia en ambos modelos, y la tasa de descuento afecta significativamente al modelo de asciminib frente a bosutinib.
Conclusionesasciminib amplía las opciones terapéuticas para pacientes refractarios o intolerantes a 2 líneas previas de tratamiento de forma coste-efectiva. Los costes de los fármacos repercuten significativamente en el coste global de la enfermedad, lo que subraya la importancia de las tasas de descuento seleccionadas para cada fármaco. Dada la incidencia relativamente baja de la LMC, la introducción de asciminib tiene un impacto presupuestario limitado, lo que justifica decisiones individualizadas basadas en las características clínicas de los pacientes.
The first targeted therapy in oncology, imatinib, revolutionized chronic myeloid leukemia (CML) treatment and spurred research in targeted therapies for various cancers. CML results from a chromosomal translocation, forming the BCR-ABL1 fusion gene. Asciminib has been recently approved for 3rd-line refractory or intolerant patients. Treatment-free remission (TFR) is attainable with sustained deep molecular response (DMR) and this approach could be incorporated into pharmacoeconomic models.
AimsTo establish a cost-effectiveness model comparing asciminib to approved third-generation tyrosine kinase inhibitors (TKIs) (bosutinib and ponatinib) with a focus on achieving TFR. Additionally, the budgetary impact of incorporating asciminib as a therapeutic alternative is assessed.
MethodsThis model is based on a Markov chain with seven states. The condition for achieving TFR is to remain for 5 years in DMR state. Efficacy of the model was measured in QALYs, and the costs included in the base case analysis are based in Spain. A probabilistic (PSA) and deterministic analysis (DSA) were carried out to assess the variability of the model. There were achieved two independent models comparing asciminib vs. bosutinib and asciminib vs. ponatinib.
ResultsAsciminib, when compared with ponatinib, is a cost-saving alternative, as efficacy is similar between alternatives, and asciminib has a lower cost of 30,275 €. Asciminib showed 4.33 more QALYs and a higher cost (203,591 €) than bosutinib, resulting in an ICER of €47,010.49 per QALY. PSA shows that the parameters with higher influence in the variability of the model were the probability of transitioning to BP and probabilities of achieving MMR and DMR. A one-way analysis reports that the drug cost has a higher influence on both models, and the discount rate significantly affects the asciminib vs. bosutinib model.
ConclusionAsciminib broadens therapeutic choices for patient’s refractory or intolerant to two prior lines of treatment in a cost-effective manner. The costs of drugs significantly impact the overall cost of the disease, emphasizing the importance of the selected discount rates for each drug. Given the relatively low incidence of CML, the introduction of asciminib has a limited budgetary impact, warranting individualized decisions based on patient`s clinical characteristics.
La leucemia mieloide crónica (LMC) es el trastorno mieloproliferativo más frecuente y representa entre el 15 y el 20% de todos los casos de leucemia. La incidencia anual estimada es de 1 a 1,5 casos por cada 100.000 habitantes, con una prevalencia aproximada de uno por cada 17.000. La enfermedad suele ser trifásica, con una fase crónica, una fase acelerada (AP, del inglés Accelerated Phase) y una fase blástica (BP, del inglés Blast Phase). La mayoría de los pacientes se diagnostican en la fase crónica y pueden permanecer asintomáticos con un tratamiento adecuado1.
La primera terapia selectiva desarrollada en oncología para la LMC fue el imatinib. Este tratamiento cambió el pronóstico de los pacientes y sirvió de catalizador para seguir investigando en terapias dirigidas para otros tipos de cáncer. Antes de la aprobación del imatinib, el tratamiento de la LMC consistía en fármacos citotóxicos que afectaban a la estructura y síntesis del ADN, lo que provocaba toxicidad múltiple. La LMC está causada por una translocación recíproca entre los cromosomas 9 y 22 t (9;22) (q34; q11.2), que da lugar a la formación de un gen de fusión quimérico conocido como BCR-ABL1. Dependiendo de la localización del punto de rotura en el gen BCR, se forman varios genes quiméricos que codifican diferentes proteínas. Las proteínas que se observan con más frecuencia son p210 y p1902. El pronóstico de los pacientes con LMC mejoró tras la llegada del imatinib. Además, posteriormente se revisaron los criterios de evaluación de la eficacia del tratamiento. Antes de la llegada del imatinib, el resultado primario para evaluar la eficacia era la supervivencia global (SG). Debido a la notable eficacia de imatinib en términos de SG, se emplearon resultados alternativos basados en la respuesta citogenética (RC) y la respuesta molecular (RM) para evaluar la eficacia3,4. Los inhibidores de la tirosina cinasa (TKI, del inglés Tyrosin Kinase Inhibitor) de segunda generación han mostrado una RM más rápida y profunda en comparación con el imatinib. Sin embargo, no hay diferencias significativas en la SG entre los grupos de tratamiento. Los TKI de segunda generación son opciones adecuadas para pacientes con una puntuación elevada en el índice de Sokal en el momento del diagnóstico, mientras que el imatinib sigue siendo una opción adecuada como tratamiento de primera línea en pacientes con una puntuación de Sokal baja. La elección entre estos fármacos viene determinada por el perfil de reacciones adversas de cada fármaco y las comorbilidades del paciente. Actualmente, existen los TKI de tercera generación, como ponatinib y bosutinib, que deben reservarse para pacientes que no responden o son intolerantes a los TKI de primera o segunda generación.
La diana de todos estos fármacos es el sitio activo de la tirosina cinasa y la inhiben a través de mecanismos competitivos, lo que tiene 2 consecuencias principales: 1) la actividad in vitro de estos fármacos no afecta a la célula madre. Clínicamente, este hecho provoca recaídas si se interrumpe el tratamiento. Sin embargo, existen datos de que se puede alcanzar la remisión libre de tratamiento (TFR, del inglés Treatment Free Remission) en pacientes que mantienen una respuesta molecular profunda (DMR, del inglés Deep Molecular Response) a lo largo del tiempo5. Alcanzar la TFR implica mantener niveles indetectables de copias de BCR-ABL sin ningún tratamiento. En otras palabras, en este estado se alcanza la curación de la enfermedad. Existe controversia respecto al tiempo óptimo tras alcanzar la DMR antes de intentar la discontinuación del tratamiento. Las propuestas oscilan entre 2 y 5 años6. 2) La falta de selectividad entre los TKI debido al sitio central conservado de estas proteínas. Se observaron diferencias en los acontecimientos adversos (AA) en función del perfil inhibitorio de cada TKI.
Recientemente, la Agencia Europea del Medicamento ha aprobado el asciminib. El asciminib no inhibe el centro de la tirosina cinasa. En vez de eso, asciminib se une a un sitio alostérico en BCR-ABL1, induciendo un cambio conformacional que conduce a su inhibición. El innovador mecanismo de acción de asciminib lo ha posicionado como una alternativa para pacientes refractarios o intolerantes que no han respondido a otros tratamientos. El ensayo ASCEMBL es un ensayo aleatorizado, controlado y abierto, que compara asciminib frente a bosutinib en pacientes refractarios o intolerantes que han recibido 2 o más líneas de tratamiento. Sin embargo, se excluyó a pacientes con mutaciones T315I o V299L7. En este estudio, las tasas de DMR en la semana 96 fueron del 10,8% para asciminib y del 5,3% para bosutinib. Actualmente, no existe ningún estudio que compare directamente asciminib y ponatinib. Sin embargo, los datos de una comparación indirecta ajustada por emparejamiento (MAIC, del inglés matching-adjusted indirect comparison) informaron de que asciminib alcanza tasas más elevadas de respuesta molecular mayor (MMR) que ponatinib, con un riesgo relativo de 1,55 a los 6 meses8.
No cabe duda del valor terapéutico y social añadido de estos fármacos, atribuibles a su eficacia en términos de SG y a su perfil de AA bien tolerado. Ampliar las opciones de tratamiento es importante para lograr mejores resultados en las terceras o posteriores líneas de tratamiento. Además, es factible alcanzar la TFR en pacientes que alcanzan la DMR durante un periodo de tiempo prudencial, incluidos aquellos que reciben tratamiento de tercera línea. La TFR representa el estado de salud más favorable, ya que supone el coste más bajo y una calidad de vida sin efectos aversos a los fármacos ni complicaciones asociadas a la LMC.
El objetivo de este estudio es establecer un modelo que evalúe la relación coste-efectividad de asciminib en comparación con los TKI de tercera generación que están aprobados (bosutinib y ponatinib). Nos enfocamos en la TFR como métrica principal, ya que representa el estado de salud óptimo: sin enfermedad ni AA derivados del tratamiento.
Además, evaluamos el impacto presupuestario de incluir asciminib como alternativa terapéutica.
MétodosMedición de la eficaciaEn el tratamiento de la LMC, se utilizan habitualmente 3 indicadores de resultados: la respuesta hematológica (RH), la RC y la RM. Una RH completa se define como la normalización del recuento de leucocitos en sangre periférica, la ausencia de granulocitos inmaduros y la ausencia de enfermedad extramedular. La RC se evalúa observando las metafases en el cariotipo o mediante la hibridación fluorescente in situ (FISH, del inglés fluorescence in situ hybridization) para medir el número de cromosomas con la mutación BCR-ABL1. La RM mide el número de transcritos del gen BCR-ABL1 mediante PCR. Para estandarizar la medición de la RM, se utiliza la escala internacional (international scale, IS). Los criterios de DMR pueden variar según la fuente, pero generalmente se acepta una RM superior a RM4,5, lo que indica que los transcritos se consideran indetectables. La RH y RC son útiles en las fases iniciales de la LMC o en pacientes que no responden al tratamiento. Sin embargo, cuando los pacientes responden bien al tratamiento, el parámetro más valioso para el seguimiento es la RM. La RM es la más apropiada a largo plazo, ya que los pacientes con una RM adecuada generalmente mantendrán una buena RH y RC. De hecho, la RH y la RC rara vez se utilizan para monitorizar la respuesta a los TKI9. La RC requiere una muestra de sangre de la médula ósea, mientras que la RM puede medirse en sangre periférica. Además, el criterio utilizado para seleccionar a los pacientes candidatos a TFR es la duración del mantenimiento de una DMR determinada. La DMR se define como la consecución de una RM4,5. En conclusión, la RH y la RC pueden ser adecuadas para enfermedades agudas, pero el parámetro más apropiado para incluir en un modelo con un horizonte temporal más largo es la RM.
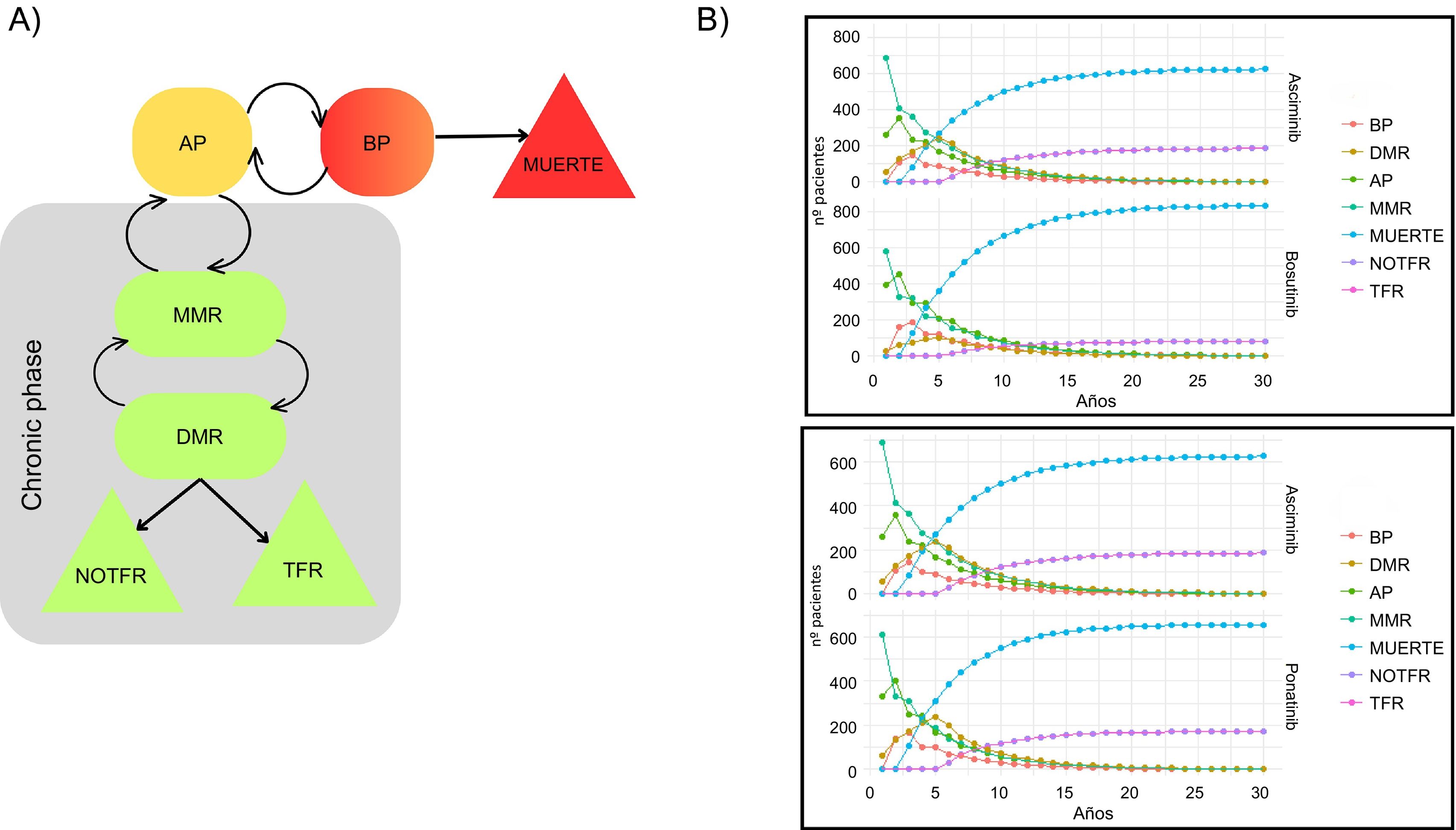
Definición del modeloEl modelo farmacoeconómico se basa en una cadena de Markov con 7 estados: respuesta molecular mayor (MMR), respuesta molecular profunda (DMR), remisión libre de tratamiento (TFR), remisión libre de tratamiento (NOTFR), fase acelerada (AP), fase blástica (BP) y muerte (fig. 1A). Los estados TFR y NOTFR son estados absorbentes que simulan pacientes que alcanzan la DMR. La diferencia entre TFR y NOTFR es que los pacientes en estado TFR no necesitan tratamiento, mientras que los pacientes en estado NOTFR necesitan mantener el tratamiento para alcanzar la DMR. La condición para lograr TFR o NOTFR es permanecer en estado DMR durante 5 ciclos de Markov. Esto representa que los pacientes deben mantener la DMR durante 5 años con tratamiento. Alcanzada esta condición, se puede intentar retirar el tratamiento y lograr TFR o NOTFR. El estado NOTFR es similar al DMR, pero es absorbente y se consideró que al restablecer el tratamiento se conseguirá una respuesta correcta.
A) Modelo de Markov que refleja los 7 estados de salud. Las flechas muestran las posibilidades de transición dentro del modelo. B) Flujo de pacientes a través del modelo en el caso base. MMR: Respuesta molecular mayor; DMR: Respuesta molecular profunda; TFR: Remisión libre de tratamiento; NOTFR: Remisión no libre de tratamiento; AP: Fase acelerada; BP: Fase blástica.
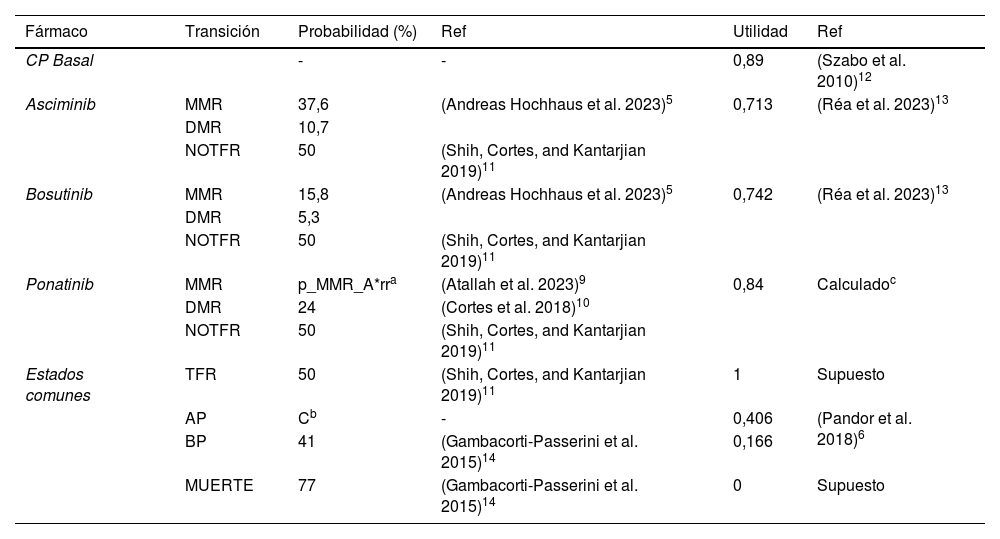
El horizonte temporal considerado fue de 30 años. La aproximación se basa en la esperanza de vida relativamente larga de estos pacientes, aproximadamente unos 80 años, comparable a la de la población general. La edad media de diagnóstico supera los 50 años10. La duración de cada ciclo de Markov es de un año. La eficacia del tratamiento se mide en años de vida ajustados por calidad (AVAC). En la tabla 1 se muestran las probabilidades de transición entre estados de salud y las utilidades empleadas para calcular los AVAC. La probabilidad de alcanzar los estados TFR o NOTFR fue del 50% para cada alternativa. La probabilidad de progresar a BP y experimentar la muerte fue consistente en todas las alternativas, ya que se requería la interrupción de los fármacos tras la recaída en AP. La probabilidad de recaer en AP se calculó como el complementario a la unidad (en la matriz de transición) de los pacientes que no alcanzaban la MMR y la DMR para cada tratamiento. Se calculó la probabilidad de alcanzar la MMR en el modelo de ponatinib utilizando un riesgo relativo11. El modelo adopta la perspectiva del proveedor de servicios médicos. La tasa de descuento en el caso base fue del 2,5%. La tabla 2 detalla los costes incluidos en el caso base del modelo y abarcan los costes de adquisición del fármaco y los gastos sanitarios de los pacientes en cada estado de salud12. El coste de asciminib se extrapoló de la evaluación del NICE (National Institute for Health and Care Excellence)13. Puesto que los precios y costes se expresan en euros, se aplicó el tipo de cambio correspondiente (tabla 3). El tipo de cambio utilizado fue 1€ = 1,1678 £, (agosto de 2023). El impacto presupuestario se calculó siguiendo la guía GENESIS14. Se emplearon 2 modelos independientes para evaluar las 2 alternativas terapéuticas principales a asciminib: bosutinib y ponatinib. Los costes incluidos en el análisis del caso base proceden de España, ya que el modelo se basa en este país.
Probabilidades de transición entre estados y utilidades asociadas a cada estado
| Fármaco | Transición | Probabilidad (%) | Ref | Utilidad | Ref |
|---|---|---|---|---|---|
| CP Basal | - | - | 0,89 | (Szabo et al. 2010)12 | |
| Asciminib | MMR | 37,6 | (Andreas Hochhaus et al. 2023)5 | 0,713 | (Réa et al. 2023)13 |
| DMR | 10,7 | ||||
| NOTFR | 50 | (Shih, Cortes, and Kantarjian 2019)11 | |||
| Bosutinib | MMR | 15,8 | (Andreas Hochhaus et al. 2023)5 | 0,742 | (Réa et al. 2023)13 |
| DMR | 5,3 | ||||
| NOTFR | 50 | (Shih, Cortes, and Kantarjian 2019)11 | |||
| Ponatinib | MMR | p_MMR_A*rra | (Atallah et al. 2023)9 | 0,84 | Calculadoc |
| DMR | 24 | (Cortes et al. 2018)10 | |||
| NOTFR | 50 | (Shih, Cortes, and Kantarjian 2019)11 | |||
| Estados comunes | TFR | 50 | (Shih, Cortes, and Kantarjian 2019)11 | 1 | Supuesto |
| AP | Cb | - | 0,406 | (Pandor et al. 2018)6 | |
| BP | 41 | (Gambacorti-Passerini et al. 2015)14 | 0,166 | ||
| MUERTE | 77 | (Gambacorti-Passerini et al. 2015)14 | 0 | Supuesto | |
Calculado como: CP basal - (Desutilidad EA ponatinib)× tasa de discontinuación ponatinib // Desutilidad EA ponatinib extraída de doi: https://doi.org/10.1007/s40273-018-0627-4 // tasa de discontinuación ponatinib extraída de doi: https://doi.org/10.1056/NEJMoa1306494.
Cada probabilidad representa la tasa de respuesta del estado anterior según el modelo ilustrado en la Figura 1 (es decir, la tasa de MMR representa el porcentaje de pacientes que alcanzan la MMR tras iniciar el tratamiento). Las probabilidades representadas en esta tabla son las utilizadas para construir la matriz de transición del modelo de Markov. Las 4 últimas filas son comunes para 3 alternativas. CP: Fase crónica, MMR: Respuesta molecular mayor, DMR: Respuesta molecular profunda, TFR: Remisión libre de tratamiento, NOTFR: Remisión no libre de tratamiento, AP: Fase acelerada, BP: Fase blástica.
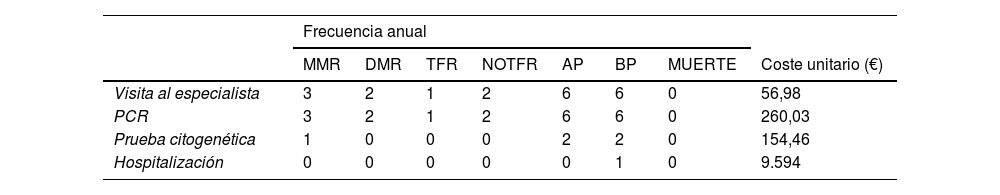
Frecuencia de eventos y coste unitario asociado a cada estado de salud
| Frecuencia anual | ||||||||
|---|---|---|---|---|---|---|---|---|
| MMR | DMR | TFR | NOTFR | AP | BP | MUERTE | Coste unitario (€) | |
| Visita al especialista | 3 | 2 | 1 | 2 | 6 | 6 | 0 | 56,98 |
| PCR | 3 | 2 | 1 | 2 | 6 | 6 | 0 | 260,03 |
| Prueba citogenética | 1 | 0 | 0 | 0 | 2 | 2 | 0 | 154,46 |
| Hospitalización | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 9.594 |
CP: Fase crónica; MMR: Respuesta molecular mayor; DMR: Respuesta molecular profunda; TFR: Remisión libre de tratamiento; NOTFR: Remisión no libre de tratamiento; AP: Fase acelerada; BP: Fase blástica; PCR: Reacción en cadena de la polimerasa.
La población incluida en el modelo de asciminib frente a bosutinib se extrajo del ensayo ASCEMBL7 (NCT03106779). En ASCEMBL, se incluyeron pacientes en fase crónica que habían recibido previamente 2 o más líneas de tratamiento, incluyendo tanto pacientes intolerantes como refractarios. Los pacientes con respuesta citogenética completa (RCC) también formaron parte de la población del estudio. En el momento del cribado, los niveles de transcritos de BCR-ABL1 en el SI debían ser igual o mayor a 1%. Se excluyeron los pacientes en fase crónica en el momento del cribado que hubieran progresado en cualquier momento previo a AP o BP. También se excluyeron los pacientes con mutaciones conocidas de BCR-ABL1 (T315I o V299L) y los pacientes con trastornos cardiacos o anomalías de la repolarización.
En el modelo que compara asciminib frente a ponatinib, la población diana se corresponde con la población del MAIC8 entre ASCEMBL y PACE15 (NCT01207440). El MAIC es una metodología estadística utilizada para comparar tratamientos en ausencia de datos comparativos directos. Consiste en seleccionar estudios clínicos, identificar las características basales de los pacientes y ajustarlas para crear grupos de tratamiento comparables. El emparejamiento por puntuación de propensión es una técnica común empleada con este fin. Una vez ajustadas las características basales, se realiza un análisis comparativo para evaluar la efectividad relativa o la seguridad de los tratamientos. Aunque el MAIC tiene limitaciones, puede ofrecer información valiosa cuando se carece de pruebas directas procedentes de ensayos clínicos controlados y aleatorizados.
En este MAIC8 se excluyeron pacientes con RCC incluidos en la cohorte ASCEMBL, ya que, el estudio PACE no los incluyó. Se incluyeron pacientes intolerantes o refractarios a dasatinib o nilotinib en el estudio PACE, puesto no serían necesariamente intolerantes o refractarios a terapias de tercera línea. Además, se incluyeron pacientes con la mutación T351I. Estas diferencias entre las poblaciones PACE y ASCEMBL no se abordaron en el MAIC. Sin embargo, consideramos que las poblaciones son similares en términos de pacientes refractarios o intolerantes a los TKI de segunda generación.
Análisis de sensibilidadSe realizó un análisis probabilístico de sensibilidad (PSA, del inglés probalistic sensitivity análisis) con 1.000 simulaciones para evaluar la incertidumbre del modelo. Se empleó una distribución gamma para incluir en el análisis los costes asociados a tratamientos farmacológicos, hospitalización, AP y BP. Las probabilidades de alcanzar la MMR y la DMR, así como el riesgo de recaer en AP, se modelaron mediante una distribución multinomial. Se modelaron las probabilidades de transición de AP a BP y de BP a muerte utilizando una distribución beta. En el modelo asciminib frente a ponatinib, se modeló mediante una distribución normal el riesgo relativo para definir la probabilidad de alcanzar la MMR. Todos los demás parámetros se modelaron del mismo modo que en el modelo asciminib frente a bosutinib.
La distribución gamma es útil para modelar variables continuas positivas como los costes. Para modelar la probabilidad entre variables categóricas multinivel se utilizó la distribución multinomial. La distribución beta es útil para variables continuas definidas en el intervalo [0-1], y por eso se empleó para modelizar la probabilidad de las transiciones de AP a BP y de BP a muerte. Se estimó la probabilidad de alcanzar la MMR en el modelo de ponatinib utilizando el riesgo relativo extraído de Atallah et al.8. Esta probabilidad se modeló como una variable normal centrada en el valor de riesgo relativo dado.
Para evaluar el impacto de los parámetros del modelo se llevó a cabo un análisis de sensibilidad determinista (DSA, del inglés deterministic sensitivity analysis). Los parámetros incluidos en el análisis fueron los costes del tratamiento farmacológico (rango 90-110%), la tasa de descuento (0-6%), el coste de la BP (50-150% respecto al caso base) y las probabilidades de transición (apéndice complementario). El análisis se realizó con el paquete Heemod del software R (versión 4.3.1) y RStudio 2023.06.0© 2009-2023 Posit Software, PBC.
ResultadosCaso baseEl modelo asciminib frente a bosutinib arrojó una diferencia de AVAC de 4,33 a favor de asciminib. Además, asciminib se asoció a un coste superior que bosutinib, lo que dio lugar a una razón de coste-efectividad incremental (RCEI) de 47.010,5 € por AVAC para asciminib. En el modelo de asciminib frente a ponatinib, la diferencia de eficacia entre las alternativas fue mínima, con una ventaja de 0,17 AVAC a favor de ponatinib. Asciminib tiene un coste inferior que ponatinib, lo que resulta en una diferencia de coste de 30.275,4 €. Estos resultados indican que, si bien asciminib es ligeramente menos eficaz, también es menos costoso que ponatinib, con una RCEI de 175.135,6 € por AVAC. Los resultados del modelo se ven influidos de forma significativa por la diferencia en la duración y la profundidad de la MR, ya que estos factores pueden afectar a la SG y a la probabilidad de que los pacientes alcancen la TFR. En la figura 1B se ilustra el flujo de pacientes en el modelo.
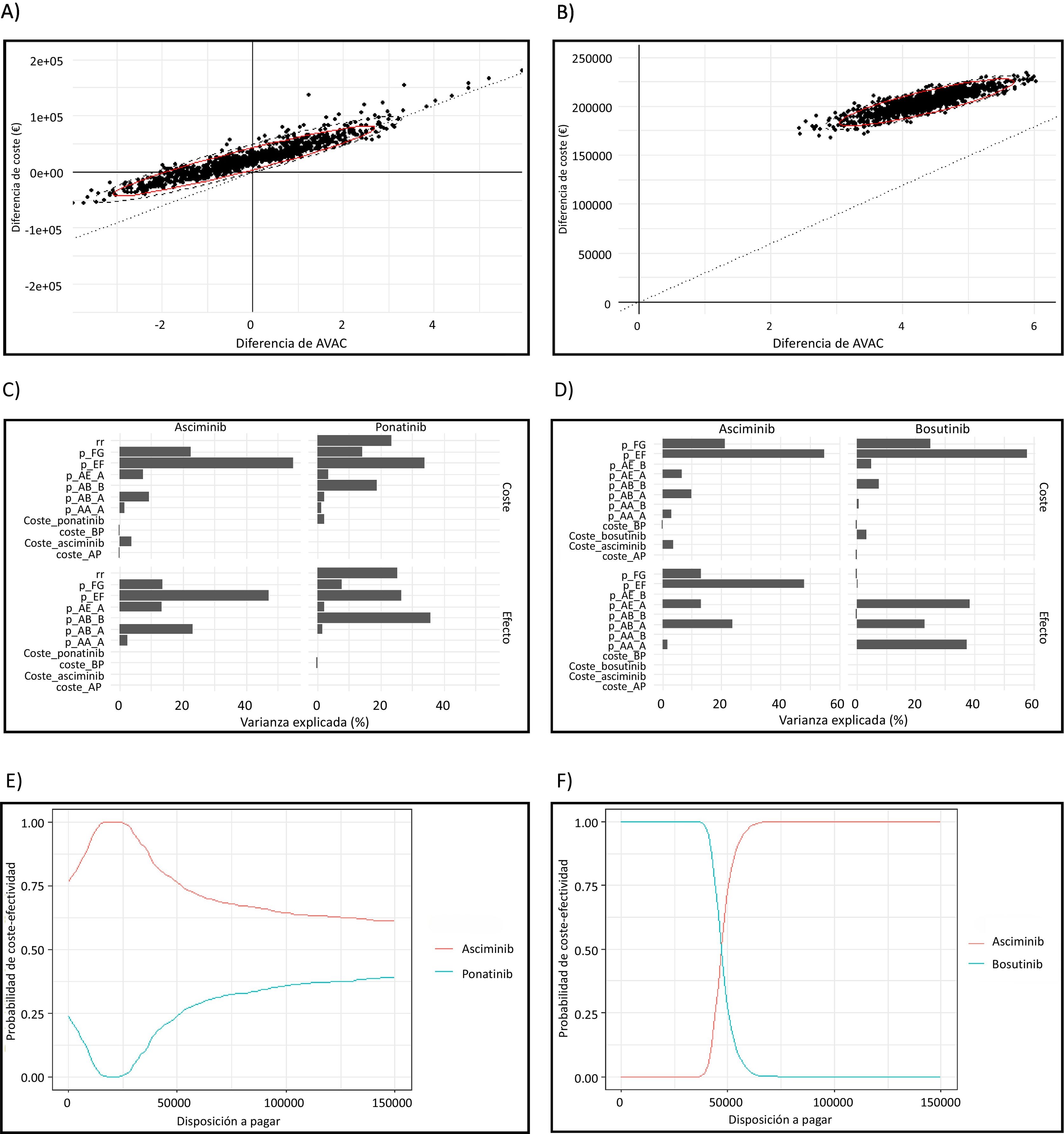
Análisis de sensibilidad probabilísticoEl modelo asciminib frente a bosutinib demuestra una solidez significativa, como demuestra el hecho de que todas las simulaciones se sitúan dentro del primer cuadrante del plano de rentabilidad en el sistema de coordenadas cartesianas (fig. 2B). La RCEI calculada en el PSA se mantuvo similar al caso base, con una RCEI de 46.958,90 € por AVAC. Estos resultados indican un alto nivel de validez interna. Los parámetros con mayor impacto en la variabilidad del modelo fueron la probabilidad de alcanzar la DMR y la probabilidad de recaer en la AP. Además, el coste de asciminib tuvo una influencia significativa en la variabilidad del modelo.
A) PSA del modelo asciminib frente a ponatinib. B) PSA del modelo asciminib frente a bosutinib. La línea negra discontinua representa el IC del 95%. La línea roja indica el umbral de 25.000 euros por AVAC. C) Impacto de los parámetros incluidos en el PSA del modelo asciminib frente a ponatinib. D) Impacto de los parámetros incluidos en el PSA del modelo asciminib frente a bosutinib. E) Análisis de escenarios en función de la variación de la disposición a pagar en el modelo asciminib frente a ponatinib. F) Análisis de escenarios en función de la variación de la disposición a pagar en el modelo asciminib frente a bosutinib. p_AA_A: probabilidad de alcanzar la MMR (asciminib); p_AA_B: probabilidad de alcanzar la MMR (ponatinib en C y bosutinib en D); p_AB_A: probabilidad de pasar de MMR a DMR (asciminib); p_AB_B: probabilidad de pasar de MMR a DMR (ponatinib en C y bosutinib en D); p_AE_A: probabilidad de transición de MMR a AP (absciminib); p_AE_B: probabilidad de transición de MMR a AP (ponatinib en C y bosutinib en D); p_EF: probabilidad de transición de AP a BP; p_FG: probabilidad de transición de BP a muerte; rr: riesgo relativo; DAP: disposición a pagar.
El modelo asciminib frente a ponatinib presentó mayor variabilidad que el modelo asciminib frente a bosutinib (fig. 2A). La similitud de los resultados de eficacia en el caso base hace que el modelo sea más sensible a las variaciones de eficacia que afectan a los resultados globales del modelo. La probabilidad de transición a AP tuvo el impacto más significativo en la variabilidad del modelo. Las variaciones en el riesgo relativo también ejercieron una influencia sustancial. Por tanto, si el riesgo relativo cambia, la probabilidad de alcanzar la MMR también se ve afectada. El tercer factor que contribuyó a la variabilidad del modelo fue la probabilidad de alcanzar la DMR (fig. 2C y D). En el análisis del escenario alternativo, asciminib resultó ser ligeramente más eficaz que ponatinib, lo que difiere del caso base. La diferencia fue de 0,13 AVAC a favor de asciminib. Además, se observó que el coste de asciminib era inferior al de ponatinib, lo que convertía a asciminib en una alternativa más rentable que ponatinib, tal y como indicaba el análisis de escenarios, que consideraba un rango diferente de disposición a pagar (fig. 2E). Además, el análisis muestra la importancia de definir la probabilidad de transición a AP para reducir la incertidumbre del modelo. La probabilidad de que asciminib sea una alternativa coste-efectiva es mayor a medida que aumenta la disposición a pagar, en comparación con bosutinib (fig. 2F).
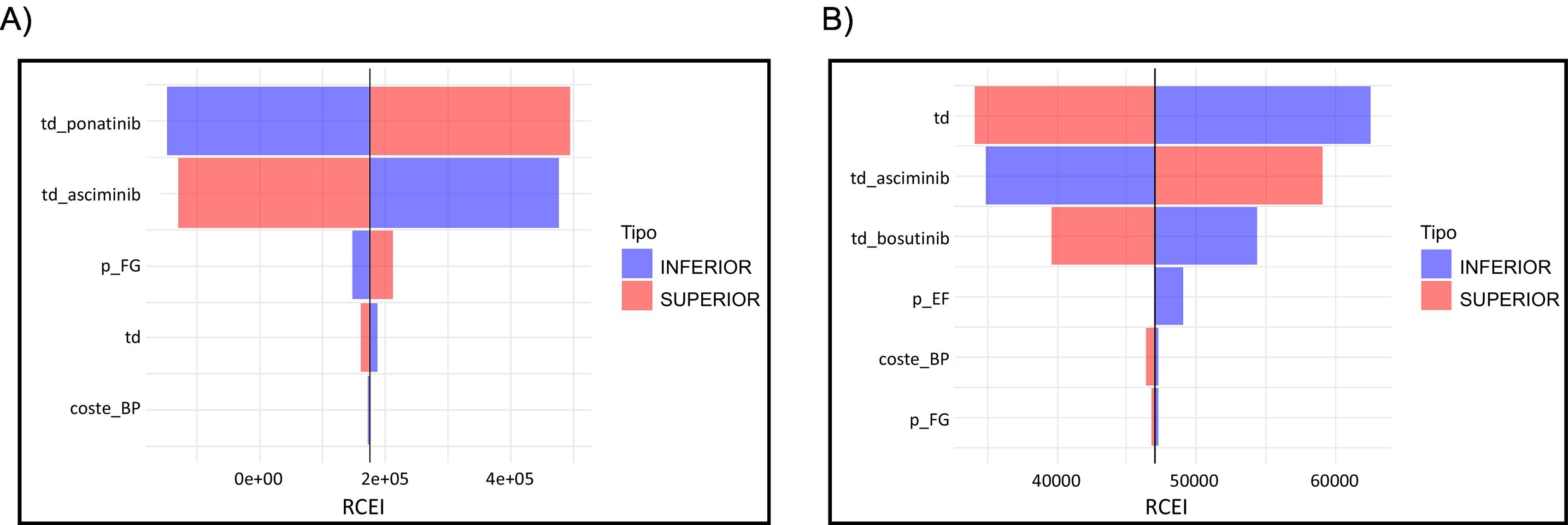
Análisis de sensibilidad deterministaSe realizó un análisis de sensibilidad unidireccional para evaluar la influencia en el modelo de cada parámetro. Los costes de los fármacos tuvieron una influencia significativa, como refleja el diagrama de tornado (fig. 3). El diagrama ilustra el efecto de una variación del coste de los fármacos del 10% (entre 0,9 y 1,1 veces el caso base) en los resultados. En el modelo de bosutinib, la aplicación de un descuento del 10% a asciminib da lugar a una RCEI inferior a 40.000 € por AVAC. La tasa de descuento tuvo una mayor influencia en el modelo de bosutinib que en el modelo de ponatinib. Así, cuanto mayor es la diferencia entre las tasas de MMR y DMR, mayor es la influencia de la tasa de descuento en el modelo a lo largo del tiempo. Las variaciones en el coste de la BP tuvieron un efecto menor, lo cual es digno de mención porque este estado de salud se asocia con los costes más altos respecto a los demás estados de salud del modelo, y están principalmente derivados de los gastos sanitarios (excluidos el coste de los fármacos). La utilidad de ponatinib se comprobó mediante un análisis de sensibilidad unidireccional, ya que ante la ausencia de estudios que evaluaran la calidad de vida en pacientes con ponatinib, el valor incluido en el caso base fue una suposición. Se utilizó un valor de utilidad arbitrario y cuando se le asignó a ponatinib un valor de utilidad de 0,7 puntos, se obtuvieron diferencias de eficacia de hasta 0,98 a favor de asciminib.
Análisis unidireccional en: A) modelo asciminib frente a ponatinib y B) modelo asciminib frente a bosutinib. El eje X representa la variación del RCEI. El diagrama de tornado está centrado en el valor de la RCEI del caso base de cada modelo. td: tasa de descuento; p_EF: probabilidad de transición de la fase acelerada a la fase blástica; p_FG: probabilidad de transición de la fase blástica a la muerte; td_bosutinib: tasa de descuento aplicada para el coste de bosutinib (rango 0,9-1,1); dr_ponatinib: tasa de descuento aplicada para el coste de ponatinib (rango 0,9-1,1).
Este modelo de Markov representa una alternativa a otros modelos farmacoeconómicos basados en la supervivencia particionada. Los modelos de supervivencia particionada requieren el uso de parámetros sustitutos para estimar la SG, principalmente porque hay una falta de datos de SG debido a los periodos de seguimiento relativamente cortos en ciertas cohortes (por ejemplo, asciminib). Uno de estos parámetros empleados recientemente es el tiempo hasta la discontinuación del tratamiento (TDT). Por lo tanto, este modelo se basa en datos empíricos y no requiere el uso de parámetros indirectos para estimar la eficacia de la misma, lo que constituye un buen punto fuerte. Además, la modelización del enfoque TFR reviste especial interés debido a la eficacia de los nuevos tratamientos, que se asocian a tasas de DMR relativamente elevadas. De ahí que sea pertinente incorporar el enfoque TFR a los modelos farmacoeconómicos, ya que este estado de salud carece de costes de medicamentos. El enfoque TFR se ha incorporado a modelos farmacoeconómicos previos16. Alcanzar la TFR es importante desde el punto de vista clínico porque implica la ausencia de enfermedad y de tratamiento, y que el paciente no sufre AA por medicamentos. La práctica clínica se dirige cada vez más en esta dirección y, en pacientes que han alcanzado la DMR durante periodos prolongados, debería intentarse la interrupción del tratamiento. Además, desde el punto de vista económico, es el mejor escenario porque el coste de los fármacos es un factor importante en el coste total de la enfermedad.
En este modelo, la SG depende de las probabilidades de transición establecidas en el mismo, por lo que es una suposición. Este hecho constituye una de las limitaciones del modelo. La población diana del modelo comprendió pacientes refractarios e intolerantes a líneas de tratamiento previas, lo que puede constituir otra limitación debido a las posibles diferencias de respuesta entre pacientes refractarios e intolerantes. Además, el modelo no incorpora el parámetro de las tasas de TDT para cada alternativa, y esta omisión puede influir en los resultados finales. Estas limitaciones podrían afectar a su validez externa. Este modelo no incorpora el coste de los AA a fármacos, pero se asume el impacto de los AA en la eficacia del modelo gracias a la incorporación de los datos de calidad de vida, que reflejan el efecto de los AA. Otra limitación del estudio es que los datos utilizados en la comparación con ponatinib proceden de una comparación indirecta.
Como indica el diagrama de tornado, la variación en los costes de los fármacos ejerce una influencia significativa en el coste total de la enfermedad, así que resulta importante establecer un precio que optimice el uso de cada alternativa. En el modelo asciminib frente ponatinib, un incremento del 10% en el precio de asciminib supone un cambio en el signo de la RCEI. Esto implica que, en este escenario, ponatinib sería una alternativa dominante sobre asciminib (fig. 3A). El precio de asciminib en España se ha establecido recientemente en 5.369 €17 , igual al de ponatinib. Esto constituye un incremento del 11% respecto al caso base, situándonos en un escenario similar al observado en el análisis de sensibilidad unidireccional. Esto sugiere que ponatinib puede ser una alternativa superior a asciminib. Esta información es crucial para considerar la aplicación de tasas de descuento a los fármacos y sus implicaciones en la RCEI. En el modelo asciminib vs. bosutinib, el parámetro con mayor influencia en el modelo es la tasa de descuento. Un aumento de la tasa de descuento al 6% implica una disminución de la RCEI respecto al caso base, alcanzando un valor de 34.121 € por AVAC (fig. 3B). Los costes asociados a la BP tienen una influencia menor en ambos modelos, a pesar de ser la fase con mayores costes derivados de la hospitalización. La elección del intervalo de costes en el análisis unidireccional fue arbitraria, pero sirve para evaluar el impacto de los costes de los fármacos en el modelo. La tasa de descuento elegida osciló entre el 0 y el 6% para obtener un rango desde ninguna tasa de descuento hasta una tasa de descuento alta y evaluar su influencia en el modelo.
En la evaluación del NICE13, asciminib se posiciona como una alternativa más eficaz que bosutinib y con el descuento confidencial a asciminib, la RCEI fue de 30.000 £ por AVAC al comparar asciminib con bosutinib. Según nuestro modelo, se requiere una tasa de descuento de hasta el 42% sobre el caso base para alcanzar una RCEI incremental de 30.000 € por AVAC para asciminib. Los resultados obtenidos en el modelo de asciminib frente a ponatinib coinciden con los comunicados en la evaluación del NICE. Se concluye que asciminib representa una alternativa que ahorra costes frente a ponatinib, principalmente debido a resultados de eficacia similares y costes más bajos. Esta aproximación debe interpretarse con cautela debido a la diferencia de moneda utilizada.
En la toma de decisiones sanitarias, el cálculo del impacto presupuestario de una intervención es un factor importante. La incidencia de LMC en España es superior a 1,08 casos por 100.000 habitantes y año. A partir de estos datos, se calculó el impacto presupuestario del uso de asciminib, incluyendo el coste incremental calculado por paciente. El impacto presupuestario anual adicional asciende a 106.300 € cuando se compara asciminib frente a bosutinib y a 15.800 € cuando se compara asciminib frente a ponatinib. El mayor valor social y terapéutico resultante de la ampliación de las opciones de tratamiento justifica el gasto incremental calculado. Por lo tanto, la toma de decisiones clínicas debe basarse en las características clínicas de los pacientes y el perfil de AA farmacológicos, en lugar de únicamente en los costes asociados a las alternativas. Además, la selección de fármacos dependiendo del perfil de AA y las características del paciente pueden mejorar los resultados al reducir las tasas de AA y, por tanto, disminuir los costes asociados.
ConclusiónAsciminib es una nueva alternativa terapéutica de tercera línea con un mecanismo de acción novedoso para los pacientes con LMC. La eficacia en términos de utilidad es similar a ponatinib y superior a bosutinib, lo que resulta en una RCEI de 175.135,6 y 47.010,49 €, respectivamente. El coste del fármaco es el factor con mayor impacto en el coste total de la enfermedad y la tasa de descuento también tiene un impacto importante en el modelo asciminib frente a bosutinib. A pesar de ser un fármaco de tercera línea, el enfoque TFR es cada vez más frecuente en la práctica clínica en pacientes con DMR y debe incorporarse a los estudios farmacoeconómicos. El impacto presupuestario anual del uso de asciminib es 106.000 y 15.800 € superior a bosutinib y ponatinib, respectivamente. Es necesario aumentar las alternativas terapéuticas para pacientes refractarios o intolerantes a 2 líneas de tratamiento y la decisión de utilizar asciminib debe basarse en las características del paciente.
FinanciaciónEsta investigación no ha recibido financiación.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Datos complementariosLos datos complementarios de este artículo pueden consultarse en línea en https://doi.org/10.1016/j.farma.2024.03.008.
Declaración de contribución de autoría CRediTAntonio García Molina: Writing – review & editing, Writing – original draft, Validation, Methodology, Investigation, Formal analysis, Conceptualization.