La reacción de hipersensibilidad a abacavir (un potente inhibidor de la transcriptasa inversa) es un efecto adverso importante que limita su uso en la terapia antirretroviral y precisa un elevado grado de vigilancia clínica. Determinados haplotipos de las proteínas del complejo principal de histocompatibilidad (HLA-B*5701) predicen, de forma muy significativa, el riesgo de hipersensibilidad a este fármaco. El objetivo del estudio es identificar los casos que, después de desarrollar una probable reacción de hipersensibilidad a abacavir, presentaban el alelo HLA-B*5701.
MétodosSe ha realizado un estudio retrospectivo a todos los pacientes adultos infectados por el virus de la inmunodeficiencia humana 1 (VIH-1) que recibieron tratamiento con abacavir entre enero de 2000 y diciembre de 2007, en el Departamento 6 de la Agencia Valenciana de Salud. Se recogieron los efectos adversos desarrollados por los pacientes para identificar los casos con probable reacción de hipersensibilidad diagnosticada clínicamente. Finalmente, se realizó la tipificación de HLA-B*5701 a estos 39 pacientes.
ResultadosEn total, 323 pacientes recibieron tratamiento con abacavir entre 2000 y 2007. Se retiró el tratamiento por reacción de hipersensibilidad a 39 pacientes (12,1 %); 9 (23,1 %) de ellos resultaron HLA-B*5701 positivo; 8 pacientes manifestaron exantema y únicamente se observó positividad en un paciente con síntomas gastrointestinales y fiebre.
ConclusionesLa realización del test genético HLA-B*5701 podría ser favorable para la práctica clínica habitual, ya que evita errores en el diagnóstico de la reacción de hipersensibilidad y permite interpretar los síntomas con más seguridad.
Hypersensitivity reaction to abacavir (a powerful inverse transcriptase inhibitor) is a serious adverse effect that limits its use in antiretroviral treatment and requires a high level of clinical surveillance. Certain haplotypes of the primary histocompatibility complex proteins (HLA-B*5701) are very significant predictors of the risk of hypersensitivity to this drug. The purpose of this study is to identify the cases where a probable hypersensitivity reaction to abacavir presented the HLA-B*5701 allele.
MethodA retrospective study was conducted in all HIV-1 positive adult patients infected treated with abacavir between January 2000 and December 2007, in Department 6 of the Agencia Valenciana de Salud (Valencia Health Agency). The adverse effects developed by the patients were collected to determine which cases presented a probable clinically diagnosed hypersensitivity reaction. Finally, these 39 patients were screened for HLA-B*5701.
ResultsIn total, 323 patients were treated with abacavir between 2000 and 2007. The treatment was discontinued in 12.1 % (n = 39 patients) presenting a hypersensitivity reaction. Nine (23.1 %) of these were HLA-B*5701 positive. Eight patients presented skin rash and positivity was observed in only single patient with gastrointestinal symptoms and fever.
ConclusionsThe administration of the HLA-B*5701 gene test may be of benefit in clinical practice, because it prevents diagnostic errors of the hypersensitivity reaction and enables more accurate interpretation of the symptoms.
La reacción de hipersensibilidad a abacavir es un efecto adverso importante que limita su uso en la terapia antirretroviral y requiere un elevado grado de vigilancia clínica.
Abacavir es un inhibidor de la transcriptasa inversa recomendado por GESIDA/Plan Nacional sobre el Sida como uno de los fármacos preferentes en la terapia de inicio en pacientes con infección por el virus de la inmunodeficiencia humana (VIH)1,2. Disponible en una pauta de una vez al día en combinación con otros agentes antirretrovirales. En cuanto a su perfil de toxicidad, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado recientemente de la posible relación del uso de abacavir y didanosina con incremento del riesgo de infarto de miocardio3,4.
La reacción de hipersensibilidad (RHS) aparece, sobre todo, en pacientes caucásicos o con recuento de linfocitos CD8 > 850 células/ml al iniciar el tratamiento5. Generalmente, los síntomas aparecen en un 5-8 % de los pacientes en las primeras 6 semanas (tiempo medio de aparición de 11 días) de tratamiento con abacavir, aunque estas reacciones pueden ocurrir en cualquier momento durante la terapia6-8. Se caracteriza por la aparición de fiebre y/o erupción como parte del síndrome. Otros signos observados con frecuencia son: síntomas gastrointestinales (náuseas, vómitos, diarrea y dolor abdominal) y letargo o malestar general. Han tenido lugar reacciones de hipersensibilidad sin erupción o fiebre. Otros síntomas pueden incluir disnea, tos, síntomas reumáticos (mialgia, dolor osteomuscular), cefalea, parestesia o edema.
Es probable que el tratamiento intermitente pueda incrementar el riesgo de desarrollar sensibilización y, por lo tanto, de que tengan lugar reacciones de hipersensibilidad clínicamente significativas. Los síntomas relacionados con esta reacción de hipersensibilidad empeoran si continúa el tratamiento y normalmente se resuelven al interrumpirlo. Continuar el tratamiento con abacavir tras una sospecha de reacción de hipersensibilidad está contraindicado, debido al incremento del riesgo de toxicidad.
Diversos factores complican el diagnóstico, incluidas la variable signos y síntomas no específicos y la combinación con otros antirretrovirales por la superposición de distintos perfiles de efectos adversos.
La especie humana tiene un grupo de genes estrechamente ligados y muy polimórficos, con un gran número de variantes genéticas (alelos) en cada locus, denominado complejo principal de histocompatibilidad (MHC) situado en el cromosoma 6, y se conoce como región HLA. Las moléculas codificadas por el MHC intervienen de un modo central en el desarrollo de las respuestas inmunitarias específicas9.
Debido a la relación entre las proteínas del MHC y el desarrollo de reacciones de hipersensibilidad a los fármacos, hay especial interés por determinar si los haplotipos de las proteínas del complejo principal de histocompatibilidad conllevan riesgo de hipersensibilidad. Recientes comunicaciones han referido que el haplotipo HLA B*5701 predice de forma muy significativa el riesgo de hipersensibilidad a abacavir10-15, de manera que estos análisis genéticos son útiles para precisar, en el futuro, qué pacientes no deberían recibir abacavir.
El objetivo del estudio consiste en identificar, en pacientes con probable reacción de hipersensibilidad, los casos que realmente desarrollaron una reacción de hipersensibilidad definitiva al abacavir, mediante la determinación de la presencia del alelo HLA-B*5701.
MétodosSe ha realizado un estudio retrospectivo con todos los pacientes adultos infectados por VIH-1 que recibieron tratamiento con abacavir entre enero de 2000 y diciembre de 2007, en el Departamento 6 de la Agencia Valenciana de Salud. A continuación, se ha analizado a todos los pacientes a quienes se suspendió el tratamiento por una sospecha de reacción de hipersensibilidad al fármaco. Se consideraron los casos documentados de reacción alérgica o la presencia de 2 o más de los siguientes síntomas: erupción cutánea, fiebre, síntomas gastrointestinales y letargo o malestar; síntomas respiratorios; síntomas osteomusculares; cefalea, parestesias, y edema e hipotensión.
Se identificó a 39 pacientes con supuesta RHS y se los distribuyó en función de la edad, el sexo, la coinfección con el virus de la hepatitis C (VHC), la combinación de antirretrovirales, las fechas de inicio y fin del tratamiento con abacavir, si presentaban o no el alelo HLA-B*5701, el recuento de linfocitos CD8 y CD4 al inicio del tratamiento, el estadio de la infección por el VIH y el número de tratamientos previos al inicio de abacavir.
En cuanto a los marcadores genéticos, se realizó el análisis de la tipificación del grado del alelo HLA-B*5701 en el laboratorio Centro de Transfusiones de la Comunidad Valenciana; para la tipificación de HLA de clase I se utilizó una combinación de sondas de oligonucleótidos específicos de secuencia (SSOP) o por microlinfocitotoxicidad y, finalmente, una reacción en cadena de la polimerasa con cebadores específicos de la secuencia (PCR-SSP) para la determinación del alelo HLA-B*5701.
Los resultados se procesaron con el programa de análisis estadístico G-stat 2.0®. Las variables cuantitativas se estudiaron en función de las medidas de distribución y dispersión (media, máximo y mínimo), y las cualitativas, mediante su frecuencia absoluta y relativa.
Para la comparación de las poblaciones de linfocitos CD8 y el género con la presencia del alelo HLA-B*5701 se realizó la prueba de la χ2.
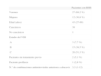
ResultadosEn total, 323 pacientes recibieron tratamiento con abacavir durante el periodo estudiado. Se retiró el tratamiento a 39 pacientes (12,1 %) por una probable reacción de hipersensibilidad. En la tabla 1 se muestran las variables demográficas, el estadio de la infección por el VIH y el número de combinaciones previas a la inclusión de abacavir en el tratamiento de los pacientes.
Características de los pacientes tratados con abacavir con reacción de hipersensibilidad (RHS)
| Pacientes con RHS | |
| Varones | 27 (69,2 %) |
| Mujeres | 12 (30,8 %) |
| Edad (años) | 43 (27-69) |
| Caucásicos | 38 |
| No caucásicos | 1 |
| Estadio del VIH | |
| A | 3 (7,7 %) |
| B | 15 (38,5 %) |
| C | 20 (51,3 %) |
| Pacientes sin tratamiento previo | 2 (5,1 %) |
| Paciente-profilaxis | 1 (2,6 %) |
| N.° de combinaciones antirretrovirales anteriores a abacavir | 3,3 (1-12) |
VIH: virus de la inmunodeficiencia humana.
Los datos expresan n (%) o media (intervalo).
La combinación más utilizada incluye abacavir-lamivudina-zidovudina, que se prescribió al 30,6 % de los pacientes; en menor proporción (16,7 %) recibieron abacavir-lamivudina-tenofovir. El 13,9 % utilizó abacavir-didanosina más un inhibidor de la proteasa (IP), principalmente, atazanavir. En ninguno de los casos se ha combinado con efavirenz o nevirapina, debido a que pueden dar lugar a confusión en el diagnóstico, ya que tienen una toxicidad similar al abacavir (exantema y síntomas gastrointestinales).
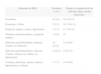
Se distribuyó a los pacientes en 7 subgrupos (tabla 2), en función de los distintos signos y síntomas que presentaron, relacionados con la reacción de hipersensibilidad9, y se estableció la duración media del tratamiento con abacavir.
Clasificación de los signos y síntomas de reacción de hipersensibilidad (RHS)
| Síntomas de RHS | Pacientes, n (%) | Tiempo de aparición de los síntomas (días), media (intervalo) |
| Exantema | 16 (41) | 10,4 (6-15) |
| Exantema y fiebre | 2 (5,1) | 10,5 (10-11) |
| Erupción cutánea, astenia, hipotensión | 3 (7,7) | 17,7 (6-32) |
| Síntomas osteomusculares y erupción cutánea | 1 (2,6) | 32 |
| Síntomas gastrointestinales (náuseas, vómitos y/o diarreas) | 10 (25,6) | 31 (4-65) |
| Síntomas gastrointestinales (náuseas, vómitos, diarreas) y/o fiebre y/o hipotensión | 4 (10,3) | 12 (8-14) |
| Cefaleas, parestesia, astenia, edema e hipotensión y/o disnea | 3 (7,7) | 32 (6-80) |
El 56,4 % de los pacientes desarrollaron exantema como síntoma de RHS. En la tabla 3, se diferencia, para los 7 grupos de pacientes, el sexo, la positividad o negatividad al HLA-B*5701, la población linfocitaria y la carga viral antes del inicio del tratamiento con abacavir.
Diferencias genéticas, virológicas e inmunológicas entre los subgrupos de pacientes en función de los signos y síntomas que han presentado
| RHS | Sexo | HLA-B*5701 | Población linfocitaria (media) | Carga viral (copias/ml) | ||||
| Varones | Mujeres | Positivo | Negativo | CD4+ (cel/ml) | CD8+ (cel/ml) | Negativo (%) | > 10.000 (%) | |
| Exantema | 12 | 4 | 6 | 10 | 315 | 1.206 | 69,2 | 30,8 |
| Exantema y fiebre | 2 | 0 | 1 | 1 | 1 25 | 555 | 50 | 50 |
| Erupción cutánea, astenia, hipotensión | 1 | 2 | 1 | 2 | 527 | 1.170 | 100 | 0 |
| Síntomas osteomusculares y erupción cutánea | 1 | 0 | 0 | 1 | 290 | 1.300 | 100 | 0 |
| Síntomas gastrointestinales | 9 | 1 | 0 | 10 | 648 | 932 | 83,3 | 16,7 |
| Síntomas gastrointestinales y/o fiebre y/o hipotensión | 2 | 2 | 1 | 3 | 455 | 633 | 75 | 25 |
| Cefaleas, parestesia, astenia, edema e hipotensión y/o disnea | 0 | 3 | 0 | 3 | 427 | 960 | 66,7 | 33,3 |
RHS: reacción de hipersensibilidad.
El 23,1 % de los pacientes que desarrollaron una supuesta RHS a abacavir han resultado con HLA-B*5701 positivo, 2 mujeres y 7 varones con edades entre 30 y 50 años. Uno de ellos no había recibido tratamiento antirretroviral antes del inicio con abacavir. Sólo 2 casos han presentado un valor de CD8 < 850 células/ml y 6 pacientes tenían recuento de linfocitos CD4 de 250-500 células/ml, en el momento de la introducción de abacavir en su terapia.
No se han encontrado diferencias significativas entre el sexo y la presencia del HLA-B*5701 (p = 0,5265).
El 66,7 % de los pacientes presentaron recuento de linfocitos CD8+ > 850 células/ml. La distribución de estos linfocitos entre los pacientes que han resultado con positividad o negatividad en la prueba genética no presenta diferencias significativas (p = 0,8601).
DiscusiónEn nuestro estudio el 12,1 % de los pacientes tratados con abacavir han presentado una supuesta RHS, valor mayor que en otros estudios, como el realizado por Hetherington et al14 y por Crutell et al7, en los que la reacción tiene lugar en el 4,3 y el 5 % (intervalo, 0-14 %) de los pacientes, respectivamente. Esto demuestra la hetereogeneidad de los resultados atendiendo exclusivamente a datos clínicos, probablemente debido a que no se ha podido diferenciar con claridad las RHS totalmente atribuibles al abacavir, ya que la única forma de confirmarlas clínicamente es con la reintroducción del fármaco y esperar que aparezcan los síntomas, supuesto éticamente inaceptable.
Los síntomas en relación con la RHS al abacavir aparecen dentro de las primeras semanas, suelen empeorar con dosis consecutivas y su retirada produce la mejoría de los síntomas en 48-72 h16-18.
El síntoma predominante hallado ha sido el exantema, en el 56,4 % de los pacientes, seguido de sintomatología gastrointestinal en el 41 %; mientras que sólo presentó fiebre el 7,7 % y síntomas respiratorios, el 5,1 %. Destaca también la hipotensión en el 7,7 % de los pacientes, en ninguno de los casos la RHS fue grave. Todos los datos analizados concuerdan con la literatura19, excepto la fiebre que se ha presentado en un porcentaje menor, debido probablemente a la rápida retirada del abacavir.
Todos los síntomas se han producido antes de las 6 semanas de tratamiento, con una media de aparición de 22,2 días, valor mayor que la media de los datos bibliográficos encontrados, probablemente por la introducción de casos de errores de RHS, ya que en el caso de los HLA-B*5701 positivos la media se reduce a 7 días.
Se realizó la tipificación del HLA-B*5701 a los 39 pacientes que tuvieron RHS por ser la prueba de mayor sensibilidad entre los alelos del MHC, demostrada en distintos estudios11-14,20,21. En un reciente estudio, el PREDICT-1, la presencia del HLA-B*5701 tuvo un valor predictivo positivo a la reacción de hipersensibilidad a abacavir del 100 % y un valor predictivo negativo del 97 %10. Es decir, esos autores demostraron que una variación genética humana específica, conocida como HLA-B*5701, tiene relación con la susceptibilidad a la hipersensibilidad por abacavir12.
Realizar una prueba de cribado antes del inicio del tratamiento evitaría errores en el diagnóstico y permitiría interpretar los síntomas con más seguridad.
De los 323 pacientes en tratamiento con abacavir, 9 presentan el alelo HLA-B*5701, lo que representa el 2,8 % de todos los pacientes tratados. Este valor se encuentra dentro de los datos obtenidos por los diferentes estudios, un 1-2 % en la población mediterránea10,22.
De los 9 pacientes que han resultado ser positivos, 8 manifestaron erupción cutánea y únicamente se observó positividad en un paciente con síntomas gastrointestinales y fiebre.
Entre los factores de riesgo de desarrollar la RHS analizados, se encuentra la utilización conjunta de efavirenz o nevirapina, debido a que pueden dar lugar a confusión en el diagnóstico, ya que tienen una toxicidad similar al abacavir23-25. El resto de los antirretrovirales que forman parte de la terapia pueden favorecer la aparición de otros efectos adversos no relacionados con la RHS que pueden confundir al iniciar la terapia, pues es frecuente la combinación de síntomas gastrointestinales (diarrea, dispepsia, náuseas, vómitos) y el uso de algunos inhibidores de la proteasa (ritonavir, lopinavir, etc.).
Un elevado recuento de linfocitos CD8 en el momento del inicio del tratamiento con abacavir se ha asociado con la RHS5,13,26-28. Al actuar el fármaco sobre las células presentadoras de antígeno (MHC-I), en una respuesta específicamente con HLA-B*5701 desencadena la liberación de citocinas de linfocitos T CD8 en sangre, y causa RHS. A mayor activación de los CD8, mayor riesgo de desarrollar RHS. Este riesgo de RHS se incrementa cuando el recuento de linfocitos CD8 se encuentra por encima de 850 células/ml. De los 39 pacientes analizados, el 66,7 % tiene CD8 > 850 células/ml. Entre los pacientes que han resultado ser positivos al HLA-B*5701, sólo uno presenta valores de linfocitos CD8 < 850 células/ml.
El sexo masculino predomina entre los pacientes que han resultado positivos en el test genético (el 83,3 %, similar a otros estudios publicados). Mientras que las mujeres son minoritarias, en nuestro estudio, el 16,7 %, dato que concuerda con la literatura13,14.
La coinfección del VIH y el VHC es un factor a tener en cuenta en la evaluación de los signos y síntomas de la RHS, ya que la presenta un elevado porcentaje de pacientes con VIH, y el uso de fármacos para la hepatitis C puede motivar el aumento de la toxicidad hepática, e interpretar síntomas de hepatopatía de base como reacción de hipersensibilidad.
Hay que destacar que, de los 39 pacientes analizados, uno de ellos no había recibido tratamiento previo, tenía VIH negativo y HLA-B*5701 positivo, y se trató con profilaxis anti-VIH por accidente biológico, lo que confirma la relación, incluso en pacientes seronegativos, entre el HLA-B*5701 y la RHS a abacavir.
ConclusionesLa utilización del test genético HLA-B*5701 permite disminuir el riesgo de toxicidad al abacavir y evita el coste que conlleva el tratamiento de la RHS por sucesivas consultas con los especialistas, cambio de tratamiento, inutilización de este antirretroviral y la adición de medicación concomitante29. La realización de la prueba se ha incorporado a la práctica clínica habitual, teniendo en cuenta que, de los 39 pacientes a quienes se retiró el tratamiento, sólo 9 son positivos.
AgradecimientosA todo el Servicio de Farmacia, Hospital de Día y Urgencias del Hospital Arnau de Vilanova de Valencia. Al Centro de Transfusiones de la Comunidad Valenciana por los conocimientos, la accesibilidad, la amabilidad y la atención ofrecidos. A todos los pacientes por su gran colaboración, ya que sin ellos no hubiese sido posible este estudio.