Most cytostatic drugs cannot be administered directly to patients in their marketed presentation, but require previous reconstitution conducted in the Pharmacy Unit areas for cytostatic preparation.
There are systems that allow drug reconstitution and transfer once it has been diluted, in order to protect staff from any potential contamination during handling. These are commonly known as Closed Systems, and generally have a piece for vial attachment and a syringe adapter with a built-in filter, that replace the traditional needles. Closed systems feature different characteristics and costs which is necessary to analyze in order to determine the most efficient one.
La mayoría de fármacos citostáticos no pueden ser administrados directamente desde la presentación comercial al paciente, sino que requieren de una reconstitución previa realizada en las áreas de elaboración de citostáticos en los Servicios de Farmacia.
Existen sistemas que permiten reconstituir y extravasar el fármaco una vez diluido, para evitar la posible contaminación derivada de su manejo al personal. Estos sistemas se conocen comúnmente como sistemas cerrados, y de manera genérica constan de una pieza de fijación al vial y un adaptador para la jeringa con filtro integrado, que sustituyen a las tradicionales agujas. Los sistemas cerrados presentan diversas características y costes que son necesarios analizar para conocer cuál es el sistema más eficiente.
Occupational safety has become one of the main concerns in hospitals, and exposure to cytotoxic agents is one of the most relevant issues, as well as accidental needle-sticks. Since the 70s, it has been well known that nurses who prepare chemotherapy presented high levels of mutagenic agents in their bodies1. Therefore, there have been many guidelines and agreement documents2,10 prepared in order to try to minimize the exposure of workers to this type of agents3. One of the first advances in this field was the use of biological safety cabinets in combination with individual protection equipment, and the use of closed systems for preparation and transfer of antineoplastic agents4, according to Royal Decree (RD 665/97) which was subsequently modified (RD 1124/2000 and RD 349/2003)5,6. This Royal Decree regulates closed systems and therefore encourages their use, and sophisticated systems have been launched that will replace the use of traditional needles. These complex devices present heterogeneous costs that require their costefficiency assessment7. The Pharmacy Area is legally responsible for this assessment (RD 1591/2009)8, which will allow to select the most efficient devices. In order to conduct this assessment, it will be essential to consider that the increased safety offered for cytostatic handling by these Closed Systems (CS) is obtained at the expense of dead space, higher than that of traditional loading needles, which does not allow the total extraction of the liquid contents from the vials9. Therefore, in this study we have analyzed the potential economic impact of incorporating each one of these systems in a third-level hospital; additionally, a cost-efficiency study has been conducted for said devices, based on the most efficient use of the vials.
MethodsA study was conducted with the objective of measuring the cost-efficiency of some of the CS available in the market. The following CS were assessed:
BD-Phaseal®; Hospira ICU CLAVE® CH 70 and CH74; Baxter-ChemoAI- DE®; Care Fusion Smart Site® and VM04®; Fresenius Extra Spike®; Braun Chemo V Mini Spike®.
These systems include, among other features, an awl that allows to pierce the rubber septum of each vial, remaining affixed through anchorage. They also allow to access the vial contents through a luer connector to the syringe, not requiring the use of needles. All these systems feature 0.2 µm venting filters in all their models, except for BD Phaseal, which features an airtight expansion chamber.
The calculation of the estimated economic impact for one year included:
- –
The cost associated with the loss of the drug that remains in the system. To this aim, the outcomes from the study were extrapolated with each vial size and CS model included, shown in table 1, to the vials used during one year in our hospital, in the Day Hospital areas for Oncology and Haematology.
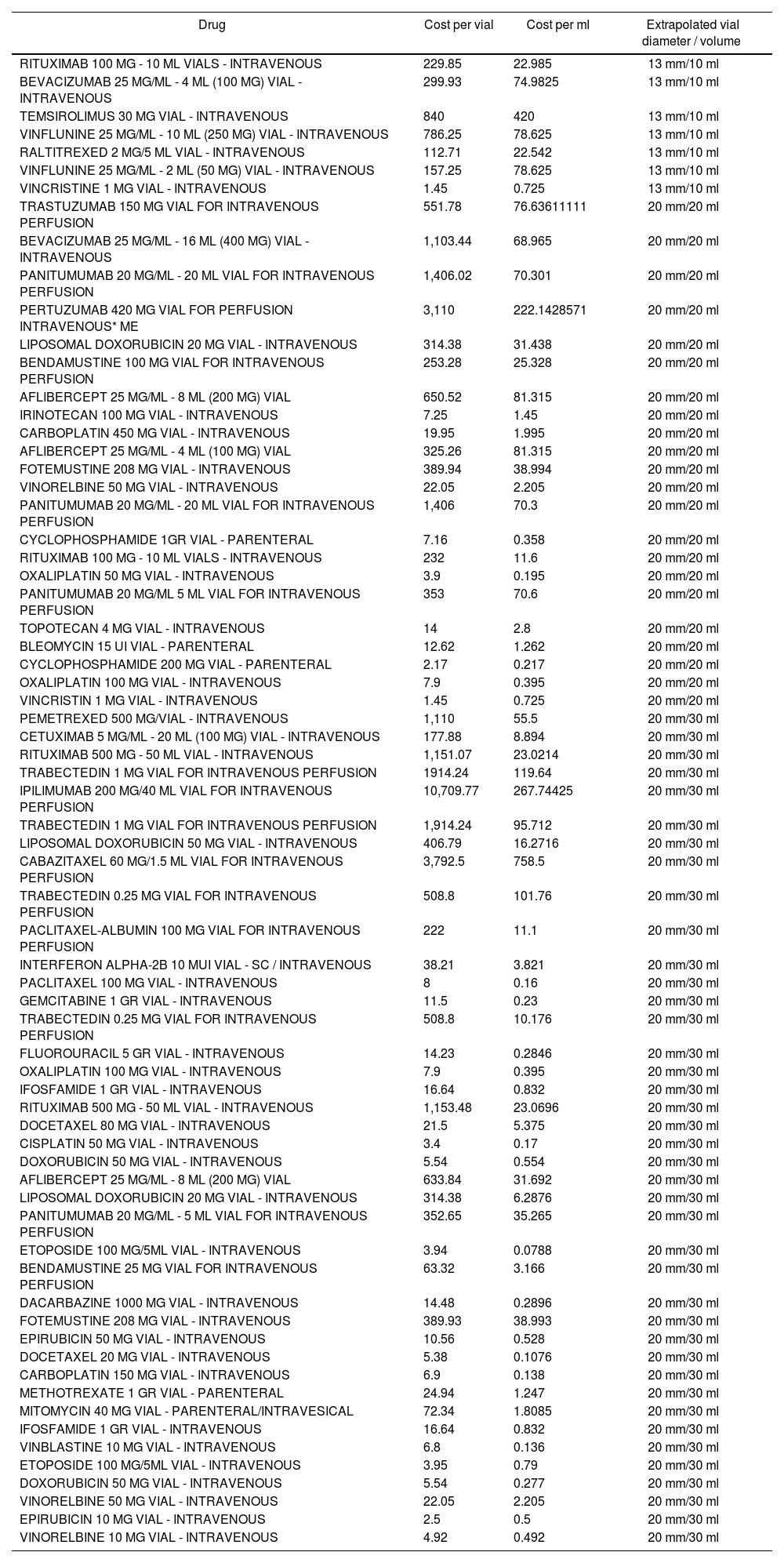
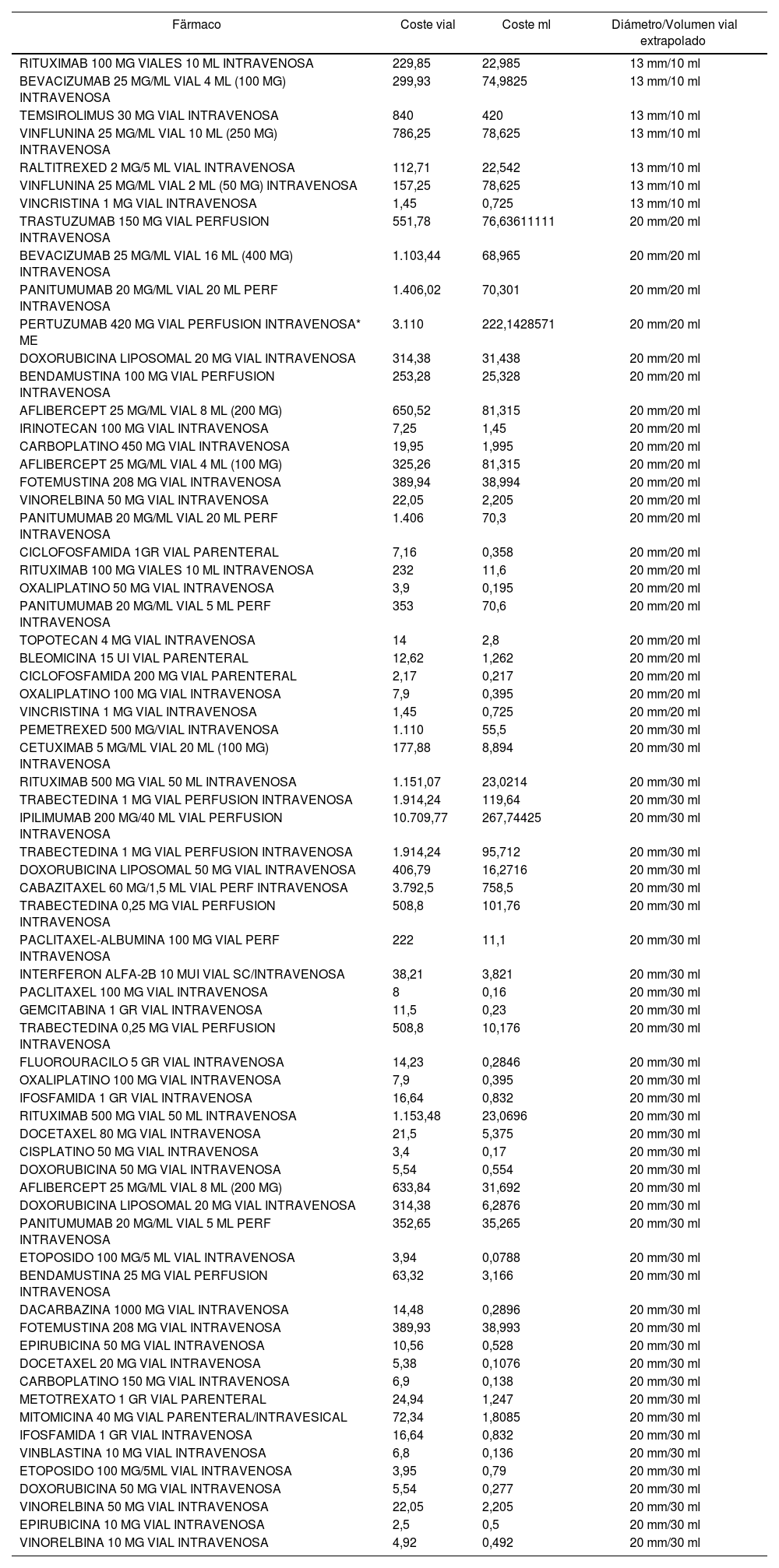
Table 1.Classification of the marketed presentations used in Oncology and Haematology Day Hospitals in 2014
Drug Cost per vial Cost per ml Extrapolated vial diameter / volume RITUXIMAB 100 MG - 10 ML VIALS - INTRAVENOUS 229.85 22.985 13 mm/10 ml BEVACIZUMAB 25 MG/ML - 4 ML (100 MG) VIAL - INTRAVENOUS 299.93 74.9825 13 mm/10 ml TEMSIROLIMUS 30 MG VIAL - INTRAVENOUS 840 420 13 mm/10 ml VINFLUNINE 25 MG/ML - 10 ML (250 MG) VIAL - INTRAVENOUS 786.25 78.625 13 mm/10 ml RALTITREXED 2 MG/5 ML VIAL - INTRAVENOUS 112.71 22.542 13 mm/10 ml VINFLUNINE 25 MG/ML - 2 ML (50 MG) VIAL - INTRAVENOUS 157.25 78.625 13 mm/10 ml VINCRISTINE 1 MG VIAL - INTRAVENOUS 1.45 0.725 13 mm/10 ml TRASTUZUMAB 150 MG VIAL FOR INTRAVENOUS PERFUSION 551.78 76.63611111 20 mm/20 ml BEVACIZUMAB 25 MG/ML - 16 ML (400 MG) VIAL - INTRAVENOUS 1,103.44 68.965 20 mm/20 ml PANITUMUMAB 20 MG/ML - 20 ML VIAL FOR INTRAVENOUS PERFUSION 1,406.02 70.301 20 mm/20 ml PERTUZUMAB 420 MG VIAL FOR PERFUSION INTRAVENOUS* ME 3,110 222.1428571 20 mm/20 ml LIPOSOMAL DOXORUBICIN 20 MG VIAL - INTRAVENOUS 314.38 31.438 20 mm/20 ml BENDAMUSTINE 100 MG VIAL FOR INTRAVENOUS PERFUSION 253.28 25.328 20 mm/20 ml AFLIBERCEPT 25 MG/ML - 8 ML (200 MG) VIAL 650.52 81.315 20 mm/20 ml IRINOTECAN 100 MG VIAL - INTRAVENOUS 7.25 1.45 20 mm/20 ml CARBOPLATIN 450 MG VIAL - INTRAVENOUS 19.95 1.995 20 mm/20 ml AFLIBERCEPT 25 MG/ML - 4 ML (100 MG) VIAL 325.26 81.315 20 mm/20 ml FOTEMUSTINE 208 MG VIAL - INTRAVENOUS 389.94 38.994 20 mm/20 ml VINORELBINE 50 MG VIAL - INTRAVENOUS 22.05 2.205 20 mm/20 ml PANITUMUMAB 20 MG/ML - 20 ML VIAL FOR INTRAVENOUS PERFUSION 1,406 70.3 20 mm/20 ml CYCLOPHOSPHAMIDE 1GR VIAL - PARENTERAL 7.16 0.358 20 mm/20 ml RITUXIMAB 100 MG - 10 ML VIALS - INTRAVENOUS 232 11.6 20 mm/20 ml OXALIPLATIN 50 MG VIAL - INTRAVENOUS 3.9 0.195 20 mm/20 ml PANITUMUMAB 20 MG/ML 5 ML VIAL FOR INTRAVENOUS PERFUSION 353 70.6 20 mm/20 ml TOPOTECAN 4 MG VIAL - INTRAVENOUS 14 2.8 20 mm/20 ml BLEOMYCIN 15 UI VIAL - PARENTERAL 12.62 1.262 20 mm/20 ml CYCLOPHOSPHAMIDE 200 MG VIAL - PARENTERAL 2.17 0.217 20 mm/20 ml OXALIPLATIN 100 MG VIAL - INTRAVENOUS 7.9 0.395 20 mm/20 ml VINCRISTIN 1 MG VIAL - INTRAVENOUS 1.45 0.725 20 mm/20 ml PEMETREXED 500 MG/VIAL - INTRAVENOUS 1,110 55.5 20 mm/30 ml CETUXIMAB 5 MG/ML - 20 ML (100 MG) VIAL - INTRAVENOUS 177.88 8.894 20 mm/30 ml RITUXIMAB 500 MG - 50 ML VIAL - INTRAVENOUS 1,151.07 23.0214 20 mm/30 ml TRABECTEDIN 1 MG VIAL FOR INTRAVENOUS PERFUSION 1914.24 119.64 20 mm/30 ml IPILIMUMAB 200 MG/40 ML VIAL FOR INTRAVENOUS PERFUSION 10,709.77 267.74425 20 mm/30 ml TRABECTEDIN 1 MG VIAL FOR INTRAVENOUS PERFUSION 1,914.24 95.712 20 mm/30 ml LIPOSOMAL DOXORUBICIN 50 MG VIAL - INTRAVENOUS 406.79 16.2716 20 mm/30 ml CABAZITAXEL 60 MG/1.5 ML VIAL FOR INTRAVENOUS PERFUSION 3,792.5 758.5 20 mm/30 ml TRABECTEDIN 0.25 MG VIAL FOR INTRAVENOUS PERFUSION 508.8 101.76 20 mm/30 ml PACLITAXEL-ALBUMIN 100 MG VIAL FOR INTRAVENOUS PERFUSION 222 11.1 20 mm/30 ml INTERFERON ALPHA-2B 10 MUI VIAL - SC / INTRAVENOUS 38.21 3.821 20 mm/30 ml PACLITAXEL 100 MG VIAL - INTRAVENOUS 8 0.16 20 mm/30 ml GEMCITABINE 1 GR VIAL - INTRAVENOUS 11.5 0.23 20 mm/30 ml TRABECTEDIN 0.25 MG VIAL FOR INTRAVENOUS PERFUSION 508.8 10.176 20 mm/30 ml FLUOROURACIL 5 GR VIAL - INTRAVENOUS 14.23 0.2846 20 mm/30 ml OXALIPLATIN 100 MG VIAL - INTRAVENOUS 7.9 0.395 20 mm/30 ml IFOSFAMIDE 1 GR VIAL - INTRAVENOUS 16.64 0.832 20 mm/30 ml RITUXIMAB 500 MG - 50 ML VIAL - INTRAVENOUS 1,153.48 23.0696 20 mm/30 ml DOCETAXEL 80 MG VIAL - INTRAVENOUS 21.5 5.375 20 mm/30 ml CISPLATIN 50 MG VIAL - INTRAVENOUS 3.4 0.17 20 mm/30 ml DOXORUBICIN 50 MG VIAL - INTRAVENOUS 5.54 0.554 20 mm/30 ml AFLIBERCEPT 25 MG/ML - 8 ML (200 MG) VIAL 633.84 31.692 20 mm/30 ml LIPOSOMAL DOXORUBICIN 20 MG VIAL - INTRAVENOUS 314.38 6.2876 20 mm/30 ml PANITUMUMAB 20 MG/ML - 5 ML VIAL FOR INTRAVENOUS PERFUSION 352.65 35.265 20 mm/30 ml ETOPOSIDE 100 MG/5ML VIAL - INTRAVENOUS 3.94 0.0788 20 mm/30 ml BENDAMUSTINE 25 MG VIAL FOR INTRAVENOUS PERFUSION 63.32 3.166 20 mm/30 ml DACARBAZINE 1000 MG VIAL - INTRAVENOUS 14.48 0.2896 20 mm/30 ml FOTEMUSTINE 208 MG VIAL - INTRAVENOUS 389.93 38.993 20 mm/30 ml EPIRUBICIN 50 MG VIAL - INTRAVENOUS 10.56 0.528 20 mm/30 ml DOCETAXEL 20 MG VIAL - INTRAVENOUS 5.38 0.1076 20 mm/30 ml CARBOPLATIN 150 MG VIAL - INTRAVENOUS 6.9 0.138 20 mm/30 ml METHOTREXATE 1 GR VIAL - PARENTERAL 24.94 1.247 20 mm/30 ml MITOMYCIN 40 MG VIAL - PARENTERAL/INTRAVESICAL 72.34 1.8085 20 mm/30 ml IFOSFAMIDE 1 GR VIAL - INTRAVENOUS 16.64 0.832 20 mm/30 ml VINBLASTINE 10 MG VIAL - INTRAVENOUS 6.8 0.136 20 mm/30 ml ETOPOSIDE 100 MG/5ML VIAL - INTRAVENOUS 3.95 0.79 20 mm/30 ml DOXORUBICIN 50 MG VIAL - INTRAVENOUS 5.54 0.277 20 mm/30 ml VINORELBINE 50 MG VIAL - INTRAVENOUS 22.05 2.205 20 mm/30 ml EPIRUBICIN 10 MG VIAL - INTRAVENOUS 2.5 0.5 20 mm/30 ml VINORELBINE 10 MG VIAL - INTRAVENOUS 4.92 0.492 20 mm/30 ml - –
The cost of the syringes for cytostatic preparations (attached to the CS for handling during preparation).
- –
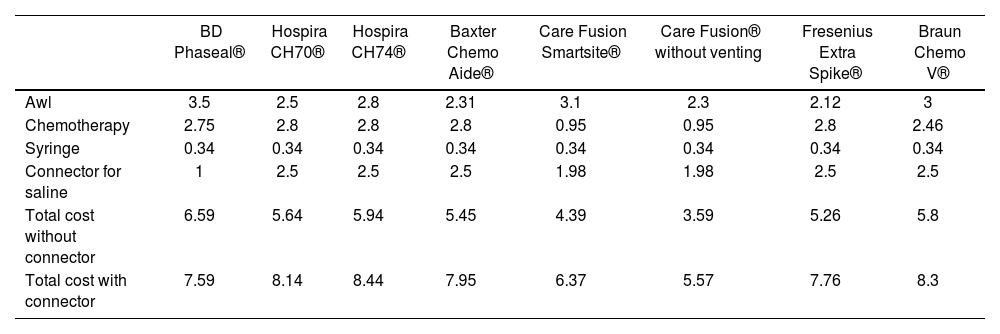
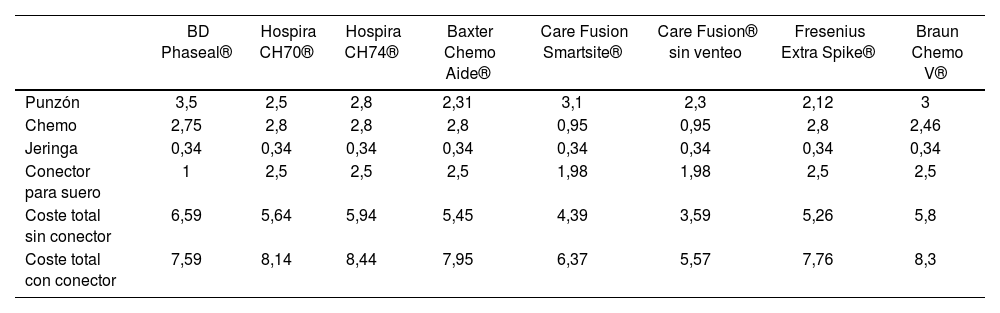
The costs of the CS available at the time of conducting the study (Table 3).
Table 3.Breakdown of the costs of CS by components
BD Phaseal® Hospira CH70® Hospira CH74® Baxter Chemo Aide® Care Fusion Smartsite® Care Fusion® without venting Fresenius Extra Spike® Braun Chemo V® Awl 3.5 2.5 2.8 2.31 3.1 2.3 2.12 3 Chemotherapy 2.75 2.8 2.8 2.8 0.95 0.95 2.8 2.46 Syringe 0.34 0.34 0.34 0.34 0.34 0.34 0.34 0.34 Connector for saline 1 2.5 2.5 2.5 1.98 1.98 2.5 2.5 Total cost without connector 6.59 5.64 5.94 5.45 4.39 3.59 5.26 5.8 Total cost with connector 7.59 8.14 8.44 7.95 6.37 5.57 7.76 8.3
The cost of drug loss was estimated through the weight difference technique. The procedure was conducted as follows:
- a.
Empty 10, 20 and 30 ml vials were weighed.
- b.
Vials were filled with an innocuous and coloured solution, with the respective volumes (10, 20 and 30 mL).
- c.
Each CS model was attached, according to size, to the relevant vial.
- d.
Liquid extraction was conducted through each one of the CS.
- e.
Each vial was weighed once its liquid contents had been extracted. We applied the weight difference technique regarding the initial weight of the empty vial.
This process was conducted three times by three different operators, with the objective of avoiding any bias caused by the level of skill in the use of these systems: Operator 1: with high experience in cytostatic preparation, conducted in his daily practice, wide knowledge of CS; Operator 2: limited experience, with knowledge of the mechanism and performance, and occasionally handling these preparation materials; and Operator 3, without any experience, with knowledge of the mechanism and performance of CS.
The mean level of the 3 measurements was taken as reference. This specific value for each vial size and CS model was considered as drug loss in ml.
The vials of the marketed presentations of drugs used in Oncology and Haematology were classified into 3 groups, according to their diameter size and volume: 13 mm/10 mL, 20 mm/20 mL and 20 mm/30 mL (Table 1); this allowed to extrapolate the loss of the drug discarded in the vial represented by the use of each CS model, through calculating the cost per drug ml, using the price reported at the date of the study, on February, 2015.
The number of total preparations was obtained from the Oncowin® computer system, and the use of vials from SAP®.
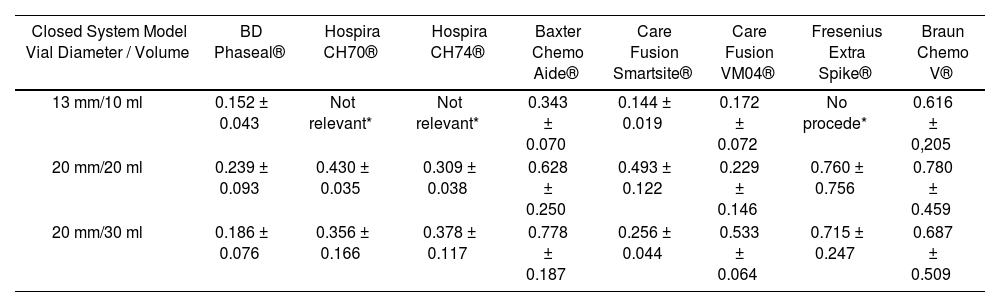
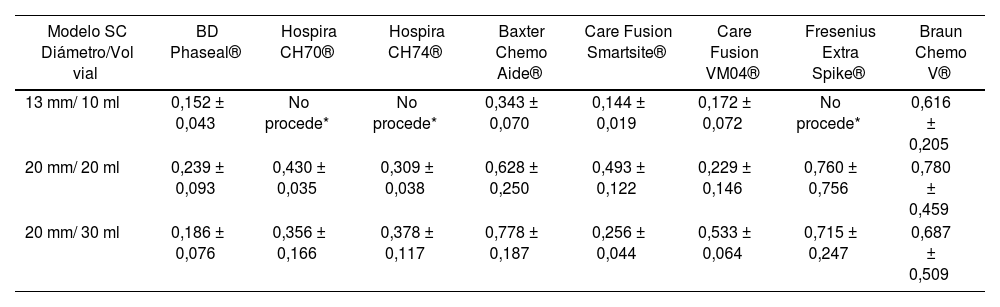
ResultsIn total, there were 63 tests through difference in weight, with each vial size and CS model measured three times, and the mean level of drug not used in each of the three measurements was used as value of reference. These systems were not available to us; Hospira ICU CLAVE® CH 70, CH74, or Fresenius Extra Spike® for the 10ml vial size. The outcomes are stated in table 2.
Volume (ml) of drug lost during the preparation process
| Closed System Model Vial Diameter / Volume | BD Phaseal® | Hospira CH70® | Hospira CH74® | Baxter Chemo Aide® | Care Fusion Smartsite® | Care Fusion VM04® | Fresenius Extra Spike® | Braun Chemo V® |
|---|---|---|---|---|---|---|---|---|
| 13 mm/10 ml | 0.152 ± 0.043 | Not relevant* | Not relevant* | 0.343 ± 0.070 | 0.144 ± 0.019 | 0.172 ± 0.072 | No procede* | 0.616 ± 0,205 |
| 20 mm/20 ml | 0.239 ± 0.093 | 0.430 ± 0.035 | 0.309 ± 0.038 | 0.628 ± 0.250 | 0.493 ± 0.122 | 0.229 ± 0.146 | 0.760 ± 0.756 | 0.780 ± 0.459 |
| 20 mm/30 ml | 0.186 ± 0.076 | 0.356 ± 0.166 | 0.378 ± 0.117 | 0.778 ± 0.187 | 0.256 ± 0.044 | 0.533 ± 0.064 | 0.715 ± 0.247 | 0.687 ± 0.509 |
It was observed that the CS with the best efficient use of the drug in 10ml vials was the system marketed by Care Fusion Smartsite®, with a mean loss of 0.144 ± 0.019 mL, followed by BD-Phaseal® with 0.152 ± 0.433 ml; the system with the highest loss was Braun's Awl, with 0.661 ± 0.205 mL.
For the 20 mL vial size, the device by Care Fusion® model VM04 allowed the most efficient use of the vial contents (0.229 ± 0.146 mL), followed by BD-Phaseal® with a 0.239 ± 0.093ml loss; the device by Braun® presented the highest recorded loss (0.780 ± 0.459 mL).
For 30 mL vials, the BD-Phaseal® system showed the best results (0.186 ± 0.760 mL), followed by the Care Fusion Smarthsitesystem with 0.256±0.044 mL.
The estimated cost that these losses would represent for the hospital was calculated based on the preparations conducted during 2014 for the Oncology and Haematology Units. In total, 71 different commercial presentations were used, classified by vial size and diameter into 3 groups, as appears in table 1.
During this period, 34,598 cytostatic preparations were conducted in total, using 16,788 vials.
In terms of the different CS models used, the detailed cost was the one available at the time of the study. Table 3 shows the breakdown of these costs by components: chemotherapy, awl, and adapter to the infusion system.
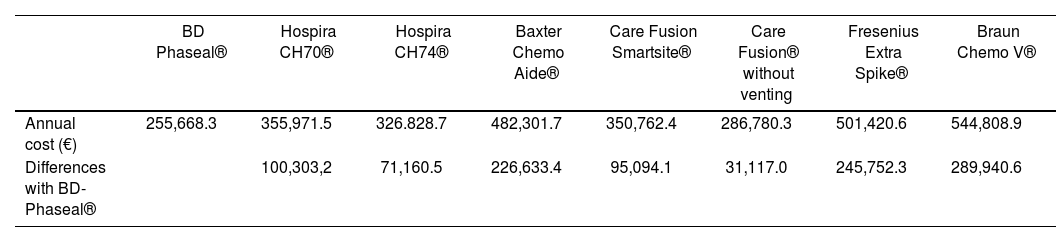
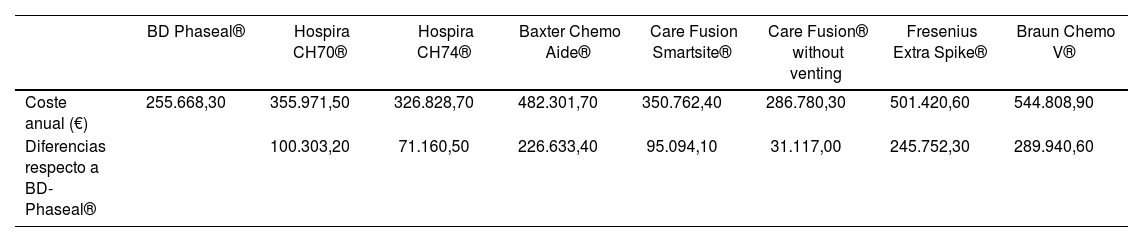
The economic impact represented by the use of each CS model during one year in a third level hospital included the cost of the drug loss, the remains that were not used in each marketed vial, and the cost of CS. The outcomes of this analysis appear in table 4: we consider that the most efficient CS model would be BD-Phaseal®, with a cost of 255.668,3 €/ year. On the other hand, according to our study, the Braun® model would be considered the least efficient, with an impact of 544,808,9 €/year.
Annual economic impact derived of the use of each Closed System
| BD Phaseal® | Hospira CH70® | Hospira CH74® | Baxter Chemo Aide® | Care Fusion Smartsite® | Care Fusion® without venting | Fresenius Extra Spike® | Braun Chemo V® | |
|---|---|---|---|---|---|---|---|---|
| Annual cost (€) | 255,668.3 | 355,971.5 | 326.828.7 | 482,301.7 | 350,762.4 | 286,780.3 | 501,420.6 | 544,808.9 |
| Differences with BD-Phaseal® | 100,303,2 | 71,160.5 | 226,633.4 | 95,094.1 | 31,117.0 | 245,752.3 | 289,940.6 |
Closed Systems have been gradually incorporated in Pharmacy Units, due to the recommendations by our current legislation (RD1591/2009). One of the main drawbacks for their implementation has been their high budgetary impact, as well as the current continuous innovation in this market. The objective of this study was to present an evaluation method for the efficiency of closed systems, through a cost-efficiency analysis, based on the lack of efficient use of the vials shown by these systems.
According to our data, the system with the lowest overall impact on the budget is, however, the one with the highest cost of purchase: the system marketed by BD-Phaseal®; the essential reason for this is that it allows a most efficient use of the drug vials, almost 15% higher than the mean of the other CS.
It is true that this is not the only characteristic that must be assessed at the time of incorporating a new healthcare technology. In fact, this is one of the limitations in our study, which is simply based on cost aspects derived of the purchase of systems and the efficient use of vials. There are even studies that have been publishediii, taking into account the time of preparation of treatments based on the CS used. Besides, currently there are rules that classify these CS into different levels of safety; among these, the BD-Phaseal® systems meet the most demanding requirements. However, we have assumed that all systems present the same sealing and safety datax, and also that there is an equivalent handling of these systems by the nursing staff. The study presented is only a tool for calculating the direct costs derived of the use of different CS. Different hospitals will be able to incorporate these analyses, if they consider them necessary for their assessment of these systems.
IntroducciónLa seguridad laboral se ha convertido en una de las principales preocupaciones de los hospitales, y junto con los pinchazos accidentales, la exposición a los agentes citotóxicos es uno de los temas de mayor relevancia. Desde los años 70 es conocido que las enfermeras que preparan la quimioterapia, presentaban en su organismo niveles elevados de agentes mutagénicos1. Así que desde esa fecha muchas han sido las guías y consensos2,10 que se han elaborado para tratar de minimizar la exposición de los trabajadores a este tipo de agentes3. Uno de los primeros avances en este campo ha sido el uso de cabinas de seguridad biológica en combinación con equipos de protección individual y el empleo de los sistemas cerrados para la transferencia y elaboración de agentes antineoplásicos4, tal y como queda reflejado en el Real Decreto, (RD 665/97) posteriormente modificado (RD 1124/2000 y por el RD 349/2003)5,6. Este decreto regula los sistemas cerrados (SC), por tanto incentiva el uso y la aparición en el mercado de sofisticados sistemas, que relevan el uso de agujas convencionales, estos complejos dispositivos presentan costes heterogéneos que obligan a evaluar su coste-eficiencia7. Esta evaluación, legalmente responsabilidad del Área de Farmacia (RD 1591/2009)8, permite seleccionar los de mayor eficiencia. Para esta evaluación es indispensable considerar que el aumento de seguridad que nos aportan en el manejo de citostáticos estos SC, es a costa de un espacio muerto que presentan, mayor que el de las agujas de carga convencionales, que no permite la extracción total del contenido líquido de los viales9. Así en el presente trabajo hemos analizado el impacto económico que tendría la incorporación de cada uno de estos sistemas en un hospital del tercer nivel, y de manera secundaria se ha realizado un análisis de coste-eficiencia de los mismos basado en el aprovechamiento de los viales.
MétodosSe llevó a cabo un estudio con el objetivo de medir el coste-eficiencia de algunos de los SC disponibles en el mercado. Se evaluaron los siguientes SC:
BD-Phaseal®; Hospira ICU CLAVE® CH 70 y CH74; Baxter-ChemoAI- DE®; Care Fusion Smart Site® y VM04®; Fresenius Extra Spike®; Braun Chemo V Mini Spike®.
Estos sistemas constan, entre otros, de un punzón que permite perforar el septum de caucho de cada vial, quedando fijados a los mismos mediante anclaje. Igualmente permiten el acceso al contenido mediante conexión luer a la jeringa, sin necesidad del empleo de agujas. Todos ellos poseen filtros de venteo de 0,2 pm en todos los modelos a excepción de BD Pha- seal que dispone de una cámara de expansión sellada hermética.
El cálculo del impacto económico supuesto para un año incluyó:
- –
Coste asociado a pérdida de fármaco, que queda remante en el sistema. Para ello se extrapolaron los resultados obtenidos en el ensayo con cada tamaño de vial y modelo de SC del ensayo, mostrados en tabla 1, a los viales usados durante un año en nuestro hospital, áreas de Hospitalización de Día de Oncología y Hematología.
- –
El coste de jeringas para las preparaciones citóstaticas (acopladas al SC para la manipulación durante la mezcla).
- –
Costes de los SC disponibles en el momento de realización del estudio (Tabla 3).
Tabla 3.Costes SC separado por componentes
BD Phaseal® Hospira CH70® Hospira CH74® Baxter Chemo Aide® Care Fusion Smartsite® Care Fusion® sin venteo Fresenius Extra Spike® Braun Chemo V® Punzón 3,5 2,5 2,8 2,31 3,1 2,3 2,12 3 Chemo 2,75 2,8 2,8 2,8 0,95 0,95 2,8 2,46 Jeringa 0,34 0,34 0,34 0,34 0,34 0,34 0,34 0,34 Conector para suero 1 2,5 2,5 2,5 1,98 1,98 2,5 2,5 Coste total sin conector 6,59 5,64 5,94 5,45 4,39 3,59 5,26 5,8 Coste total con conector 7,59 8,14 8,44 7,95 6,37 5,57 7,76 8,3
El coste de pérdida de fármaco se realizó mediante la técnica de diferencia de pesada. El procedimiento se realizó de la siguiente forma:
- a.
Se pesaron los viales vacíos de 10, 20 y 30 ml.
- b.
Se llenaron los viales con una solución inocua y coloreada, con la respectivas cantidades (10, 20 y 30 mL).
- c.
Se colocó cada modelo de SC según tamaño, a los respectivos viales. d. Se llevó a cabo la extracción de liquido a través de cada uno de los SC.
- e.
Se realizó pesada de cada vial una vez extraído el líquido contenido. Aplicamos técnica de diferencia de pesada respecto a la pesada inicial del vial vacío.
Este proceso, se realizó por triplicado por tres operarios diferentes, con el fin de evitar sesgos en el grado de destreza en cuanto al manejo de estos sistemas (operador 1: con elevada experiencia en preparación de citostáticos, desempeña en su puesto de trabajo diario, conocimiento amplio de SC; operador 2: experiencia limitada, conoce el mecanismo y funcionamiento y realiza manejo ocasional de este material de preparación; operario 3: sin experiencia, conoce el mecanismo y funcionamiento de SC).
Se tomó como referencia la media de las 3 determinaciones. Este valor, específico para cada tamaño de vial y modelo de SC, se consideró como ml de pérdida de fármaco.
La clasificación de los viales de las presentaciones comercializadas de fármacos empleados en Oncología y Hematología en 3 grupos, según tamaño de diámetro y volumen: 13 mm/10 mL, 20 mm/20 mL y 20 mm/30 mL (Tabla 1), permitió extrapolar la pérdida de fármaco desechado en vial que supondría el empleo de cada modelo de SC, mediante el cálculo de coste por ml de fármaco, usando el precio notificado a fecha del estudio, febrero 2015.
Clasificación de las presentaciones comerciales usadas en los hospitales de día de Oncología y Hematología en el año 2014
| Färmaco | Coste vial | Coste ml | Diámetro/Volumen vial extrapolado |
|---|---|---|---|
| RITUXIMAB 100 MG VIALES 10 ML INTRAVENOSA | 229,85 | 22,985 | 13 mm/10 ml |
| BEVACIZUMAB 25 MG/ML VIAL 4 ML (100 MG) INTRAVENOSA | 299,93 | 74,9825 | 13 mm/10 ml |
| TEMSIROLIMUS 30 MG VIAL INTRAVENOSA | 840 | 420 | 13 mm/10 ml |
| VINFLUNINA 25 MG/ML VIAL 10 ML (250 MG) INTRAVENOSA | 786,25 | 78,625 | 13 mm/10 ml |
| RALTITREXED 2 MG/5 ML VIAL INTRAVENOSA | 112,71 | 22,542 | 13 mm/10 ml |
| VINFLUNINA 25 MG/ML VIAL 2 ML (50 MG) INTRAVENOSA | 157,25 | 78,625 | 13 mm/10 ml |
| VINCRISTINA 1 MG VIAL INTRAVENOSA | 1,45 | 0,725 | 13 mm/10 ml |
| TRASTUZUMAB 150 MG VIAL PERFUSION INTRAVENOSA | 551,78 | 76,63611111 | 20 mm/20 ml |
| BEVACIZUMAB 25 MG/ML VIAL 16 ML (400 MG) INTRAVENOSA | 1.103,44 | 68,965 | 20 mm/20 ml |
| PANITUMUMAB 20 MG/ML VIAL 20 ML PERF INTRAVENOSA | 1.406,02 | 70,301 | 20 mm/20 ml |
| PERTUZUMAB 420 MG VIAL PERFUSION INTRAVENOSA* ME | 3.110 | 222,1428571 | 20 mm/20 ml |
| DOXORUBICINA LIPOSOMAL 20 MG VIAL INTRAVENOSA | 314,38 | 31,438 | 20 mm/20 ml |
| BENDAMUSTINA 100 MG VIAL PERFUSION INTRAVENOSA | 253,28 | 25,328 | 20 mm/20 ml |
| AFLIBERCEPT 25 MG/ML VIAL 8 ML (200 MG) | 650,52 | 81,315 | 20 mm/20 ml |
| IRINOTECAN 100 MG VIAL INTRAVENOSA | 7,25 | 1,45 | 20 mm/20 ml |
| CARBOPLATINO 450 MG VIAL INTRAVENOSA | 19,95 | 1,995 | 20 mm/20 ml |
| AFLIBERCEPT 25 MG/ML VIAL 4 ML (100 MG) | 325,26 | 81,315 | 20 mm/20 ml |
| FOTEMUSTINA 208 MG VIAL INTRAVENOSA | 389,94 | 38,994 | 20 mm/20 ml |
| VINORELBINA 50 MG VIAL INTRAVENOSA | 22,05 | 2,205 | 20 mm/20 ml |
| PANITUMUMAB 20 MG/ML VIAL 20 ML PERF INTRAVENOSA | 1.406 | 70,3 | 20 mm/20 ml |
| CICLOFOSFAMIDA 1GR VIAL PARENTERAL | 7,16 | 0,358 | 20 mm/20 ml |
| RITUXIMAB 100 MG VIALES 10 ML INTRAVENOSA | 232 | 11,6 | 20 mm/20 ml |
| OXALIPLATINO 50 MG VIAL INTRAVENOSA | 3,9 | 0,195 | 20 mm/20 ml |
| PANITUMUMAB 20 MG/ML VIAL 5 ML PERF INTRAVENOSA | 353 | 70,6 | 20 mm/20 ml |
| TOPOTECAN 4 MG VIAL INTRAVENOSA | 14 | 2,8 | 20 mm/20 ml |
| BLEOMICINA 15 UI VIAL PARENTERAL | 12,62 | 1,262 | 20 mm/20 ml |
| CICLOFOSFAMIDA 200 MG VIAL PARENTERAL | 2,17 | 0,217 | 20 mm/20 ml |
| OXALIPLATINO 100 MG VIAL INTRAVENOSA | 7,9 | 0,395 | 20 mm/20 ml |
| VINCRISTINA 1 MG VIAL INTRAVENOSA | 1,45 | 0,725 | 20 mm/20 ml |
| PEMETREXED 500 MG/VIAL INTRAVENOSA | 1.110 | 55,5 | 20 mm/30 ml |
| CETUXIMAB 5 MG/ML VIAL 20 ML (100 MG) INTRAVENOSA | 177,88 | 8,894 | 20 mm/30 ml |
| RITUXIMAB 500 MG VIAL 50 ML INTRAVENOSA | 1.151,07 | 23,0214 | 20 mm/30 ml |
| TRABECTEDINA 1 MG VIAL PERFUSION INTRAVENOSA | 1.914,24 | 119,64 | 20 mm/30 ml |
| IPILIMUMAB 200 MG/40 ML VIAL PERFUSION INTRAVENOSA | 10.709,77 | 267,74425 | 20 mm/30 ml |
| TRABECTEDINA 1 MG VIAL PERFUSION INTRAVENOSA | 1.914,24 | 95,712 | 20 mm/30 ml |
| DOXORUBICINA LIPOSOMAL 50 MG VIAL INTRAVENOSA | 406,79 | 16,2716 | 20 mm/30 ml |
| CABAZITAXEL 60 MG/1,5 ML VIAL PERF INTRAVENOSA | 3.792,5 | 758,5 | 20 mm/30 ml |
| TRABECTEDINA 0,25 MG VIAL PERFUSION INTRAVENOSA | 508,8 | 101,76 | 20 mm/30 ml |
| PACLITAXEL-ALBUMINA 100 MG VIAL PERF INTRAVENOSA | 222 | 11,1 | 20 mm/30 ml |
| INTERFERON ALFA-2B 10 MUI VIAL SC/INTRAVENOSA | 38,21 | 3,821 | 20 mm/30 ml |
| PACLITAXEL 100 MG VIAL INTRAVENOSA | 8 | 0,16 | 20 mm/30 ml |
| GEMCITABINA 1 GR VIAL INTRAVENOSA | 11,5 | 0,23 | 20 mm/30 ml |
| TRABECTEDINA 0,25 MG VIAL PERFUSION INTRAVENOSA | 508,8 | 10,176 | 20 mm/30 ml |
| FLUOROURACILO 5 GR VIAL INTRAVENOSA | 14,23 | 0,2846 | 20 mm/30 ml |
| OXALIPLATINO 100 MG VIAL INTRAVENOSA | 7,9 | 0,395 | 20 mm/30 ml |
| IFOSFAMIDA 1 GR VIAL INTRAVENOSA | 16,64 | 0,832 | 20 mm/30 ml |
| RITUXIMAB 500 MG VIAL 50 ML INTRAVENOSA | 1.153,48 | 23,0696 | 20 mm/30 ml |
| DOCETAXEL 80 MG VIAL INTRAVENOSA | 21,5 | 5,375 | 20 mm/30 ml |
| CISPLATINO 50 MG VIAL INTRAVENOSA | 3,4 | 0,17 | 20 mm/30 ml |
| DOXORUBICINA 50 MG VIAL INTRAVENOSA | 5,54 | 0,554 | 20 mm/30 ml |
| AFLIBERCEPT 25 MG/ML VIAL 8 ML (200 MG) | 633,84 | 31,692 | 20 mm/30 ml |
| DOXORUBICINA LIPOSOMAL 20 MG VIAL INTRAVENOSA | 314,38 | 6,2876 | 20 mm/30 ml |
| PANITUMUMAB 20 MG/ML VIAL 5 ML PERF INTRAVENOSA | 352,65 | 35,265 | 20 mm/30 ml |
| ETOPOSIDO 100 MG/5 ML VIAL INTRAVENOSA | 3,94 | 0,0788 | 20 mm/30 ml |
| BENDAMUSTINA 25 MG VIAL PERFUSION INTRAVENOSA | 63,32 | 3,166 | 20 mm/30 ml |
| DACARBAZINA 1000 MG VIAL INTRAVENOSA | 14,48 | 0,2896 | 20 mm/30 ml |
| FOTEMUSTINA 208 MG VIAL INTRAVENOSA | 389,93 | 38,993 | 20 mm/30 ml |
| EPIRUBICINA 50 MG VIAL INTRAVENOSA | 10,56 | 0,528 | 20 mm/30 ml |
| DOCETAXEL 20 MG VIAL INTRAVENOSA | 5,38 | 0,1076 | 20 mm/30 ml |
| CARBOPLATINO 150 MG VIAL INTRAVENOSA | 6,9 | 0,138 | 20 mm/30 ml |
| METOTREXATO 1 GR VIAL PARENTERAL | 24,94 | 1,247 | 20 mm/30 ml |
| MITOMICINA 40 MG VIAL PARENTERAL/INTRAVESICAL | 72,34 | 1,8085 | 20 mm/30 ml |
| IFOSFAMIDA 1 GR VIAL INTRAVENOSA | 16,64 | 0,832 | 20 mm/30 ml |
| VINBLASTINA 10 MG VIAL INTRAVENOSA | 6,8 | 0,136 | 20 mm/30 ml |
| ETOPOSIDO 100 MG/5ML VIAL INTRAVENOSA | 3,95 | 0,79 | 20 mm/30 ml |
| DOXORUBICINA 50 MG VIAL INTRAVENOSA | 5,54 | 0,277 | 20 mm/30 ml |
| VINORELBINA 50 MG VIAL INTRAVENOSA | 22,05 | 2,205 | 20 mm/30 ml |
| EPIRUBICINA 10 MG VIAL INTRAVENOSA | 2,5 | 0,5 | 20 mm/30 ml |
| VINORELBINA 10 MG VIAL INTRAVENOSA | 4,92 | 0,492 | 20 mm/30 ml |
El número de preparaciones totales se obtuvo del sistema informático Oncowin® y el consumo de viales de SAP®.
Resultados
Se realizaron un total de 63 determinaciones por diferencia de pesada, cada tamaño de vial y modelo de SC por triplicado, tomándose como valor el desaprovechamiento medio de las tres medidas, no tuvimos disponible el sistema Hospira ICU CLAVE® CH 70, CH74 ni Fresenius Extra Spike® para el tamaño de vial de 10 ml; resultados expuestos en la tabla 2.
Volumen (ml) de fármaco perdido en el proceso de preparación
| Modelo SC Diámetro/Vol vial | BD Phaseal® | Hospira CH70® | Hospira CH74® | Baxter Chemo Aide® | Care Fusion Smartsite® | Care Fusion VM04® | Fresenius Extra Spike® | Braun Chemo V® |
|---|---|---|---|---|---|---|---|---|
| 13 mm/ 10 ml | 0,152 ± 0,043 | No procede* | No procede* | 0,343 ± 0,070 | 0,144 ± 0,019 | 0,172 ± 0,072 | No procede* | 0,616 ± 0,205 |
| 20 mm/ 20 ml | 0,239 ± 0,093 | 0,430 ± 0,035 | 0,309 ± 0,038 | 0,628 ± 0,250 | 0,493 ± 0,122 | 0,229 ± 0,146 | 0,760 ± 0,756 | 0,780 ± 0,459 |
| 20 mm/ 30 ml | 0,186 ± 0,076 | 0,356 ± 0,166 | 0,378 ± 0,117 | 0,778 ± 0,187 | 0,256 ± 0,044 | 0,533 ± 0,064 | 0,715 ± 0,247 | 0,687 ± 0,509 |
Se observó que el SC que con menor pérdida en los viales de 10 ml fue el sistema comercializado por Care Fusion Smartsite®, con una pérdida media de 0,144 ± 0,019mL, seguido de BD-Phaseal® con 0,152±0,433 ml; el de mayor pérdida fue el punzón de Braun produjo una pérdida de 0,661 ± 0,205 mL.
Para el tamaño de vial de 20 mL el dispositivo que permitió un mayor aprovechamiento del contenido del vial (0,229 ± 0,146 mL) fué el dispositivo de Care Fusion® modelo VM04, seguido de BD-Phaseal® con pérdida de 0,239 ± 0,093ml; el de mayor pérdida registrada fue Braun® (0,780±0,459 mL).
Para los viales de 30 mL, el sistema que mejores resultados mostró fue el de BD-Phaseal® (0,186 ± 0,760 mL), seguido del sistema de Care Fusion Smarthsite con 0,256 ± 0,044 mL.
El coste que estas pérdidas supondrían para el hospital, fueron calculadas a partir de las preparaciones realizadas durante el año 2014 para los Servicios de Oncología Médica y Hematología. El total de presentaciones comerciales diferentes usadas fueron 71, clasificadas según tamaño de vial y diámetro para nuestro estudio en 3 grupos, tal y como se expone en la tabla 1.
Durante este periodo de tiempo se elaboraron un total de 34.598 preparaciones citostáticas a partir de 16.788 viales.
En cuanto a los diferentes modelos de SC empleados, el coste detallado, fue el disponible a fecha del estudio. Estos costes aparecen detallados por componentes en la tabla 3: chemo, punzón y adaptador al sistema de infusión.
El impacto económico que supondría el uso de cada modelo de SC durante un año en un hospital de tercer nivel incluyó el coste de la pérdida de fármaco, remanente del vial comercial no aprovechable y el coste de los SC. Tras este análisis, con resultados expuestos en la tabla 4, consideraríamos que el modelo de SC más eficiente sería BD-Phaseal®, con un coste de 255.668,3 €/año. En contraposición, el modelo de Braun®, con un impacto de 544.808,9 €/año se consideraría según nuestro estudio como el menos eficiente.
Impacto económico anual derivado del uso de cada uno de los SC
| BD Phaseal® | Hospira CH70® | Hospira CH74® | Baxter Chemo Aide® | Care Fusion Smartsite® | Care Fusion® without venting | Fresenius Extra Spike® | Braun Chemo V® | |
|---|---|---|---|---|---|---|---|---|
| Coste anual (€) | 255.668,30 | 355.971,50 | 326.828,70 | 482.301,70 | 350.762,40 | 286.780,30 | 501.420,60 | 544.808,90 |
| Diferencias respecto a BD-Phaseal® | 100.303,20 | 71.160,50 | 226.633,40 | 95.094,10 | 31.117,00 | 245.752,30 | 289.940,60 |
La incorporación de los SC en los servicios de farmacia, se ha ido realizando poco a poco, gracias a las recomendaciones de la legislación vigente (RD1591/2009). Uno de los principales inconvenientes, para su implantación, ha sido el elevado impacto presupuestario de los mismos, junto con la continua innovación que está aconteciendo en estos momentos en este mercado. Con el presente trabajo hemos querido mostrar un sistema de evaluación de la eficiencia de los sistemas cerrados, con un análisis de tipo coste-eficiencia, basándose en el no-aprovechamiento que estos sistemas tienen de los viales.
Según nuestros datos, el sistema que menor impacto presupuestario general, es el que curiosamente tiene un mayor coste de adquisición, el sistema comercializado por BD-Phaseal®, debido fundamentalmente a que permite un mayor aprovechamiento de los viales de los fármacos, casi un 15% de media más que el resto de los SC.
Es cierto que esta no es la única característica que hay que valorar a la hora de incorporar una nueva tecnología sanitaria. De hecho esta es una de las limitaciones de nuestro estudio que simplemente está basado en aspectos de costes, derivados de la adquisición de los sistemas y del aprovechamiento de los viales. Incluso hay estudios que han sido publicados3, considerando el tiempo de preparación de los tratamientos en función del SC empleado. Además, en la actualidad existen normativas que clasifican en diversos grados de seguridad estos SC, entre los que los sistemas de BD-Phaseal®, cumplen los requisitos más exigentes. Sin embargo, nosotros hemos asumido que todos presentan los mismos datos de estanqueidad y seguridadx y que además, el manejo de estos sistemas, por parte del personal de enfermería, es equivalente. El estudio presentado es únicamente una herramienta para el cálculo de costes directos derivados del uso de los diferentes SC. Los diversos hospitales podrán incorporar estos análisis, si los consideran necesarios en sus evaluaciones de estos sistemas.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas