el objetivo principal es describir la efectividad y seguridad en vida real del tratamiento con nivolumab en pacientes con linfoma de Hodgkin clásico en recaída o refractario. El objetivo secundario es describir el manejo terapéutico tras la monoterapia con nivolumab.
Métodoestudio observacional, retrospectivo y multidisciplinar que incluyó a todos los pacientes con linfoma de Hodgkin clásico en recaída o refractario, tratados con nivolumab en monoterapia desde noviembre de 2015 hasta marzo de 2023. Se recogieron variables relacionadas con el paciente y con el tratamiento. La efectividad se midió como tasa de respuestas globales, supervivencia libre de progresión y supervivencia global. La seguridad se midió como porcentaje de pacientes con efectos adversos y su gravedad.
Resultadosse incluyeron 13 pacientes, mediana de edad 37,5 años (RIQ: 25,3-54,7), 84,6% hombres. La mediana de líneas terapéuticas previas fue 3 (RIQ: 2,0–4,5), incluyendo trasplante autógeno de progenitores hematopoyéticos (84,6%) y brentuximab vedotin (100%). Todos recibieron nivolumab 3 mg/kg/14 días, con una mediana de 11 ciclos (RIQ: 6,5–20,5) por paciente. La mediana de tiempo en tratamiento fue de 4,9 meses (RIQ: 3,0–9,6) y la de tiempo de seguimiento de 9,2 meses (RIQ: 5,6-32,3).
Consiguieron respuesta completa 3 pacientes (23,1%), respuesta parcial 3 (23,1%), enfermedad estable 3 (23,1%) y progresaron 4 (30,8%). La tasa de respuesta objetiva fue del 46,2%. La mediana de supervivencia libre de progresión fue 23,9 meses (IC95%: 0–49,1), la mediana de supervivencia global no se alcanzó. A la fecha de corte del estudio, 5 pacientes murieron (38,5%), 4 mantenían remisión completa sin tratamiento activo (30,8%) y 4 continuaban en tratamiento (30,8%).
El 76,9% de los pacientes presentó efectos adversos, 44% de gravedad ≥3, siendo los más frecuentes hipotiroidismo y hepatotoxicidad. Un paciente suspendió tratamiento por neumonitis, 2 tuvieron retrasos de tratamiento (trombocitopenia e hipertransaminemia) y uno modificó la pauta a mensual (toxicidad pulmonar).
Conclusionesnivolumab en el tratamiento del linfoma de Hodgkin clásico en recaída o refractario ha confirmado en la muestra de estudio datos favorables de efectividad, expresada en tasa de respuesta objetiva del 46,2% y beneficio clínico del 69,2%. La seguridad fue aceptable, manejable y concordante con lo descrito en la bibliografía.
The primary objective is to describe the real-life effectiveness and safety of nivolumab treatment in patients with relapsed or refractory classical Hodgkin's lymphoma. The secondary objective is to describe the therapeutic management after nivolumab monotherapy.
MethodObservational, retrospective, multidisciplinary study including all patients with relapsed or refractory classical Hodgkin's lymphoma treated with nivolumab monotherapy from November 2015 to March 2023. Patient and treatment-related variables were collected. Effectiveness was measured as overall response rate, progression-free survival and overall survival. Safety was measured as percentage of patients with adverse effects and severity.
ResultsThirteen patients were included, median age 37.5 years (RIQ: 25.3–54.7), 84.6% male. The median number of previous lines of therapy was 3 (RIQ: 2.0–4.5), including autologous hematopoietic stem cell transplantation (84.6%) and brentuximab vedotin (100%). All received nivolumab 3 mg/kg/14 days, with a median of 11 cycles (RIQ: 6.5–20.5) per patient. Median time on treatment was 4.9 months (RIQ: 3.0–9.6) and median follow-up time was 9.2 months (RIQ: 5.6–32.3).
Complete response was achieved by 3 patients (23.1%), partial response by 3 (23.1%), stable disease by 3 (23.1%) and progression by 4 (30.8%). The objective response rate was 46.2%. Median progression-free survival was 23.9 months (95%CI: 0–49.1), median overall survival was not reached. At the study cutoff date, five patients had died (38.5%), four were in complete remission without active treatment (30.8%) and four were continuing treatment (30.8%).
Adverse events occurred in 76.9% of patients, 44% of severity ≥3, the most frequent being hypothyroidism and hepatotoxicity. One patient discontinued treatment due to pneumonitis, two suffered treatment delays (thrombocytopenia and hypertransaminemia) and one changed the regimen to monthly (pulmonary toxicity).
ConclusionsNivolumab in the treatment of relapsed or refractory classical Hodgkin's lymphoma has confirmed in the study sample favorable effectiveness data, expressed as objective response rate of 46.2% and clinical benefit of 69.2%. Safety was acceptable, manageable, and consistent with that described in the literature.
El linfoma de Hodgkin (LH) supone aproximadamente el 10% de todos los linfomas y el 0,6% de todos los cánceres diagnosticados en el mundo cada año1. Se caracteriza histológicamente por la presencia de células malignas de Hodgkin y de Reed Sternberg (HRS), rodeadas por abundantes células inflamatorias no tumorales. Se divide en 2 subtipos histológicos fundamentales: LH clásico (LHc) y LH de predominio linfocítico nodular. Este último con un curso generalmente indolente.
En los últimos años, los avances en el uso de radioterapia y poliquimioterapia han incrementado la tasa de curaciones en los pacientes con LHc, y aproximadamente el 80% de los menores de 60 años con LH de nuevo diagnóstico pueden alcanzar remisión completa (RC) duradera2,3.
Sin embargo, un porcentaje importante de pacientes no alcanzan estas respuestas o recaen. El tratamiento estándar de los pacientes con LHc refractario o en recaída (LHc R/R) es la quimioterapia de rescate seguida de trasplante autógeno de progenitores hematopoyéticos (TAPH) con lo que se alcanza una tasa de RC del 50%4,5. En los pacientes que presentan LHc R/R tras el TAPH, el pronóstico es muy desfavorable, con una mediana de supervivencia de 27 meses6.
En los últimos años, la supervivencia global de los pacientes que recaen tras un TAPH ha mejorado debido a la introducción de nuevos fármacos7. El trasplante alogénico de progenitores hematopoyéticos (aloTPH) ha representado durante muchos años la única opción terapéutica curativa para estos pacientes8. Sin embargo, el panorama ha cambiado de manera significativa con la aprobación de brentuximab vedotin (BV) y más recientemente de los inhibidores del punto de control inmunitario (ICI)9.
La expresión de PD-L1 y PD-L2 es un hallazgo frecuente en las células HRS del LHc, estando relacionado el aumento de esta expresión con la amplificación o ganancia de la región cromosómica 9p24.110. Este hallazgo hace que sean una excelente diana terapéutica para los ICI, nivolumab y pembrolizumab, este último no financiado en España actualmente para esta indicación.
Nivolumab es un anticuerpo monoclonal humano que se une al receptor de muerte programada 1 (PD-1) y bloquea su interacción con PD-L1 y PD-L2. En España tiene indicación aprobada y financiada para el tratamiento en monoterapia de pacientes adultos con LHc R/R tras TAPH y tratamiento con BV11. Los datos que sustentaron su aprobación provienen de un estudio fase 1b (CheckMate 039) y un estudio fase 2 (CheckMate 205) en el que se incluyeron un total de 95 pacientes que habían recibido TAPH y BV. Para esta población, y con mediana de seguimiento de 22,7 meses, la tasa de respuesta objetiva (TRO) fue del 68% (13% RC y 55% respuesta parcial [RP]) y una mediana de duración de la respuesta de 15,9 meses. La mediana de supervivencia libre de progresión (SLP) fue de 14,7 meses, la mediana de supervivencia global (SG) no se había alcanzado en el momento del análisis, siendo la tasa de SG del 95% a los 12 meses12,13. Un análisis ampliado del ensayo CheckMate 205 mostró respuestas duraderas, no solo en pacientes en RC o RP, sino también en aquellos que logran una enfermedad estable, con tasas similares de SG a un año14. En relación al manejo de pacientes que fracasan a la terapia anti-PD-1 la quimioterapia sola o en combinación con un ICI, especialmente como puente a un aloTPH, ha mostrado respuestas alentadoras en algunos pacientes15.
En relación a la seguridad, nivolumab en el LH se asocia con un perfil similar al establecido para otras indicaciones, y la mayoría de las reacciones adversas, incluyendo las graves, suelen resolverse después de suspender el tratamiento, retrasar algunas dosis o tras iniciar un tratamiento adecuado (corticoides a altas dosis u otros inmunosupresores)11,16,17. Aunque la mayoría de las reacciones adversas son leves y moderadas, puede ser necesaria la suspensión definitiva del tratamiento. Cabe destacar que el tratamiento con nivolumab puede aumentar el riesgo de enfermedad injerto contra huésped (EICH) grave y de muerte en pacientes con un aloTPH previo, principalmente en aquellos con antecedentes de EICH. Otras reacciones adversas inmunorelacionadas que pueden aparecer en los pacientes que han recibido un aloTPH previo a nivolumab son el síndrome de obstrucción sinusoidal (SOS) y el síndrome febril hiperagudo (SFH) de desarrollo temprano (1–7 días tras aloTPH)15,18.
El objetivo principal del estudio es evaluar la efectividad (medida como tasa de respuestas globales, así como supervivencia libre de progresión y supervivencia global) y la seguridad del tratamiento con nivolumab en monoterapia en pacientes con LHc R/R en vida real en un hospital de tercer nivel. El objetivo secundario es describir el manejo terapéutico de los pacientes tras la monoterapia con nivolumab.
MétodosEstudio observacional, retrospectivo, multidisciplinar y unicéntrico que incluyó a todos los pacientes con LHc R/R tratados con nivolumab en monoterapia en el entorno de un hospital de tercer nivel desde noviembre de 2015 hasta agosto de 2023.
Se incluyeron los pacientes mayores de 18 años con diagnóstico de LHc R/R que hubieran recibido tratamiento con nivolumab durante al menos 3 meses (6 ciclos). Se excluyeron aquellos que hubieran recibido nivolumab en el contexto de un ensayo clínico o que presentaran LH no clásico.
Se recogieron las siguientes variables al inicio del tratamiento con nivolumab: la edad, el sexo, el subtipo de LHc (nodular, celularidad mixta, rico en linfocitos, con depleción linfoide), el número de líneas previas (incluyendo TPH), LHc refractario a primera línea, tratamiento previo, TPH y brentuximab antes de nivolumab, el tiempo desde el diagnóstico del LHc hasta la primera dosis de nivolumab y Ann Arbor Stage.
En relación al tratamiento, se recogió la dosis, la pauta y el número de ciclos de nivolumab recibidos, la duración de la monoterapia con nivolumab, las líneas sucesivas desde la suspensión hasta fin de seguimiento, la realización de TPH y tipo tras nivolumab.
La efectividad se midió como mejor respuesta obtenida medida mediante tomografía de emisión de positrones asociada a tomografía axial computarizada (PET/TAC) o TAC. La respuesta se clasificó en 4 grupos de acuerdo con los criterios de la clasificación de Lugano19,20: respuesta completa metabólica (RC), respuesta parcial metabólica (RP), enfermedad estable (EE) y progresión.
Se definió la tasa de respuesta global objetiva (TRO) como la suma de RC y RP, y la tasa de pacientes que obtienen beneficio clínico como la suma de RC, RP y EE. Se evaluó también la supervivencia libre de progresión (SLP) y la supervivencia global (SG) a la fecha de fin del estudio.
La seguridad se midió con la aparición de efectos adversos (EA) y la gravedad de los mismos según criterios del National Cancer Institute's Common Terminology Criteria for Adverse Events más reciente NCI CTCAE v5.021. También se recogió el motivo de reducción de dosis, suspensión o retraso de tratamiento. En los pacientes que recibieron un aloTPH posterior al tratamiento con nivolumab se evaluó la aparición de EICH aguda, SOS y SFH.
Los datos se obtuvieron de la historia clínica electrónica, Orion Clinic®, así como del programa que gestiona el proceso farmacoterapéutico de los pacientes Farmis-Oncofarm®.
Las variables cuantitativas de distribución central se describieron como media e IC 95%, y las de distribución asimétrica como mediana y rango intercuartílico (RIQ). Las variables categóricas se presentaron como frecuencias absolutas y relativas. La significación estadística para las pruebas de contraste fue de p<0,05. Para calcular la SLP y SG se aplicó el método Kaplan–Meier. El tratamiento estadístico se realizó con el programa informático SPSS®.
El estudio fue presentado y aprobado por la comisión de investigación del hospital: código 2023–435-1 (EOm), fecha aprobación 10 de mayo de 2023. Atendiendo a la Ley Orgánica de protección de datos 3/2018 y al Reglamento 2016/679 del Parlamento europeo y del Consejo de 27 de abril de 2016, con el fin de proteger los datos de carácter confidencial de los pacientes, estos se identificaron con un código numérico.
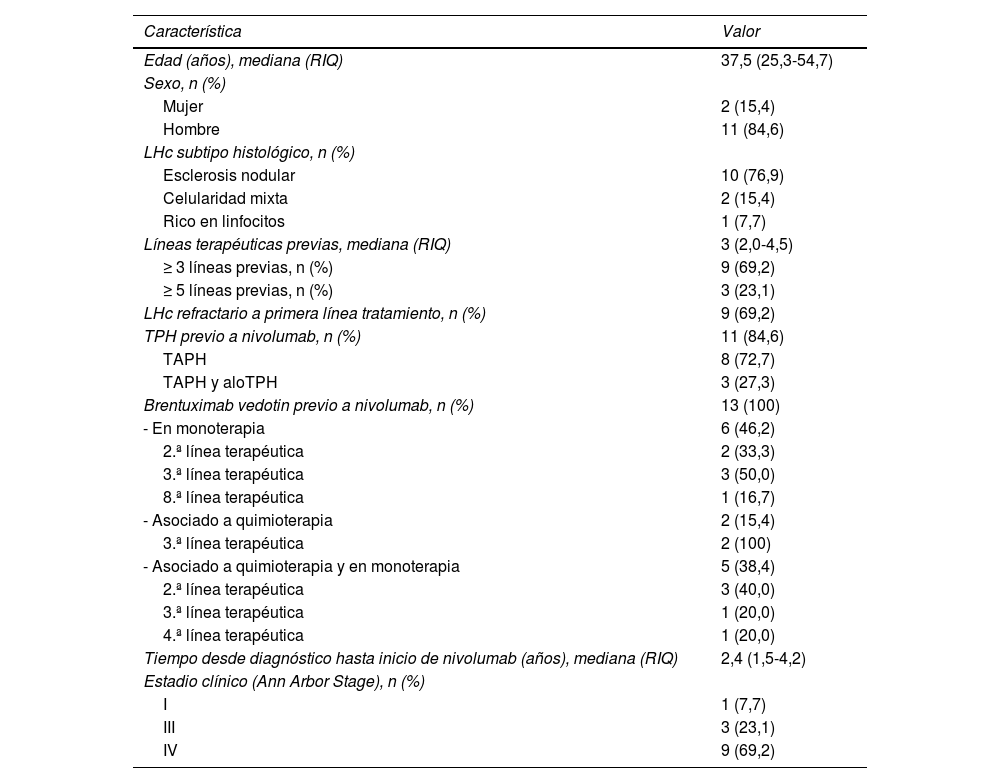
ResultadosSe incluyeron 13 pacientes en el estudio, cuyos datos demográficos y características clínicas al inicio del tratamiento con nivolumab se describen en la tabla 1.
Características de los pacientes al inicio del tratamiento con nivolumab (n = 13)
| Característica | Valor |
|---|---|
| Edad (años), mediana (RIQ) | 37,5 (25,3-54,7) |
| Sexo, n (%) | |
| Mujer | 2 (15,4) |
| Hombre | 11 (84,6) |
| LHc subtipo histológico, n (%) | |
| Esclerosis nodular | 10 (76,9) |
| Celularidad mixta | 2 (15,4) |
| Rico en linfocitos | 1 (7,7) |
| Líneas terapéuticas previas, mediana (RIQ) | 3 (2,0-4,5) |
| ≥ 3 líneas previas, n (%) | 9 (69,2) |
| ≥ 5 líneas previas, n (%) | 3 (23,1) |
| LHc refractario a primera línea tratamiento, n (%) | 9 (69,2) |
| TPH previo a nivolumab, n (%) | 11 (84,6) |
| TAPH | 8 (72,7) |
| TAPH y aloTPH | 3 (27,3) |
| Brentuximab vedotin previo a nivolumab, n (%) | 13 (100) |
| - En monoterapia | 6 (46,2) |
| 2.ª línea terapéutica | 2 (33,3) |
| 3.ª línea terapéutica | 3 (50,0) |
| 8.ª línea terapéutica | 1 (16,7) |
| - Asociado a quimioterapia | 2 (15,4) |
| 3.ª línea terapéutica | 2 (100) |
| - Asociado a quimioterapia y en monoterapia | 5 (38,4) |
| 2.ª línea terapéutica | 3 (40,0) |
| 3.ª línea terapéutica | 1 (20,0) |
| 4.ª línea terapéutica | 1 (20,0) |
| Tiempo desde diagnóstico hasta inicio de nivolumab (años), mediana (RIQ) | 2,4 (1,5-4,2) |
| Estadio clínico (Ann Arbor Stage), n (%) | |
| I | 1 (7,7) |
| III | 3 (23,1) |
| IV | 9 (69,2) |
aloTPH: trasplante alogénico de progenitores hematopoyéticos; RIQ: rango intercuartílico; TAPH: trasplante autógeno de progenitores hematopoyéticos; TPH: trasplante de progenitores hematopoyéticos.
Todos los pacientes recibieron inicialmente nivolumab 3 mg/kg cada 14 días, con una mediana de 11 ciclos (RIQ: 6,5-20,5) por paciente. La mediana de tiempo en tratamiento fue de 4,9 meses (RIQ: 3,0-9,6). El tiempo de seguimiento total del estudio fue de 93,9 meses, siendo la mediana de 9,2 meses (RIQ: 5,6-32,3).
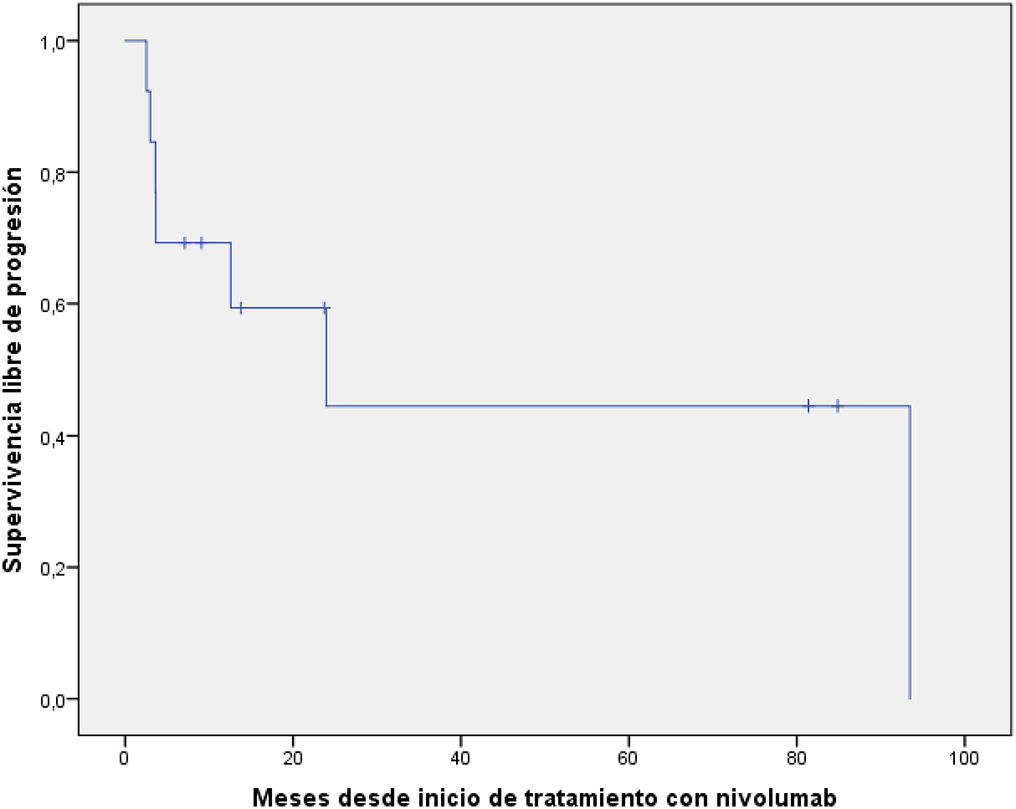
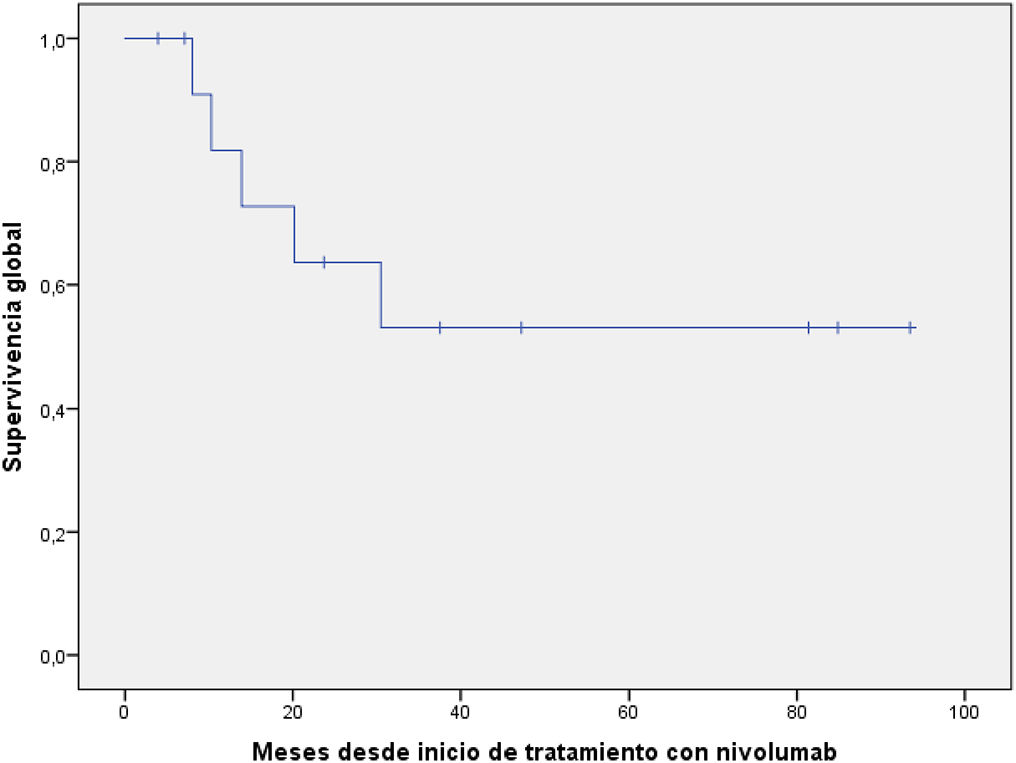
Los resultados de efectividad están resumidos en la tabla 2. Las curvas de supervivencia se muestran en las figuras 1 y 2.
Resultados de efectividad
| Mejor respuesta obtenida, n (%) | |
| RC | 3 (23,1) |
| RP | 3 (23,1) |
| EE | 3 (23,1) |
| TRO (RC + RP) | 6 (46,2) |
| Beneficio clínico (RC + RP + EE) | 9 (69,2) |
| Tiempo hasta respuesta (meses), mediana (RIQ) | |
| TRO (RC + RP) | 3,8 (2,6-5,5) |
| Beneficio clínico (RC + RP + EE) | 3,9 (3,1-6,7) |
| Duración de la respuesta (meses), mediana (RIQ) | |
| TRO (RC + RP) | 15,4 (3,1-79,4) |
| Beneficio clínico (RC + RP + EE) | 18,1 (6,2-75,9) |
| En pacientes RC | 79,1 (21,0-80,1) |
| SLP | |
| N.° de eventos (%) | 7 (53,8) |
| Mediana (IC del 95%), meses | 23,9 (0,0–49,1) |
| SG | |
| N° de muertes (%) | 5 (38,5) |
| Mediana (IC del 95%), meses | No alcanzada |
EE: enfermedad estable; IC: intervalo de confianza; RC: respuesta completa; RIQ: rango intercuartílico; RP: respuesta parcial; SG: supervivencia global; SLP: supervivencia libre de progresión; TRO: Tasa de Respuesta Objetiva.
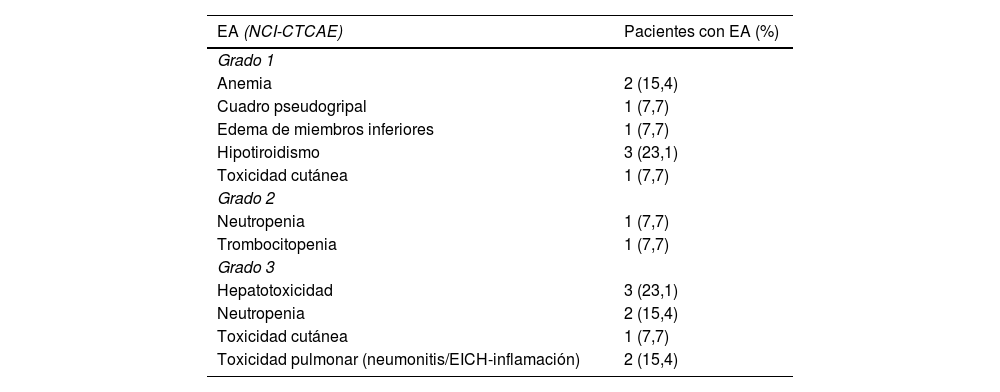
Respecto a la seguridad, el 76,9% de los pacientes (10) presentaron algún EA de cualquier grado. Se reportaron un total de 18 EA relacionados con el tratamiento. En la tabla 3 se describen los EA, así como su gravedad según los criterios NCI–CTCAE. El 55,6% (10) de los EA fueron grado 1 y 2, y el 44,4% (8) grado 3. Un paciente suspendió tratamiento por toxicidad (neumonitis), 2 pacientes tuvieron retrasos o suspensiones temporales de tratamiento (trombocitopenia e hipertransaminemia) y en un paciente se aumentó el intervalo interciclo, modificando la pauta de quincenal a mensual (toxicidad pulmonar). En cuanto al manejo de los EA, 2 pacientes recibieron filgrastim para la neutropenia, un paciente recibió epoetina para la anemia y 2 pacientes recibieron corticoides por toxicidad inmunomediada (cutánea y pulmonar).
Eventos adversos
| EA (NCI-CTCAE) | Pacientes con EA (%) |
|---|---|
| Grado 1 | |
| Anemia | 2 (15,4) |
| Cuadro pseudogripal | 1 (7,7) |
| Edema de miembros inferiores | 1 (7,7) |
| Hipotiroidismo | 3 (23,1) |
| Toxicidad cutánea | 1 (7,7) |
| Grado 2 | |
| Neutropenia | 1 (7,7) |
| Trombocitopenia | 1 (7,7) |
| Grado 3 | |
| Hepatotoxicidad | 3 (23,1) |
| Neutropenia | 2 (15,4) |
| Toxicidad cutánea | 1 (7,7) |
| Toxicidad pulmonar (neumonitis/EICH-inflamación) | 2 (15,4) |
EA: evento adverso; EICH: enfermedad injerto contra huésped; NCI-CTCAE: National Cancer Institute's Common Terminology Criteria for Adverse Events.
En relación a la aparición de complicaciones en los pacientes que recibieron un aloTPH posterior al tratamiento con nivolumab (n = 4), el 50% presentó EICH aguda, el 25% SOS y el 25% SFH. Los progenitores hematopoyéticos procedieron de sangre periférica de donante emparentado HLA idéntico (n = 2) o haploidéntico (n = 2). El régimen de acondicionamiento utilizado en todos los casos fue de intensidad reducida: tiotepa 10 mg/kg en 2 días, busulfan 6,4 mg/kg en 2 días y fludarabina 150 mg/m2 en 3 días. La profilaxis de EICH consistió en la administración de ciclofosfamida intravenosa post-TPH (días +3 y +4) junto con sirolimus y micofenolato de mofetilo a partir del día 5 pos-TPH. La mediana de tiempo transcurrido entre la última dosis de nivolumab y el aloTPH fue de 73,5 días (RIQ: 41,5-94,8).
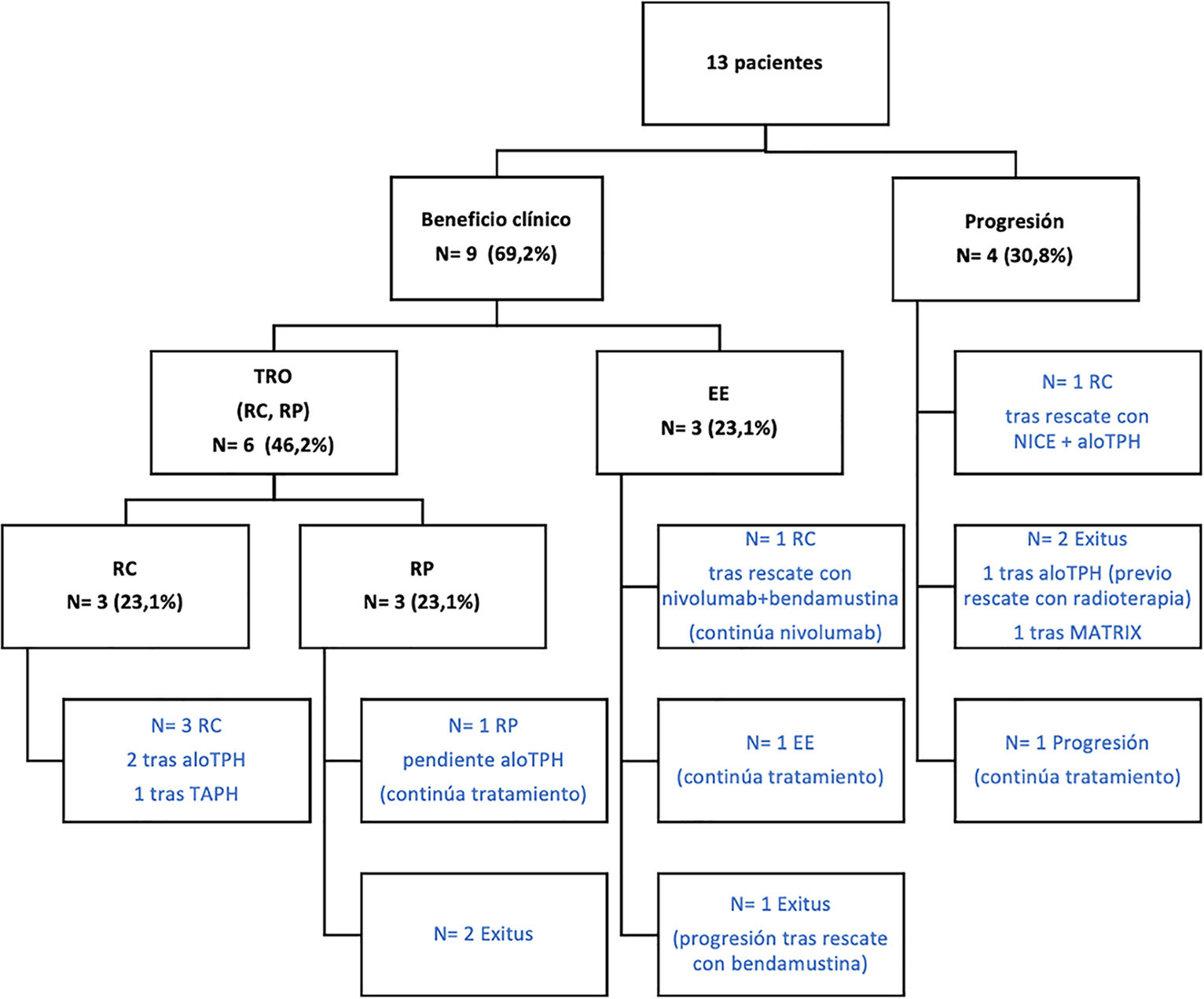
A la fecha de corte del estudio, tal y como se describe en la figura 3, 5 pacientes fallecieron (38,5%), 4 mantenían la RC sin tratamiento activo (30,8%) y 4 continuaban en tratamiento (30,8%). En la figura 3 se resumen los resultados de efectividad de la monoterapia con nivolumab, así como el manejo terapéutico posterior de los pacientes y su situación final.
Resultados de efectividad de la monoterapia con nivolumab y estrategia terapéutica posterior.
TRO: tasa respuesta objetiva; RC: respuesta completa; RP: respuesta parcial; TAPH: trasplante autógeno de progenitores hematopoyéticos; aloTPH: trasplante alogénico de progenitores hematopoyéticos; NICE: nivolumab-ifosfamida-carboplatino-etopósido; NICE: nivolumab + ifosfamida/carboplatino/etopósido; MATRIX: metotrexato/citarabina/rituximab/tiotepa.
Cinco pacientes recibieron un trasplante tras el tratamiento con nivolumab, 4 aloTPH y uno TAPH. Todos ellos presentaban RC previa al trasplante, siendo uno de ellos rescatado con 2 ciclos de un esquema de nivolumab en combinación con ifosfamida/carboplatino/etopósido (protocolo NICE). Tras el trasplante, y hasta la finalización del estudio, todos estaban en RC, salvo un paciente que falleció por complicación posterior al trasplante.
Dos pacientes (15,4%) fueron rescatados con un esquema de inmunoquimioterapia. Uno de ellos presentaba EE y fue tratado con un esquema de nivolumab 3 mg/kg cada 14 días asociado a bendamustina 90 mg/m2 días 1 y 2 cada 28 días durante 4 ciclos, y posteriormente continuó con nivolumab en monoterapia, presentando RC en el momento de finalizar el presente estudio. El otro paciente, ya descrito anteriormente, presentaba progresión y fue rescatado con 2 ciclos de NICE más aloTPH posterior.
DiscusiónEn el presente estudio se analizaron los datos en vida real del tratamiento con nivolumab en monoterapia en pacientes con diagnóstico de LHc R/R tras TAPH y tratamiento con BV, confirmando en nuestra población datos de efectividad y seguridad comparables con los reportados en los ensayos clínicos pivotales12,13.
La mediana de edad de nuestra población coincidió con la de las cohortes de los estudios pivotales que recibieron TAPH y BV (37 años), y su variabilidad se situó dentro del ámbito descrito. Respecto al sexo, nuestra muestra presentó menor porcentaje de mujeres respecto al de los estudios pivotales (30–40%), que puede deberse a la escasa muestra de pacientes incluidos en el presente estudio. Se trató de casos altamente pretratados (69% ≥ 3 líneas previas y 23% ≥ 5,52% ≥ 5 líneas en estudios pivotales), y en su mayoría con estadios avanzados de la enfermedad (92% estadio III y IV, 85% en estudios pivotales).
La TRO del 46,2% en nuestro estudio fue inferior a la del estudio pivotal CheckMate 205 (68%) en la cohorte B que recibió tratamiento de forma similar a los pacientes de nuestra serie (13). Además de los datos del análisis ampliado del ensayo fase II CheckMate 20514, 5 grandes estudios han publicado resultados en vida real del uso de nivolumab en pacientes con LHc R/R22–26. En estos estudios, laTRO y RC son del 60 al 69% y del 15 al 45%, respectivamente, superiores a las tasas de respuestas globales evidenciadas en el presente estudio (TRO: 46,2%; RC: 23,1%). En el estudio retrospectivo del grupo GELTAMO, realizado en nuestro medio en vida real por Martinez et al.26, con 74 pacientes tratados con nivolumab, la TRO es del 58%, con un porcentaje de RC del 30,6%, superior al presente estudio.
La mediana de tiempo hasta la mejor respuesta obtenida (RC + RP + EE) fue de 3,9 meses, superior a la de los estudios pivotales (2 meses), pero parecida a la descrita por el grupo GELTAMO (3 meses). La mediana de duración de la respuesta en los respondedores (RC + RP) fue de 15,4 meses (RIQ: 3,1-79,4), similar a la descrita en el estudio CheckMate 205 (cohorte B) de 16,6 meses (rango: 0–71). En los pacientes que alcanzaron RC la duración mediana de la respuesta fue de 79,1 meses, superior a la descrita en el estudio CheckMate 205 (cohorte B) de 30,3 meses.
En relación a la supervivencia, la mediana de SLP fue de 23,9 meses (IC95%: 0–49,1), superior a la del estudio CheckMate 205 (cohorte B) de 14,8 meses (IC95%: 11,0-19,8), con una SLP a los 12 meses del 57%. La mediana de la SG no se alcanzó en nuestro estudio, 61,5% de pacientes seguían vivos al finalizar este análisis.
Los motivos de suspensión de la monoterapia con nivolumab fueron la consolidación con trasplante en 3 pacientes (23,1%), la progresión de la enfermedad en 5 pacientes (38,5%) y la toxicidad en un paciente (7,7%). De los pacientes que suspendieron por progresión o toxicidad (n = 6), 5 fallecieron (38,5%). En el estudio del grupo GELTAMO26, los principales motivos de suspensión fueron la consolidación con trasplante (41,7%) y la progresión de la enfermedad (37,5%). En este estudio se sometió a aloTPH al 52,8% de los pacientes, frente al 38,5% de nuestra serie (uno de ellos con TAPH y 4 con aloTPH).
Dos de nuestros pacientes (15,4%) pudieron ser rescatados con un esquema de inmunoquimioterapia, presentando RC en el momento de finalizar el presente estudio. Romero et al.27 describen 3 casos de pacientes muy pretratados con LHc refractario a monoterapia con nivolumab, que fueron rescatados con éxito con la adición de quimioterapia a nivolumab, como puente hacia el aloTPH. Todos los pacientes presentaban características clínicas desfavorables, como 3 o 4 líneas previas, incluidas BV y TAPH, refractariedad a última línea de terapia previa a nivolumab y rápida progresión de la enfermedad. A pesar de estas características, lograron una RC después de la adición de quimioterapia, se consolidaron con aloTPH y aún permanecen en RC.
La quimioterapia combinada con los inhibidores de PD-1 ha mostrado resultados alentadores28,29, aunque todavía existen pocos estudios sobre dicha combinación en pacientes que fracasan a nivolumab. Hay varios ensayos en curso que investigan nuevas combinaciones de quimioterapia e inhibidores PD-1 en LHc R/R, así como en primera línea30. Todos estos datos sugieren que la terapia anti-PD-1 puede reprogramar el sistema inmunológico, activando e inhibiendo células efectoras e inmunosupresoras, respectivamente, lo que llevaría a superar la quimiorefractariedad.
Respecto a los EA, en nuestro estudio el 76,9% de los pacientes presentaron alguno, el 44% de gravedad ≥3. Los más frecuentes fueron hipotiroidismo, hepatotoxicidad, toxicidad pulmonar, anemia y neutropenia. Solamente fue necesaria la suspensión definitiva del tratamiento con nivolumab en un paciente que presentó neumonitis (≈8%). Estos datos son similares a los descritos en los ensayos clínicos pivotales donde se observaron EA en el 77,1% de los pacientes, aunque con un porcentaje de EA grado ≥3 menor (19,5%), y reflejan una mayor incidencia de EA que los publicados en vida real. Martínez et al.24 informaron EA relacionados con el tratamiento en el 56,8% de los pacientes (grado ≥3 en el 9,4%), Manson et al.22 informaron que el 37% de los pacientes tuvieron EA de grado 3 y el 20,5% tuvieron EA graves. La principal toxicidad hematológica grado ≥3 fue la neutropenia con un 15,4%, superior a la de los estudios pivotales (2,3%).
En cuanto a los EA inmunorelacionados, se observó hepatotoxicidad y toxicidad pulmonar grado 3 en el 23,1 y 15,4% de los pacientes, perfil superior al descrito en los estudios pivotales (0,8 y 3,4%, respectivamente)12,13. Aunque los resultados de los estudios retrospectivos deben interpretarse con cautela, los datos sugieren que en el mundo real el perfil de seguridad de nivolumab puede diferir del observado en los ensayos clínicos, que no incluyeron a pacientes con alto riesgo de padecer EA, como son los pacientes con antecedentes de trastornos autoinmunes o con aloTPH previo. En nuestra serie, 3 pacientes habían recibido un aloTPH de forma previa al tratamiento con nivolumab. Pese a todo ello, cabe destacar que en nuestra muestra ningún paciente falleció por toxicidad del tratamiento.
Tras el aloTPH se observó una tasa de EICH aguda del 50% que es superior a la de los estudios pivotales (27,4%), y también fue mayor la incidencia de SOS (25% frente a 2%) y de SFH (25% frente a 12%). Sin embargo, estos datos están sesgados por el limitado número de pacientes que ha recibido aloTPH. En el estudio en vida real del grupo GELTAMO26 la incidencia acumulada de EICH aguda grado II-IV fue del 33,3% (grado III-IV en 2 de 74 pacientes).
Nuestro estudio presenta varias limitaciones. La primera de ellas tiene que ver con el pequeño tamaño de la muestra. Por otro lado, la recogida de datos es retrospectiva, lo que puede suponer que la información recabada en la historia clínica no sea completa. Finalmente, hay que considerar la limitación de la TRO como variable principal y la ausencia de datos firmes en variables relevantes para el paciente.
En conclusión, en el limitado número de pacientes analizados en vida real se evidencia una TRO a nivolumab en monoterapia de aproximadamente el 46% y un beneficio clínico cercano al 70%. Aunque la incidencia de efectos adversos fue relevante, 44% de grado ≥3, solamente un paciente requirió suspender el tratamiento de forma definitiva. Nivolumab consiguió una respuesta muy duradera en los pacientes que alcanzaron RC (79 meses). La asociación de nivolumab con quimioterapia permitió rescatar a 2 pacientes con pronóstico muy desfavorable, consiguiendo una respuesta completa en ambos casos. Este estudio representa una oportunidad para analizar y aprender de la práctica clínica, puesto que los pacientes provienen de la vida real y difieren de las cohortes altamente seleccionadas de los ensayos clínicos.
Aportación a la literatura científicaLos pacientes con linfoma de Hodgkin clásico en recaída o refractario (LHc R/R) después de un trasplante autógeno de progenitores hematopoyéticos y de tratamiento con brentuximab vedotin presentan un mal pronóstico, con pocas alternativas terapéuticas disponibles.
Actualmente existe literatura que avala la eficacia y seguridad de nivolumab en el LHc R/R, sin embargo, gran parte de los trabajos publicados se realizan bajo condiciones óptimas, propias de los estudios experimentales. La observación en el contexto de uso habitual permite ampliar los resultados y generar evidencia poscomercialización, aunque en ningún caso debe sustituir a la evidencia generada con los ensayos clínicos.
El presente estudio se ha desarrollado con el fin de ofrecer una visión descriptiva de la efectividad y seguridad del tratamiento con nivolumab en el LHc R/R en la práctica clínica.
FinanciaciónLos autores declaran no haber recibido ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses.
Consideraciones éticasEl estudio fue presentado y aprobado por la Comisión de Investigación del hospital. Los autores declaran que, atendiendo a la Ley Orgánica de protección de datos 3/2018 y al Reglamento 2016/679 del Parlamento europeo y del Consejo de 27 de abril de 2016, se protegieron los datos de carácter confidencial de los pacientes.
Declaración de contribución de autoría CRediTLaura Lorente Fernández: Writing – review & editing, Writing – original draft, Visualization, Validation, Supervision, Software, Resources, Project administration, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Samuel Romero Domínguez: Validation, Supervision, Methodology, Investigation, Formal analysis, Data curation, Conceptualization. Asunción Albert Marí: Writing – review & editing, Writing – original draft, Validation, Supervision, Data curation. Esperanza Núñez Benito: Writing – original draft, Visualization, Validation, Data curation, Conceptualization. Eduardo López Briz: Writing – original draft, Validation, Methodology, Conceptualization. José Luis Poveda Andrés: Visualization, Validation, Conceptualization.