To assess the toxicity of a standardized triple intrathecal chemotherapy in onco- hematological adult patients and to establish risk factors of toxicity.
MethodObservational and prospective study of standardized triple intrathecal chemotherapy administrations in onco-hematologic adult patients for 18 months.
ResultsThere were some adverse events in 39.3% of the 56 administrations registered. 96.7% of the events were grade 1-2 and only 1 event was grade 3. The lower age of the patient and the greater difference between the administered drug volume and cerebrospinal fluid removed volume were shown as risk factors for toxicity.
ConclusionsThe administration of standardized triple intrathecal chemotherapy was related to a low frequency of toxicity and most of adverse events were mild-moderate. The detection of adverse effects was significantly greater in young adults and in those administrations where the difference between cerebrospinal fluid remove volume and the administered drug was greater.
Evaluar la toxicidad asociada a la administración de quimioterapia triple intratecal estandarizada en pacientes onco-hematológicos adultos e identificar los factores de riesgo asociados.
MétodoEstudio observacional y prospectivo de las administraciones de quimioterapia triple intratecal estandarizada administradas a pacientes onco-hematológicos adultos durante 18 meses.
ResultadosSe registró algún evento adverso en el 39,3% de las 56 administraciones registradas. El 96,7% de los eventos fueron grado 1-2 y solo 1 evento fue grado 3. La menor edad del paciente y la mayor diferencia entre el volumen administrado y el líquido cefalorraquídeo extraído se mostraron como factores de riesgo de toxicidad.
ConclusionesLa administración de quimioterapia triple intratecal estandarizada estuvo relacionada con una baja frecuencia de toxicidad y la mayoría de los eventos adversos fueron de gravedad leve-moderada. La detección de efectos adversos fue significativamente mayor en adultos jóvenes y en aquellas administraciones en las que la diferencia entre el volumen de líquido cefalorraquídeo extraído y de fármaco administrado fue mayor.
Infiltration of neoplastic cells into the central nervous system (CNS) is a rare complication in patients with acute leukaemias and non-Hodgkin's lymphoma (NHL), but when it does occur, it is associated with a high morbidity and mortality rate1.
The use of prophylaxis or neuromeningeal infiltration treatment is normally included in the treatment protocols and, in general, the administration of intrathecal chemotherapy is recommended. However, therapeutic suitability, the standard used and the drugs and doses to be administered in intrathecal therapy are not applied uniformly amongst countries and/or working groups, or even amongst different hospitals. In Spain, according to the QUIT survey, the combined administration of methotrexate, cytarabine and hydrocortisone, known as triple intrathecal (TIT) chemotherapy, is used in most cases2-3.
In addition to this non-uniform application, there are few studies that evaluate tolerance of intrathecal chemotherapy administration. Furthermore, other aspects that, according to several authors, may affect toxicity, such as the volume, pH and osmolarity of the solution, as well as aspects of the administration technique, are not normally indicated in the existing studies and could affect the results4,5.
Therefore, an internal hospital protocol was drafted to standardise preparation and provide recommendations for TIT administration.
The purpose of this study is to evaluate the toxicity associated with standardised administration of triple intrathecal chemotherapy and to identify associated risk factors.
MethodsA prospective observational study was conducted on all standardised TIT administrations given to adult haematology-oncology patients (age > 18 years) over an 18-month period (January 2013 - June 2014). Patient follow-up was conducted until 31 July 2014.
Triple Intrathecal ChemotherapyThe methotrexate, cytarabine and hydrocortisone doses were extracted from the PETHEMA (Programa para el Estudio y Tratamiento de las Hemopatias Malignas, Programme for the Study and Treatment of Malignant Blood Disorders) protocols, at 12 mg, 30 mg and 20 mg, respectively. The final volume of the solution was 8 mL. The preparations were adjusted to pH and osmolarity values similar to those of cerebrospinal fluid (CSF), using 0.9% sodium chloride as a solvent (osmolarity approximately 300 mOsm/L) and adjusting the pH to 7-7.5 with sodium bicarbonate6,7.
The preparations were sterile, non-pyrogenic and free of preservatives.
TIT AdministrationRecommendations were established in order to improve tolerance: (1) extract a volume of CSF similar to the volume of TIT to be administered; (2) perform lumbar puncture (LP) with the patient seated or in the lateral decubitus position during administration; (3) use local anaesthetics prior to administration; (4) have the patient rest 2 hours in the supine position following administration.
Variables studied and statistical analysisAdverse events (AE) occurring after administration of TIT chemotherapy were recorded, as well as several patient- and administration-related variables that could have influenced toxicity. Adverse effects were defined and evaluated based on the CTCAE v4.0 classification8, and causality was studied using the Naranjo Scale9.
The relationship between the variables and the presence or absence of toxicity was analysed using the Chi-Square test (qualitative or categorical variables) or the Student-t or Mann-Whitney U tests (quantitative variables). A logistic regression analysis was conducted with toxicity as a dependent variable and variables in which a relationship with toxicity had been observed as covariates. Variables with p-values <0.15 in univariate analysis were included in the multivariate regression model. A p-value of p< 0.05 was considered significant.
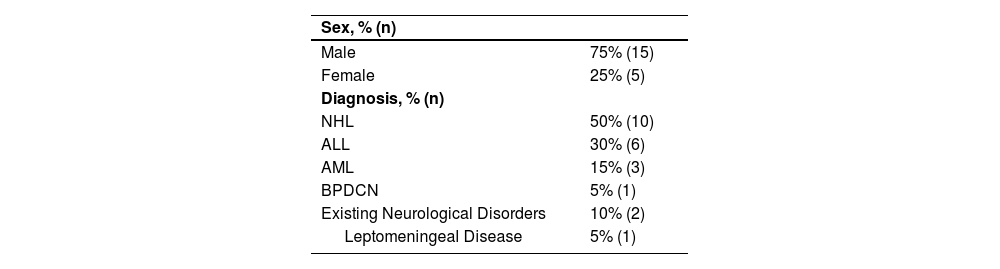
ResultsA total of 56 standardised TIT administrations were recorded in 20 patients, with a mean age of 47.7 ± 13.8 years (Table 1).
Clinical characteristics and demographics of the patients included
| Sex, % (n) | |
| Male | 75% (15) |
| Female | 25% (5) |
| Diagnosis, % (n) | |
| NHL | 50% (10) |
| ALL | 30% (6) |
| AML | 15% (3) |
| BPDCN | 5% (1) |
| Existing Neurological Disorders | 10% (2) |
| Leptomeningeal Disease | 5% (1) |
*Abbrevialions: ALL: Acute Lymphoblastic Leukaemia; AML: Acute Myeloid Leukaemia; NHL: Non-Hodgkin Lymphoma; BPDCN Blastic Plasmacytoid Dendritic Cell Neoplasm.
Amongst all administrations, 94.6% were given as prophylaxis for CNS infiltration and only 3 procedures were performed as treatment, all in the same patient. The median number of TITs administered prior to the recorded TIT was 2 (interquartile range (IQR) = 0.25-7). The median time interval between administrations was 28 days (IQR = 20.5-51 days).
Prior cranio-spinal radiotherapy had not been administered in any of the patients, although total body irradiation (TBI) had been administered in 2 procedures (1 patient) and concomitant TBI had been administered in 10 procedures (17.9%) (5 patients). In 76.8% of the administrations, the patient was receiving concomitant chemotherapy, and in 75% the patient received a potentially neurotoxic antineoplastic drug.
All procedures were conducted by means of lumbar puncture. In 62.5% of administrations, the patient remained in a lateral decubitus positionduring the procedure, and following the procedure, 94.6% remained in a supine position. Local anaesthetics were used prior to administration in 19.6% of administrations. The post-puncture resting time was recorded in 24 administrations (42.8%), with a median time of 1 hour (IQR = 1-2h) and a maximum resting time of 4 hours. Complications arose during the procedure in just 2 cases; both were minor and did not require treatment.
The volume of TIT administered was 8 mL in all procedures, and the mean difference between the volume of drug administered and CSF extracted was 2.7 ± 2.2 mL (Range = 1-6.75 mL).
In 87.5% of the procedures the patient was hospitalised; the rest of the administrations were performed on an outpatient basis. The in-hospital observation time was 13 ± 11 days for inpatient care and 2.8 ± 0.7 hours for outpatient care.
AEs were recorded in 39.3% of the administrations (22), affecting 70% of the patients included in the study. In 95.5% of the administrations in which AEs were detected, the patients were receiving inpatient care. In 22.7% of the administrations in which AEs were detected, the patient was receiving concomitant TBI; in 86.4%, chemotherapy; and in 68.2%, a potentially neurotoxic antineoplastic drug.
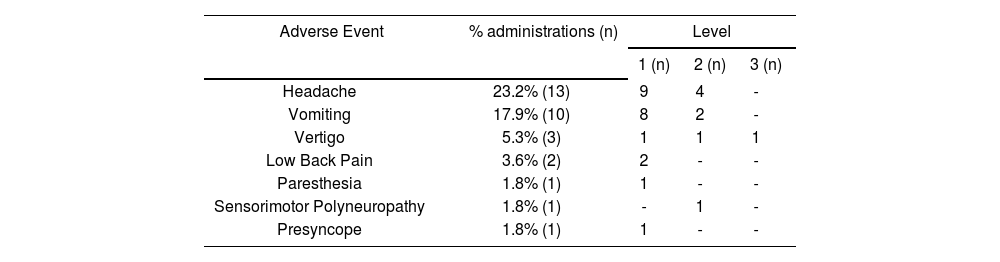
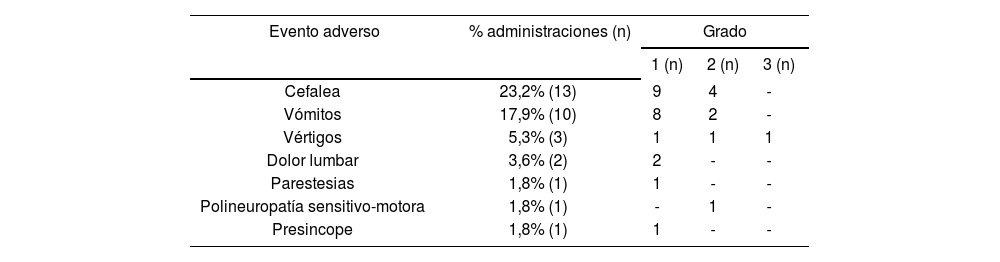
In 8 procedures, more than one AE was detected (2 AEs in 7 procedures and 3 AEs in 1), with a total number of 31 AEs recorded in 7 clinical events (Table 2). The severity in 96.7% of the cases was minor to moderate; only one adverse event was level 3. Symptomatic treatment was required in 77.4% of the cases.
Adverse events recorded and level of severity
| Adverse Event | % administrations (n) | Level | ||
|---|---|---|---|---|
| 1 (n) | 2 (n) | 3 (n) | ||
| Headache | 23.2% (13) | 9 | 4 | - |
| Vomiting | 17.9% (10) | 8 | 2 | - |
| Vertigo | 5.3% (3) | 1 | 1 | 1 |
| Low Back Pain | 3.6% (2) | 2 | - | - |
| Paresthesia | 1.8% (1) | 1 | - | - |
| Sensorimotor Polyneuropathy | 1.8% (1) | - | 1 | - |
| Presyncope | 1.8% (1) | 1 | - | - |
The median time to event onset following TIT administration was 20 hours (IQR = 4-48h). The median duration of the AEs was 48 hours (IQR=5-144h).
Applying the Naranjo Scale, a probable causal relationship was established between the TIT and the AE in 6.5% of the AEs, with a possible relationship in 77.4% and an uncertain relationship in 16.1% of AEs.
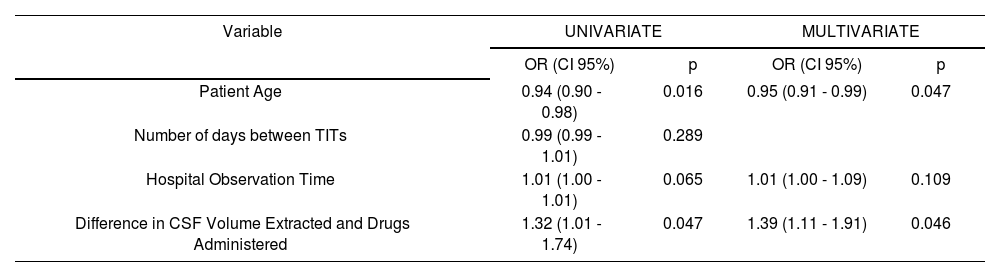
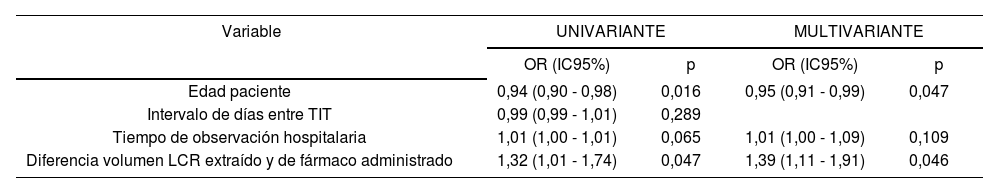
When comparing the variables collected during the study, between TIT administrations in which toxicity was and was not detected, statistically significant differences were observed in (median [interquartile range]): patient age (43 [31.5-53.7] vs. 52.5 [41.2-59.2] years, p = 0.019), days between administrations (20 [4-32] vs. 31 [22-74], p = 0.010), hospital observation time (360 [90-600] vs. 84 [3-462] hours, p = 0.042) and in the difference in volume of CSF extracted and drug administered (3.2 [2.7 -5] vs. 3 [0-3.6] ml, p = 0.036). No statistically significant differences were observed in: appearance of complications during the procedure, inpatient vs. outpatient care, purpose of the TIT (prophylaxis or treatment), prior or concomitant CNS irradiation, concomitant chemotherapy, concomitant neurotoxic drugs or number of prior TITs. The results of the logistic regression analysis for the variables associated with toxicity are shown in table 3.
Logistic regression model for the presence of toxicity in triple intrathecal therapy administrations
| Variable | UNIVARIATE | MULTIVARIATE | ||
|---|---|---|---|---|
| OR (CI 95%) | p | OR (CI 95%) | p | |
| Patient Age | 0.94 (0.90 - 0.98) | 0.016 | 0.95 (0.91 - 0.99) | 0.047 |
| Number of days between TITs | 0.99 (0.99 - 1.01) | 0.289 | ||
| Hospital Observation Time | 1.01 (1.00 - 1.01) | 0.065 | 1.01 (1.00 - 1.09) | 0.109 |
| Difference in CSF Volume Extracted and Drugs Administered | 1.32 (1.01 - 1.74) | 0.047 | 1.39 (1.11 - 1.91) | 0.046 |
Abbreviations: CI: Confidence Interval; CSF: Cerebrospinal Fluid, OR: Odds Ratio; CNS: Central Nervous System; TIT: Triple Intrathecal.
The administration of TIT chemotherapy, under the controlled conditions described, has proven to be a relatively safe procedure, with a single episode of level 3 toxicity; the rest of the adverse events recorded were of minor to moderate severity, and all cases were acute or subacute and self-limiting, requiring only symptomatic treatment. It is worth noting that in 86.4% of all administrations with an AE, the patient was receiving concomitant chemotherapy or radiotherapy, and in 68.2% the patient also received some type of neurotoxic drug, which makes it considerably complicated to determine whether these AEs were due to the TIT treatment or to the systemic treatment of haematological malignancies. Furthermore, most of the AEs recorded could be due to complications associated with the administration procedure itself, as they have been described as complications of the LP: post-puncture headache, low back pain, nerve root irritation, subdural haemorrhage, inter alia10. Due to this complexity in establishing a causal relationship between AEs and TIT, when using the Naranjo Scale, the relationship was considered possible in most cases and definite in none of them.
There are few published studies that describe toxicity due to TIT chemotherapy in adults11-16. Furthermore, these studies vary greatly in their methodologies, making it extremely difficult to compare the results of the present study directly with those reported by other authors. Hitchins et al.11, prospectively, and Kim et al.12, retrospectively, focus their studies on patients with meningeal carcinomatosis due to solid tumours; neither describes the appearance of severe neurotoxicity. The studies by Huguet et al.13, Thomas et al.14 and Storring et al.15 use TIT chemotherapy as part of the treatment protocol for ALL in adults; only the study by Storring et al. describes the appearance of level 1-2 headaches and nausea as a result of CNS prophylaxis, although no incidence data was provided15.
Pardo et al.16 retrospectively analysed toxicity associated with intrathecal administration of different drugs (TIT, methotrexate, cytarabine, trastuzumab and liposomal cytarabine) in a total of 627 procedures; an AE was recorded in 9.4% of cases. Excluding the administration of liposomal cytarabine, which is associated with greater toxicity, only 8% of the remaining 537 procedures (80% TIT) recorded an AE. However, unlike our study, 40.9% of them were considered severe. The adverse effect recorded most often by Pardo, as in our study, was headache, possibly attributed to the intrathecal chemotherapy, according to the Naranjo Scale. However, this author does not include emesis as an AE possibly related to IT administration, which may contribute to the difference in the results.
None of the studies cited describe the conditions for conducting the procedure, the volume of IT solution administered and whether a similar volume was extracted, or the method of preparation and final condition of the solution. Nor do they tend to indicate the use of premedication, position during the puncture or the amount of post-puncture rest, aspects that are indicated in this study asadditional information. Of those factors, the only one of note is that the amount of rest was less than the recommended time.
Good TIT chemotherapy tolerance by the patients in our study seems to suggest that the TIT solution preparation and administration conditions are suited to achieving a good safety profile.
In a paediatric population, with the same methodology, toxicity was observed less frequently (16.7% of the procedures), although with a similar profile; most of the AEs detected were level 1-2, with vomiting, headache and low back pain the most frequent17.
As regards the relationship between toxicity and the study variables, only in the multivariate analysis did we observe a relationship to the age of the patient and the difference in volume extracted and administered.
Age acted as a protective factor in the appearance of toxicity, with a 0.95 risk that a patient of a certain age of will suffer an AE compared to that of a patient one year younger. Although a greater risk of toxicity has been described in older patients due to systemic chemotherapy, especially neurotoxicity with high doses of cytarabine, there are no data in the literature associating age in adult patients with toxicity due to IT chemotherapy. The relationship observed between lower age and toxicity may not be due specifically or exclusively to age, but rather to the fact that a more aggressive chemotherapy regimen tends to be used in younger patients, and systemic chemotherapy could influence the appearance of the toxicity described. Furthermore, the risk of emesis is greater in younger patients, and this adverse effect was included in our study due to its possible association with the IT treatment.
A greater difference between the CSF extracted and the volume administered acted as a risk factor in the development of toxicity. The appearance of headache, nausea, vomiting and obtundation, due to increased intracranial pressure when administering a volume of drugs greater than the CSF extracted, is described in the literature4,16. However, despite the results obtained, it is not probable that an increase in intracranial pressure would occur due to a volume increase of 1 to 6.75 mL, taking into account that the volume of CSF in an adult is between 125 and 150 mL. Therefore, the underlying mechanism for this toxicity must be influenced by other factors, such as the rate at which the additional volume is administered15.
As regards limitations, note that the patient follow-up time may have been insufficient to detect the appearance of some adverse reactions related to IT chemotherapy in the long term. The 12.5% of outpatient administrations may have led to a loss of information, with a subsequent underestimated frequency of toxicity, especially in mild symptoms. Furthermore, the high level of complexity in the sample patients and the occasional difficulty in differentiating between toxicity due to the drug and to the procedure itself has made it difficult to establish a causal relationship between toxicity and IT chemotherapy.
Administration of triple intrathecal chemotherapy under controlled conditions has proven to have a good safety profile. The most frequent adverse events were minor-to-moderate intensity headache and vomiting. Risk factors for toxicity that were identified included lower patient age and greater difference between the volume of CSF extracted and that of the drugs administered.
To the best of our knowledge, this study is the first prospective study focusing on the evaluation of toxicity in the administration of intrathecal chemotherapy in a controlled setting in adult haematology-oncology patients. This study describes the use of standardised solutions of methotrexate, cytarabine and hydrocortisone in saline solution, with pH and osmolarity adjusted to the physiological range of cerebrospinal fluid. This description of the standardised solution, together with that of the controlled administration conditions, may be of great use to various professionals as, although the administration of intrathecal chemotherapy is widespread, there is very little pertinent information in the literature on these aspects.
It is important to highlight that this study evaluates real health results. It describes a protocol for using intrathecal chemotherapy that provides a good toxicity profile. It is also important to highlight the study of predictive toxicity factors that may help foresee the risk of toxicity in different populations.
La infiltración de células neoplásicas en el sistema nervioso central (SNC) es una complicación poco frecuente de los pacientes con leucemias agudas y linfomas no Hodgkin (LNH) pero que cuando aparece está asociada a una elevada morbimortalidad1.
El uso de profilaxis o tratamiento de la infiltración neuromeníngea suele incluirse en los protocolos de tratamiento y, en general, se recomienda la administración de quimioterapia intratecal. Sin embargo, la indicación terapéutica, la pauta utilizada y los fármacos y dosis a utilizar en la terapia intratecal no es una práctica homogénea entre países y/o grupos de trabajo o, incluso, entre distintos hospitales. En España, según el estudio QUIT, se utiliza mayoritariamente la administración conjunta de metotrexato, citarabi- na e hidrocortisona, conocido como quimioterapia triple intratecal (TIT)2-3.
A esta práctica heterogénea, hay que añadirle el hecho de que existen pocos estudios que evalúen la tolerancia de la administración de quimioterapia intratecal; además, otros aspectos que según diversos autores pueden afectar a la toxicidad, tales como el volumen, pH y osmolaridad de la mezcla, así como aspectos relacionados con la técnica de administración, no suelen indicarse en los estudios existentes y podrían afectar los resultados4,5.
Por todo ello, se elaboró un protocolo intrahospitalario donde se estandarizaba la forma de preparación y se indicaban recomendaciones para la administración de la TIT.
El objetivo del presente estudio es evaluar la toxicidad asociada a la administración de quimioterapia triple intratecal estandarizada e identificar factores de riesgo asociados a la misma.
MétodosSe realizó un estudio observacional y prospectivo de todas las administraciones de TIT estandarizada administradas a pacientes onco-hematológicos adultos (edad > 18 años) durante 18 meses (Enero 2013 - Junio 2014). Se realizó el seguimiento de los pacientes hasta el 31 de Julio de 2014.
Quimioterapia triple intratecalLas dosis de metotrexato, citarabina e hidrocortisona se extrajeron de los protocolos PETHEMA (Programa para el Estudio y Tratamiento de las Hemopatias Malignas) siendo éstas 12 mg, 30 mg y 20 mg, respectivamente. El volumen final de la mezcla fue de 8 mL. Las preparaciones se ajustaron a valores de pH y osmolaridad similares a los del líquido cefalorraquídeo (LCR), utilizando como disolvente cloruro sódico 0,9% (os- molaridad aproximada 300 mOsm/L) y ajustando el pH entre 7-7,5 con bicarbonato sódico6,7.
La preparaciones eran estériles, apirógenas y libres de conservantes.
Administración de la TITSe establecieron recomendaciones con el objetivo de mejorar la tolerancia: (1) extraer un volumen de LCR similar al volumen de TIT a administrar; (2) realizar la PL con el paciente en decúbito lateral o sedestación durante la administración; (3) usar anestésicos locales previos a la administración (4) mantener al paciente 2 horas en reposo en decúbito supino tras la administración.
Variables estudiadas y análisis estadísticoSe registraron los eventos adversos (EA) aparecidos tras la administración de la quimioterapia TIT, así como diferentes variables del paciente y de la administración que podían influir en la toxicidad. Los efectos adversos se definieron y evaluaron según la clasificación CTCAE v4.08 y se estudió su causalidad mediante el Algoritmo de Naranjo9.
Se analizó la relación de las variables con la presencia o ausencia de toxicidad mediante el test de Chi-cuadrado (variables cualitativas o categóricas) o t-Student o U-Mann-Whitney (variables cuantitativas). Se realizó un análisis de regresión logística con la aparición de toxicidad como variable dependiente, y las variables en las que se había observado relación con la aparición de toxicidad como covariables. Las variables con p < 0,15 en el análisis univariante se incluyeron en el modelo de regresión multivariante. Se consideró significativo un valor de p < 0,05.
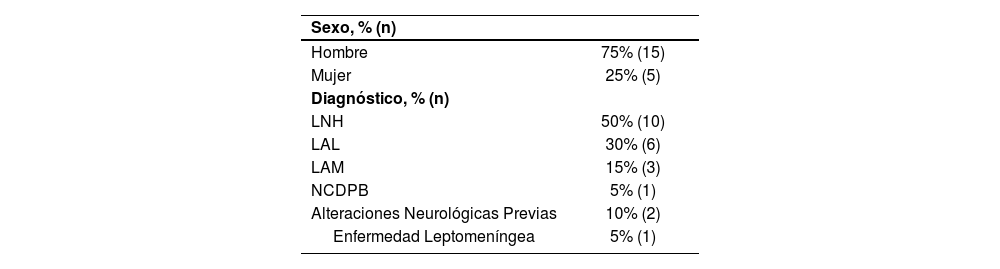
ResultadosSe registraron 56 administraciones de TIT estandarizada, en 20 pacientes, con una media de edad de 47,7 ± 13,8 años (Tabla 1).
Características clínicas y demográficas de los pacientes incluidos
| Sexo, % (n) | |
| Hombre | 75% (15) |
| Mujer | 25% (5) |
| Diagnóstico, % (n) | |
| LNH | 50% (10) |
| LAL | 30% (6) |
| LAM | 15% (3) |
| NCDPB | 5% (1) |
| Alteraciones Neurológicas Previas | 10% (2) |
| Enfermedad Leptomeníngea | 5% (1) |
*Abreviaturas: LAL: Leucemia Aguda Linfoblástica; LAM: Leucemia Aguda Mieloide; LNH: Linfoma no Hodking; NCDPB: Neoplasia Células Dendríticas Plasmocitoides Blásticas.
El 94,6% de las administraciones se realizaron como profilaxis de la infiltración del SNC y solo 3 procedimientos se realizaron como tratamiento, todos en el mismo paciente. La mediana de TIT administradas previamente a la TIT registrada fue de 2 (Rango intercuartílico (RIQ) = 0,25-7). La mediana del intervalo de tiempo entre administraciones fue de 28 días (RIQ = 20,5-51 días).
No se había administrado radioterapia craneoespinal previa en ninguno de los pacientes, pero sí se había administrado previamente irradiación corporal total (ICT) en 2 procedimientos (1 paciente) y se administró ICT concomitante en 10 administraciones (17,9%) (5 pacientes). En el 76,8% de las administraciones el paciente estaba recibiendo concomitantemente quimioterapia y en el 75% algún antineoplásico potencialmente neurotóxico.
Todos los procedimientos se realizaron mediante PL, durante el procedimiento el paciente permaneció en decúbito lateral en el 62,5% de las administraciones y tras el procedimiento en el 94,6% permaneció en decúbito supino. Se utilizaron anestésicos locales previos a la administración en el 19,6% de las administraciones. El tiempo de reposo post-punción se registró en 24 administraciones (42,8%) siendo la mediana de 1 hora (RIQ = 1-2h) y el tiempo máximo de reposo de 4 horas. Aparecieron complicaciones durante el procedimiento en sólo 2 casos, ambas fueron leves y no necesitaron tratamiento.
El volumen de TIT administrado fue de 8 mL en todos los procedimientos y la diferencia media entre el volumen de fármaco administrado y de LCR extraído fue de 2,7 ± 2,2 mL (Rango = 1-6,75 mL).
En el 87,5% de los procedimientos el paciente estaba ingresado y el resto de administraciones se realizaron en régimen ambulatorio. El tiempo de observación hospitalaria fue de 13 ± 11 días en los pacientes ingresados y 2,8 ± 0,7 horas en los pacientes ambulatorios.
En el 39,3% de las administraciones (22) se registró algún EA, afectando al 70% de los pacientes incluidos en el estudio. El 95,5% de las administraciones donde se detectó algún EA tuvo lugar en pacientes ingresados. En el 22,7% de las administraciones donde apareció algún EA el paciente estaba recibiendo concomitantemente ICT, en el 86,4% quimioterapia y en el 68,2% algún fármaco potencialmente neurotóxico.
En 8 procedimientos apareció más de un EA (2 EA en 7 procedimientos y 3 EA en 1), siendo el número total de EA registrados de 31 divididos en 7 eventos clínicos (Tabla 2). El 96,7% tuvieron una gravedad leve-moderada, sólo un evento adverso fue de grado 3. Se precisó tratamiento sintomático en el 77,4% de los casos.
Eventos adversos registrados y grado de gravedad
| Evento adverso | % administraciones (n) | Grado | ||
|---|---|---|---|---|
| 1 (n) | 2 (n) | 3 (n) | ||
| Cefalea | 23,2% (13) | 9 | 4 | - |
| Vómitos | 17,9% (10) | 8 | 2 | - |
| Vértigos | 5,3% (3) | 1 | 1 | 1 |
| Dolor lumbar | 3,6% (2) | 2 | - | - |
| Parestesias | 1,8% (1) | 1 | - | - |
| Polineuropatía sensitivo-motora | 1,8% (1) | - | 1 | - |
| Presincope | 1,8% (1) | 1 | - | - |
La mediana de tiempo de inicio de los eventos desde la administración de la terapia TIT fue de 20 horas (RIQ = 4-48h). La mediana de duración de los EA fue de 48 horas (RIQ = 5-144h).
Aplicando el Algoritmo de Naranjo se obtuvo una relación de causalidad entre la TIT y el EA probable en el 6,5% de los EA, posible en el 77,4% y dudosa en el 16,1%.
Al comparar las variables recogidas durante el estudio entre las administraciones de TIT donde se detectó o no toxicidad, se observaron diferencias estadísticamente significativas en (mediana [Rango Intercuartílico]): edad del paciente (43[31,5-53,7] vs. 52,5[41,2-59,2] años, p = 0,019), intervalo de días entre administraciones (20[4-32] vs. 31 [22-74], p = 0,010), tiempo de observación hospitalaria (360[90-600] vs. 84[3-462] horas, p = 0,042) y en la diferencia entre volumen de LCR extraído y de fármaco administrado (3,2[2,7 -5] vs. 3[0-3,6] ml, p = 0,036). No se observaron diferencias estadísticamente significativas en: aparición de complicaciones durante el procedimiento, régimen de ingreso hospitalario, indicación de la TIT (profilaxis o tratamiento), irradiación SNC previa o concomitante, quimioterapia concomitante, fármacos neurotóxicos concomitantes o número de TIT previas. Los resultados del análisis de regresión logística para las variables que se asociaron con toxicidad se muestran en la tabla 3.
Modelo de regresión logística para la presencia de toxicidad en las administraciones de terapia triple intratecal
| Variable | UNIVARIANTE | MULTIVARIANTE | ||
|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | |
| Edad paciente | 0,94 (0,90 - 0,98) | 0,016 | 0,95 (0,91 - 0,99) | 0,047 |
| Intervalo de días entre TIT | 0,99 (0,99 - 1,01) | 0,289 | ||
| Tiempo de observación hospitalaria | 1,01 (1,00 - 1,01) | 0,065 | 1,01 (1,00 - 1,09) | 0,109 |
| Diferencia volumen LCR extraído y de fármaco administrado | 1,32 (1,01 - 1,74) | 0,047 | 1,39 (1,11 - 1,91) | 0,046 |
Abreviaturas: IC: Intervalo de Confianza; LCR: Líquido cefalorraquídeo, OR: Odds Ratio; SNC: Sistema Nervioso Central; TIT: Triple Intratecal.
La administración de quimioterapia TIT, en las condiciones protocolizadas descritas, se ha mostrado como un procedimiento relativamente seguro, con un único episodio de toxicidad grado 3; el resto de los eventos adversos registrados fueron de gravedad leve-moderada, siendo todos de aparición aguda o sub-aguda y autolimitados, requiriendo sólo tratamiento sintomático. Cabe destacar que en el 86,4% de las administraciones donde apareció algún EA el paciente estaba recibiendo concomitantemente quimioterapia o radioterapia y en el 68,2% algún fármaco neurotóxico, lo que complica considerablemente diferenciar si estos EA eran debidos al tratamiento TIT o al tratamiento sistémico de la neoplasia maligna hematológica. Además, la mayoría de los EA registrados podrían ser debidos a las complicaciones asociadas al propio procedimiento de administración, ya que se han descrito como complicaciones de la PL: cefalea post-punción, lumbalgia, irritación de raíces nerviosas, hemorragia subdural, entre otras10. Debido a esta complejidad para el establecimiento de la relación de causalidad entre los EA y la TIT, al utilizar el Algoritmo de Naranjo, se consideró la relación posible en la mayoría de los casos y en ninguno definida.
Existen pocos estudios publicados que describan la toxicidad debida a la quimioterapia TIT en adultos11-16; además, estos estudios presentan una gran variabilidad metodológica, lo que dificulta extremadamente la comparación directa de los resultados del presente estudio con los comunicados por otros autores. Hitchins y col.11 de forma prospectiva y Kim y col.12 retrospectivamente, centran sus estudios en pacientes con carcinomatosis meníngea por tumores sólidos; ninguno de los dos describe la aparición de neurotoxicidad grave. En los estudios de Huguet y col.13, Thomas y col.14 y Storring y col.15 se utiliza quimioterapia TIT como parte del protocolo de tratamiento de LAL en adultos; sólo el estudio de Storring y col. describe la aparición de cefalea y náuseas grado 1-2 como consecuencia de la profilaxis del SNC, aunque sin dar datos de incidencia15.
Pardo y col.16 analizaron retrospectivamente la toxicidad asociada a la administración intratecal de diversos fármacos (TIT, metotrexato, ci- tarabina, trastuzumab y citarabina liposomal) en un total de 627 procedimientos; se registró algún EA en el 9,4% de los mismos. Excluyendo la administración de citarabina liposomal, asociada a mayor toxicidad, solo en el 8% de los 537 procedimientos restantes (80% TIT) se registró algún EA, pero, a diferencia de nuestro estudio, el 40,9% de estos fueron considerados graves. El efecto adverso mayoritario registrado por Pardo, al igual que en nuestro estudio, fue la cefalea, atribuida posiblemente, según el Algoritmo de Naranjo, a la quimioterapia intratecal. Sin embargo, este autor no recoge la emesis como EA con posible relación con la administración IT, lo que puede contribuir a la diferencia en los resultados.
Ninguno de los estudios citados describe las condiciones de realización del procedimiento, el volumen de mezcla IT administrado y si se extrajo un volumen similar, la forma de preparación de la mezcla y las condiciones finales de la misma. Tampoco suelen indicarse el uso de premedicación, la posición durante la punción o el tiempo de reposo post-punción, aspectos que sí se han recogido en este estudio, como información adicional. De ellos solo destacar que el tiempo de reposo fue inferior al recomendado.
La buena tolerancia de los pacientes a la quimioterapia TIT en nuestro estudio parece sugerir que las condiciones de preparación y administración de la mezcla TIT son adecuadas para conseguir un buen perfil de seguridad.
En población pediátrica, con igual metodología, se ha observado una menor frecuencia de aparición de toxicidad (16,7% de los procedimientos), aunque con un perfil similar, siendo la mayoría de los EA detectados grado 1-2 y destacando como más frecuentes la aparición de vómitos, cefalea y dolor lumbar17.
En cuanto a la relación de la toxicidad con las variables a estudio, sólo se observó en el análisis multivariante una relación con la edad del paciente y la diferencia de volumen extraído y administrado.
La edad se comportó como un factor protector de la aparición de toxicidad, siendo 0,95 el riesgo de un paciente de una determinada edad de sufrir un EA comparado con el de un paciente que tiene un año menos. Aunque está descrito el mayor riesgo de toxicidad por quimioterapia sistémica en pacientes de mayor edad, especialmente de neurotoxicidad con dosis altas de citarabina, no existen datos en la literatura que asocien la edad en los pacientes adultos con la aparición o no de toxicidad por quimioterapia IT. La relación observada entre la menor edad y la toxicidad podría no ser debida propiamente o exclusivamente a la edad, sino a que en los pacientes más jóvenes se suelen utilizar regímenes de quimioterapia más intensivos, pudiendo influir la quimioterapia sistémica en la aparición de la toxicidad descrita. Además, el riesgo de emesis es mayor en pacientes jóvenes y este efecto adverso se incluyó en nuestro estudio por su posible asociación al tratamiento IT.
La mayor diferencia de LCR extraído y volumen administrado se comportó como un factor de riesgo de desarrollo de toxicidad. La aparición de cefalea, náuseas, vómitos y obnubilación, por aumento de la presión intracraneal al administrar un volumen de fármaco mayor del LCR que se extrae, está descrito en la literatura4,16. Sin embargo, a pesar de los resultados obtenidos, no es probable que se produjese un aumento de la presión intracraneal por aumento del volumen en un rango de 1 a 6,75 mL, teniendo en cuenta que el volumen de LCR en una persona adulta es de 125 a 150 mL. Luego el mecanismo subyacente para esta toxicidad debe estar influido por otros factores, como la velocidad de administración de ese volumen adicional15.
En cuanto a las limitaciones, destacar que el tiempo de seguimiento de los pacientes, puede haber sido insuficiente para detectar la aparición de algunas reacciones adversas a largo plazo relacionadas con la quimioterapia IT. El 12,5% de administraciones en régimen ambulatorio puede haber ocasionado una pérdida de información, con la consiguiente in- fraestimación de la frecuencia de aparición de toxicidad, especialmente en síntomas leves. Además, la elevada complejidad de los pacientes de la muestra y la dificultad de diferenciación, en ocasiones, entre la toxicidad debida al fármaco o al propio procedimiento ha complicado el establecimiento de la relación causal de la toxicidad con la quimioterapia IT.
La administración de la quimioterapia triple intratecal en las condiciones protocolizadas ha mostrado un buen perfil de seguridad. Los eventos adversos más frecuentes fueron la aparición de cefalea y vómitos de intensidad leve-moderada. Se identificaron como factores de riesgo para la aparición de toxicidad la menor edad del paciente y la mayor diferencia entre el volumen de LCR extraído y de fármaco administrado.
Según nuestro conocimiento, este estudio es el primer estudio prospectivo focalizado en evaluar la toxicidad de la administración de quimioterapia intratecal en condiciones protocolizadas de uso en pacientes onco-hematológicos adultos. En este estudio se describe la utilización de mezclas estandarizadas de metotrexato, citarabina e hi- drocortisona en suero fisiológico, con ajuste de pH y osmolaridad al rango fisiológico del líquido cefalorraquídeo. Esta descripción de la mezcla estandarizada junto con la de las condiciones protocolizadas de administración puede ser de gran utilidad para los diferentes profesionales, ya que aunque la administración de quimioterapia intratecal está ampliamente extendida, existe muy poca información al respecto en la literatura sobre estos aspectos.
Es importante destacar que este estudio evalúa resultados reales en salud, describe el protocolo de uso de quimioterapia intratecal con el que se obtiene un buen perfil de toxicidad. También es importante destacar, el estudio de factores predictores de toxicidad que puede ayudar en la predicción del riesgo de toxicidad según los diferentes grupos de población.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas