la COVID-19 supuso una amenaza para la capacidad hospitalaria por el elevado número de ingresos, lo que llevó al desarrollo de diversas estrategias para liberar y crear nuevas camas hospitalarias. Dada la importancia de los corticoides sistémicos en esta enfermedad, se evaluó la eficacia de estos en la reducción de la duración de la estancia hospitalaria (EH) y se comparó el efecto de 3 corticosteroides diferentes sobre este resultado.
Métodose realizó un estudio de vida real de diseño tipo cohorte retrospectiva y controlado. Se analizó una base de datos hospitalaria de 3.934 pacientes hospitalizados con diagnóstico de COVID-19 en un hospital terciario entre abril y mayo de 2020. Se comparó un grupo de enfermos que recibieron corticosteroides sistémicos (grupo con corticoides [GC]) frente a un grupo control que no recibió corticosteroides sistémicos (grupo sin corticoides [GSC]) emparejado por edad, sexo y gravedad de la enfermedad mediante una puntuación de propensión. La decisión de prescribir glucocorticoides dependía principalmente del criterio del médico responsable.
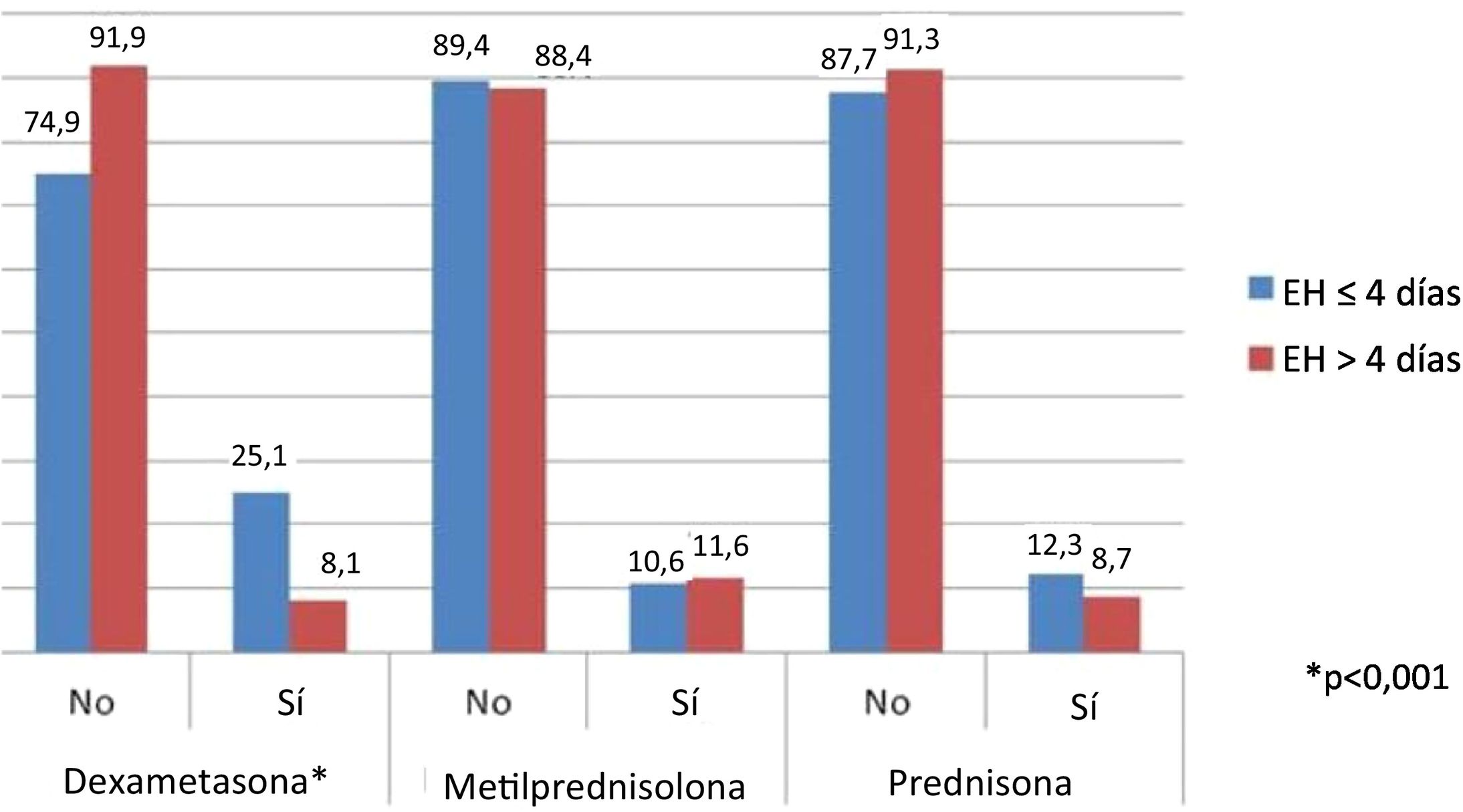
Resultadosse compararon un total de 199 pacientes hospitalizados en el GC con 199 en el GSC. La EH fue más corta para el GC que para el GSC (mediana=3 [rango intercuartílico=0-10] vs. 5 [2-8,5]; p=0,005, respectivamente), mostrando un 43% más de probabilidad de ser hospitalizado ≤4 días que >4 días cuando se usaron corticosteroides. Además, esta diferencia solo la mostraron aquellos tratados con dexametasona (76,3% hospitalizados ≤4 días vs. 23,7% hospitalizados >4 días [p<0,001]). Los niveles de ferritina sérica, glóbulos blancos y plaquetas fueron más elevados en el GC. No se observaron diferencias en la mortalidad ni en el ingreso a la unidad de cuidados intensivos.
Conclusionesel tratamiento con corticosteroides sistémicos se asocia con una disminución de la estancia hospitalaria en pacientes hospitalizados con diagnóstico de COVID-19. Esta asociación es significativa en aquellos tratados con dexametasona, no así en metilprednisolona o prednisona.
The COVID-19 pandemic has posed a threat to hospital capacity due to the high number of admissions, which has led to the development of various strategies to release and create new hospital beds. Due to the importance of systemic corticosteroids in this disease, we assessed their efficacy in reducing the length of stay (LOS) in hospitals and compared the effect of 3 different corticosteroids on this outcome.
MéthodWe conducted a real-world, controlled, retrospective cohort study that analysed data from a hospital database that included 3934 hospitalised patients diagnosed with COVID-19 in a tertiary hospital from April to May 2020. Hospitalised patients who received systemic corticosteroids (CG) were compared with a propensity score control group matched by age, sex and severity of disease who did not receive systemic corticosteroids (NCG). The decision to prescribe CG was at the discretion of the primary medical team.
ResultsA total of 199 hospitalized patients in the CG were compared with 199 in the NCG. The LOS was shorter for the CG than for the NCG (median=3 [interquartile range=0–10] vs. 5 [2–8.5]; p=0.005, respectively), showing a 43% greater probability of being hospitalised ≤4 days than >4 days when corticosteroids were used. Moreover, this difference was only noticed in those treated with dexamethasone (76.3% hospitalised ≤4 days vs. 23.7% hospitalised >4 days [p<0.001]). Serum ferritin levels, white blood cells and platelet counts were higher in the CG. No differences in mortality or intensive care unit admission were observed.
ConclusionsTreatment with systemic corticosteroids is associated with reduced LOS in hospitalised patients diagnosed with COVID-19. This association is significant in those treated with dexamethasone, but no for methylprednisolone and prednisone.
La enfermedad por coronavirus 2019 (COVID-19) sigue siendo responsable de un gran número de hospitalizaciones. Entre el 12 y el 20% de pacientes con COVID-19 necesitan ser hospitalizados debido a una enfermedad severa que provoca un fallo respiratorio agudo apenas unas horas después del inicio de la disnea1,2. La mortalidad en este subgrupo de pacientes es extremadamente elevada, alcanzando tasas de entre el 20 y el 52%3,4.
Estas estadísticas tan alarmantes han supuesto un enorme desafío para el sistema sanitario, que se vio obligado a reducir el número de camas hospitalarias disponibles para pacientes sin COVID-19, ampliar la disponibilidad de camas en las unidades de cuidados intensivos (UCI) y recurrir a recursos y dispositivos adicionales. De hecho, la demanda de camas hospitalarias fue tan grande en Madrid durante la primera ola de la pandemia que fue necesario convertir hoteles en hoteles hospital5 y adaptar una sala de exposiciones para transformarla en un hospital provisional. En concreto, para hacer frente a esta difícil situación, se construyó un hospital de pandemias en Madrid, así como numerosos hospitales de campaña por toda la geografía española.
Para mejorar los datos disponibles sobre tratamientos y resultados, se han evaluado distintos tratamientos para pacientes hospitalizados. Hasta el momento, los corticoides3, junto con los anticoagulantes, el antivírico remdesivir, los inmunomoduladores como el tocilizumab o el inhibidor de la Janus cinasa baricitinib, han demostrado un cierto grado de eficacia en ensayos clínicos aleatorizados, mientras que muchos otros agentes se encuentran actualmente bajo estudio6.
En relación con los corticoides sistémicos, la experiencia cosechada con otros síndromes de dificultad respiratoria aguda (SDRA) de origen vírico, como el síndrome respiratorio de Oriente Medio, el síndrome respiratorio agudo severo y la influenza, ha demostrado un aclaramiento vírico más lento, una ausencia de beneficio e incluso un cierto riesgo de lesión7–9. Sin embargo, aunque en las primeras fases de la pandemia el tratamiento con corticoides no estaba recomendado en pacientes con COVID-1910, actualmente se sabe que, en la fase inflamatoria de la COVID-19 severa, éstos pueden reducir la producción de citoquinas proinflamatorias y aumentar la de citoquinas antiinflamatorias, así como mejorar la integridad de la barrera pulmonar y la microcirculación11–13. Afortunadamente la evidencia es cada vez mayor, demostrándose en el estudio aleatorizado RECOVERY que la dexametasona es capaz de reducir la mortalidad en pacientes con fallo respiratorio3. Además, múltiples estudios observacionales han demostrado que la administración de corticoides es beneficiosa en cuanto a retrasar el ingreso en la UCI, reducir la necesidad de ventilación mecánica14 e incluso disminuir la mortalidad14,15.
La dexametasona es un fármaco bien conocido con más de 60 años de uso en la clínica. Su potencial terapéutico se fundamenta en una serie de efectos. En primer lugar, se une a los receptores de glucocorticoides presentes en el citoplasma celular, responsables de activar ciertas células inmunitarias y dar lugar a la supresión proinflamatoria de ciertas citoquinas, algunas de las cuales están relacionadas con la progresión de la COVID-19. También es responsable de aumentar la expresión génica de la interleucina (IL)-10, un mediador clave en la respuesta antiinflamatoria. En segundo lugar, inhibe la adhesión de los neutrófilos a las células endoteliales, impidiendo la liberación de enzimas lisosomales y la quimiotaxis de leucocitos en el foco de la inflamación. Asimismo, inhibe la activación de los macrófagos, que están entre los principales responsables de las tormentas de citoquinas propias de la COVID-19 y que, a su vez, son una de las principales señas de identidad de la COVID-19 severa. Además, la dexametasona posee otros importantes beneficios, como su bajo coste, su disponibilidad generalizada y su efecto duradero, que permite pautas de administración de una vez al día11,16.
Dados los alentadores resultados de los estudios sobre corticoides ya mencionados, es de esperar que el tratamiento con estos fármacos sea también capaz de acortar la estancia hospitalaria (EH) de los pacientes, reduciendo por lo tanto el consumo de recursos sanitarios e incrementando la disponibilidad de camas hospitalarias para otros pacientes que pudieran necesitarlas. No obstante, no existen estudios que se hayan centrado en esta cuestión. Más aún, aunque ya existe abundante evidencia sobre la dexametasona, aún falta por evaluar el efecto de otros grupos de corticoides.
En este estudio, nos hemos centrado en la primera ola de la pandemia, en la que se empezó a recurrir al uso de los corticoides, comparando a los pacientes que recibieron corticoides con los que no lo hicieron. Se trata de un estudio con datos de la vida real, cuyo objetivo fue determinar la eficacia de los corticoides a la hora de acortar la EH en pacientes con COVID-19, en comparación con pacientes que no recibieron corticoides. El estudio también se centró en investigar qué grupo de corticoides es más efectivo a la hora de acortar la EH de los pacientes.
MétodosDiseño y objetivos del estudioSe trata de un estudio de cohortes, controlado y retrospectivo, con datos de la vida real. El objetivo principal fue determinar el impacto de los corticoides sistémicos en la EH de pacientes hospitalizados por la COVID-19. También se investigó si el uso de corticoides podía estar relacionado con la aparición de complicaciones severas de la COVID-19, tales como la muerte o el ingreso en UCI. Por último, intentamos identificar qué subgrupo específico de corticoides es el más eficaz.
Pacientes y base de datos de COVID-19En el estudio se incluyeron pacientes de 18 años o más ingresados en un hospital de 1.286 camas de Madrid (Hospital Universitario La Paz) de abril a mayo de 2020, con diagnóstico de COVID-19. Todos ellos recibieron corticoides sistémicos (grupo con tratamiento basado en corticoides [GC]). Debido a la escasa evidencia sobre el uso de corticoides sistémicos en esta enfermedad de que se disponía en ese momento, la prescripción de estos agentes dependía principalmente de la experiencia previa del facultativo. No se incluyó a pacientes no hospitalizados o dados de alta del servicio de urgencias tras una estancia de menos de 24 horas en el hospital.
Se incluyó un grupo control de pacientes, extraídos de una base de datos hospitalaria, que habían sido hospitalizados por COVID-19 durante el mismo período, pero que no habían recibido tratamiento con corticoides sistémicos (grupo sin corticoides [GSC]). Las características de los pacientes incluidos en esta base de datos fueron objeto de publicación anteriormente17. Se trataba de 3.934 pacientes tratados de forma consecutiva en el servicio de urgencias de un hospital universitario desde el 25 de febrero de 2021 hasta el 16 de junio de 2021 y que, posteriormente, fueron hospitalizados. La base de datos (llamada COVID@HULP) incluía 372 variables, agrupadas en variables demográficas, antecedentes clínicos, antecedentes infecciosos, síntomas, complicaciones, tratamientos (fuera de ensayos clínicos) y progresión de la enfermedad durante la EH. Para este estudio, se extrajo de la mencionada base de datos la información sobre edad, sexo, hábito tabáquico, trasmisión, comorbilidades, síntomas en el momento del ingreso, gravedad de la enfermedad, complicaciones, ingreso en UCI y fallecimiento durante la EH. La gravedad de la enfermedad se evaluó según lo previsto en el Documento Oficial Español sobre el Manejo Clínico de la COVID-19, que considera que una neumonía por COVID-19 es leve cuando la saturación de oxígeno es superior al 90%, no existen signos de gravedad y el paciente presenta una puntuación inferior a 2 en la escala CURB-65 y grave cuando existe fallo orgánico, una saturación de oxígeno por debajo del 90% o una frecuencia respiratoria superior a 30 respiraciones por minuto18.
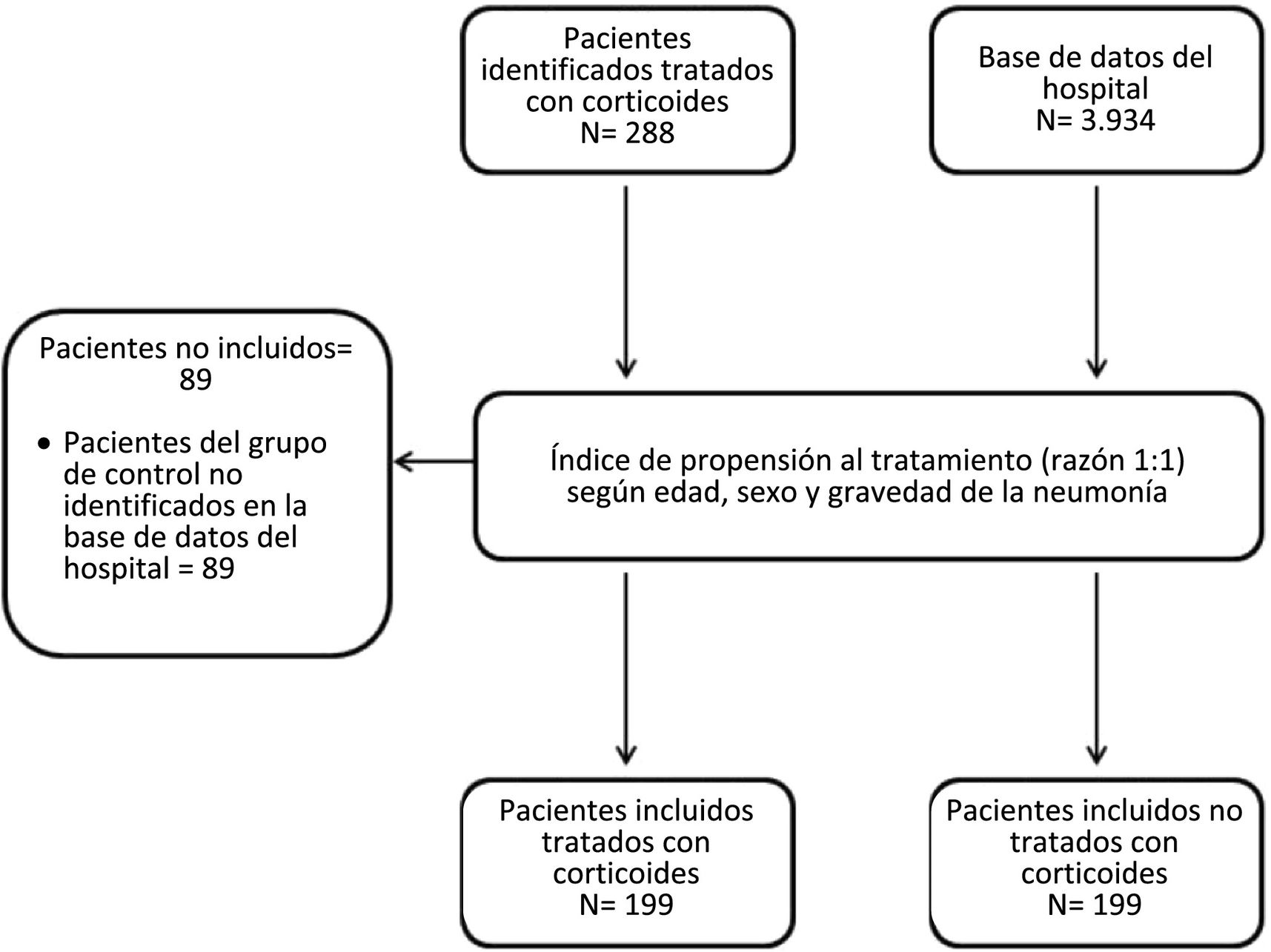
Los pacientes (tratados o no con corticoides sistémicos) fueron pareados a razón de 1:1 por edad, sexo y gravedad de la enfermedad. El pareado estuvo a cargo del equipo de estadística de la Unidad Central de Investigación, que trabajó bajo estricto enmascaramiento hasta finalizar el análisis de los datos.
Los resultados de los análisis de laboratorio (hematología, bioquímica, microbiología) se extrajeron de distintos sistemas de gestión de datos hospitalarios y la información relativa a los fármacos utilizados durante la EH se extrajo del sistema de prescripción electrónica.
Los pacientes tratados con corticoides se identificaron por medio de un sistema de prescripción electrónica asistida (PEA). La tarea de identificar pacientes tratados con corticoides estuvo a cargo de un farmacéutico con dilatada experiencia en el uso de sistemas PEA.
El estudio fue aprobado por el Comité de Ética de la Investigación del Hospital Universitario La Paz (PI-4455).
Criterios de evaluaciónLos principales criterios de evaluación fueron la EH, la muerte y el ingreso en UCI. También se evaluaron las diferencias entre el GC y el GSC así como la aparición de complicaciones durante el período de hospitalización.
Análisis estadísticoLa primera parte del análisis consistió en una evaluación de las características basales de ambos grupos de pacientes (GC y GSC). En la segunda parte, el análisis se centró en los subgrupos de corticoides utilizados. Los pacientes de ambos grupos fueron pareados por índice de propensión al tratamiento a razón de 1:1, según edad, sexo y gravedad de la enfermedad. Las variables cuantitativas se expresaron como medianas y rango intercuartílico (RIC). Para las variables categóricas, se utilizaron frecuencias y proporciones. Antes del análisis, se realizó una evaluación previa utilizando la prueba de Shapiro–Wilk. El análisis paramétrico se llevó a cabo con la prueba t de Student y el no paramétrico con la prueba U de Mann–Whitney. Las correlaciones entre las variables cuantitativas se analizaron utilizando la prueba de Spearman y la asociación entre las variables cualitativas se evaluó mediante la prueba de chi cuadrado o, en su caso, la prueba de Fisher. Por último, para investigar la relación entre el uso de corticoides y la EH, se utilizó un análisis de regresión logística. Para ello, los pacientes se clasificaron en 2 grupos según la duración de su EH: ≤4 y >4 días, dado que esa fue la EH media de la población incluida. La significación estadística se fijó en un valor de p ≤0,05. Los análisis estadísticos se realizaron utilizando la versión 4.0.4. del programa informático R.
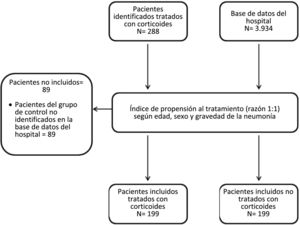
ResultadosCaracterísticas basales de los pacientes incluidosSe identificó un grupo de 288 pacientes hospitalizados con diagnóstico de COVID-19, tratados con corticoides durante el período de estudio. Finalmente se decidió no incluir a 89 de estos pacientes debido a la imposibilidad de encontrar un participante control en la base de datos hospitalaria tras aplicar el método de pareado por puntuación de propensión. Finalmente, 199 pacientes fueron asignados al GC y 199 al GSC (fig. 1).
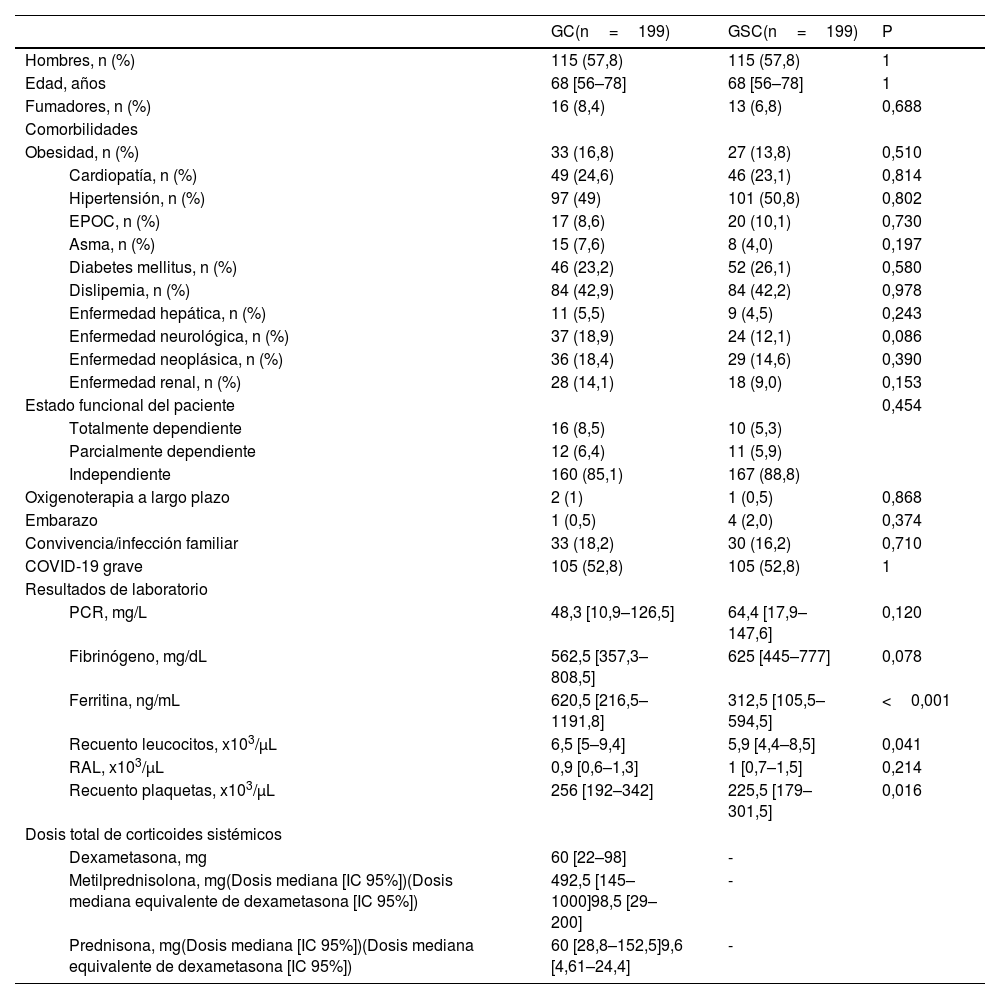
Al comparar los grupos GC y GSC no se observaron diferencias en cuanto a la distribución de comorbilidades. En lo relativo a la respuesta inflamatoria sistémica ante la COVID-19, solo los niveles de ferritina sérica (620,5 [RIC 216,5–1191,8] vs 312,5 [RIC 105,5–594,5]; p<0,001), recuento leucocitario (6,5 [RIC 5–9,4] vs 5,9 [RIC 4,4–8,5]; p=0,041) y plaquetario (256 [RIC 192–342] vs 225,5 [RIC 179–301,5]; p=0,016) fueron significativamente superiores en el GC en relación con el GSC. Las comparaciones entre ambos grupos se detallan en la tabla 1.
Características basales de los pacientes hospitalizados con diagnóstico de la COVID-19 tratados con corticoides sistémicos
| GC(n=199) | GSC(n=199) | P | ||
|---|---|---|---|---|
| Hombres, n (%) | 115 (57,8) | 115 (57,8) | 1 | |
| Edad, años | 68 [56–78] | 68 [56–78] | 1 | |
| Fumadores, n (%) | 16 (8,4) | 13 (6,8) | 0,688 | |
| Comorbilidades | ||||
| Obesidad, n (%) | 33 (16,8) | 27 (13,8) | 0,510 | |
| Cardiopatía, n (%) | 49 (24,6) | 46 (23,1) | 0,814 | |
| Hipertensión, n (%) | 97 (49) | 101 (50,8) | 0,802 | |
| EPOC, n (%) | 17 (8,6) | 20 (10,1) | 0,730 | |
| Asma, n (%) | 15 (7,6) | 8 (4,0) | 0,197 | |
| Diabetes mellitus, n (%) | 46 (23,2) | 52 (26,1) | 0,580 | |
| Dislipemia, n (%) | 84 (42,9) | 84 (42,2) | 0,978 | |
| Enfermedad hepática, n (%) | 11 (5,5) | 9 (4,5) | 0,243 | |
| Enfermedad neurológica, n (%) | 37 (18,9) | 24 (12,1) | 0,086 | |
| Enfermedad neoplásica, n (%) | 36 (18,4) | 29 (14,6) | 0,390 | |
| Enfermedad renal, n (%) | 28 (14,1) | 18 (9,0) | 0,153 | |
| Estado funcional del paciente | 0,454 | |||
| Totalmente dependiente | 16 (8,5) | 10 (5,3) | ||
| Parcialmente dependiente | 12 (6,4) | 11 (5,9) | ||
| Independiente | 160 (85,1) | 167 (88,8) | ||
| Oxigenoterapia a largo plazo | 2 (1) | 1 (0,5) | 0,868 | |
| Embarazo | 1 (0,5) | 4 (2,0) | 0,374 | |
| Convivencia/infección familiar | 33 (18,2) | 30 (16,2) | 0,710 | |
| COVID-19 grave | 105 (52,8) | 105 (52,8) | 1 | |
| Resultados de laboratorio | ||||
| PCR, mg/L | 48,3 [10,9–126,5] | 64,4 [17,9–147,6] | 0,120 | |
| Fibrinógeno, mg/dL | 562,5 [357,3–808,5] | 625 [445–777] | 0,078 | |
| Ferritina, ng/mL | 620,5 [216,5–1191,8] | 312,5 [105,5–594,5] | <0,001 | |
| Recuento leucocitos, x103/μL | 6,5 [5–9,4] | 5,9 [4,4–8,5] | 0,041 | |
| RAL, x103/μL | 0,9 [0,6–1,3] | 1 [0,7–1,5] | 0,214 | |
| Recuento plaquetas, x103/μL | 256 [192–342] | 225,5 [179–301,5] | 0,016 | |
| Dosis total de corticoides sistémicos | ||||
| Dexametasona, mg | 60 [22–98] | - | ||
| Metilprednisolona, mg(Dosis mediana [IC 95%])(Dosis mediana equivalente de dexametasona [IC 95%]) | 492,5 [145–1000]98,5 [29–200] | - | ||
| Prednisona, mg(Dosis mediana [IC 95%])(Dosis mediana equivalente de dexametasona [IC 95%]) | 60 [28,8–152,5]9,6 [4,61–24,4] | - | ||
Datos expresados como medianas (rango intercuartílico) o números (porcentaje).
Comparaciones entre grupos realizadas mediante prueba t de Student para muestras independientes, prueba U de Mann–Whitney y prueba de chi cuadrado. Abreviaturas: EPOC = enfermedad pulmonar obstructiva crónica; GC = grupo con corticoides; GSC = grupo sin corticoides; PCR= proteína C reactiva; RAL=recuento absoluto de linfocitos.
La edad mediana de los pacientes tratados con corticoides fue de 68 años (RIC 56–78), un 57,8% de ellos fueron hombres. La dosis total de corticoides sistémicos clasificados según la clase de corticoides al que pertenecieran fue de 60 mg (RIC 22–98) para la dexametasona, 492,5 mg (RIC 145–1000) para la metilprednisolona y 60 mg (RIC 28,8–152,5) para la prednisona (tabla 1). Las cantidades de corticoides utilizados fueron convertidos en una dosis equivalente de dexametasona, dando lugar a una dosis mediana total de dexametasona de 12 mg (RIC 22–98) (tabla 1).
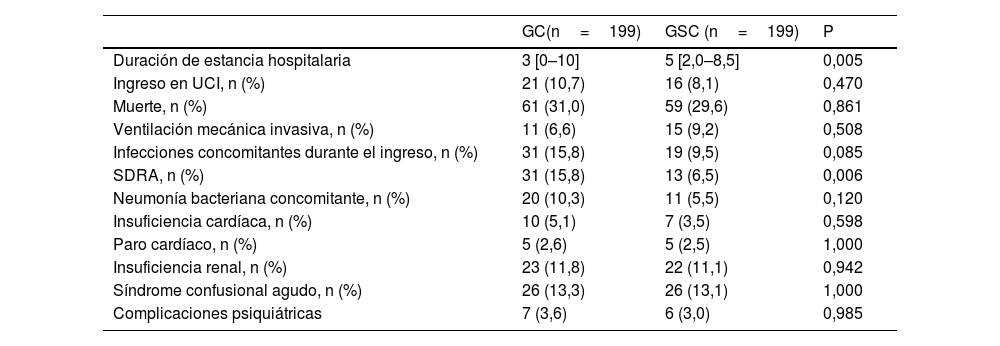
Efectos de la prescripción de corticoides en los resultados obtenidosLa EH fue estadísticamente más corta en el GC que en el GSC (3 [RIC 0–10] vs. 5 [RIC 2.0–8.5] días; p=0,005). Esta diferencia podría no estar relacionada con una mayor mortalidad, dado que la tasa de mortalidad no mostró diferencias entre los grupos (31% vs. 29,6%; p=0,861); ni con una mayor gravedad de la enfermedad en el momento del ingreso, puesto que la gravedad fue tenida en cuenta en el proceso de pareado de los grupos GSC y GC. De hecho, el GC experimentó una tasa más alta de complicaciones relacionadas con el SDRA durante su EH que el GSC (p=0,006). No se observaron diferencias en cuanto a la tasa de ingreso en UCI ni al desarrollo de otras complicaciones durante el período de hospitalización (tabla 2). Además, al convertir las dosis de las distintas clases de corticoides en dosis equivalentes de dexametasona, se observó que esta dosis estaba bien correlacionada con la EH (r=0,31; p=0,058).
Resultado de los pacientes hospitalizados con diagnóstico de la COVID-19 tratados o no con corticoides
| GC(n=199) | GSC (n=199) | P | |
|---|---|---|---|
| Duración de estancia hospitalaria | 3 [0–10] | 5 [2,0–8,5] | 0,005 |
| Ingreso en UCI, n (%) | 21 (10,7) | 16 (8,1) | 0,470 |
| Muerte, n (%) | 61 (31,0) | 59 (29,6) | 0,861 |
| Ventilación mecánica invasiva, n (%) | 11 (6,6) | 15 (9,2) | 0,508 |
| Infecciones concomitantes durante el ingreso, n (%) | 31 (15,8) | 19 (9,5) | 0,085 |
| SDRA, n (%) | 31 (15,8) | 13 (6,5) | 0,006 |
| Neumonía bacteriana concomitante, n (%) | 20 (10,3) | 11 (5,5) | 0,120 |
| Insuficiencia cardíaca, n (%) | 10 (5,1) | 7 (3,5) | 0,598 |
| Paro cardíaco, n (%) | 5 (2,6) | 5 (2,5) | 1,000 |
| Insuficiencia renal, n (%) | 23 (11,8) | 22 (11,1) | 0,942 |
| Síndrome confusional agudo, n (%) | 26 (13,3) | 26 (13,1) | 1,000 |
| Complicaciones psiquiátricas | 7 (3,6) | 6 (3,0) | 0,985 |
Los datos se expresan como medias [rango intercuartílico] o números (porcentajes). Comparaciones entre grupos realizadas mediante prueba t de Student para muestras independientes, prueba U de Mann–Whitney y prueba de chi cuadrado. Abreviaturas: GC=grupo con corticoides; GSC = grupo sin corticoides; SDRA = síndrome de distrés respiratorio agudo; UCI=unidad de cuidados intensivos.
Los pacientes se clasificaron en 2 grupos según la duración de su EH, ≤4 y >4 días, ya que esa fue la EH mediana de la población incluida. El modelo de regresión logística reveló que la prescripción de corticoides conllevaba una probabilidad de un 43% superior de ser hospitalizado dentro de los primeros 4 días en el GSC (OR 0,57 [0,37-0,87; p=0,009]).
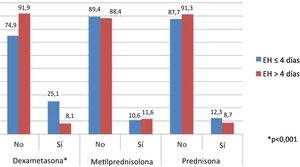
Análisis del impacto del tipo de corticoide utilizado en la duración de la estancia hospitalariaEn este análisis, solo se incluyeron pacientes tratados con un único tipo de corticoides durante todo el tiempo que permanecieron ingresados. Solo se observaron diferencias en los sujetos tratados con dexametasona, de los que un 76,3% permaneció hospitalizado ≤4 días y un 23,7% >4 días (p<0,001). Para las otras clases de corticoides no se observaron diferencias en materia de EH (fig. 2).
DiscusiónLa pandemia de la COVID-19, especialmente durante la primera ola, obligó a paralizar la práctica totalidad de hospitalizaciones por problemas no relacionados con la COVID-19, así como las cirugías no urgentes, para poder ocuparse de todos los pacientes con la COVID-19 grave que requerían ser ingresados. Además, aunque el número de camas UCI ya se había incrementado de forma significativa, en algunos momentos de la pandemia resultó ser insuficiente19. Por lo tanto, la reducción de la EH fue (y sigue siendo) extremadamente beneficiosa para atender a los pacientes que requieren ser hospitalizados.
En la primera ola de la pandemia de la COVID-19 hubo un período durante el cual los corticoides no se recomendaban de forma rutinaria, llegando incluso a considerarse contraindicados. Posteriormente, se tuvo conocimiento de los primeros datos que avalaban su uso en pacientes con la COVID-19 grave18. Los hallazgos de este estudio retrospectivo de cohortes con datos de la vida real permiten demostrar que los corticoides, específicamente la dexametasona, consiguen reducir la EH en pacientes con altos niveles de marcadores inflamatorios, en comparación con los del grupo de control. Como se ha demostrado, los pacientes del GC registraron altos niveles de plaquetas y leucocitos, con niveles de ferritina dos veces mayores que los del GSC. La COVID-19 severa es causada por un incremento sistémico excesivo de citoquinas y quimioquinas, también llamado «tormenta de citoquinas», que suele provocar daño pulmonar inmunopatológico y lesiones alveolares difusas, pudiéndose desarrollar SDRA e incluso producirse la muerte del paciente20. En este subgrupo de individuos, se ha descrito un fenotipo hiperinflamatorio en el que las concentraciones séricas de los marcadores inflamatorios y de la coagulación (incluidas la ferritina, el dímero D y la proteína C reactiva), así como de citoquinas proinflamatorias (como IL-2R, IL-6, IL-10 y el factor de necrosis tumoral-α) registran valores elevados, registrándose menores niveles de linfocitos y neutrófilos y observándose incluso reprogramación inmunometabólica13,21,22. Puesto que los corticoides son potentes agentes inmunomoduladores que, en algunos individuos, pueden romper el bucle de retroalimentación inflamatoria11 (como hemos visto en el grupo GC), aquellos pacientes con niveles de inflamación más altos podrían obtener un mayor beneficio en materia de EH11–13,21.
La investigación realizada en el marco de este estudio se llevó a cabo durante un período en el que comenzaban a aparecer las primeras noticias sobre los beneficios de los corticoides en pacientes con la COVID-19. Dado que en el momento de realizar este estudio los datos eran aún heterogéneos y todavía no se sabía qué clase de corticoides eran los más idóneos, nuestro hospital permitió a cada facultativo escoger entre los 3 tipos de corticoides ya mencionados en función de su propio criterio. Mientras que la dexametasona consiguió reducir la EH, ni la metilprednisolona ni la prednisona consiguieron ese resultado.
La mayoría de los datos empíricos recogidos hasta la fecha sobre la COVID-19 se refieren a la dexametasona. De hecho, el mayor estudio aleatorizado sobre el uso de corticoides en pacientes con COVID-19 grave fue el estudio RECOVERY, en el que se observó que la administración de dexametasona conseguía reducir la mortalidad en pacientes con fallo respiratorio3. Este resultado fue, posteriormente, confirmado por 2 metaanálisis que incluyeron un gran número de pacientes críticos con datos heterogéneos23,24. La metilprednisolona también ha demostrado producir mejores resultados clínicos, incrementar el número de días sin asistencia ventilatoria, y reducir la tasa de mortalidad en pacientes con la COVID-19 de moderada a grave14,25,26. De hecho, se han publicado 2 estudios aleatorizados en pacientes con la COVID-19 hospitalizados en los que la metilprednisolona se asoció con un menor uso de ventilación mecánica y un acortamiento de la permanencia de los pacientes en el hospital, en comparación con la dexametasona27,28.
Al evaluar ambos ensayos clínicos, se observa que la dosis de metilprednisolona utilizada fue mucho más elevada que la de dexametasona, lo que dificulta la extracción de conclusiones en cuanto a si la metilprednisolona es mejor opción que la dexametasona, o si la mejora experimentada por este grupo de pacientes se debió a la administración de una dosis superior de corticoides. Por otro lado, al comparar los datos de nuestro estudio con los de otras series, cabe formular ciertas observaciones. En primer lugar, aunque nuestra cohorte registró una tasa de mortalidad más elevada que la observada en el ensayo RECOVERY3, esta se mantuvo dentro de los rangos publicados en otras series2–4. Es preciso considerar el sesgo de selección que caracteriza a los estudios clínicos aleatorizados, según el cual podría excluirse a los pacientes más graves. Afortunadamente, la mortalidad parece haber ido reduciéndose según ha avanzado la pandemia. En segundo lugar, la proporción de pacientes ingresados en la UCI en nuestro estudio fue menor a la de otras cohortes3,4,29. Esta diferencia se debe probablemente a la labor de las unidades intermedias de cuidados respiratorios, integradas dentro del servicio de neumología de nuestro hospital durante la pandemia19,30. Los sistemas de ventilación no invasiva, así como otras estrategias de asistencia respiratoria no invasiva como la oxigenoterapia de alto flujo con cánula nasal, han desempeñado un importante papel en este sentido1,29,31. Estas terapias podrían aplicarse en combinación con una estrecha vigilancia cardiorrespiratoria en estas unidades con el fin de reducir o retrasar los ingresos en UCI en pacientes que requieren asistencia respiratoria no invasiva en situaciones de crisis y acelerar las altas de la UCI. También se podrían aplicar en pacientes no aptos para ser ingresados en la UCI debido a sus comorbilidades.
La principal fortaleza de nuestro estudio radica en que se centra en una cohorte de vida real estudiada en el momento en que comenzaron a utilizarse los corticoides para tratar la COVID-19. Esto permitió comparar los grupos de tratamiento con corticoides dentro del mismo contexto clínico (protocolos de tratamiento de un único hospital), durante la misma ola de la COVID-19. El estudio también incluye un grupo de control, pareado por sexo, edad y gravedad de la enfermedad, que representa una gran proporción de los pacientes hospitalizados con la COVID-19 en España.
No obstante, este estudio adolece de ciertas limitaciones. En primer lugar, fue realizado en un único centro hospitalario sobre una muestra de pacientes relativamente pequeña, lo que reduce la validez externa de los resultados obtenidos y se antoja insuficiente para analizar el efecto del fármaco estudiado sobre la mortalidad. Dicho esto, cabe destacar que el número de pacientes estudiados es mayor de lo habitual en los estudios observacionales que analizan los efectos de los corticoides14,26,27. En segundo lugar, aunque el estudio explora diversas características basales de los pacientes, el propio diseño del análisis y su naturaleza retrospectiva hacen que puedan no haberse evaluado ciertos factores, lo que podría distorsionar la interpretación de los resultados. No obstante, como se ha señalado más arriba, los datos fueron extraídos de una base de datos compleja que alberga una multitud de posibles variables que podrían dar lugar a confusión. En tercer lugar, el diseño transversal del estudio solo permite evaluar asociaciones o relaciones potenciales. Para evaluar la causalidad, sería menester llevar a cabo un estudio en que los pacientes fueran seguidos a largo plazo. Además, no disponemos de información sobre las necesidades de suplementación de oxígeno o de ventilación mecánica no invasiva de los pacientes. Por último, cabe señalar que, en el momento de recoger estos resultados, no disponíamos de datos clínicos sobre mortalidad a largo plazo, lo que hubiese enriquecido significativamente nuestros resultados. No obstante, estos pacientes asisten a consultas de seguimiento post-COVID, lo que podría resolver esta limitación en el futuro.
En conclusión, los corticoides, especialmente la dexametasona, podrían acortar las EH de los pacientes hospitalizados, lo que tendría un impacto positivo sobre la capacidad hospitalaria durante la pandemia de la COVID-19.
FinanciaciónLos autores declaran que no han recibido financiación alguna para la elaboración de este artículo.
AutoríaEster Zamarrón y M. Concepción Prados contribuyeron igualmente a este trabajo.
Conflicto de interesesLos autores declaran que no poseen ningún conflicto de intereses en relación con este trabajo.
AgradecimientosLos autores desean agradecer a María Jiménez González de la Unidad Central de Investigación Clínica del Hospital Universitario La Paz, por su colaboración en el análisis estadístico.
GRUPO POSTCOVID HULP
| Servicio | Apellidos | Nombre |
| Medicina | Arnalich Fernández | Francisco |
| Fernández Capitán | Carmen | |
| Salgueiro Origlia | Giorgina | |
| Moreno Fernández | Alberto | |
| Laboratorio | Buño Soto | Antonio |
| Qasem Moreno | Ana Laila | |
| Prieto Arribas | Daniel | |
| Aparato respiratorio | Álvarez Sala Walther | Rodolfo |
| Gómez Carrera | Luis | |
| Carpio Segura | Carlos | |
| Mariscal Aguilar | Pablo | |
| Laorden Escudero | Daniel | |
| Plaza Moreno | Cristina | |
| Arnalich Montiel | Victoria | |
| Unidad Central de Inv. Clínica | Borobia Pérez | Alberto |
| Jiménez González | María | |
| Enfermería | Alegre Segura | Carmen |
| Cuesta Luzzy | Tania | |
| Martínez Gómez | Alejandra | |
| Moreno Juan | Ana María | |
| Rey Iborra | Cristina | |
| Sanz Jiménez | Andrea |
Grupo COVID HULP
| APELLIDOS | NOMBRE |
| Comité científico | |
| Arribas | José Ramón |
| Borobia | Alberto M. |
| Carcas-Sansuán | Antonio |
| Frías | Jesús |
| Ramírez | Elena |
| Martín-Quirós | Alejandro |
| Quintana-Díaz | Manuel |
| Mingorance | Jesús |
| Arnalich | Francisco |
| Moreno | Francisco |
| Carlos Figueiras | Juan |
| García-Arenzana | Nicolás |
| Servicio de microbiología | |
| Montero Vega | María Dolores |
| Romero Gómez | María Pilar |
| Toro-Rueda | Carlos |
| García-Bujalance | Silvia |
| Ruiz-Carrascoso | Guillermo |
| Cendejas-Bueno | Emilio |
| Falces-Romero | Iker |
| Lázaro-Perona | Fernando |
| Ruiz-Bastián | Mario |
| Gutiérrez-Arroyo | Almudena |
| Girón De Velasco-Sada | Patricia |
| Dahdouh | Elie |
| Gómez-Arroyo | Bartolomé |
| García-Sánchez | Consuelo |
| Guedez-López | Virginia |
| Bloise-Sánchez | Iván |
| Alguacil-Guillén | Marina |
| Liras-Hernández | María Gracia |
| Sánchez-Castellano | Miguel Ángel |
| García-Clemente | Paloma |
| González-Donapetry | Patricia |
| San José-Villar | Sol |
| de Pablos Gómez | Manuela |
| Gómez-Gil | Rosa |
| Corcuera-Pindado | María Teresa |
| Rico-Nieto | Alicia |
| Servicio de farmacia | |
| Herrero | Alicia |
| Laboratorio | |
| Prieto Arribas | Daniel |
| Oliver-Sáez | Paloma |
| Mora Corcovado | Roberto |
| Fernández-Calle | Pilar |
| Alcaide Martín | M. José |
| Díaz-Garzón Marco | Jorge |
| Fernández-Puntero | Belén |
| Núñez Cabetas | Rocío |
| Crespo Sánchez | Gema |
| Rodríguez Fraga | Olaia |
| Méndez del Sol | Helena |
| Duque Alcorta | Marta |
| Gómez Rioja | Rubén |
| Sanz de Pedro | María |
| Pascual García | Lydia |
| Segovia Amaro | Marta |
| Iturzaeta Sánchez | José Manuel |
| Rodríguez Gutiérrez | Mercedes |
| Pérez García Morillon | Amparo |
| Martínez Gallego | Miguel Ángel |
| Fabre Estremera | Blanca |
| Martínez | Estefaní |
| Moreno Parra | Isabel |
| Rodríguez Roca | Neila |
| Ortiz Sánchez | Daniel |
| Simón Velasco | Manuela |
| Gabriela Tomoiu | Ileana |
| Pizarro Sánchez | Cristina |
| Montero San Martín | Blanca |
| Qasem Moreno | Ana Laila |
| Gómez López | Marta |
| Casares Guerrero | Ismael |
| Buño Soto | Antonio |
| Servicio de radiología | |
| Martí de Gracia | Milagros |
| Parra Gordo | Luz |
| Diez Tascón | Aurea |
| Ossaba Vélez | Silvia |
| Pinilla | Inmaculada |
| Cuesta | Emilio |
| Fernández-Velilla | María |
| Torres | María Isabel |
| Garzón | Gonzalo |
| Medicina preventiva | |
| Pérez-Blanco | Verónica |
| Quintás-Viqueira | Almudena |
| San Juan | Isabel |
| Cantero-Escribano | José Miguel |
| Pérez-Romero | César |
| Castro-Martínez | Mercedes |
| Hernández-Rivas | Lucía |
| Pedraz | Teresa |
| Fernández-Bretón | Eva |
| García-Vaz | Claudia |
| Robustillo-Rodela | Ana |
| Medicina de urgencias | |
| Torres Santos-Olmo | Rosario María |
| Rivera Núñez | Angélica |
| Fernández Fernández | Ignacio |
| Noguerol Gutiérrez | Marina |
| Martínez Virto | Ana María |
| González Viñolis | Manuel |
| Cabrera Gamero | Regina |
| Mayayo Alvira | Rosa |
| Marín Baselga | Raquel |
| Lo-Iacono García | Victoria |
| Lerín Baratas | Macarena |
| Romero Gallego-Acho | Paloma |
| Reche Martínez | Begoña |
| Tejada Sorados | Renzo |
| Rico Briñas | Mikel |
| Deza Palacios | Ricardo |
| Fabra Cadenas | Sara |
| Arroyo Rico | Isabel |
| Dani Ben-Abdellah | Lubna |
| Labajo Montero | Laura |
| Soriano Arroyo | Rubén |
| López Corcuera | Lorena |
| Calvin García | Elena |
| Martínez Álvarez | Susana |
| López-Tappero Irazábal | Laura |
| Pilares Barco | Martín |
| González Peña | Olga |
| Bejarano Redondo | Guillermina |
| Iglesias Sigüenza | Alberto |
| Tung Chen | Yale |
| Maroun Eid | Charbel |
| Bravo Lizcano | Ruth |
| Silvestre Niño | Miguel |
| Perdomo García | Frank |
| Alonso González | Berta |
| Antón Huguet | Berta |
| Arenas Berenguer | Isabel |
| Cabré-Verdiell Surribas | Clara |
| Marqués González | Francisco |
| Muñoz del Val | Elena |
| Molina | María Ángeles |
| Cancelliere Fernández | Nataly |
| Pastor Yvorra | Sivia |
| Frade Pardo | Laura |
| López Arévalo | Paloma |
| García | Isabel |
| Medicina interna | |
| Fernández Capitán | Carmen |
| González García | Juan José |
| Herrero | Juan |
| Quesada Simón | María Angustias |
| Robles Marhuenda | Ángel |
| Soto Abanedes | Clara |
| Noblejas Mozo | Ana María |
| Ramos | Juan Carlos |
| Jaras Hernández | María Jesús |
| Martínez Robles | Elena |
| Moreno Fernández | Alberto |
| Sánchez Purificación | Aquilino |
| Martin Gutiérrez | Juan Carlos |
| Martínez Hernández | Pedro Luis |
| Sancho Bueso | Teresa |
| Lorenzo Hernández | Alicia |
| Gutierrez Sancerni | Belén |
| Salgueiro | Giorgina |
| Martín Carbonero | Luz |
| Mostaza | José María |
| Martínez-López | María Ángeles |
| Hontañon | Víctor |
| Menéndez | Araceli |
| Álvarez Troncoso | Jorge |
| Castellano | Arancha |
| Marcelo Calvo | Cristina |
| Vives Beltrán | Ivo |
| Ramos Ruperto | Luis |
| Daroca Bengoa | Germán |
| Arcos Rueda | María |
| Vásquez Manau | Julia |
| Fernández Cidón | Pelayo |
| Herrero Gil | Carmen Rosario |
| Palmier Peláez | Esmeralda |
| Untoria Tabares | Yeray |
| Lahoz | Carlos |
| Estirado | Eva |
| Hernández | Clara |
| García-Iglesias | Francisca |
| Monteoliva | Enrique |
| Martínez | Mónica |
| Varas | Marta |
| González Alegre | Teresa |
| Valencia | Maria Eulalia |
| Moreno | Victoria |
| Montes | María Luisa |
| Servicio de neumología | |
| Alcolea Batres | Sergio |
| Cabanillas Martín | Juan José |
| Carpio Segura | Carlos |
| Casitas Mateo | Raquel |
| Fernández-Bujarrabal Villoslada | Jaime |
| Fernández Navarro | Isabel |
| Fernández Lahera | Juan |
| García Quero | Cristina |
| Hidalgo Sánchez | María |
| Galera Martínez | Raúl |
| García Río | Francisco |
| Gómez Carrera | Luis |
| Gómez Mendieta | María Antonia |
| Mangas Moro | Alberto |
| Martínez Cerón | Elisabet |
| Martínez Redondo | María |
| Martínez Abad | Yolanda |
| Martínez-Verdasco | Antonio |
| Plaza Moreno | Cristina |
| Quirós Fernández | Sarai |
| Romera Cano | Delia |
| Romero Ribate | David |
| Sánchez Sánchez | Begoña |
| Santiago Recuerda | Ana |
| Villasante Fernández-Montes | Carlos |
| Zamarrón de Lucas | Ester |
| Arnalich Montiel | Victoria |
| Mariscal Aguilar | Pablo |
| Falcone | Adalgisa |
| Laorden Escudero | Daniel |
| Prados Sánchez | María Concepción |
| Álvarez-Sala Walther | Rodolfo |
| Cuidados intensivos | |
| García | Andony |
| Arévalo | Cristina |
| Gutiérrez | Carola |
| Yus | Santiago |
| Asensio | María José |
| Sánchez | Manolo |
| Manuel Añón | José |
| Manzanares | Jesús |
| García de Lorenzo | Abelardo |
| Perales | Eva |
| Civantos | Belén |
| Cachafeiro | Lucía |
| Agrifoglio | Alexander |
| Estébanez | Belén |
| Flores | Eva |
| Hernández | Mónica |
| Millán | Pablo |
| Rodríguez | Montserrat |
| Nanwani | Kapil |
| UCI pediatría | |
| Arizcun | Beatriz |
| Pérez-Costa | Elena |
| Rodríguez-Álvarez | Diego |
| Sánchez-Martín | María |
| Quesada | Úrsula |
| Román-Hernández | Carmen |
| Dorao | Paloma |
| Álvarez-Rojas | Elena |
| Menéndez | Juan José |
| Verdú | Cristina |
| Gómez-Zamora | Ana |
| Schüffelmann | Cristina |
| Calderón-Llopis | Belén |
| Laplaza-González | María |
| Río-García | Miguel |
| Amores-Hernández | Irene |
| Rodríguez-Rubio | Miguel |
| de la Oliva | Pedro |
| Servicio de cardiología | |
| Ruiz | José |
| Rosillo | Sandra |
| González | Óscar |
| Iniesta | Ángel |
| Ponz | Inés |
| Servicio de anestesia | |
| Muñoz Ramón | José María |
| Hernández Gancedo | María Carmen |
| Uña Orejón | Rafael |
| Sanabria Carretero | Pascual |
| Moreno Gómez-Limón | Isidro |
| Seiz-Martínez | Alverio |
| Guasch-Arévalo | Emilia |
| Martín-Carrasco | Cristina |
| Alvar | Elena |
| Serrá | Lucía |
| Iannuccelli | Fabricio |
| Latorre | Julieta |
| Casares | Sandra |
| Valbuena | Isabel |
| Díaz Díez Picazo | Luis |
| Rodríguez Roca | Cristina |
| Cervera | Omar |
| García de las Heras | Esteban |
| Durán | Pilar |
| Castro | Carmen |
| Manrique de Lara | Carlos |
| Veganzones | Javier |
| López-Tofiño | Araceli |
| Fernández-Cerezo | Estefanía |
| Zurita | Sergio |
| López-Martinez | Mercedes |
| Prim | Teresa |
| Alvárez del Vayo | Julia |
| Alcaraz | Gabriela |
| Castro | Luis |
| Yagüe | Julio |
| Díaz-Carrasco | Sofía |
| González-Pizarro | Patricio |
| Montero | Ana |
| Sagra | Francisco Javier |
| Suárez | Alejandro |
| Cuidados paliativos | |
| Díez Porres | Leyre |
| Varela Cerdeira | María |
| Alonso Babarro | Alberto |
| Copiado de datos | |
| Abellán Martínez | Francisco |
| Alonso Eiras | Jorge Ignacio |
| Álvarez Brandt | Alejandra |
| Archinà | Martina |
| Arribas Terradillos | Silvia |
| Baselga Puente | Trinidad |
| Barco Núñez | Pilar |
| Barrera López | Natalia Guadalupe |
| Barrera López | Lorena |
| Bartrina Tarrio | Andrés |
| Bassani | Gemma |
| Betancort de la Torre | Paula |
| Blanco Bartolomé | Irene |
| Blasco Andrés | Celia |
| Brieba Plata | Lucía |
| Cadenas Gota | Fernando |
| Carrera Vázquez | Paloma |
| Cascajares Sanz | Carlota |
| Catino | Arianna |
| Cavallé Pulla | Raquel |
| Ceniza Pena | Daniel |
| Conde Alonso | Ylenia María |
| Currás Sánchez | Laura |
| Daltro Lage | Marcelo |
| Esteban Romero | Ana |
| Fernández Vidal | María Luisa |
| Ferrer Ortiz | Inés |
| de la Fuente Regaño | Lydia |
| Galindo Ballesteros | Pablo |
| García-Bellido Ruiz | Sara |
| García-Mochales Fortún | Carlos |
| Gómez Ballesteros | Teresa |
| Gómez Domínguez | Cecilia |
| González Aguado | Nelsa |
| González García | Sofía |
| Guisández Martín | Jorge |
| Hernández Liebo | Paula Alejandra |
| Hernando Nieto | Raquel |
| Llorente Cortijo | Irene María |
| Marín García | Antonio |
| López Pirez | Pilar |
| Mejuto Illade | Lucía |
| Palma | Marco |
| Peña Hidalgo | Adrian |
| Platero Dueñas | Lucía |
| Pujol Pocull | David |
| Ramírez Verdyguer | Miguel |
| Redondo Gutiérrez | Marta |
| Reinoso Lozano | Francisco |
| Rodríguez Revillas | Ana |
| Rodríguez Saenz de Urturi | Alejandro |
| Romero Imaz | Lucía |
| Sánchez Rico | Susana |
| Sánchez Santiuste | Mónica |
| Serrano de la Fuente | Patricia |
| Serrano Martín | Henar |
| Silva Freire | Thamires |
| Soria Alcaide | Eva |
| Suárez Plaza | Andrés Enrique |
| Tejero Soriano | Beatriz |
| Torrecillas Mainez | Andrea |
| Torres Cortés | Javier |
| Valentín-Pastrana Aguilar | María de las Mercedes |
| Villanueva Freije | Angélica |
| Virgós Varela | Marta |
| Yagüe Barrado | Marta |
| Yustas Benitez | Natalia |
| Prevención de riesgos | |
| Núñez | M. Concepción |
| Farmacología clínica | |
| Montserrat | Jaime |
| Queiruga | Javier |
| Rodríguez Mariblanca | Amelia |
| Martínez de Soto | Lucía |
| Urroz | Mikel |
| Seco | Enrique |
| Zubimendi | Mónica |
| Stuart | Stephan |
| Díaz | Lucía |
| García | Irene |
| Management: | Data |
| García Morales | María Teresa |
| Martín-Vega | Alberto |
| Revisión de los datos | |
| Caro | Abel |
| Martínez-Alés | Gonzalo |