Presentamos el caso de una interacción farmacológica entre nirmatrelvir/ritonavir (fármaco aprobado para la infección por COVID-19) y voriconazol, derivada del efecto bidireccional del ritonavir sobre las 2 principales enzimas metabolizadoras del voriconazol (citocromo P450 3A y 2C19) de forma que, ritonavir inhibe la primera e induce la segunda.
De acuerdo con las principales bases de datos de información farmacoterapéutica, en la interacción entre ambos fármacos, se espera una disminución en el área bajo la curva del voriconazol por el efecto inductor de su metabolismo, sin embargo, en el caso que presentamos ha ocurrido el efecto opuesto, se dan niveles supraterapéuticos de forma mantenida, lo cual es un efecto paradójico según la literatura.
Dado el corto periodo de tratamiento con nirmatrelvir/ritonavir (5 días), no llega a manifestarse el efecto inductor del ritonavir propuesto en los estudios en los que se basan las recomendaciones, donde el tratamiento con ritonavir es más prolongado.
This case is based on a drug interaction between nirmatrelvir/ritonavir (approved drug for COVID-19) and voriconazole is presented, possibly derived from the bidirectional effect of ritonavir on the 2 main voriconazole metabolising enzymes (cytochrome P450 3A and 2C19) ritonavir inhibits the former and induces the latter respectively.
According to the main pharmacotherapeutic information databases, in the interaction between both drugs, a decrease in the area under the curve of voriconazole is expected due to the.
inducing effect of its metabolism; however, in the case we present, unexpectedly, a paradoxical effect occurs, according to what is described in literature, with the result of sustained supratherapeutic levels of voriconazole.
Given the short treatment period with nirmatrelvir/ritonavir (5 days), the induction effect of ritonavir proposed in the studies on which the recommendations are based, where treatment with ritonavir is longer, does not occur.
Nirmatrelvir/ritonavir es un antiviral para la enfermedad por COVID-19 indicado en los casos leves-moderados con un alto riesgo de progresar a enfermedad grave1.
El objetivo es presentar un caso de una interacción farmacológica entre nirmatrelvir/ritonavir y voriconazol con un aumento notable en los niveles de voriconazol. Esta interacción se debe a que el antifúngico se metaboliza principalmente por el citocromo P450 (CYP) 3A y CYP2C19, a su vez el ritonavir tiene efectos duales, de forma que, por un lado, provoca la inhibición del CYP3A y por otro, induce la actividad del CYP2C192. Por ello, en la coadministración de voriconazol y nirmatrelvir/ritonavir puede resultar una interacción bidireccional, pudiendo depender la magnitud y la dirección de la misma del estado metabolizador del CYP2C19.
En nuestro medio, la determinación genotípica no se realiza en la práctica clínica habitual, lo que genera cierta incertidumbre sobre las recomendaciones de dosificación.
Descripción del casoSe describe el caso de una mujer de 65 años, inmunodeprimida por estar en tratamiento de un linfoma no hodgkiniano folicular estadio III-A y sin otros antecedentes de interés. Pese a haber recibido 3 dosis de vacunas contra el COVID-19 (última en septiembre de 2021), tuvo 2 ingresos en febrero y marzo de 2022 por una infección por SARS-CoV-2, variante ómicron 21 K (BA.1.1). En el primer ingreso recibió remdesivir y sotrovimab durante 5 días, y en el segundo remdesivir 10 días.
Aún sin haber negativizado la carga vírica medida por la técnica del PRC (siglas en inglés de «reacción en cadena de la polimerasa») la paciente fue dada de alta. Reingresó el 06/04/2022 con un cuadro de neumonía bilateral extensa por SARS-CoV-2. A los 10 días de su ingreso presentó PCR en suero positiva para Aspergillus terreus y beta-D-glucano positivo en suero, por lo que el 21/04/2022 se inició la administración de voriconazol intravenoso según ficha técnica (dosis de carga 6 mg/kg/12 h y posteriormente 4 mg/kg/12 h). Se realizó la determinación genotípica a la paciente resultando metabolizadora intermedia del voriconazol (polimorfismo CYP2C19 *2/*17); la frecuencia de este fenotipo es del 18-45% en los caucásicos, su recomendación terapéutica es iniciar a dosis estándar3.
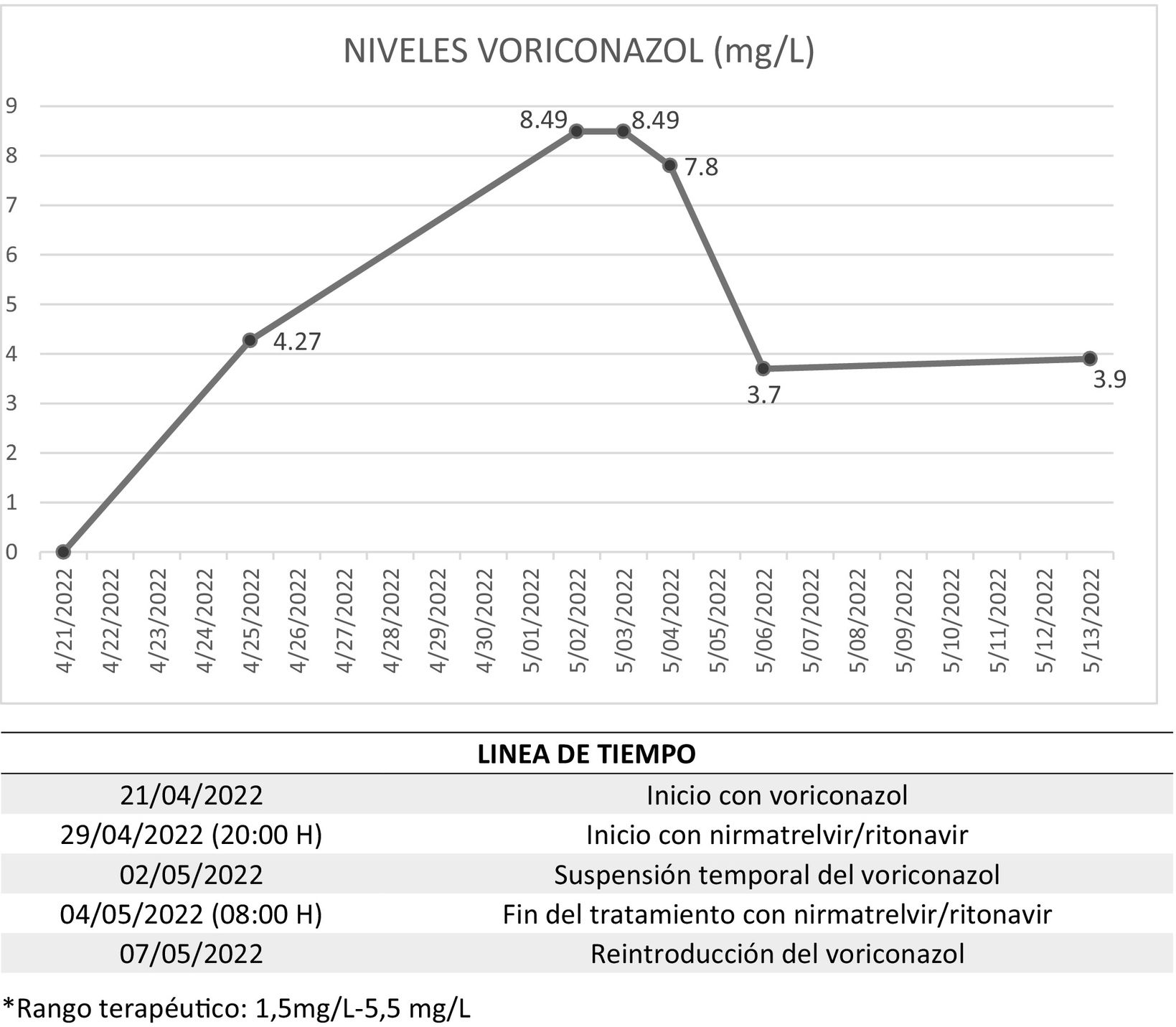
A los 5 días se realizó la determinación del nivel valle de voriconazol encontrándose en rango terapéutico (4,27 mg/L; rango terapéutico: 1,5-5,5 mg/L), no obstante, dada la mejoría clínica y analítica, y aplicando nuestro nomograma4 de dosificación, se disminuyó la dosis y se pasó a vía oral.
El 29/04/2022, ante la persistencia de la infección por SARS-CoV-2, y aunque llevaba más de 5 días de evolución, se aprobó nirmatrelvir/ritonavir como uso fuera de indicación. Transcurridas 60 h de la administración concomitante de voriconazol y nirmatrelvir/ritonavir, los niveles valle de voriconazol se duplicaron (8,49 mg/L), recomendándose por parte del Servicio de Farmacia suspender el voriconazol y monitorizar estrechamente. Tras 24 h sin voriconazol, se mantuvo el mismo nivel y a las 48 h solo había disminuido un 8,1%. Finalmente consiguió entrar en rango terapéutico (3,7 mg/L) 48 h después de haber completado los 5 días de tratamiento con nirmatrelvir/ritonavir y tras 4 días sin voriconazol (fig. 1).
Respecto a la toxicidad del voriconazol, se incrementó la alanina transaminasa 1,4 veces el límite superior de la normalidad.
Se realizó la notificación al Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano.
DiscusiónLas principales bases de datos de información farmacoterapéutica como Lexicomp®, IBM Micromedex® y Liverpool COVID-19 Interactions®, contraindican el uso concomitante de voriconazol y ritonavir a dosis de 400 mg/12 h e indican evitarlo con ritonavir 100 mg/12 h. Todas ellas se apoyan en el estudio de Liu et al.2, donde observaron que el ritonavir 400 mg/12 h disminuye el área bajo la curva del voriconazol un 82% y con 100 mg/12 h un 39%, efecto explicado por los autores por el efecto inductor del ritonavir sobre el CYP2C19. También observaron que el 3,9% de sus pacientes experimentaban un efecto opuesto (aumento de los niveles valle de voriconazol) que ellos justificaban por el efecto inhibidor de ritonavir sobre CYP3A en los pacientes que suponían metabolizadores lentos (no hubo determinación genotípica) ya que presentaban niveles de voriconazol significativamente más altos cuando todavía no se había introducido ritonavir.
En nuestro caso nos encontramos con una paciente metabolizadora intermedia que parece tolerar las dosis habituales de voriconazol en monoterapia, ya que, tanto el primer nivel analizado (antes de empezar con nirmatrelvir/ritonavir) como el obtenido a los 9 días de haber finalizado nirmatrelvir/ritonavir, estaban en el rango terapéutico.
Si analizamos el efecto inductor CYP2C19 del ritonavir en el que se basan los resultados del estudio de Liu et al.2 vemos que, en este estudio, se determina voriconazol tras 20 días de ritonavir (10 en monoterapia y 10 concomitante con voriconazol), lo que supone tiempo suficiente para que el efecto inductor se manifieste, ya que la síntesis de enzimas se estima que tarda desde días a semanas5. Sin embargo, en nuestro caso, el tratamiento con nirmatrelvir/ritonavir es de tan solo 5 días.
Hay que resaltar que, en nuestro caso, los niveles de voriconazol no entraron en rango hasta 48 h después de la suspensión del nirmatrelvir/ritonavir (y tras 4 días sin voriconazol). Stader et al.6, diseñaron un modelo para analizar la duración de la inhibición del CYP3A tras suspender el tratamiento con lopinavir/ritonavir (400/100 mg cada 12 h) usando midazolam como fármaco modelo (sustrato del CYP3A) y observaron que, para el rango de edad 60-69 años, a las 24 h había desaparecido un 51% del efecto y a las 48 h hasta un 76%.
Por lo tanto, vemos que los hallazgos descritos en este caso clínico remarcan la necesidad de realizar una monitorización estrecha de los niveles de voriconazol para evitar toxicidad o falta de respuesta, así como la importancia de individualizar a cada paciente, ya que como ocurre en el caso descrito, es posible que las recomendaciones publicadas en las bases de datos no siempre coincidan ni en la magnitud ni en el sentido de la interacción propuesta. No obstante, serían necesarios más estudios para poder aportar más evidencia científica y conocimiento en el manejo de las posibles interacciones de nirmatrelvir/ritonavir.
Responsabilidades éticasEn todo momento se respetará lo establecido por la legislación actual sobre la protección de datos de carácter personal y se asegurará la confidencialidad del paciente.
FinanciaciónNinguna.
AutoríaEl autor 4 ha obtenido los datos y han sido analizados por el autor 1, el cual ha establecido los conceptos generales y el diseño. Los autores 1, 3 y 4 han participado en la búsqueda exhaustiva de la literatura, y posteriormente el autor 1 ha redactado el manuscrito con la ayuda de los autores 2 y 4 en la construcción del contenido intelectual y los conceptos. Finalmente, el autor 5 ha hecho la revisión y corrección del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.