el objetivo de esta revisión es reunir la evidencia disponible de los diferentes medicamentos utilizados en las enfermedades inflamatorias inmunomediadas en la gestación y lactancia, su influencia en la fertilidad femenina y masculina, consejos sobre su suspensión antes de la concepción y servir de ayuda en la práctica clínica habitual para un mejor consejo al paciente en la planificación familiar.
Métodose realizó una búsqueda bibliográfica, donde se seleccionaron los artículos publicados (estudios de revisión, observacionales y series de casos) en lengua inglesa o española hasta abril de 2020 que analizaban el manejo del embarazo, la lactancia y/o la fertilidad en pacientes con tratamientos utilizados en las enfermedades inflamatorias inmunomediadas de dermatología, reumatología y digestivas.
Resultadosse seleccionaron un total de 95 referencias y se sintetizó la información de cada medicamento en tablas. Los fármacos contraindicados en el embarazo son los retinoides tópicos, pimecrolimus, inhibidores de la ciclooxigenasa 2, metotrexato, micofenolato de mofetilo, leflunomida, acitretina y tiopurinas. La falta de datos desaconseja el uso de apremilast, tofacitinib, baricitinib, anakinra, abatacept, tocilizumab y los nuevos biológicos. Mientras que son seguros los salicilatos y los emolientes tópicos, el paracetamol, la terapia ultravioleta, la hidroxicloroquina y en la terapia biológica los anti-TNF se consideran de bajo riesgo, siendo el certolizumab el de elección durante todo el embarazo y la lactancia. La mayoría son compatibles con la exposición paterna, excepto algunos como la sulfasalazina, micofenolato y leflunomida, que se recomienda la suspensión del tratamiento previa a la concepción, y la ciclosporina con requerimientos de dosis inferiores a 2 mg/kg/día.
Conclusionesen este contexto de tratamientos crónicos con potencial teratogénico, es necesario visibilizar la importancia de la planificación gestacional para seleccionar el fármaco más seguro.
Ante la calidad de los datos disponibles, sigue siendo necesaria la continua actualización de la información, así como el promover estudios observacionales de cohortes de pacientes embarazadas, lactantes y hombres en edad fértil, incluso realizar estudios prospectivos, con el fin de generar una mayor evidencia científica.
The objective of this review is to gather the available evidence on the different drugs used in immune-mediated inflammatory diseases in pregnancy, lactation, their influence on female and male fertility, advice on discontinuation before conception and to help in routine clinical practice for better patient advice on family planning.
MethodsA bibliographic search was carried out, where published articles (review studies, observational studies and case series) in English or Spanish until April 2020 that analyzed the management of pregnancy, lactation and/or fertility in patients on treatment in immune-mediated diseases were selected.
ResultsA total of 95 references were selected and the information on each drug was synthesized in tables. Drugs contraindicated in pregnancy are topical retinoids, pimecrolimus, cyclooxygenase 2 inhibitors, methotrexate, mycophenolate mofetil, leflunomide, acitretin, and thiopurines. The lack of data advises against the use of apremilast, tofacitinib, baricitinib, anakinra, abatacept, tocilizumab and the new biologicals. Topical salicylates, paracetamol, ultraviolet therapy and hydroxychloroquine treatment are safe, and anti-TNF biological therapy are considered low risk, with certolizumab being the drug of choice throughout pregnancy and lactation.
Most are compatible with paternal exposure except for sulfasalazine, mycophenolate and leflunomide, for which suspension of treatment prior to conception is recommended, and cyclosporine with dose requirements of less than 2mg/kg/day.
ConclusionsIn this context of chronic treatments with teratogenic potential, it is necessary to highlight the importance of pregnancy planning to select the safest drug. Given the quality of the available data, it is still necessary to continuously update the information, as well as to promote observational studies of cohorts of pregnant patients and men of childbearing age, including prospective studies, in order to generate more scientific evidence.
Las enfermedades inflamatorias inmunomediadas (IMID) son un grupo de enfermedades consecuencia de una inflamación crónica sistémica, causada por una alteración del sistema inmune que puede afectar a distintos órganos. Incluyen enfermedades tan heterogéneas como la artritis reumatoide (AR), la enfermedad de Crohn, la colitis ulcerosa, la psoriasis (PSO), la espondilitis anquilosante, la artropatía psoriásica, la hidradenitis supurativa, el lupus y la uveítis.
Aunque la prevalencia de estas enfermedades es difícil de concretar, en un estudio epidemiológico transversal realizado en España, se diagnosticaron un 6,39% de pacientes con una IMID relevante en el 2017, siendo las de mayor prevalencia la PSO (2,69%) y la AR (1,07%)1 y con una afectación importante en las mujeres y en la edad fértil. Hace unos años, el tratamiento activo y un buen control de las IMID limitaban el deseo gestacional2. Actualmente, gracias al arsenal terapéutico disponible y los estudios en práctica clínica, la gestación, la lactancia y las consultas de fertilidad son temas a abordar con los pacientes.
El objetivo de esta revisión sistemática es recopilar y sintetizar la evidencia disponible de los diferentes medicamentos utilizados en las IMID, tanto en la gestación, la lactancia, su influencia en la fertilidad femenina y masculina, así como dar recomendaciones de modificar el tratamiento antes de la concepción.
MétodoSe realizó una búsqueda bibliográfica de la literatura disponible empleando términos Medical Subject Heading (MeSH), en las siguientes bases de datos: Medline (vía Pubmed), Web of Science y The Cochrane Library, con la finalidad de recopilar información sobre el manejo de medicamentos en el contexto de la concepción, el embarazo y la lactancia en las IMID.
Se seleccionaron los artículos con base en los siguientes criterios de inclusión: publicados en lengua inglesa o española hasta el 2020 que analizaron el manejo del embarazo, la lactancia o la fertilidad en pacientes con tratamientos utilizados en las IMID de dermatología, reumatología y digestivas; principalmente estudios de revisión y observacionales, pero también series de casos. En caso de información redundante, se seleccionaron aquellos artículos de mayor calidad y mayor número de casos.
Se combinaron los siguientes términos: «pregnancy», «therapy during pregnancy», «fertility», «breastfeeding», «male exposition», «dermatology», «rheumatology», «digestive»; con medicamentos empleados en las IMID y se restringió la búsqueda a enfermedades autoinmunes. La revisión de los artículos seleccionados se realizó de forma independiente por 2 autores y las discrepancias fueron resueltas por un tercer revisor. Inicialmente se revisaba el título y el resumen, y si cumplían los criterios establecidos, se pasaba a la revisión de texto completo.
ResultadosDe la búsqueda inicial de 6.013 referencias se seleccionaron 32 artículos que cumplían los objetivos del estudio. Posteriormente, tras la revisión de los artículos y su bibliografía, se añadieron hasta completar las 93 referencias que se utilizaron para sintetizar la información disponible y resumirla en las tablas.
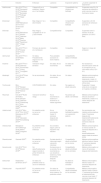
Tratamientos tópicos y antiinflamatorios (tabla 1)Salicilatos y emolientesLos salicilatos y emolientes son de elección para su uso durante el embarazo. La absorción sistémica del tratamiento tópico depende de la concentración, del tiempo de aplicación y puede llegar a ser del 10 al 25% de lo aplicado sobre la piel3, por ello se recomienda evitar concentraciones altas (> 3%), grandes cantidades (> 20 g/día) o usarlo bajo oclusión, para evitar la penetración4–6.
Tratamientos tópicos y antiinflamatorios
| Estudios | Embarazo | Lactancia | Exposición paterna/ fertilidad | ¿Cuándo suspender el tratamiento? | |
|---|---|---|---|---|---|
| Salicilatos y emolientes | Schwarb 19993Rademarker 20184Hoffman 20155Bae Y-SC 20126Butleer 20147 | Son de elecciónevitar concentraciones altas, grandes cantidades y oclusión | Evitar aplicación en el pecho, no utilizar en grandes extensiones ni periodos prolongados | Seguros durante el embarazo Valorar durante el 3er trimestre | |
| Antralina o ditranol | Rademarker 20184 | Sin datos. No se recomienda | Compatible con la lactancia | Suspender el tratamiento 4 semanas antes del embarazo | |
| Análogos de vitamina D | Hoffman 20155Bae Y-SC 20126Butleer 20147 | Anomalías esqueléticas en animalesValoración riesgo- beneficio | Compatible con la lactancia | - | |
| Retinoides tópicos | Bangsgaard 20158Rademarker 20184Hoffman 20155 | CONTRAINDICADO Teratógenos. Realizar un test de embarazo previo al inicio y usar contracepción durante la terapia | Riesgo muy bajo durante la lactancia | Retirar el tratamiento 4 semanas antes del embarazo | |
| Pimecrolimus | Pariser 20099 Rademarker 20184Koh 201910Butleer 20147 | No se recomienda su uso durante el embarazo | Compatible con la lactancia. Evitar la aplicación en el pecho | - | |
| Fototerapia | Hoffman 20155Rademarker 20184Bangsgaard 2015 8 | UVB y UVBBE. Se recomienda suplementación con ácido fólicoContraindicada la PUVA | UVB: segura, administrar protector solar en el pecho. UVA: retrasar la lactancia 5 h desde la última dosis | PUVA: 3 meses antes de la concepción | |
| AINE clásicos | Toda 201711Flint II 201612Smeele 201913Sapag Duran 201214Micu 201815 | AAS a dosis bajas seguroIndometacina máximo 2 díasPrecaución AINE durante el 3er trimestre de embarazo | Compatible con la lactancia. Los de mayor experiencia son ibuprofeno, diclofenaco y naproxeno | Compatible Afectación: fertilidad femenina y masculina | Suspender AINE en la semana 32 de gestación |
| Inhibidores COX-2 | Sapag Duran 201214Dathe 201816Gardiner 200617Flint II 201612 | CONTRAINDICADO | Transferencia mínima del celecoxib | Infertilidad femenina reversible | Interrumpir el tratamiento durante el embarazo |
PUVA: psoraleno más radiación UVA; UVBBE: UVB de banda estrecha.
En la lactancia se recomienda evitar la aplicación de tratamientos tópicos en el pecho, en grandes extensiones de la piel, ni por periodos prolongados, para impedir la absorción directa por el lactante, aunque es muy poco probable que alcance cantidades significativas en la leche materna10,7.
Retinoides tópicosEn general los retinoides, adapaleno, tazaroteno y tretinoína, son potencialmente teratogénicos en el embarazo8. Sin embargo, en los estudios preclínicos no se observaron efectos teratógenos, mutagénicos, ni carcinógenos a las dosis utilizadas, aunque puede producirse teratogenicidad si se aplica en más del 20% de la superficie corporal4,5.
En la lactancia el tazaroteno presenta una absorción transcutánea mínima, por lo que el riesgo parece bajo4,8.
PimecrolimusDebido a su mayor tamaño molecular, pimecrolimus de forma tópica tiene una pobre absorción sistémica y no existe o es insignificante la acumulación sistémica después de aplicaciones repetidas, en grandes superficies corporales (hasta un 69%) o en su uso a largo plazo9. No obstante, no se recomienda su uso durante el embarazo10,7.
FototerapiaLa terapia con luz ultravioleta (UV)B y la UVB de banda estrecha (UVBBE) parece ser segura durante el embarazo. Sin embargo, puede haber depleción de folato materno, por lo que se recomienda suplementación con ácido fólico5. En cuanto a la terapia PUVA (psoraleno más radiación UVA), en un estudio que incluía 107 pacientes se detectaron casos de parto prematuro y anomalías fetales. Este medicamento es considerado como categoría C de embarazo de la FDA (Food and Drug Administration). Psoraleno, que se administra oralmente a los pacientes para aumentar la reactividad de la piel a los rayos UVA, tiene un riesgo teórico de efectos teratogénicos y mutagénicos, debido a la síntesis de ADN y la inhibición de la división celular. Se recomienda evitar durante el embarazo4,5,8.
Paracetamol y AINE clásicosEl paracetamol es el fármaco más seguro como analgésico y antipirético en el embarazo. Estudios experimentales en animales y estudios de cohortes prospectivos en humanos, no mostraron un incremento de las malformaciones a las dosis terapéuticas usadas y es compatible en la periconcepción y durante todo el embarazo. Existe evidencia que sugiere una asociación positiva, aunque débil, del uso de paracetamol prenatal y cuadros de alergia y asma en los niños, los adolescentes y en las etapas adultas de la vida, probablemente asociado a la disminución de los niveles de glutatión en el pulmón, produciendo daño oxidativo e inflamación. Por ello, se recomienda el uso intermitente, en la dosis efectiva más baja y por el menor tiempo posible11,12.
No se han descrito riesgos teratogénicos o de aborto al utilizar los AINE clásicos durante el primer trimestre de embarazo, pero en el tercer trimestre puede provocar el cierre prematuro del ductus arterioso, hipertensión pulmonar, anuria neonatal, anemia, aumento del riesgo de hemorragia pre y posparto y oligohidramnios. Además, puede provocar disminución de la agregación plaquetaria en el feto, incrementando el riesgo de hemorragia intracraneal en prematuros o neonatos de bajo peso.
El ácido acetilsalicílico a dosis altas (más de 3 g) inhibe la contractilidad uterina y prolongan la gestación, mientras que a dosis bajas usadas como agente antiplaquetario han mostrado ser seguras durante el embarazo12.
Los AINE se pueden utilizar de forma segura durante la lactancia, aunque se ha descrito cierto riesgo de ictericia y kernícterus10,12. Los de mayor experiencia de uso son el ibuprofeno, diclofenaco y naproxeno. En la fertilidad masculina, se han descrito alteraciones del esperma dependiente de la dosis de AINE utilizadas en los padres en tratamiento, y en las mujeres los AINE inhiben la producción de prostaglandinas, que juegan un papel en la ovulación e implantación de los blastocistos13–15.
Inhibidores COX-2Los inhibidores de la COX-2 presentan un riesgo incrementado de cierre prematuro del ductus arterioso especialmente durante el tercer trimestre de embarazo, por lo tanto, su uso se encuentra contraindicado en ese período14.
En un estudio observacional se comparó a 174 mujeres en tratamiento con inhibidores de la COX-2 durante el primer trimestre de embarazo frente a 521 sin dicha exposición. No se encontraron diferencias significativas en los abortos espontáneos, ni en las anomalías congénitas, aunque sí fueron superiores los abortos electivos en el grupo de pacientes expuestas16.
En la cohorte de embarazadas de Quebec, la exposición a los inhibidores de la COX-2 en los 3 meses previos al parto, se asoció a un riesgo aumentado de prematuridad 2,46 veces superior frente a las que no lo usaron, y en el caso de celecoxib el riesgo aumentó en 3,41 veces, por lo que concluyen que el uso de celecoxib en el embarazo avanzado puede aumentar el riesgo de prematuridad18.
Algunos estudios realizados con celecoxib en humanos, demuestran una transferencia mínima del fármaco en la leche materna inferior al 0,3%, por ello, su uso se considera seguro durante la lactancia17, aunque algunas guías lo contraindican12.
Los datos de fertilidad masculina en inhibidores de COX-2 son limitados y hacen referencia a los anteriores del uso con AINE. Mientras que, en la fertilidad femenina, al igual que con los AINE clásicos, debido a la alteración en la ruptura de los folículos ováricos se ha asociado con infertilidad reversible, por lo que se recomienda evitar su uso en las mujeres que intenten concebir12.
Inmunomoduladores (tabla 2)AminosalicilatosCon los aminosalicilatos, mesalazina y sulfasalazina (SSZ), no se han descrito efectos adversos y se consideran de riesgo bajo en el embarazo. La SSZ tiene efectos antifólicos, por lo que se recomienda no exceder dosis de 2 g/día e indicar un suplemento de ácido fólico en el período prenatal y durante todo el embarazo. Pueden usarse durante la lactancia materna debido a que la cantidad que se excreta en la leche materna es muy pequeña, pero se recomienda usar con precaución ya que se han descrito casos de sangre en heces19, diarrea en los lactantes e ictericia en el recién nacido10,20.
Inmunomoduladores
| Estudios | Embarazo | Lactancia | Exposición paterna/ fertilidad | ¿Cuándo suspender el tratamiento? | |
|---|---|---|---|---|---|
| Aminosalicilatos | Koh 201910Rahimi 200820Branski 198619Mouyis 201921Flint I 201622 | De riesgo bajoSSZ: dosis de < 2g/día y suplemento de ácido fólico | Compatible con la lactancia | SSZ: suspender 3 meses antes de concepción (oligospermia reversible, astenozoospermia, teratozoospermia) | Seguros durante el embarazo |
| Tiopurinas | Polifka 200223Mahadevan 201224 Mahadevan 201725Hutson 201326Puchner 201927Biancone 201728Cury 201229 Christensen 200830Norgard 200431Akbari 201332 | CONTRAINDICADOValoración riesgo- beneficio | Evitar un periodo de 4 horas desde la ingesta materna | Compatible probablemente | Suspender 3 meses antes de la concepción en hombres y mujeres |
| Corticoides | Bae Y-SC 20126Flint I 201622Park-Wyllie 200033Kavanaugh 201534 | Utilización posiblemente seguraEvitar dosis altas en primer trimestre | CompatibleLactancia 4 horas después de la toma del medicamento | CompatibleNo altera la fertilidad masculina, ni femenina | |
| Metotrexato | Koh 201910Micu 201815Mahadevan 201224 McConell 201635Zakhem 201936 Nurmohamed 201137Weber-Schoendorfer38,39 | CONTRAINDICADO | CONTRAINDICADO | No parece mayor riesgo de malformaciones congénitas | Mujer: suspender 3-6 meses antes y añadir ácido fólicoHombre: suspender 3 meses antes |
| Ciclosporina A | Rademarker 20184Koh 201910Micu 201815Puchner 201927Petri 200340Leroy 201541Haberman 199142Georgiou 201643Xu 201144 | Valoración riesgo- beneficio | La CsA pasa a la leche materna. Recomendaciones a favor y en contraConsiderar el contenido en etanol de algunas presentaciones | Dosis inferiores a 2 mg/kg/ día de CsA (para evitar la astenoteratospermia y en exposición paterna) | |
| Tacrolimus | Micu 201815Mahadevan 201725 Puchner 201927Cury 201229Georgiou 201643 | Valoración riesgo- beneficio | Compatible | Menor volumen y motilidad del espermaSin datos concluyentes que contraindiquen la exposición paternal | |
| Micofenolato de mofetilo | Koh 201910Puchner 201927Coscia 201545Hoeltzenbein 201646Skorpen 201647Midtvedt 201748 | CONTRAINDICADO | CONTRAINDICADO | Suspender 3 meses antes de intentar la concepción | 6 semanas antes de la concepción |
| Hidroxicloroquina | Flint II 201612Micu 201815Kavanaugh 201534Motta 200549Levy 200150Osadchy 201151 | Compatible | Compatible | Compatible | No necesario suspender el tratamiento ante planificación de embarazo |
| Leflunomida | Cassina 201252Warnke 201353Chambers 201054Brent 200155 | CONTRAINDICADO | CONTRAINDICADO | Suspender 3 meses antes de intentar la concepción | Suspender cuando se planifique el embarazo y realizar lavado con colestiramina o carbón activo |
| Acitretina | Koh 201910Picardo 201956 Millsop 201357 | CONTRAINDICADO | CONTRAINDICADO | Compatible | Contraindicado en el embarazo (riesgos hasta 3 años después del tratamiento) |
| Apremilast | Rademarker 20184Micu 201815 | CONTRAINDICADO | CONTRAINDICADO | No datos fertilidad (no efecto en animales) | Suspender 2 días antes de la concepción |
| Tofacitinib | Micu 201815Skorpen 201647Picardo 201956Clowse 201658 | CONTRAINDICADO | CONTRAINDICADO | Altera la fertilidad en ratas hembra, pero no en ratas macho | En mujeres en edad fértil, se recomiendan métodos anticonceptivos durante y hasta al menos 4-8 semanas después del tratamiento |
| Baricitinib | Gerosa 201859 | CONTRAINDICADO | CONTRAINDICADO | Estudios en animales: no afecta la espermatogénesis, pero sí la fertilidad femenina | Se recomienda un anticonceptivo eficaz durante y por lo menos una semana después del tratamiento |
SSZ: sulfasalazina.
Se ha observado oligospermia reversible, astenozoospermia y teratozoospermia en los hombres tratados con SSZ, por lo que se recomienda su suspensión antes de la concepción21,22.
TiopurinasEn los animales, a dosis similares a la de los humanos, el tratamiento materno con azatioprina (AZA) o mercaptopurina (6-MP) durante el embarazo es claramente teratogénico, pero la información en los humanos es limitada. Debido a que inhiben la síntesis de ácidos nucleicos, es posible que el tratamiento con estos medicamentos interfiera con la replicación del ADN en las células germinales23.
En el registro PIANO (Pregnancy Inflammatory bowel disease And Neonatal Outcomes), se estudió el efecto de la exposición a tiopurinas y anti-TNF, desde la concepción al parto, en más de 1.000 mujeres. El uso de tiopurinas o anti-TNF no se asoció a anomalías congénitas o complicaciones del embarazo, no obstante, hubo un aumento significativo en las infecciones infantiles tardías a los 9 y 12 meses de edad entre los 107 bebés expuestos a tiopurina combinada con anti-TNF (RR 1,50; IC 95%, 1,08–2,09)24. Debido al potencial de infecciones infantiles tardías podría considerarse suspender la tiopurina después de la concepción25.
En las mujeres con enfermedad inflamatoria intestinal en tratamiento con tiopurinas, se vio un mayor riesgo de malformaciones congénitas en comparación con las mujeres sanas (RR 1,45; IC 95%: 1,07 a 1,96; p = 0,02), sin embargo, no lo hubo en comparación con los controles de la enfermedad (RR 1,37; IC 95%: 0,92 a 2,05; p = 0,1)26. Aunque la mayoría de la bibliografía existente se decanta por no recomendar la administración de tiopurinas a pacientes embarazadas10,25,28,29,35, estos datos brindan soporte para su uso en las pacientes con alto riesgo de recaída27,28.
Se ha detectado la presencia de 6-MP en el calostro y en la leche materna de las mujeres que recibían tratamiento con AZA. En caso de lactancia materna, se recomienda esperar 4 horas tras la última dosis, debido a que el pico de 6-MP en la leche ocurre dentro de las primeras 4 horas tras la ingesta30.
Aunque se han notificado casos de anomalías congénitas de padres tratados con AZA o 6-MP31, en el metaanálisis de Akbari32, la exposición paterna a tiopurinas en el momento de la concepción no se asoció con anormalidades congénitas de forma significativa, siendo el OR combinado de 1,87 (IC 95%, 0,67 a 5,25).
CorticoidesLa hidrocortisona, cortisona, prednisolona y metilprednisolona se inactivan en la placenta por lo que su uso es seguro para el feto. Aunque la prednisona no presenta un riesgo teratogénico en los humanos a dosis terapéuticas, se recomienda evitar en el primer trimestre dosis altas (1-2 mg/kg) por riesgo de hendidura palatina33. Dosis mayores de 20 mg/día pueden provocar la hipoplasia de las suprarrenales en el feto con insuficiencia suprarrenal transitoria tras el parto. Dosis superiores a 5–10 mg/día de prednisona se asocian a mayor riesgo de diabetes gestacional, hipertensión arterial, edema, ruptura prematura de la membrana y osteoporosis y el uso crónico provoca una supresión de la producción de la hormona adrenocorticotropa (ACTH).
Los corticoides se pueden administrar durante la lactancia, se recomienda realizar la lactancia 4 horas después de la toma de la medicación, sobre todo si es superior a 20 mg de prednisona/día10,34 para minimizar la exposición infantil.
Datos en hombres expuestos a prednisolona no mostraron un incremento de malformaciones debido a la exposición paterna15,35,34,36.
MetotrexatoEl metotrexato (MTX), categoría X por la FDA, está contraindicado durante el embarazo por su efecto teratógeno en los humanos25,35, especialmente en el primer trimestre del embarazo, incluso a dosis menores a 30 mg por semana. De hecho, el efecto embrioletal es utilizado para el tratamiento del embarazo ectópico37. Sin embargo, un estudio de cohortes multicéntrico prospectivo de 324 embarazadas expuestas al MTX, concluye que la incidencia de aborto espontáneo y el riesgo de defectos congénitos fue mayor en el grupo de expuestos posconcepción respecto al grupo comparado no expuesto al fármaco; mientras que entre las 136 embarazadas expuestas al MTX preconcepción no se detectó mayor riesgo38,39.
Se excreta en la leche materna y la larga vida media del MTX provoca su acumulación en los tejidos de los lactantes, es por eso que su uso en lactancia se encuentra contraindicado10.
Ciclosporina A y tacrólimusLa ciclosporina A (CsA) atraviesa la barrera placentaria y puede alcanzar concentraciones en sangre fetal de hasta el 50% de la concentración en la sangre materna40. La FDA lo clasifica como riesgo X, aun así, no se han comunicado efectos teratógenos en los humanos.
No se ha demostrado un impacto negativo en la fertilidad masculina y femenina de los pacientes en tratamiento con CsA4,15,41,42. En varias cohortes, de 19, 26 y 212 hombres en tratamiento con CsA encontraron diferencias entre la motilidad y la forma asociadas a una mayor dosis, y un espermatograma normal a los 2 años tras el trasplante, considerándose ese intervalo recomendable para la concepción15,43,44. Tampoco se detectaron incrementos en las malformaciones congénitas en los niños gestados de padres expuestos a CsA44. Se puede concluir que las dosis inferiores a 2 mg/kg/día de CsA no parecen tener un efecto negativo en la fertilidad masculina, ni la exposición paterna producir daño fetal15,43,44.
En el caso de tacrólimus, los datos disponibles no muestran ninguna evidencia de un aumento del riesgo en el embarazo comparado con otros inmunosupresores. Sin embargo, se han notificado casos de abortos espontáneos, por lo que, se pueden considerar otras alternativas más seguras25,27,29.
Micofenolato de mofetiloEl ácido micofenólico es un agente teratogénico y no debe utilizarse durante el embarazo45. Los resultados de un estudio europeo multicéntrico de cohortes prospectivo, con 57 embarazos con exposición al micofenolato de mofetilo (MMF) identificó una incidencia acumulada del 45% de abortos espontáneos y 26% de riesgo de malformaciones congénitas graves46. Se recomienda suspender el tratamiento 6 semanas antes de la concepción10,27,47.
Está contraindicado durante el periodo de lactancia materna, debido al riesgo potencial de reacciones adversas graves al MMF en los niños lactantes10,27,47.
Datos de 3 estudios basados en el registro de embarazos después de la exposición paterna a los derivados de MMF no muestran un incremento en la incidencia de malformaciones congénitas en niños de padres expuestos comparados con controles y con la población general48. Aún así, se recomienda que suspendan la medicación 3 meses antes de intentar la concepción10.
HidroxicloroquinaLa hidroxicloroquina (HCQ) es el antipalúdico de elección en las mujeres con deseo de embarazo y enfermedad reumática22. Un estudio observacional prospectivo con 40 bebés nacidos de madres afectadas por enfermedades reumáticas y tratadas con HCQ no encontró relación con las malformaciones congénitas o las infecciones neonatales y determinó que el parto prematuro fue la principal complicación (20,5%), pudiendo estar relacionada con la enfermedad reumática materna49.
Los resultados del estudio de HCQ doble ciego y controlado con placebo, no revelaron anormalidades congénitas, ni tampoco una alteración neurooftalmológica y auditiva a los 1,5-3 años de edad de los niños nacidos50. Tampoco mostró evidencia de toxicidad ocular fetal una revisión sistemática que incluyó 12 estudios con un total de 588 nacidos vivos de madres tratadas con cloroquina o HCQ durante el embarazo51.
La HCQ atraviesa la placenta siendo la concentración en la sangre del cordón umbilical aproximadamente igual a la materna, mientras que la excreción en la leche materna es muy baja (< 0,2 mg/kg/día), siendo compatible con la lactancia materna22.
LeflunomidaLa leflunomida y su metabolito activo, la teriflunomida, provocan graves defectos natales y existen casos publicados de malformaciones en los niños nacidos de madres expuestas a leflunomida durante el embarazo52.
En caso de exposición, la eliminación de la teriflunomida se puede acelerar mediante la administración de colestiramina y alternativamente carbón activo34,41,53. En un estudio en mujeres con AR que quedaron embarazadas durante el tratamiento con leflunomida y fueron tratadas con colestiramina, la tasa de malformaciones fue similar al 3-4% esperado en la población en general54,55.
Se desconoce si se excreta en la leche materna, aunque sí lo hace en animales y su uso está contraindicado por el riesgo elevado de efectos secundarios en el lactante10,34.
AcitretinaEste medicamento es teratogénico y embriotóxico en los animales, por lo que su uso se encuentra contraindicado en el embarazo y en lactancia materna10,56. No parece afectar a la fertilidad masculina57 y los estudios postautorización del fármaco indican ausencia de riesgo reproductivo56.
ApremilastSu uso durante el embarazo y la lactancia está contraindicado. Entre los efectos del apremilast sobre el embarazo se incluyeron: pérdida embriofetal en los animales, disminución del peso fetal y retraso en la osificación en ratones a dosis superiores a la dosis máxima humana actualmente recomendada. No se observaron dichos efectos cuando la exposición en los animales fue a dosis 1,3 veces la exposición clínica4.
Inhibidores de la JAK: tofacitinib y baricitinibLos datos en los humanos son escasos y confusos debido al uso frecuente concomitante con el MTX. Se ha demostrado que tofacitinib es teratogénico en ratas y conejos, y afecta al parto y al desarrollo peri y posnatal.
Los resultados de las bases de datos de seguridad clínica de tofacitinib y de estudios poscomercialización en AR, así como informes de eventos adversos, reveló que, de los 47 embarazos, hubo un nacimiento de un bebé con una anomalía congénita y 7 abortos espontáneos, 3 de ellos en combinación con MTX58.
Se desconoce si tofacitinib se excreta en la leche materna. No se puede excluir el riesgo en los lactantes ya que el bajo peso molecular de la molécula de tofacitinib podría facilitar su paso a la leche materna. Como medida de precaución, está contraindicado su uso durante la lactancia47,56.
No hay datos suficientes sobre el uso de baricitinib en las mujeres embarazadas y si se excreta en la leche materna. Los estudios en animales han mostrado toxicidad, siendo teratogénico en ratas y conejos debido a que afecta al desarrollo óseo en el útero a dosis elevadas, así como la excreción del baricitinib en la leche materna. No se puede excluir un riesgo en el feto o recién nacido, por lo que, en general, está contraindicado durante el embarazo y la lactancia59.
Terapia biológica (tabla 3)Los primeros biológicos en aparecer fueron los anti-TNF, debido a su mayor experiencia de uso, son de preferencia frente a los nuevos anticuerpos de dianas terapéuticas como interleukina (IL) 12, IL-17 o IL-23.
Terapias biológicas
| Estudios | Embarazo | Lactancia | Exposición paterna | ¿Cuándo suspender el tratamiento? | |
|---|---|---|---|---|---|
| Adalimumab | Micu 201815Flint I 201622Grunewald 201560Chambers 201061Burmester 201762Pottinger 201863Heppt 201764 | Categoría B en el embarazo. Segura en el 1er trimestre | Compatible | CompatibleNo hay influencia en fertilidad | Suspender entre 20 y 24 semanas de embarazo o evitar vacunas vivas los 6 primeros meses |
| Etanercept | Carter 200665Mahadevan 201725 Flint I 201622Clark 201066 | Bajo riesgo en 1er y 2do trimestre | Compatible | CompatibleNo influencia en fertilidad | Suspender a 24–32 semanas del embarazo (t1/2 70 h) |
| Infliximab | Flint I 201622Mahadevan 201725Nielsen 201367Ostensen 201468Matro 201569Paschou 200970Perdichizzi 200771Villiger 201072 | Bajo riesgo y compatible en el 1er y 2do trimestre | Compatible/evitar | Compatible | Suspender entre la semana 16-20 de gestación (t1/2 8-9.5 días) |
| Certolizumab | Micu 201815Flint I 201622Clowse 201673Cohen 201674 | Fármaco de elección en el embarazo | Compatible | Compatible | Seguro a lo largo del embarazo |
| Golimumab | Micu 201815Flint I 201622Matro 201569 | Sin datos. Probablemente segura en el 1er trimestre | Poco probable excreción en leche materna | CompatibleNo datos en fertilidad | |
| Anakinra | Micu 201815Flint I 201622Ostensen 201475Fischer-Betz 201176Chang 201477Youngstein 201778 | Valoración riesgo- beneficio | Sin datos. No se recomienda | Sin datos en fertilidad | No necesaria la discontinuación antes de la concepción por su vida media corta (t1/2 4-6 h) |
| Abatacept | Flint I 201622Pham 201279Kumar 201580 | No se recomienda | Sin datos. No se recomienda | Sin datos | Métodos anticonceptivos efectivos durante el tratamiento y hasta 14 semanas después de la última dosis |
| Tocilizumab | Micu 201815Skorpen 201647Hoeltzenbein 201281Sakurai 201282 | CONTRAINDICADO | Sin datos | No sugiere un efecto relevante | Suspender 3 meses antes de la concepción en mujeres y hombres |
| Rituximab | Koh 201910Butler 20147Micu 201815Skorpen 201647Ostensen 201468Chakravarty 201183Klink 200884Owczarek 202085 | Valoración beneficio/ riesgo | No se recomienda la lactancia ni durante los 12 meses siguientes | No parece que afecte a la fertilidad | Métodos anticonceptivos eficaces durante el tratamiento y hasta 6-12 meses después del tratamiento |
| Ustekinumab | Koh 201910Micu 201815Flint I 201622 Mahadevan 201725 Skorpen 201647Owczarek 202085Schaufelberg 201486 | Es preferible evitar su uso en el embarazo | No se recomienda (hasta 15 semanas después del tratamiento) | Sin datos de fertilidadCompatible con exposición paterna | Se recomienda usar métodos anticonceptivos hasta 15 semanas después del tratamientoPosiblemente seguro hasta 8-10 semanas antes del parto |
| Vedolizumab | Mahadevan 201725Wieringa 201887Moens 202088Julsgaard 201889 | Es preferible evitar su uso en el embarazo | Se considera seguro, pero se requieren más estudios | Sin datos | Métodos anticonceptivos al menos durante 18 semanas después de la última dosisPosiblemente seguro hasta la semana 30-32 |
| Risankizumab | Owzarek 202085 | Es preferible evitar su uso en el embarazo | Se debe decidir si interrumpir según valoración individual | CompatibleNo afecta la fertilidad en los monos | Métodos anticonceptivos efectivos hasta al menos 21 semanas después del tratamiento |
| Secukinumab | Koh 201910Flint I 201622Warren 201890 | Sin datosPosiblemente seguro durante el primer trimestre de embarazo | Se desconoce si se excreta. No se recomienda su uso durante la lactancia y hasta 20 semanas después | CompatibleNo afecta la fertilidad en los animales | Método anticonceptivo al menos 20 semanas después del tratamiento |
| Ixekizumab | Rademarker 20184Irani 201591 | Sin datos. Es preferible evitar su uso en el embarazo | Sin datos | No afecta la fertilidad en animales | Método anticonceptivo efectivo hasta 9-10 semanas después del tratamiento |
| Tildrakizumab | Haycraft 202092 | Es preferible evitar su uso en el embarazo | Sin datos de excreción en la leche materna. Es preferible evitarlo | CompatibleNo afecta la fertilidad en los animales | Método anticonceptivo efectivo hasta al menos 17 semanas tras finalizar el tratamientoEvitar vacunas vivas hasta 17 semanas después del tratamiento |
t1/2: tiempo de vida media
Al igual que otros anti-TNF, el adalimumab es considerado como categoría B en el embarazo. En un registro de 500 mujeres embarazadas, no se demostró evidencia de embriotoxicidad, teratogenicidad y abortos espontáneos60. En otros estudios posteriores en las mujeres con AR o la enfermedad de Crohn, el riesgo relativo de defectos congénitos o de abortos espontáneos no fue mayor en el grupo de los expuestos a adalimumab, pero presentaron un riesgo mayor de parto prematuro respecto a las mujeres sanas independientemente de la exposición a adalimumab61,62.
Debido al mayor paso transplacentario en el segundo y tercer trimestre, el tratamiento con anti-TNF durante todo el embarazo podría llevar a una inmunosupresión neonatal con un riesgo aumentado de infecciones, es por ello que la vacunación con vacunas vivas debería evitarse al menos en los 6 primeros meses63 o suspender el tratamiento con adalimumab entre la semana 20-24 de gestación22,47.
Se excreta a través de la leche materna en concentraciones muy bajas y por vía oral, la IgG se somete a proteólisis intestinal y tiene una biodisponibilidad escasa, por lo que puede utilizarse durante la lactancia, ya que los casos notificados no muestran efectos adversos en los niños7.
Un estudio reciente analizó el semen de 14 pacientes expuestos al fármaco, sin influencia en la fertilidad masculina ni daño en su descendencia15, ni efectos relevantes ni negativos sobre la fertilidad64.
EtanerceptExisten varios estudios de cohortes y caso control de más de 300 mujeres embarazadas sin observarse aumento en el riesgo de defectos congénitos importantes47, aunque se ha descrito el caso de un niño con enfermedad de Vater tras el uso de etanercept durante el embarazo65. En 138 mujeres expuestas a etanercept, se produjeron 6 abortos espontáneos y 2 interrupciones (una anomalía cardíaca y un síndrome de Turner), y 130 nacimientos sin patrón de malformaciones93.
Se ha notificado que etanercept se excreta en la leche materna tras la administración subcutánea. En las guías mencionadas anteriormente se sugiere que es compatible con la lactancia22,47. Según una revisión reciente de anti-TNF, etanercept no parece influir en la fertilidad masculina ni dañar su descendencia66.
InfliximabEs un anticuerpo monoclonal IgG1 contra el TNF. En 260 mujeres incluidas en el registro PIANO y expuestas a infliximab durante el embarazo, no se detectó un aumento de anomalías congénitas comparado con un grupo control67. A partir de la semana 30 de gestación, los niveles medios de infliximab permanecen detectables hasta los 6 meses y alcanzan unos niveles del 160% de los de la madre68.
Se excreta en la leche y se recomienda evitar la lactancia durante al menos 6 meses después del tratamiento, aunque en el registro PIANO no se encontró riesgo de infección o retraso en el crecimiento en los niños, cuyas madres estaban en tratamiento con tiopurinas o anti-TNF69 y hay guías que lo consideran compatible.
Una serie discreta de casos describe que infliximab no afecta a la fertilidad masculina ni femenina, no siendo genotóxico ni embriotóxico70, aunque datos in vitro muestran un descenso en la motilidad e integridad del esperma71,72.
CertolizumabEs el fármaco biológico de elección en el embarazo disponiendo de un registro de 1.137 pacientes en los que no se evidencia teratogenicidad o incremento del riesgo de muerte fetal73. Su semivida de eliminación es de 14 días, pero al no disponer de región Fc, no atraviesa la placenta y las guías recomiendan mantener el tratamiento durante todo el embarazo22,47.
Ha demostrado una mínima transferencia del plasma materno a la leche por lo que puede administrarse durante la lactancia74. Y en relación a la fertilidad masculina, datos de un ensayo clínico en 20 varones sanos muestran que certolizumab no presenta efectos negativos en la calidad y resto de propiedades del semen comparado con un placebo15.
AnakinraAnakinra, inhibidor de la IL 1α e IL 1β, a pesar de su detección en el líquido amniótico, en estudios en animales no mostró efectos negativos en el feto incluso a dosis 100 veces superiores a las terapéuticas75. Existen series de casos publicados que describen algún aborto espontáneo y 2 nacimientos con anomalías congénitas76–78. En general, no se recomienda continuar durante el embarazo22,47 y tampoco en lactancia por falta de datos.
AbataceptEn estudios en animales, el abatacept atraviesa la placenta, alcanzando concentraciones fetales de 1,7-2,4 veces más bajas que en suero materno. No ha demostrado teratogenicidad en ratones a dosis hasta 30 veces superiores a las utilizadas en los humanos79. En un estudio reciente en 151 embarazos expuestos a abatacept, se produjeron 86 nacimientos, 40 abortos espontáneos y 19 electivos, habiendo recibido MTX concomitante el 51,3%. Siete de los niños nacidos vivos presentaron anomalías congénitas y de ellos, 3 estuvieron expuestos a otras medicaciones concomitantes teratogénicas como micofenolato y leflunomida80.
TocilizumabTocilizumab es un anticuerpo monoclonal inhibidor de los receptores de IL-6. En las mujeres en tratamiento concomitante con MTX, se observó un alto grado de abortos, pero no de malformaciones congénitas47. Por falta de datos, no se recomienda el uso de tocilizumab durante el embarazo, ni en la lactancia81.
Los datos no clínicos disponibles no sugieren un efecto sobre la fertilidad femenina durante el tratamiento con tocilizumab82 y en relación a la fertilidad masculina, en animales se estudiaron dosis hasta 10 veces superiores a las empleadas en los humanos y no hubo alteraciones. Tampoco se registraron malformaciones congénitas en 22 embarazadas de padres expuestos15.
RituximabEs un anticuerpo monoclonal que se une específicamente al antígeno CD20 de los linfocitos B. No se han determinado los niveles de linfocitos B en recién nacidos de madres expuestas a rituximab, sin embargo, se han notificado depleción transitoria de células B y linfocitopenia en algunos niños nacidos de madres expuestas a rituximab durante el embarazo47.
La exposición previa al embarazo y durante el primer trimestre parece no exponer al feto a un riesgo excesivo83, aunque se han registrado datos de linfopenia transitoria o neutropenia. Durante el segundo y tercer trimestre de embarazo, produce depleción de células B en el feto, que se recupera a lo largo de los 6 primeros meses de vida75. Los estudios revelan un incremento de abortos, se desconoce si relacionados directamente por la exposición al fármaco o la propia enfermedad, pero no de malformaciones congénitas47,83.
Se desconoce si el rituximab se excreta en la leche materna47. Sin embargo, teniendo en cuenta que la IgG materna se excreta en la leche, las mujeres no deben dar el pecho a sus hijos durante el tratamiento con rituximab ni durante los 12 meses siguientes[7].
Los niños expuestos durante el embarazo al tratamiento materno con rituximab mostraron una respuesta normal a la vacunación, sin embargo, debido a los pocos datos disponibles, se recomienda precaución75,84.
UstekinumabAnticuerpo monoclonal IgG1 que inhibe las citoquinas IL-12 e IL-23. Aunque los estudios en animales no muestran efectos dañinos sobre el embarazo, desarrollo embrional/fetal, parto o desarrollo posnatal, no existen datos suficientes sobre la utilización de ustekinumab en las mujeres embarazadas y es preferible evitarlo10,85. Se han notificado 26 casos de mujeres embarazadas expuestas a ustekinumab, detectándose 5 abortos espontáneos (19%), un porcentaje similar al de la población en general86. Otras revisiones consideran a ustekinumab como posiblemente seguro, recomendándolo incluso hasta 8-10 semanas antes del parto25.
VedolizumabAnticuerpo monoclonal que actúa como antagonista de los receptores de integrina a4ß7, que se expresa mayoritariamente en los linfocitos T colaboradores que migran al intestino.
Una serie de casos de 24 mujeres en tratamiento con vedolizumab provocó el nacimiento de 12 bebés vivos, 4 abortos espontáneos, 5 abortos selectivos y una anomalía congénita94. A pesar de que su vida media es 3 veces superior a la del infliximab (25 días), los niveles en recién nacidos fueron inferiores a los maternos en 7 embarazos expuestos al tratamiento87.
En el estudio europeo observacional caso-control retrospectivo CONCEIVE en mujeres con EII embarazadas, 79 expuestas a vedolizumab, frente al grupo control de 186 expuestos a anti-TNF y 184 no expuestos, no se encontraron diferencias significativas en la tasa de aborto espontáneo entre los grupos vedolizumab y anti-TNF, ni entre vedolizumab y no expuestos. En los recién nacidos la media de edad gestacional, el peso y la prematuridad fue similar entre los grupos, incluso la corregida por la actividad de la enfermedad durante el embarazo. Tampoco hubo diferencias en anomalías congénitas, ni se detectaron malignidades al año del nacimiento, aunque probablemente sean necesarios más estudios prospectivos para confirmar estos datos88.
Se ha detectado vedolizumab en la leche materna con un pico menor al 1% de las concentraciones séricas89,95. Por ello se considera seguro, pero se requieren más estudios que evalúen la influencia sobre el sistema inmune de los lactantes25.
SecukinumabSecukinumab es un anticuerpo de tipo IgG1/κ monoclonal, íntegramente humano, que inhibe la IL-17A. No se dispone de datos suficientes sobre el uso de secukinumab en las mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales en el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo posnatal.
Se analizaron los registros que incluían 238 casos de mujeres expuestas y 54 casos con exposición paterna. La mayoría de las pacientes suspendieron el tratamiento con secukinumab en el primer trimestre de embarazo. La tasa de aborto espontáneo fue de 10,3% y hubo 3 casos de anormalidades congénitas, en línea con la tasa en la población en general90.
IxekizumabIxekizumab es un anticuerpo monoclonal de tipo IgG4 que inhibe la IL-17A. Los estudios en animales no sugieren efectos perjudiciales en el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo postnatal. No se dispone de datos suficientes sobre el uso de ixekizumab en las mujeres embarazadas y se recomienda evitar su uso4, aunque al tratarse de un anticuerpo IgG4 se supone que el paso a través de placenta es menor que con otros anticuerpos monoclonales con estructura IgG191.
Se desconoce si ixekizumab se excreta en la leche materna o se absorbe tras la ingestión. Al ser una proteína de gran peso molecular se cree que no se absorbe tras las primeras semanas posparto4,86.
TildrakizumabTildrakizumab es un anticuerpo monoclonal de tipo IgG1/κ humanizado que inhibe la IL-23. Los estudios en animales no sugieren efectos perjudiciales en la reproducción y los datos en las mujeres embarazadas son limitados. En los ensayos clínicos con tildrakizumab de mujeres que se quedaron embarazados no se evidenció un incremento en las tasas de abortos espontáneos ni se notificaron anomalías congénitas92.
Se desconoce si el tildrakizumab se excreta en la leche materna. Tampoco se dispone de datos sobre la respuesta a las vacunas de microorganismos vivos, por lo que se recomienda evitarlos durante el tratamiento ni durante al menos las 17 semanas posteriores85.
DiscusiónLa información sintetizada en esta revisión pretende actualizar la evidencia existente y ser de utilidad para un adecuado consejo a las mujeres y los hombres con deseo gestacional, así como, para tomar la mejor de las decisiones en caso de embarazo accidental.
Son medicamentos teratógenos a evitar durante el embarazo los retinoides, la terapia PUVA, los inhibidores de la COX, tiopurinas, MTX, MMF, la leflunomida y la acitretina. La falta de datos haría desaconsejable el uso de los inhibidores de la JAK, apremilast; mientras que el paracetamol, la hidroxicloroquina y los corticoides serían relativamente seguros. En cambio, un estudio prospectivo reciente (registro PIANO), indica la importancia de controlar la actividad de la enfermedad antes y durante el embarazo con tratamientos libres de corticoides, debido a un riesgo aumentado de parto prematuro e infecciones serias a los 9 y 12 meses tras su uso en el segundo y/o tercer trimestre en pacientes con EII96.
Los anti-TNF se consideran de bajo riesgo en el primer y segundo trimestre del embarazo, siendo el certolizumab el fármaco de elección durante todo el embarazo y la lactancia. Recientemente un metaanálisis en pacientes con EII, encuentra que la actividad de la enfermedad se relaciona con una mayor incidencia de partos prematuros, peso bajo al nacer y pequeños para la edad gestacional. Mientras que el uso de anti-TNF durante el embarazo se asocia con una incidencia mayor de ingreso en cuidados intensivos y bajo peso al nacer97. Finalmente, el resto de los biológicos, por disponer de datos limitados, se deben utilizar con precaución y tras una valoración individualizada de riesgo- beneficio.
Existen limitaciones importantes asociadas a la calidad de los datos disponibles. En general son estudios de bajo poder estadístico; no ajustados por factores confusores, como puede ser la actividad de la enfermedad o el uso de concomitante de FAME; el impacto del embarazo en el curso de la enfermedad; la heterogeneidad de los estudios en cuanto a la variación de la exposición a biológicos, la definición de resultado adverso y el periodo de seguimiento. Todo ello limita la extrapolación de los hallazgos y obliga a considerar estos datos con precaución.
La ausencia de datos consistentes sobre la exposición paterna lleva a no recomendar su uso, pero esto no quiere decir que tengamos datos en contra de su utilización, y en los programas de planificación familiar el consejo gestacional también ha de incluir a los hombres con deseo de ser padres.
Es por ello que sigue siendo necesaria la continua actualización de los datos, así como el promover estudios observacionales de cohortes de pacientes embarazadas y exposición paterna, con el fin de generar más evidencia. Son básicos los registros de madres y padres expuestos a medicamentos, como el registro PIANO, registro del British Association of Dermatologist Biologics Intervention Register, European Psoriasis Registry Network, Psoriasis Longitudinal Assessment and Registry98, para ir generando datos de mayor calidad. Así como las guías y recomendaciones de las sociedades científicas99 que establecen por consenso y basados en la evidencia disponible, recomendaciones de buenas prácticas, como el uso de contracepción para evitar el embarazo no planificado, consejo preconcepcional para planificar el embarazo en periodos de enfermedad estable y mientras se usa medicación compatible con el embarazo, y permitir la decisión compartida con el paciente.
Conflicto de interesesEl trabajo se ha llevado a cabo sin conflicto de intereses.
FinanciaciónEl trabajo se ha llevado a cabo sin financiación.