El micetoma es un tipo de aspergilosis pulmonar consistente en una masa producida por la infección micótica que crece en las cavidades pulmonares. Las guías de referencia recomiendan como primera línea de tratamiento el voriconazol y el itraconazol, posicionando como alternativas al posaconazol, al isavuconazol o a la anfotericina-B1,2.
El voriconazol se puede administrar por las vías oral e intravenosa. En ambos casos está indicado administrar una dosis de carga para alcanzar concentraciones plasmáticas terapéuticas de manera más rápida2.
La monitorización farmacocinética del voriconazol está justificada por una alta variabilidad interindividual en las concentraciones plasmáticas en dosis estándar, un estrecho margen terapéutico, una farmacocinética no lineal por su metabolismo saturable, un elevado riesgo de interacciones con fármacos metabolizados a través del citocromo-P450 y por la presencia en la población de polimorfismos genéticos de las isoformas responsables de su metabolismo (CYP3A4, CYP2C9, CYP2C19). Dentro de estas, el CYP2C19 lleva a cabo la mayor parte de reacciones3.
Descripción del casoSe presenta el caso de una paciente mujer de 32 años, de 153 cm y 45 kg de peso, diagnosticada de vasculitis y en seguimiento por neumología por una lesión cavitada en el lóbulo superior del pulmón derecho; que acude a urgencias de un hospital de tercer nivel ante el empeoramiento de su tos habitual y la aparición de expectoración hemoptoica, sin fiebre ni otra sintomatología acompañante. A su llegada al centro, destaca la presencia de sibilancias espiratorias difusas, por lo que ingresa en el Servicio de Neumología.
El segundo día del ingreso se realiza una fibrobroncoscopia, mediante la que se confirma que las secreciones purulentas proceden del bronquio-B2 derecho; y una angiotomografía computarizada de tórax, que revela una disminución de la lesión cavitada respecto al estudio previo, una hipertrofia de las arterias bronquiales derecha, torácica lateral derecha, y probablemente también de las pulmonares. El cuarto día de ingreso se detecta el antígeno galactomanano en una muestra de lavado broncoalveolar. Finalmente, se diagnostica de aspergilosis pulmonar invasiva y la progresión de la vasculitis, decidiéndose iniciar el tratamiento con voriconazol y se solicita al Servicio de Farmacia la monitorización farmacocinética.
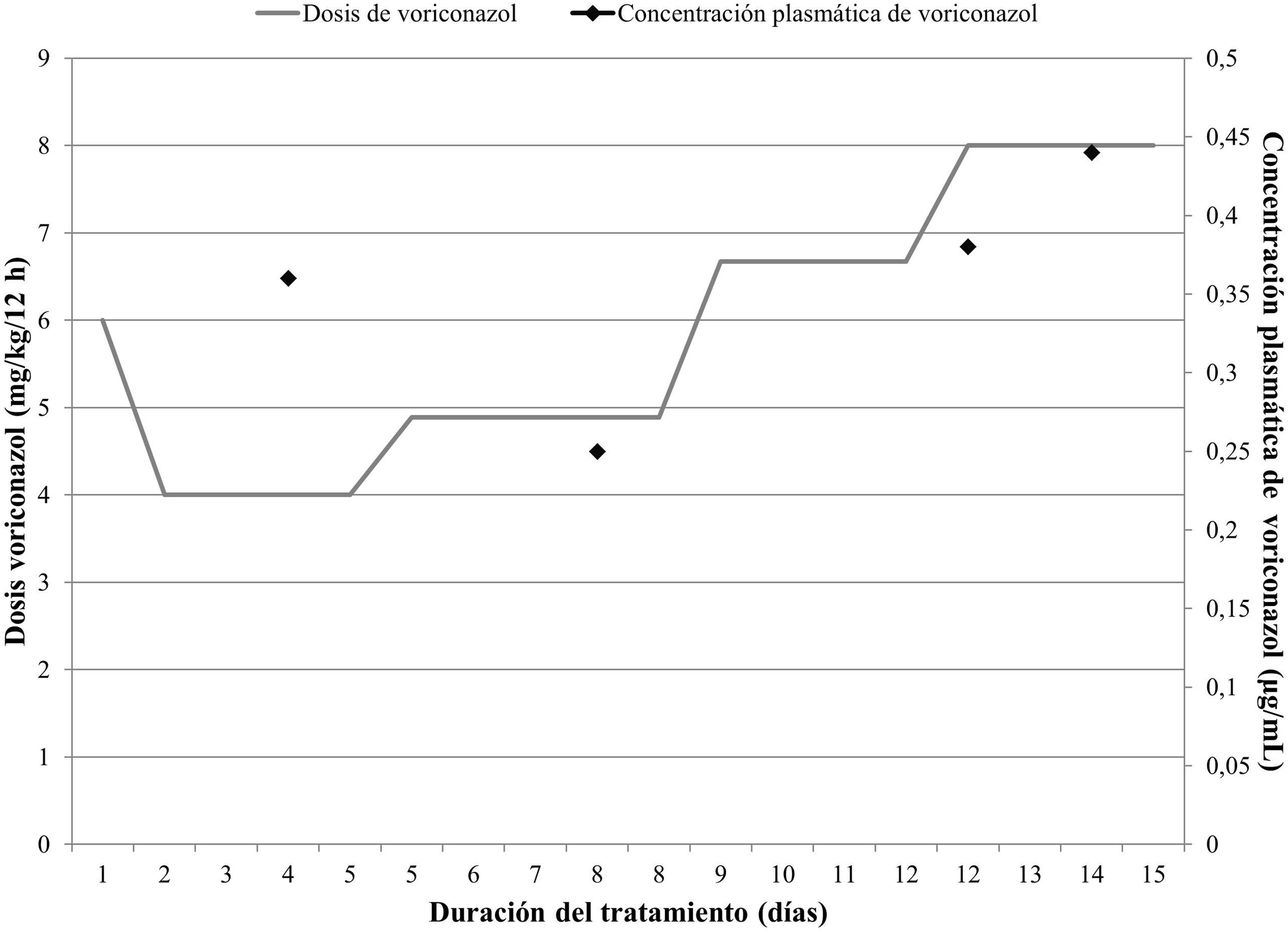
El tratamiento con voriconazol se inicia por vía intravenosa con una dosis de carga de 6 mg/kg/12 h durante el primer día, y dosis de mantenimiento de 4 mg/kg/12 h a partir del segundo día. La monitorización farmacocinética se realiza a partir de determinaciones del nivel valle del fármaco 48 horas tras la primera dosis, con un intervalo objetivo establecido entre uno y 5 μg/mL4. El primer nivel obtenido, determinado por enzimoinmunoensayo homogéneo (Cobas-Integra-400 [Roche®]), fue inferior a 1 μg/mL (por tanto, infraterapéutico). La monitorización se realizó mediante el modelo farmacocinético poblacional empleando el software Abbottbase-Pharmacokinetic-System (PKS)5. Con base en las estimaciones realizadas, se propuso aumentar la dosis a 4,89 mg/kg/12 h (+ 22,25%) manteniendo el intervalo de dosificación, y dada la gravedad clínica, monitorizar transcurridos 3 días, para cuando se estimaban concentraciones terapéuticas. La determinación fue nuevamente inferior al objetivo, por lo que se incrementó la dosis a 6,67 mg/kg/12 h (+36,40%). Tras un nuevo nivel infraterapéutico, se propuso otro incremento de la dosis a 8 mg/kg/12 h (+19,94%), el doble de la recomendada1,2. El fármaco se monitorizó durante 2 semanas, en las que el peso de la paciente no varió. La evolución de las dosis y las lecturas de concentración se muestran en la figura 1.
Para explicar la dificultad para alcanzar las concentraciones terapéuticas, fueron planteadas varias hipótesis. En primer lugar, se descartaron incidencias preanalíticas y analíticas, confirmando los resultados por cromatografía líquida/tándem masas (LC-MS/MS) en el laboratorio de referencia (Reference Laboratory). Asimismo, se revisó el tratamiento de la paciente para descartar concomitancia con inductores del CYP2C19 que pudieran acelerar el metabolismo del voriconazol.
Paralelamente, se planteó la posibilidad de que la paciente presentase un fenotipo metabolizador rápido o ultrarrápido del voriconazol, por lo que se solicitó el genotipado del CYP2C19 a la Unidad de Genética del Servicio de Análisis Clínicos del hospital. Se diseñaron primers para detectar las variantes alélicas del CYP2C19 más frecuentes en la población europea6 (tabla 1).
Relación fenotipo/genotipo CYP2C19
| Fenotipo CYP2C19 | Genotipo | CYP2C19 diplotipos |
|---|---|---|
| Metabolizador ultrarrápido(2-5% pacientes) | Individuo portador de 2 alelos con función incrementada (*17) | *17/*17 |
| Metabolizador rápido(2-30% pacientes) | Individuo portador de un alelo de función normal (*1) y otro de función incrementada | *1/*17 |
| Metabolizador normal(35-50% pacientes) | Individuo portador de 2 alelos de función normal (*1) | *1/*1 |
| Metabolizador intermedio(18-45% pacientes) | Individuo portador de un alelo de función normal (1*) y otro de no funcionante (*2, *3); individuo portador de un alelo no funcionante (*2, *3) y otro con actividad incrementada (*17) | *1/*2, *1/*3, *2/*17 |
| Metabolizador pobre(2-15% pacientes) | Individuo portador de 2 alelos no funcionantes (*2, *3) | *2/*2,*2/*3, *3/*3 |
CYP2C19: citocromo P450 2C19.
Ante la imposibilidad de conseguir niveles terapéuticos con voriconazol, y en espera del resultado del estudio genético, se decidió cambiar de antifúngico a isavuconazol, que presenta menos interacciones y se metaboliza por una ruta metabólica que no involucra al CYP2C196,7.
Los resultados del estudio genético revelaron que la paciente presentaba el genotipo *1/*17. Según la guía del Clinical-Pharmacogenetics-Implementation-Consortium (CPIC)6 para el CYP2C19 y voriconazol, el fenotipo de esta paciente era de metabolizadora rápida, ya que presentaba un alelo de función normal (*1) y otro de función incrementada (*17) (tabla 1).
DiscusiónEn metabolizadores rápidos, la probabilidad de alcanzar concentraciones terapéuticas con dosis estándar de voriconazol es variable. En estos casos se recomienda sustituir voriconazol por otro antifúngico con metabolismo independiente del CYP2C19. Aunque la frecuencia de metabolizadores rápidos en la población no es desdeñable (2-30% de caucásicos), el genotipado es poco frecuente en la práctica y hay pocos casos descritos en la bibliografía.
Existen publicaciones que recomiendan el genotipado y emplear un antifúngico alternativo en los pacientes que mantengan las concentraciones infraterapéuticas pese a 2 ajustes de dosis mediante la monitorización farmacocinética4,8.
La monitorización terapéutica de triazoles como voriconazol, itraconazol y posaconazol puede mejorar la eficacia, detectar fracasos terapéuticos atribuibles a las concentraciones subterapéuticas y minimizar el riesgo de toxicidad2.
El isavuconazol, pese a poseer un perfil farmacocinético y de seguridad favorable, cuenta con pocos estudios que relacionen las concentraciones plasmáticas con la eficacia y la seguridad. Parece que sus concentraciones plasmáticas están sujetas a menos variabilidad que las del voriconazol, y presenta un mejor perfil de seguridad con una menor incidencia de hepatotoxicidad9. No obstante, si bien la monitorización del isavuconazol en los tratamientos cortos podría no ser necesaria10, se carece de información sobre este tema en tratamientos superiores a 2 meses.
ConclusionesEl genotipado del CYP2C19 podría predecir la respuesta terapéutica a voriconazol, pero actualmente no se recomienda como actividad rutinaria ni ofrece resultados inmediatos. No obstante, fue la prueba que confirmó la necesidad de cambiar de tratamiento antifúngico, que había sido detectada de forma precoz a través de la monitorización farmacocinética.
Aportación al conocimiento previoSe presenta para la valoración de su publicación, un caso clínico de monitorización farmacocinética y estudio farmacogenético de voriconazol en el contexto del tratamiento de una infección fúngica invasiva en una paciente inmunodeprimida. El número de publicaciones relacionadas con la farmacogenética de voriconazol es limitado debido a la relativamente baja prevalencia de fenotipos metabolizadores rápidos, careciendo de publicaciones con un número significativo de pacientes, poniendo de manifiesto la necesidad de realizar estudios multicéntricos.
El genotipado del citocromo P450 2C19 no se realiza de forma rutinaria ni está implantado en muchos hospitales. Este es el caso de nuestro centro, un hospital de tercer nivel, donde el caso que se presenta dio lugar al desarrollo de la técnica y a la resolución de la incógnita que explicase porqué el tratamiento con voriconazol no lograba alcanzar dosis terapéuticas pese a los incrementos de dosis.
Además, el caso clínico pone de manifiesto no solo la necesidad de realizar la monitorización farmacocinética en los pacientes tratados con voriconazol, sino cómo el manejo multidisciplinar, en este caso mediante la colaboración de los servicios de farmacia, análisis clínicos y neumología, permitió resolver una pregunta clínica.
Aportación a la literatura científicaCaso clínico de seguimiento terapéutico de voriconazol mediante el estudio farmacocinético y farmacogenético.
Se justifican estos estudios como parte de los protocolos de seguimiento de tratamientos con voriconazol.
Consideraciones éticasEl trabajo que se presenta no ha sido publicado previamente, ni se encuentra en proceso de revisión en ninguna otra revista.
Se han tenido en cuenta las instrucciones para el envío de manuscritos y las responsabilidades éticas (todos los autores firmantes cumplen los requisitos de autoría y todos declaran no poseer conflicto de intereses).
Declaración de autoríaLos autores firmantes han contribuido a la elaboración del artículo en cuanto a la concepción y diseño del caso clínico descrito. Jorge Esquivel Negrín se ha encargado de la escritura del artículo. Asimismo, Enrique Tévar Alonso, Ruth López Travieso, Jesús Rodríguez González, Javier Merino Alonso y Andrea Santos Fagundo han realizado una revisión crítica del artículo con importantes contribuciones intelectuales. Los 6 autores firmantes han aprobado la versión final de cara a su publicación. La recogida de datos ha corrido de la cuenta de Jorge Esquivel Negrín, Enrique Tévar Alfonso, Ruth López Travieso y Jesús Rodríguez González.
FinanciaciónSin financiación.
Conflicto de interesesSe adjunta la declaración de los posibles conflictos de intereses de cada una de las personas firmantes.