la presencia de partículas metálicas en los parches transdérmicos de medicamentos se ha asociado con riesgo de quemaduras en la piel cuando a los pacientes se les realiza una resonancia magnética, cardioversión eléctrica o desfibrilación.
Por este motivo, el objetivo del trabajo fue analizar la presencia de partículas metálicas en los parches transdérmicos de medicamentos comercializados en España.
Métodode cada presentación comercial se revisó la ficha técnica para comprobar la presencia de estas partículas en su composición. Si no constaba, entonces se contactó con el laboratorio fabricante.
Resultadosse identificaron 59 presentaciones comerciales de 12 principios activos diferentes. Un 59,3% contenía partículas metálicas o la presencia de las mismas no se pudo descartar. Únicamente en 8 fichas técnicas (13,6%) constaba la advertencia de retirar el parche cuando el paciente recibe alguno de estos procedimientos.
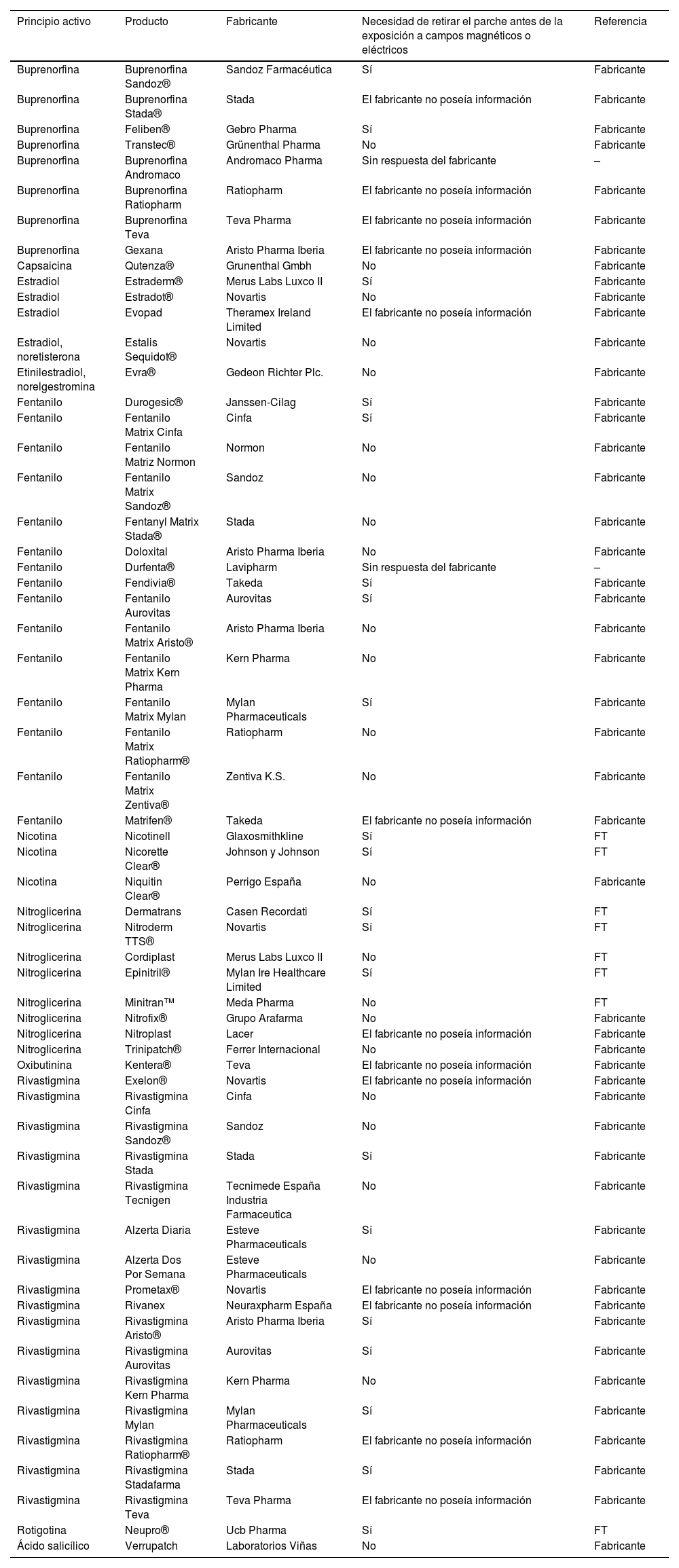
Se elaboró una tabla que incluyó los siguientes aspectos: principio activo, presentación comercial, laboratorio fabricante, necesidad de retirar el parche cuando el paciente es expuesto a un campo magnético o eléctrico y referencias.
Conclusiónmás de la mitad de los parches comercializados contenían compuestos metálicos o su presencia no pudo descartarse por el laboratorio fabricante. Sin embargo, esta información solo constaba en un 13,6% de las fichas técnicas.
Skin burns are associated with the presence of metallic components in transdermal drug delivery systems during Magnetic Resonance Imaging, cardioversion or defibrillation procedures.
The aim of the study was to review the presence of metallic components in marketed products of transdermal drug delivery systems in Spain.
MethodFor each presentation, the summary of product characteristics was reviewed. If the information was not provided, manufacturers were contacted.
ResultsWe identified 59 marketed products of transdermal drug delivery systems of 12 different active substances.
59.3% of patches contained metallic components or their presence could not be ruled out. Information regarding the need to remove the patch was only included in 8 summaries of product characteristics (13.6%).
A table was elaborated and included the following aspects: product, active substance, manufacturer, need to remove the patch before the exposure to magnetic or electric fields and references.
ConclusionMore than a half of the patches at the time of the study contained metals or their absence could not be confirmed by the manufacturer. However, this information was only included in 13.6% of summaries of product characteristics.
En 2009, la agencia estadounidense del medicamento, la FDA, alertó sobre posibles quemaduras cutáneas provocadas por parches transdérmicos que contienen componentes metálicos y permanecen colocados en la piel del paciente durante procedimientos de Resonancia Magnética (RM), cardioversión o desfibrilación1. Se notificaron 2 acontecimientos adversos debidos a que pacientes con parches transdérmicos de nicotina sufrieron quemaduras durante una RM2.
Los parches transdérmicos con componentes metálicos pueden conducir la electricidad, y durante los procedimientos citados, aquellos formulados con una capa de aluminio podrían causar lesiones al paciente. Los sistemas de RM requieren el uso de pulsos de radiofrecuencia (RF) para crear la señal de RM. Cuando existen materiales conductores, como la lámina protectora aluminizada, dentro del campo de RF, pueden generarse corrientes eléctricas lo suficientemente intensas como para causar un calentamiento excesivo y daños tisulares3,4.
A pesar de la importancia de este riesgo, el etiquetado en el envase de los parches transdérmicos suele carecer de información sobre la existencia de materiales conductores.
Por esta razón, el objetivo de este estudio fue revisar la presencia de componentes metálicos en los parches transdérmicos disponibles comercialmente en España.
MétodosEn diciembre de 2022, se identificaron todos los productos de parches transdérmicos comercializados en España mediante la base de datos de la Agencia Española de Medicamentos y Productos Sanitarios (https://cima.aemps.es/cima/publico/home.html).
Por cada producto, 2 farmacéuticos clínicos de un hospital terciario revisaron la ficha técnica del producto para confirmar si detallaba la necesidad de retirar el parche durante una RM u otros procedimientos. Esta información suele especificarse como «el parche debe retirarse antes de la exposición a campos magnéticos o eléctricos» en la sección «4.4 Advertencias y precauciones especiales de empleo». Si no se especificaba, el siguiente paso era comprobar la sección «6.1 Lista de excipientes» para confirmar la presencia de componentes metálicos. Si no se incluían o solo se indicaban en el protector desprendible, se contactó con los fabricantes por correo electrónico para solicitarles que confirmasen si el producto contenía metales que pudieran causar quemaduras dérmicas en la RM u otros procedimientos. En los casos en los que no se obtuvo respuesta transcurrido un mes, se envió un segundo correo de seguimiento. Si no se recibió respuesta al segundo correo, la información se registró como «sin respuesta del fabricante».
Esta investigación no involucró a participantes humanos y, por tanto, no fue necesario solicitar la aprobación ética.
ResultadosSe identificaron 59 productos que administraban 12 sustancias activas diferentes mediante sistemas transdérmicos en España.
Solo 8 fichas técnicas (13,6%) incluían información sobre la necesidad de retirar el parche antes de una RM u otros procedimientos.
El 59,3% de los parches, o bien contenían componentes metálicos, o bien el fabricante no pudo confirmar su ausencia (33,9 y 25,4%, respectivamente) (tabla 1).
Recomendaciones relativas al uso de parches transdérmicos antes de la exposición a campos magnéticos o eléctricos
| Principio activo | Producto | Fabricante | Necesidad de retirar el parche antes de la exposición a campos magnéticos o eléctricos | Referencia |
|---|---|---|---|---|
| Buprenorfina | Buprenorfina Sandoz® | Sandoz Farmacéutica | Sí | Fabricante |
| Buprenorfina | Buprenorfina Stada® | Stada | El fabricante no poseía información | Fabricante |
| Buprenorfina | Feliben® | Gebro Pharma | Sí | Fabricante |
| Buprenorfina | Transtec® | Grünenthal Pharma | No | Fabricante |
| Buprenorfina | Buprenorfina Andromaco | Andromaco Pharma | Sin respuesta del fabricante | – |
| Buprenorfina | Buprenorfina Ratiopharm | Ratiopharm | El fabricante no poseía información | Fabricante |
| Buprenorfina | Buprenorfina Teva | Teva Pharma | El fabricante no poseía información | Fabricante |
| Buprenorfina | Gexana | Aristo Pharma Iberia | El fabricante no poseía información | Fabricante |
| Capsaicina | Qutenza® | Grunenthal Gmbh | No | Fabricante |
| Estradiol | Estraderm® | Merus Labs Luxco II | Sí | Fabricante |
| Estradiol | Estradot® | Novartis | No | Fabricante |
| Estradiol | Evopad | Theramex Ireland Limited | El fabricante no poseía información | Fabricante |
| Estradiol, noretisterona | Estalis Sequidot® | Novartis | No | Fabricante |
| Etinilestradiol, norelgestromina | Evra® | Gedeon Richter Plc. | No | Fabricante |
| Fentanilo | Durogesic® | Janssen-Cilag | Sí | Fabricante |
| Fentanilo | Fentanilo Matrix Cinfa | Cinfa | Sí | Fabricante |
| Fentanilo | Fentanilo Matriz Normon | Normon | No | Fabricante |
| Fentanilo | Fentanilo Matrix Sandoz® | Sandoz | No | Fabricante |
| Fentanilo | Fentanyl Matrix Stada® | Stada | No | Fabricante |
| Fentanilo | Doloxital | Aristo Pharma Iberia | No | Fabricante |
| Fentanilo | Durfenta® | Lavipharm | Sin respuesta del fabricante | – |
| Fentanilo | Fendivia® | Takeda | Sí | Fabricante |
| Fentanilo | Fentanilo Aurovitas | Aurovitas | Sí | Fabricante |
| Fentanilo | Fentanilo Matrix Aristo® | Aristo Pharma Iberia | No | Fabricante |
| Fentanilo | Fentanilo Matrix Kern Pharma | Kern Pharma | No | Fabricante |
| Fentanilo | Fentanilo Matrix Mylan | Mylan Pharmaceuticals | Sí | Fabricante |
| Fentanilo | Fentanilo Matrix Ratiopharm® | Ratiopharm | No | Fabricante |
| Fentanilo | Fentanilo Matrix Zentiva® | Zentiva K.S. | No | Fabricante |
| Fentanilo | Matrifen® | Takeda | El fabricante no poseía información | Fabricante |
| Nicotina | Nicotinell | Glaxosmithkline | Sí | FT |
| Nicotina | Nicorette Clear® | Johnson y Johnson | Sí | FT |
| Nicotina | Niquitin Clear® | Perrigo España | No | Fabricante |
| Nitroglicerina | Dermatrans | Casen Recordati | Sí | FT |
| Nitroglicerina | Nitroderm TTS® | Novartis | Sí | FT |
| Nitroglicerina | Cordiplast | Merus Labs Luxco II | No | FT |
| Nitroglicerina | Epinitril® | Mylan Ire Healthcare Limited | Sí | FT |
| Nitroglicerina | Minitran™ | Meda Pharma | No | FT |
| Nitroglicerina | Nitrofix® | Grupo Arafarma | No | Fabricante |
| Nitroglicerina | Nitroplast | Lacer | El fabricante no poseía información | Fabricante |
| Nitroglicerina | Trinipatch® | Ferrer Internacional | No | Fabricante |
| Oxibutinina | Kentera® | Teva | El fabricante no poseía información | Fabricante |
| Rivastigmina | Exelon® | Novartis | El fabricante no poseía información | Fabricante |
| Rivastigmina | Rivastigmina Cinfa | Cinfa | No | Fabricante |
| Rivastigmina | Rivastigmina Sandoz® | Sandoz | No | Fabricante |
| Rivastigmina | Rivastigmina Stada | Stada | Sí | Fabricante |
| Rivastigmina | Rivastigmina Tecnigen | Tecnimede España Industria Farmaceutica | No | Fabricante |
| Rivastigmina | Alzerta Diaria | Esteve Pharmaceuticals | Sí | Fabricante |
| Rivastigmina | Alzerta Dos Por Semana | Esteve Pharmaceuticals | No | Fabricante |
| Rivastigmina | Prometax® | Novartis | El fabricante no poseía información | Fabricante |
| Rivastigmina | Rivanex | Neuraxpharm España | El fabricante no poseía información | Fabricante |
| Rivastigmina | Rivastigmina Aristo® | Aristo Pharma Iberia | Sí | Fabricante |
| Rivastigmina | Rivastigmina Aurovitas | Aurovitas | Sí | Fabricante |
| Rivastigmina | Rivastigmina Kern Pharma | Kern Pharma | No | Fabricante |
| Rivastigmina | Rivastigmina Mylan | Mylan Pharmaceuticals | Sí | Fabricante |
| Rivastigmina | Rivastigmina Ratiopharm® | Ratiopharm | El fabricante no poseía información | Fabricante |
| Rivastigmina | Rivastigmina Stadafarma | Stada | Sí | Fabricante |
| Rivastigmina | Rivastigmina Teva | Teva Pharma | El fabricante no poseía información | Fabricante |
| Rotigotina | Neupro® | Ucb Pharma | Sí | FT |
| Ácido salicílico | Verrupatch | Laboratorios Viñas | No | Fabricante |
FT: Ficha técnica del producto.
Se elaboró una tabla que incluía la siguiente información: principio activo, producto, fabricante, necesidad de retirar el parche antes de la exposición a campos magnéticos o eléctricos y referencias (tabla 1).
DiscusiónHasta donde sabemos, este ha sido el primer estudio que ha analizado la presencia de componentes metálicos en sistemas de liberación transdérmica de fármacos comercializados en España. Algunos autores han advertido sobre el riesgo de quemaduras cutáneas graves asociadas al uso de parches transdérmicos, pero en ningún caso se ha realizado una revisión detallada de la composición de los mismos3,4.
Son varios los problemas de seguridad relacionados con el uso de parches transdérmicos, tales como errores en la frecuencia de aplicación o sobredosificación provocada por cortar el parche5,6. Sin embargo, no es tan conocida la necesidad de retirar los parches transdérmicos que contengan componentes metálicos para evitar quemaduras en la piel antes de ciertos procedimientos diagnósticos. Por estos motivos, es de suma importancia que los pacientes y los profesionales sanitarios sean conscientes de esta precaución. En este sentido, los servicios de radiología, cardiología y urgencias deberían elaborar recomendaciones de seguridad sobre el uso de parches en pacientes que se realizan una RM, cardioversión o desfibrilación. En nuestro centro, la información obtenida en este trabajo ha servido para actualizar los protocolos de manejo y, en la actualidad, todos los pacientes son advertidos de la necesidad de retirar los parches con componentes metálicos antes del procedimiento. De igual manera, pensamos que los datos recopilados pueden ser útiles en otros entornos sanitarios y así evitar daños a los pacientes.
Resulta sorprendente que solo el 13,6% de las fichas técnicas analizadas incluyan la precaución de retirar el parche antes de una RM, cuando más de la mitad de los productos contenían componentes metálicos o no podía confirmarse su ausencia. En nuestra opinión, la ficha técnica de todos los parches transdérmicos autorizados por una agencia reguladora debería incluir dicha precaución. El documento publicado por la EMA sobre las directrices para fichas técnicas del producto establece que el contenido de la sección «4.4 Advertencias y precauciones especiales de empleo» debe incluir información relativa a un riesgo específico cuando dicho riesgo conlleve una precaución de uso o cuando los profesionales sanitarios tengan que ser advertidos del mismo. En nuestro caso, se trata del riesgo de quemaduras cutáneas en pacientes que se realizan una RM u otros procedimientos7. Es más, en la sección 6.1 deberían mencionarse todos los ingredientes del parche (incluidos el adhesivo, el protector desprendible y la capa de refuerzo). Sin embargo, encontramos varios casos (por ejemplo, la Buprenorfina Sandoz®) en los que la ficha técnica no mencionaba la existencia de componentes aluminizados, pero el fabricante confirmó que contenía aluminio.
La principal limitación de este estudio es que el análisis se realizó para parches transdérmicos comercializados en el momento del estudio.
ConclusionesMás de la mitad de los parches transdérmicos disponibles en el momento del estudio contenían metales, o no pudo confirmarse su ausencia con el fabricante. Sin embargo, esta información y el correspondiente aviso de riesgo solo se incluía en el 13,6% de las fichas técnicas.
Contribución a la literatura científicaLas quemaduras cutáneas durante procedimientos de RM, cardioversión o desfibrilación se asocian a la existencia de componentes metálicos en los parches transdérmicos.
Hasta donde sabemos, este es el primer estudio que analiza la presencia de metales en los parches transdérmicos comercializados en España.
La información sobre la necesidad de retirar el parche antes de una RM u otros procedimientos solo se incluyó en el 13,6% de las fichas técnicas.
Creemos que esta revisión puede ser de utilidad para otros centros sanitarios ya que incluye recomendaciones prácticas sobre cómo prevenir quemaduras en pacientes con parches transdérmicos que se realizan alguno de estos procedimientos.
FinanciaciónNinguna.
Declaración de contribución de autoría CRediTAna de Lorenzo-Pinto: Conceptualization, Data curation, Formal analysis, Methodology, Validation, Writing – original draft, Writing – review & editing. Carmen Redondo-Galán: Data curation, Formal analysis, Investigation, Methodology, Supervision, Writing – original draft. Xandra García-González: Conceptualization, Data curation, Supervision, Validation, Writing – original draft. Carmen Fernández- Álvarez: Investigation, Supervision, Validation. Juan Andueza-Lillo: Supervision, Validation. María Sanjurjo-Sáez: Supervision, Validation.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.