describir el coste marginal y la supervivencia de los pacientes tratados con tocilizumab en un hospital universitario en condiciones de vida real y evaluar los factores que podrían influir en los costes y los resultados en la salud.
Metodologíaestudio observacional, retrospectivo y unicéntrico de una cohorte de pacientes adultos infectados con SARS-CoV-2 tratados con tocilizumab. Se analizó, en años de vida ganados (AVG), la media de supervivencia restringida a un año. Se evaluó la influencia del sexo, la edad y la gravedad en la supervivencia de los pacientes. Se calcularon el ratio, el coste marginal/AVG y coste marginal/superviviente.
Resultadosse incluyeron 508 pacientes (66 ± 13 años; 32% mujeres). Un 17% ingresó en la UCI. La supervivencia global fue del 77%. Se identificaron como factores de riesgo la edad mayor de 71,5 años (HR=1,08; IC 95% 1,07–1,10; p < 0,001), y el ingreso en la UCI al iniciar el tratamiento (HR=2,01; IC 95% 1,30–3,09; p = 0,002). El impacto presupuestario total de tocilizumab en el periodo analizado ascendió a 206.466 €. Los pacientes con mayor coste por unidad de resultado en salud son los pacientes ingresados en la UCI y mayores de 71,5 años, que presentan un coste marginal/AVG de 966 € y un coste marginal/superviviente de 1.136 €.
Conclusiónla eficiencia del tratamiento con tocilizumab se asocia a la edad y a la gravedad de los pacientes. Las cifras son inferiores en todos los subgrupos a los umbrales habitualmente utilizados en las evaluaciones coste-efectividad. Los resultados del presente estudio sugieren que el inicio precoz de tocilizumab es una estrategia eficiente.
To describe the marginal cost and survival of patients treated with tocilizumab in a university hospital under real-life conditions and to evaluate factors that could influence costs and health outcomes will be evaluated.
MethodsObservational, single-center, retrospective study of a cohort of adult patients infected with SARS-CoV-2 treated with tocilizumab. The one-year restricted mean survival time was analyzed in life-years gained (LYG). The influence of sex, age and severity on patient survival was evaluated. The marginal cost/LYG and marginal cost/survivor ratios were calculated.
Results508 patients (66 ± 13 years; 32% women) were included. Seventeen percent were admitted to the ICU. Overall survival was 77%. Age older than 71.5 years (HR = 1.08; 95% CI 1.07-1.10; p < 0.001) and ICU admission at initiation of treatment (HR = 2.01; 95% CI 1.30-3.09; p = 0.002) were identified as risk factors. The total budgetary impact of tocilizumab in the period analyzed was 206,466 euros. The patients with the highest cost per unit of health outcome were those admitted to the ICU and those over 71.5 years, with a marginal cost/LYG of € 966 and a marginal cost/survivor of € 1,136.
ConclusionThe efficiency of treatment with tocilizumab is associated with the age and severity of the patients. The figures are lower in all subgroups than the thresholds usually used in cost-effectiveness evaluations. The results of the present study suggest that early first dose of tocilizumab is an efficient strategy.
La enfermedad causada por el SARS-CoV-2 cursa con diversas manifestaciones y fases clínicas (fase vírica, pulmonar e inmunológica)1, El tratamiento farmacológico se basa en el uso de fármacos antivirales, inmunomoduladores y otros para combatir las complicaciones asociadas. Durante la fase vírica el objetivo terapéutico se centra en disminuir la carga vírica. El fármaco con propiedades antivirales más utilizado es remdesivir. No obstante, la evidencia en cuanto su utilización es modesta, mostrando una reducción limitada2 en el tiempo de recuperación de los pacientes hospitalizados.
Tras la fase vírica se observa un estado de hiperinflamación sistémica que puede acompañarse de un síndrome de liberación de citoquinas en los pacientes más graves, con elevación de numerosas citoquinas como IL-6, IP10, MCP1, TNF-α, IL-2R y la IL-103,4. Durante este estado inflamatorio se produce la desregulación de monocitos, macrófagos y células dendríticas que provoca la acumulación de infiltrados de macrófagos a nivel pulmonar y provoca un síndrome hemofagocítico5. La utilización de corticoides sistémicos como la dexametasona han demostrado disminuir la mortalidad en los pacientes críticos6. La IL-6 parece tener un papel importante en la regulación de la respuesta inmune en los pacientes con COVID. La elevada concentración de IL-6 observada en los pacientes graves convierte sus antagonistas farmacológicos en potenciales candidatos al tratamiento de esta fase de la enfermedad. No obstante, la respuesta inflamatoria es compleja y multifactorial. Intervienen otras vías de señalización como la vía JAK1/2-STAT que participa en el proceso de activación macrofágica hacia el perfil M2 tras la activación del IL-4R7. Esto genera otra nueva diana terapéutica para inhibidores JAK1/2 como el baricitinib en la fase inflamatoria de los pacientes COVID. Otros fármacos inmunomoduladores han sido utilizados durante el transcurso de la pandemia como el ruxolitinib, anakinra y colquicina8,9.
Tocilizumab es un anticuerpo monoclonal humanizado que se une al receptor de IL-6 (IL6-R), tanto receptor soluble como unido a membranas, con indicación en artritis reumatoide y artritis juvenil idiopática. Las dosis habituales utilizadas en artritis reumatoide son 4 mg/kg u 8 mg/kg vía intravenosa cada 4 semanas. También existe presentación subcutánea de 162 mg que se administra semanalmente10. Dado el carácter pleiotrópico de IL-6R y su rol central en el control de la inflamación se utiliza como tratamiento en el síndrome de liberación de citoquinas que se produce tras la administración de la terapia CAR-T. Las similitudes entre este cuadro clínico y el causado por el SARS-CoV-2 han propuesto a tocilizumab como potencial agente terapéutico11. No obstante, los estudios publicados son inconsistentes y generan dudas sobre la efectividad de tocilizumab. La supervivencia en los pacientes con enfermedad moderada no mejoró con la administración de tocilizumab12,13. Sin embargo, en los pacientes críticos el bloqueo de IL-6R con tocilizumab (o sarilumab) mejoró la supervivencia, demostrando un claro beneficio clínico en estos pacientes14.
La pandemia del COVID-19 tiene gran repercusión en los sistemas sanitarios y es necesaria la evaluación del impacto económico de las estrategias terapéuticas15. Los principales costes de la hospitalización son los gastos en pruebas diagnósticas, tanto de laboratorio como de imagen y el gasto en medicamentos16. Por este motivo es importante realizar un análisis económico del coste de las opciones terapéuticas que se utilizan en la práctica clínica habitual.
El objetivo principal de este trabajo es describir los costes marginales y la supervivencia de los pacientes tratados con tocilizumab en un hospital universitario en condiciones de la vida real y evaluar los factores que podrían influir en los costes y los resultados en la salud.
MétodosEstudio observacional retrospectivo y unicéntrico en una cohorte de pacientes hospitalizados con COVID-19 que recibieron al menos una dosis de tocilizumab durante el periodo de estudio comprendido desde febrero de 2020 hasta febrero de 2021.
Los criterios de inclusión fueron: pacientes mayores de 18 años con diagnóstico confirmado de infección por SARS-CoV-2 por PCR o test de antígenos o evidencia clínica de neumonía COVID-19 e ingreso en unidades de hospitalización. Los pacientes se estratificaron en función de la gravedad en: pacientes críticos (UCI: hospitalización en unidad de pacientes críticos) y pacientes no críticos (hospitalización convencional en unidades médicas [UH]). La clasificación se realizó en el momento de la primera administración de tocilizumab. Se excluyeron los pacientes que recibieron tocilizumab en este periodo para indicaciones reumatológicas o hematológicas. Las dosis utilizadas de tocilizumab fueron 400 mg para los pacientes con peso menor de 75 kg y 600 mg en pacientes con peso mayor de 75 mg en dosis única, aunque se permitió la administración de dosis sucesivas si la situación clínica lo requería. No se estableció un número máximo de dosis de tocilizumab. Se realizó una dispensación y registro individualizado de tocilizumab.
Se evaluó la supervivencia desde la administración de la primera dosis de tocilizumab hasta el final del seguimiento o el fallecimiento por COVID-19. El paciente fallecido por una causa no vinculada al evento de interés se consideró como censurado. Cuando los tiempos de supervivencia no se conocían con exactitud o no se había producido el evento, los datos se consideraron también como censurados. La supervivencia se analizó mediante el método de Kaplan-Meier y la media de supervivencia restringida a un año. Se realizó un análisis de regresión de COX para identificar posibles factores de riesgo asociados a la supervivencia: edad, sexo y área de hospitalización (UCI/UH). Para la categorización de la variable edad se construyó previamente una curva ROC que permitió identificar el punto de corte con mayor sensibilidad y especificidad mediante la aplicación del índice de Youden. Para el análisis estadístico se utilizó el software SPSS®.
El análisis de costes se realizó desde la perspectiva del financiador, considerando exclusivamente como coste marginal el coste de adquisición de tocilizumab, en euros. Dependiendo de la disponibilidad de las diferentes presentaciones, los viales de tocilizumab que se emplearon fueron de 80, 200 y 400 mg con un coste de 114 €, 285 € y 573 €, respectivamente. No se aplicó tasa de descuento, por tratarse de un horizonte temporal restringido.
Los años de vida ganados (AVG) se calcularon como producto de la media de supervivencia restringida multiplicado por el número de pacientes en cada subgrupo analizado.
El número de supervivientes se calculó como producto de la probabilidad de supervivencia al final del estudio multiplicado por el número de pacientes en cada subgrupo analizado.
Como aproximación a la evaluación de la eficiencia se calcularon el ratio coste marginal/AVG y el ratio coste marginal/superviviente.
ResultadosSe identificaron 508 pacientes que cumplían criterios de inclusión del estudio. La media de edad fue de 66 ± 13 años; un 32% eran mujeres. Se clasificaron como pacientes críticos en el momento de la primera administración de tocilizumab 87 pacientes (17%). La supervivencia global registrada en el conjunto de los pacientes incluidos en el estudio fue del 77%.
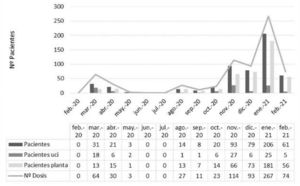
A lo largo de las sucesivas «olas» el hospital se vio afectado de modo variable en el periodo que abarca el estudio (fig. 1). El número de pacientes tratados con tocilizumab fue claramente mayor en el periodo comprendido entre noviembre y enero del 2021, coincidiendo con los peores datos de evolución de la pandemia. Además, la proporción de pacientes ingresados en la UCI fue muy superior en la primera «ola» (marzo 2020 – mayo 2020) que en la segunda (agosto 2020 – febrero 2021). Sin embargo, no se detectaron diferencias estadísticamente significativas (p = 0,97) en la supervivencia entre ambos periodos que fueron, respectivamente, del 74 y del 77%.
El periodo de tiempo incluido en el presente estudio abarca desde febrero de 2020 hasta febrero de 2021. Se recoge en la figura la evolución mensual de los ingresos por COVID durante ese periodo. En los datos se han incluido el número total de pacientes ingresados cada mes (pacientes); el número de pacientes ingresados en unidades de pacientes críticos (pacientes UCI) o en unidades convencionales de hospitalización (pacientes planta); y también, el número de tratamientos de tocilizumab (N° dosis) administrado mensualmente en el periodo estudiado.
En el análisis de regresión de COX (fig. 2) se identificaron como factores de riesgo de muerte la severidad médica del proceso y la edad del paciente. La variable sexo no mostró influencia en la mortalidad en la población analizada. En el horizonte analizado (un año), en ninguno de los grupos se alcanza la mediana de supervivencia. En cuanto a la severidad clínica del proceso, se utilizó como variable subrogada el ingreso en la UCI o en UH; esta variable mostró un HR= 2,01 (IC 95% 1,30–3,09; p = 0,002). Con relación a la edad de los pacientes, como se indicó más arriba el análisis de la curva ROC, indicó que el punto de corte óptimo, con una sensibilidad y especificidad de 0,701, se situaba en 71,5 años. En el análisis de regresión de COX, la edad mayor de 71,5 años mostró un HR = 1,08 (IC 95%; 1,07–1,10; p < 0,001).
En el análisis de supervivencia se muestran por separado: A) la influencia de la edad mayor de 71,5 años y B) influencia de la gravedad de la situación del paciente, subrrogada al ingreso en las unidades de pacientes críticos (UCI) o en las unidades de hospitalización convencional (UH). En el horizonte analizado (un año), en ninguno de los grupos se alcanza la mediana de supervivencia. En cuanto a la severidad clínica del proceso (UCI/UH) el hazard ratio mostró un valor de HR= 2,01 (IC 95%; 1,30–3,09; p = 0,002). Con relación a la edad por encima de los 71,5 años el HR = 1,08 (IC 95%; 1,07–1,10; p < 0,001). El eje de abcisas presenta el tiempo en días.
Cuando se evaluó la edad mayor de 71,5 años (fig. 2), grupo que incluye 309 (70%) pacientes, la supervivencia al final del estudio (59%) resultó estadísticamente muy inferior (p < 0,001) a la observada (89%) en los pacientes de menor edad.
En el análisis de supervivencia estratificado según la severidad del cuadro (UCI/UH), los pacientes ingresados en las UCI presentaron una supervivencia estadísticamente (p = 0,037) inferior (68%) a la de los pacientes hospitalizados en unidades médicas (79%).
La mortalidad al día 90 tras la administración de tocilizumab fue del 33% en los pacientes ingresados en las UCI y del 21% en los pacientes ingresados en UH. En este estudio, la mortalidad fue 41% en los mayores de 71,5 años frente a 11% en los menores de esta edad.
El coste de adquisición de tocilizumab fue prácticamente el mismo en todo el periodo analizado. El impacto presupuestario total de tocilizumab en el periodo analizado ascendió a 206.466 €. Sin embargo, el coste marginal por AVG o por supervivient fue diferente en los distintos subgrupos de la población (tabla 1). Las mayores diferencias en eficiencia se encontraron entre los subgrupos de población mayores de 71,5 años (701 €/AVG y 726 €/superviviente) y menores de esta edad (467 €/AVG y 478 €/superviviente).
Supervivencia de los pacientes, según el valor de la media de supervivencia restringida a un año y valores de coste marginal por años de vida ganados y coste marginal por superviviente
| Subgrupo | n | RMST (años) | Coste marginal/AVG (€) | Coste marginal/superviviente (€) |
|---|---|---|---|---|
| Global | 508 | 0,761 | 530 | 552 |
| Severidad | ||||
| UCI | 87 | 0,676 | 666 | 675 |
| UH | 421 | 0,764 | 579 | 551 |
| Edad | ||||
| Mayores 71,5 | 199 | 0,581 | 701 | 726 |
| Menores 71,5 | 309 | 0,872 | 467 | 477 |
AVG: años de vida ganados; RMST: media de supervivencia restringida a un año.
Por otra parte, en un análisis estratificado se observó que los pacientes con mayor coste por unidad de resultado en salud fueron los pacientes ingresados en la UCI y mayores de 71,5 años, que presentaron un coste marginal/AVG de 966 € y un coste marginal/superviviente de 1.136 € (tabla 2).
Análisis estratificado, con base en la edad y la gravedad de los pacientes, de los valores coste marginal por años de vida ganados y coste marginal por superviviente
| Mayores 71,5 años | Menores 71,5 años | |
|---|---|---|
| UCI | ||
| Coste marginal/AVG (€) | 966 | 576 |
| Coste marginal/superviviente(€) | 1.136 | 589 |
| UH | ||
| Coste marginal/AVG (€) | 679 | 451 |
| Coste marginal/superviviente(€) | 680 | 468 |
AVG: años de vida ganados; UH: unidades médicas.
En la población en estudio se han identificado como factores pronósticos negativos de supervivencia la edad mayor de 71 años y la gravedad de la situación clínica del paciente al inicio del tratamiento con tocilizumab. La evaluación de estos factores es importante dada la disparidad de resultados de eficacia que muestran los ensayos clínicos realizados, que reportan tasas de mortalidad similares del tratamiento con tocilizumab en comparación con placebo o el mejor tratamiento estándar12,13,17–19. Además, otros parámetros de eficacia como la disminución del riesgo de ingreso en UCI o el riesgo de ventilación de mecánica también muestran resultados controvertidos. No obstante, los investigadores del Randomized, Embedded, Multifactorial Adaptive Platform trial for Community-Acquired Pneumonia (REMAP-CAP) han reportado resultados favorables a tocilizumab con una disminución significativa en la reducción de la mortalidad en pacientes críticos con necesidades de soporte respiratorio o cardiovascular14. La mortalidad de nuestros pacientes críticos fue ligeramente más alta que la reportada en REMAP-CAP. Esto puede explicarse por la elevada presión asistencial sobre las UCI y por la gravedad de los pacientes en el periodo analizado. En un análisis post-hoc se reporta una mortalidad del 11% en el día 90 en los pacientes sin requerimientos de ventilación mecánica tratados con tocilizumab20, concluyendo que el tocilizumab podría ser una buena opción para este tipo de pacientes cuando además presenten valores de proteína C reactiva (PCR) menores de 150 mg/L. Teniendo en cuenta el porcentaje de mortalidad obtenido en nuestro estudio en los pacientes menores de 71,5 años cabe esperar que esta población sea la que mejores resultados de supervivencia obtenga.
La disparidad en estos resultados radica en la variabilidad de criterios de inclusión en los estudios, del tiempo de inicio de tratamiento con tocilizumab y de otros factores como los tratamientos asociados que reciben los pacientes21. Por ello, es importante reflejar la realidad del pronóstico de los pacientes en la práctica clínica habitual. Uno de los puntos clave fue la inclusión del tratamiento con corticoides sistémicos tras la evidencia en la mejora de la supervivencia en julio de 20206. Además, otro factor que distingue las diferentes «olas» fue el diferente manejo clínico; más incierto durante la primera ola, cuando se utilizaron estrategias terapéuticas como la hidroxicloroquina, el interferón-beta o la combinación lopinavir/ritonavir, finalmente en desuso tras haber demostrado falta de eficacia22,23.
Por su peor pronóstico, la población con mayor coste por AVG fueron los pacientes críticos mayores de 71,5 años. No obstante, los beneficios potenciales del tratamiento en cuanto a la reducción de la estancia en UCI y disminución del tiempo total de ingreso hospitalario podrían superar potencialmente el mayor coste marginal observado. La media de edad reportada en el estudio REMAP-CAP14 fue similar a la de nuestra cohorte. Estos datos están en consonancia con los reportados recientemente en un meta-análisis que incluye un total de más de 10.000 pacientes. En este estudio, se observó un menor riesgo de muerte en el grupo de tocilizumab frente al placebo o el mejor cuidado estándar de los pacientes. En el análisis por edades de este meta-análisis se reporta beneficio del tratamiento con tocilizumab en los pacientes mayores de 70 años, edad similar a la encontrada en nuestro estudio como punto de corte. Asimismo, el estudio informa de una mortalidad del 40% en el día 28 en este grupo de pacientes, en concordancia con la mortalidad reportada en nuestra cohorte.
Aunque la diferencia de costes pueda parecer poco significativa en términos absolutos, en términos relativos el coste/superviviente supone un 140% más en pacientes UCI mayores de 71,5 años con respecto a los pacientes en UH menores de 71,5 años. En términos de impacto presupuestario, en un contexto global de pandemia, pueden cobrar mayor importancia. Especialmente, en circunstancias severas de desabastecimiento de tocilizumab que podrían plantearse en un futuro.
Por otra parte, además de los gastos directos asociados a la adquisición del medicamento, es factible analizar o modelizar otros costes sanitarios directos, en particular los derivados de una reducción del riesgo de ingreso en las UCI y de la disminución de la estancia hospitalaria24. Pero, esta posibilidad supera los objetivos del presente estudio. Los datos presentados se centran en una aproximación a la eficiencia del uso de tocilizumab en la práctica clínica real, cuantificando el coste marginal/AVG y el coste marginal/superviviente en la práctica clínica real y deberían tenerse en cuenta a la hora de seleccionar los tratamientos óptimos en cada momento y para cada paciente, incluyendo otras alternativas como baricitinib que también han demostrado mejorar el pronóstico de pacientes COVID-1925.
En resumen, el tratamiento con tocilizumab en los pacientes COVID-19 continúa generando incertidumbre en cuanto a su eficacia, tanto en la disminución de la gravedad de la enfermedad como en la mejora de la supervivencia26. En nuestro análisis se han detectado diferencias en la supervivencia, en función de la gravedad clínica al inicio del tratamiento, entre los pacientes que reciben tocilizumab en las UCI y en las UH. Asimismo, se ha evidenciado el mejor pronóstico de supervivencia para los pacientes menores de 71,5 años.
En el presente estudio, la eficiencia del tratamiento con tocilizumab se asocia a la edad y a la gravedad de los pacientes. No obstante, las cifras se sitúan, en todos los subgrupos evaluados, muy por debajo de los umbrales habitualmente utilizados en las evaluaciones coste-efectividad. En consecuencia, los resultados del presente estudio sugieren que el inicio precoz de tocilizumab es una estrategia eficiente.
Presentación a reuniones científicasEl resumen de este estudio ha sido previamente presentado y aceptado en el 26th EAHP Congress.
Aportación a la literatura científicaLa pandemia producida por el SARS-CoV-2 ha tenido un gran impacto tanto en los sistemas de salud, como en los sistemas socioeconómicos y políticos de todo el mundo, por ello, es relevante la evaluación de los factores, tanto demográficos/clínicos, como económicos para tener una visión crítica de lo sucedido durante los meses de mayor incidencia de infectados y fallecidos por COVID-19. Es importante tener datos de la efectividad de los tratamientos que utilizamos en las condiciones de uso en la práctica asistencial. Además, es interesante identificar los subgrupos de población que potencialmente van a tener mejores resultados.
Los resultados del estudio cuantifican la eficiencia del tratamiento con tocilizumab en los pacientes con COVID-19 y sugieren que el inicio precoz de tocilizumab puede ser una opción terapéutica eficiente con respecto a su uso en los pacientes graves. Estos resultados deben tenerse en cuenta a la hora de plantear el abordaje terapéutico de los pacientes con riesgo de padecer complicación por la infección del virus.
Responsabilidades éticasEl proyecto de investigación con número de expediente 85/21 fue aprobado el 31/05/2021 por el CEIm del Hospital Clínico Universitario de Valencia.
Declaración de autoríaComo autor principal del trabajo declaro que mi participación en el estudio ha sido la de participar en el diseño del mismo, la recogida y análisis de datos, así como, la redacción, elaboración de las tablas y figuras y preparación del documento para el envío.
El segundo autor, Manuel Alós Almiñana, ha participado en el diseño del estudio, así como supervisor tanto del análisis estadístico, los resultados y de la redacción del artículo final, habiendo contribuido con su corrección y con su dirección durante el proceso del estudio.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses.