ORIGINALES
UTILIDAD CLINICA DE LA CONCENTRACION PLASMATICA VALLE DEGENTAMICINA TRAS SU ADMINISTRACION EN DOSIS UNICADIARIA
CLINICALUTILITY OF GENTAMICIN THOUGH PLASMA CONCENTRATION AFTER A SINGLEDAILY DOSE
PérezRuixo, J. J.,Doctor en Farmacia, Especialista en FarmaciaHospitalaria;
Pastor Boix, E.,Especialista en FarmaciaHospitalaria;
Bertolín Olmos, B.,Residente III de FarmaciaHospitalaria;
Faus Felipe, V.,Residente III de FarmaciaHospitalaria;
Almela Tejedo, M.,Doctor en Farmacia, Residente II deFarmacia Hospitalaria;
Cholvi Llovell, M.,Residente II de FarmaciaHospitalaria;
Jiménez Torres, N. V.,Doctor en Farmacia,Catedrático del Departamento de Farmacia y Tecnologíade Farmacéutica, Jefe de Servicio.
Servicio de Farmacia. Hospital Universitario Dr. Peset.Valencia.
Departamento de Farmacia y Tecnología deFarmacéutica. Universidad de Valencia.
Correspondencia:
Juan José Pérez Ruixo.
Servicio de Farmacia.
Hospital Universitario Dr. Peset.
Gaspar Aguilar, 90.
46017 Valencia.
E-mail: ruixo@ole.com
Esteartículo se presentó, parcialmente, en forma decomunicación en el Congreso de la Sociedad Españolade Farmacia Hospitalaria que se celebrará en Pamplona del 22al 25 de septiembre de 1999.
Fecha derecepción: 22-2-00
Palabrasclave:
Aminoglucósidos. Dosis única diaria.Farmacocinética. Monitorización.
Resumen:
El objetivodel presente estudio es valorar los factores pronóstico quepermiten predefinir la utilidad de la monitorización de laconcentración plasmática valle de gentamicina tras suadministración en dosis única diaria. Estasituación está relacionada íntimamente con elhecho de que a concentraciones plasmáticas valle inferioresa 1 mg/l las técnicas analíticas habitualmenteutilizadas poseen una exactitud y precisión que limita suutilidad clínica.
La utilidadde la monitorización de la concentraciónplasmática valle se valoró mediante el desarrollo deun modelo de regresión logística que permitióidentificar los factores pronóstico (edad, peso, talla,sexo, creatinina sérica y aclaramiento de creatinina) que deforma independiente determinan valores < 1 mg/l en unapoblación de estudio formada por 1.250 pacientes simuladoscon lasmismas características que los pacientes atendidos ennuestro hospital.
Elaclaramiento de creatinina (OR = 1,077; p < 0,0001) y el peso(OR = 0,978; p < 0,0001) se identifican como factorespronóstico de alcanzar concentraciones valle de gentamicina< 1 mg/l. Cuando se utiliza el modelo con el aclaramiento decreatinina como única covariable, el área bajo lacurva de rendimiento diagnóstico es de 0,85 y el punto de corteóptimo corresponde a un aclaramiento de creatinina de 60ml/min, en el cual se alcanza una sensibilidad del 79,48% y unaespecificidad de 73,21%. El área bajo la curva derendimiento diagnóstico no mejora de forma significativacuando el peso corporal es añadido como covariable a estemodelo.
En estesentido, la utilidad clínica de la determinación dela concentración valle de gentamicina para suindividualización posológica es escasa cuando elpaciente presenta un aclaramiento de creatinina superior a 60ml/min.
Keywords:
Aminoglycosides. One daily dose. Pharmacokinetic.Monitoring.
Summary:
Theprognostic factors that make it possible to predefine theusefulness of monitoring trough plasma concentrations ofgentamicin after the administration of a single daily dose wereevaluated. This situation is closely related with the fact thatanalytic techniques have little precision at trough plasmaconcentrations of less than 1 mg/l, thus limiting their clinicalvalue.
Theusefulness of monitoring trough plasma concentration was evaluatedusing a logistic regression model to identify prognostic factors(age, weight, height, sex, serum creatinine and creatinineclearance) that can independently determine trough values < 1mg/l in a study population of 1,250 simulated patients with thesame characteristics as patients attended in ourhospital.
Creatinineclearance (OR = 1.077; p < 0.0001) and weight (OR = 0.978; p< 0.0001) were identified as prognostic factors for gentamicintrough concentrations of < 1 mg/l. When the model was used withcreatinine clearance as the only covariable, the area under thediagnostic performance curve was 0.85 and the optimal cutoff pointwas a creatinine clearance of 60 ml/min, which had a sensitivity of79.48% and a specificity of 73.21%. The area under the diagnosticperformance curve did not significantly improve when body weightwas added to the model as a covariable.
Determinationof the trough concentration of gentamicin for individualizingdosage had little clinical usefulness in patients with a creatinineclearance of more than 60 ml/min.
FarmHosp 2000;24(2):89-97
INTRODUCCIÓN
Losaminoglucósidos, después de cincuenta años desu presencia en el arsenal terapéutico, continúansiendo antibióticos de primera línea en eltratamiento y profilaxis de infecciones graves por gramnegativos.Se trata de fármacos de estrecho índiceterapéutico, con elevada incidencia de nefrotoxicidad yototoxicidad, y amplia variabilidad interindividual en sucomportamiento cinético y dinámico (1). Ademásla relación establecida entre sus concentracionesplasmáticas y su respuesta terapéutica y/otóxica ha sido demostrada ampliamente en labibliografía (2, 3). De hecho, la actividad bactericida delos aminoglucósidos es concentración dependiente y sutoxicidad está relacionada con la exposición total alfármaco (4). En este sentido, la utilidad clínica yterapéutica de la monitorización de lasconcentraciones plasmáticas de aminoglucósidos, comoparte del seguimiento de los pacientes en tratamiento, ha sidoconsiderada coste-efectiva (5, 6).
Ahora bien, enlos últimos años se han puesto de manifiesto diversosargumentos a favor de una mayor efectividad de losaminoglucósidos tras su administración en dosisúnica diaria. Entre éstos cabe destacar lacinética bactericida concentración-dependiente, elefecto postantibiótico, la resistencia adaptativa ytransporte saturable al interior de la célula tubular renal(4). De esta forma la seguridad de los aminoglucósidostambién puede optimizarse con su administración endosis única diaria. En diferentes estudios se ha demostradouna menor incidencia de toxicidad debido a la disminución dela acumulación del fármaco en las célulastubulares renales y en el oído interno (7). Además,la dosis única diaria presenta las ventajas adicionalesderivadas de la comodidad de su administración, el menortiempo de enfermería y la menor necesidad demonitorización de sus concentraciones plasmáticas(8). No obstante, la evidencia aportada por diferentes ensayosclínicos y metanálisis realizados en pacientessubsidiarios de tratamiento con aminoglucósidos no reflejauna clara superioridad de la administración en dosisúnica diaria, tanto en efectividad como en seguridad (7,9-11), aunque existe una reducción en los costes asociados aeste tratamiento (12). Es más, esta modalidadterapéutica se encuentra desaconsejada en pacientespediátricos, pacientes críticos, grandes quemados,pacientes con endocarditis bacteriana y mujeres embarazadas(13).
En estosestudios la elección de la pauta posológica ha sidoempírica y en la mayoría de ellos se han utilizadodosis fijas (expresadas en mg/kg). Por este motivo la dosis y elintervalo posológico óptimos todavía no hansido establecidos y, posiblemente, la mejor estrategia seríala individualización posológica en función delmicroorganismo causante de la infección, el lugar y el tipode infección y las característicasfarmacocinéticas del paciente y/o sus concentracionesplasmáticas (4, 14, 15).
Lamonitorización de las concentraciones plasmáticastras la administración en dosis única diaria no puedebasarse directamente en el ámbito terapéuticoasociado a la pauta convencional. En la actualidad el ámbitoterapéutico asociado a la concentración pico y vallecontinúa siendo motivo de controversia en la literaturacientífica. Algunos autores suponen que tras laadministración de la dosis única diaria siempre sealcanzan concentraciones plasmáticas adecuadas, e inclusoconsideran superflua su monitorización (16). En cambio,otros autores creen que el ámbito óptimo deconcentraciones plasmáticas obtenidas treinta minutosdespués de finalizar la perfusión intravenosa degentamicina o tobramicina deben situarse entre 16 y 24 mg/l. Apesar del empirismo que soporta esta hipótesis (17), estosvalores de concentración se sitúan fuera de loslímites de las curvas de calibrado de las técnicasanalíticas habitualmente utilizadas, como son lainmunofluorescencia polarizada y el enzimoinmunoensayo demicropartículas.
Enrelación con el binomio concentración valle(Cpvalle) y dosis única diaria, existen criteriosde actuación diferentes. Así, mientras en algunosensayos clínicos la dosis única diaria sereducía si la Cpvalle era superior a 1-2 mg/lpara gentamicina y a 5 mg/l para amikacina (18-20), algunos autoresno consideran correcta su monitorización porque en lamayoría de los casos los valores son indetectables (13, 20).En este contexto de validez clínica de la Cpvallehay que tener presente que las técnicas analíticashabitualmente utilizadas no poseen una exactitud y precisiónóptima cuando la Cpvalle es inferior a 1 mg/l,por lo que no es posible alcanzar una individualizaciónposológica adecuada (21).
El objetivoprincipal del presente estudio es valorar la utilidadclínica de la monitorización de laconcentración valle de gentamicina tras suadministración en dosis única diaria para realizar laindividualización posológica de losaminoglucósidos. Además como objetivo secundario seplantea el desarrollo de una prueba diagnóstica capaz dedecidir cuándo es necesario realizar lamonitorización de la concentración valle degentamicina.
MÉTODO
El estudio se harealizado a partir de una población simulada de 1.250pacientes. El desarrollo de la metodología se compone detres etapas: en la primera etapa se obtuvo la población deestudio mediante técnicas de simulación; en segundolugar se analizaron los datos simulados con el objetivo dedesarrollar una prueba diagnóstica basada en un modelo deregresión logística, y, finalmente, se evaluóla utilidad de la prueba diagnóstica.
Primeraetapa: simulación
Mediante ungenerador de números pseudoaleatorios se simularonaleatoriamente las características antropométricas ybioquímicas correspondientes a 1.250 pacientes. Para ello seutilizaron los datos estadísticos correspondientes a laedad, peso, talla, sexo y creatinina sérica (Crs)de la población de pacientes ingresados en nuestro hospital(tabla 1). A partir de estos datospara cada paciente se calculó su peso ideal (22), el peso dedosificación (23) y el aclaramiento de creatinina (24)(ClCr). Para verificar la ausencia de sesgo en elproceso de simulación se compararon los valores de la edad,la talla, el peso, el peso ideal, el peso de dosificación,la creatinina sérica y el ClCr en funcióndel sexo mediante una prueba «t» de Student, y seasumió la existencia de diferencias estadísticamentesignificativas cuando el valor de p era inferior a 0,05.
Tabla 1. Características antropométricas ybioquímicas simuladas, junto con el tipo de funciónde distribución de probabilidad asumida para cada una deellas | |||||
| Parámetro | N | Distribución | Tendenciacentral | Variabilidad | Ámbito |
| Edad(años) | 1.250 | Normal | 60 | 15* | 20-100 |
| Peso(kg) | 1.250 | Normal | 170 | 10* | 15-190 |
| Talla(cm) | 1.250 | Normal | 70 | 15* | 40-120 |
| Sexo(V/M) | 1.250 | Binomial | 1 | 0,5*** | 0-1 |
| Crs(mg/l) | 1.000 | Log-normal | 1 | 0,3** | > 0,6 |
| 250 | Log-normal | 2,5 | 0,5*** | > 0,6 | |
*Descripción estándar. ** Coeficiencia devariación. *** Proporción. | |||||
En todos loscasos se consideró la administración de gentamicinaen dosis única diaria de 240 mg por vía intravenosa,en perfusión intermitente de treinta minutos a velocidadconstante, y la toma de muestras de sangre se realizaba justo antesde la siguiente administración (Cpvalle). De estaforma es posible obtener la Cpvalle de gentamicina enpacientes con insuficiencia renal. También se asumióque la determinación de gentamicina se realizaba medianteinmunofluorescencia polarizada Axsym TDx/FLx, de Abbott DiagnosticDivision, con un límite de sensibilidad de 0,25 mg/l y uncoeficiente de variación inferior al 10% en el ámbitode concentraciones comprendidas entre 0,25 y 8 mg/l.
Losparámetros farmacocinéticos poblacionales utilizadosen la simulación de las Cpvalle corresponden auna población general de pacientes, y fueronextraídos de la bibliografía (25). El modelofarmacoestadístico utilizado para la simulación delas Cpvalle (tabla 2) asumecomo modelo farmacocinético estructural el modelomonocompartimental abierto, con administración intravenosaen perfusión intermitente a velocidad constante,K0 y eliminación corporal de primer orden (ecuación 1):
Tabla 2. Modelo farmacoestadísticoutilizadopara la simulación de los pares devaloresconcentraciónplasmática-tiempo | |
| Modelo estructural | |
| Modelo farmacocinético | |
| --Modelo monocompartimental abierto con administraciónintravenosa de 240 mg en perfusión intermitente de treintaminutos a velocidad constante y eliminación corporal deprimer orden. | |
| Modelo de regresión | |
| --Cl (ml/min) = 0,0417 · peso ideal (kg) + 0,815 Clcr(ml/min). | |
| --Vd (l) = 0,25 · peso de dosificación. | |
| Modelo de varianza | |
| Modelo de variabilidad interindividual | |
| --Vdj (l) = Vd (l) · exp(n1)n1 = N (0,16). | |
| --Clj (m/min) = Cl (ml/min) · exp(n2)n2 = N (0,09). | |
| Modelo de variabilidad residual | |
| --Cpij (mg/l) = Cpij (mg/l) · exp(*ij)e1 = N (0,01). | |
En laecuación 1, Cj* (t) es lai-ésima concentración plasmática estimada atiempo t en el individuo j-ésimo, tras laadministración de una dosis única. Losparámetros del individuo j-ésimo son elaclaramiento, Clj, y el volumen dedistribución, Vdj, y T es el tiempode perfusión.
Se asume que laconcentración plasmática experimental, Cj(t), se halla sujeta a un error residualexponencial y, por tanto, Cj(t) se puedeexpresar mediante la ecuación 2:
C*j(t) =C*j(t) ·exp (*ij) [ecuación2]
donde*j esuna variable aleatoria que se distribuye de forma normal con media0 y varianza *2, que en elproceso de simulación de Cpvalle se asumióigual a 0,01. La variabilidad interindividual del aclaramientoplasmático y del volumen de distribución se describemediante un modelo de error exponencial, ecuaciones 3 y4:
Clj= Cl · exp (*Clj)[ecuación3]
Vd*j=Vd* · exp (*Vdj)[ecuación4]
en lasque *jCl y *jVd cuantifican lasdesviaciones del individuo j-ésimo respecto al valorpoblacional típico del aclaramiento plasmático y delvolumen de distribución, Cl y Vd, y sonvariables aleatorias independientes que se distribuyen de formanormal con media 0 y varianzas *2Cl y *2Vd, respectivamente. En elproceso de simulación se utilizaron valores de *2Cl de 0,16 y *2Vd de 0,09. Además,el aclaramiento poblacional de gentamicina se consideró comouna función del peso ideal y del ClCr, y elvolumen de distribución fue modelado como función delpeso de dosificación, tal y como muestran las ecuaciones 5 y6:
Cl =0,0417 · peso ideal + 0,815 · ClCr [ecuación5]
Vd =0,25 · peso de dosificación [ecuación6]
Segundaetapa: desarrollo de la prueba diagnóstica
El desarrollo dela prueba diagnóstica está basado en laconstrucción de un modelo de regresiónlogística. En este modelo se utilizó como variabledependiente la Cpvalle, codificada como 0 cuando suvalor era inferior a 1 mg/l y como 1 cuando su valor era mayor oigual a este valor. Las variables independientes utilizadas en elanálisis eran la edad, la talla, el peso, el peso ideal, elsexo, la creatinina sérica y el ClCr.
Laidentificación de los factores pronóstico deCpvalle >1 mg/l se realizó siguiendo lasdirectrices de Hosmer y Lemeshow (26). En primer lugar serealizó un cribado de las variables independientes medianteel análisis de un modelo de regresiónlogística univariante con el objetivo de seleccionar lospotenciales factores pronóstico a incluir en el modelomultivariante. De esta forma se seleccionaron aquellas variablesque en dicho análisis presentaron valores de p inferiores a0,25. Con estas variables se exploraron los modelos multivariantesobtenidos por los métodos de inclusión secuencial,exclusión secuencial y el método «paso apaso», con criterios de inclusión y exclusióncorrespondientes a valores de p igual a 0,05 y 0,1,respectivamente. Las variables detectadas en este análisiscomo más importantes se fijaron en el modelo y,posteriormente, se añadieron de forma controlada lasrestantes variables seleccionadas con objeto de mejorar el ajustefinal del modelo. Finalmente se realizaron las pruebas pertinentespara identificar potenciales interacciones de primer orden (cambiossignificativos del logaritmo de la verosimilitud al introducir lasposibles interacciones en el modelo), factores de confusión(método de la proporción de cambio de loscoeficientes del modelo) (27) y vulneraciones de la linealidad(análisis gráfico del logit en funciónde los factores pronóstico identificados en el modelofinal).
Al utilizar elmodelo final como prueba diagnóstica el resultado obtenidose encuentra en una escala cuantitativa comprendida entre 0 y 1.Por esta razón es necesario seleccionar un punto de corte ovalor límite adecuado que permita resumir estos resultadosen dos categorías: positivo y negativo. La seleccióndel punto de corte óptimo se realizó mediante laconstrucción de las curvas de rendimiento diagnóstico(curvas ROC --receiver operating characteristics--). Paraello se determinó la sensibilidad y la especificidadasociada a cada uno de los posibles puntos de corte existentes enel ámbito de valores comprendidos entre 0 y 1 yposteriormente se representó gráficamente en el ejede ordenadas el valor de la sensibilidad (fracción deverdaderos positivos) y en el eje de abscisas la fracción defalsos positivos o el opuesto de la especificidad de cada uno delos posibles puntos de corte. La selección del punto decorte óptimo se realizó mediante el criterio deMcNeil et al, basado en que la eficiencia en el punto de corte esigual al cociente existente entre la prevalencia deCpvalle > 1 mg/l y la prevalencia deCpvalle < 1 mg/l. La eficiencia puede establecerse apartir de la relación existente entre la sensibilidad y laespecificidad.
Terceraetapa: utilidad de la prueba diagnóstica
La utilidad dela prueba diagnóstica de Cpvalle > 1 mg/l sevaloró mediante su capacidad de clasificación, elcomportamiento de la prueba bajo distintos niveles de prevalencia,el cociente de probabilidad y la probabilidad postest (29). Lacapacidad de clasificación se evaluó mediante elárea bajo la curva de rendimiento diagnóstico(AUCROC), estimada mediante el método trapezoidal(30). Este parámetro permite comparar la capacidad declasificación de diferentes pruebas diagnósticas. Enbase al teorema de Bayes, se evaluó el comportamiento de laprueba diagnóstica para un ámbito de valores deprevalencia comprendido entre 0 y 1, mediante el cálculo delos valores predictivos positivos y negativos. El análisisestadístico se realizó en el programa SPSSversión 7.5 (SPSS Inc, Chicago, IL) (31).
RESULTADOS
Lapoblación a estudio, obtenida mediante técnicas desimulación, corresponde a 1.250 pacientes concaracterísticas antropométricas y bioquímicassimilares a la población de pacientes ingresados en nuestrohospital (tabla 3). La edad, la talla,el peso y la creatinina sérica no evidenciaron diferenciasestadísticamente significativas en función del sexo.Ahora bien, el peso ideal, el peso de dosificación y elClCr presentaban diferencias estadísticamentesignificativas entre hombres y mujeres. Estos resultados confirmanla ausencia de sesgo en el proceso de simulación, puesto quela obtención de las variables con diferencias significativasse realizó considerando un distinto comportamiento entrehombres y mujeres.
Tabla 3. Media y desviaciónestándarde lascaracterísticas antropométricas ybioquímicasobtenidas mediantesimulación | |||
| Parámetro | Varón (n = 609) | Mujer (n = 641) | p |
| Edad(años) | 59,98 (13,94) | 58,98 (14,43) | ns |
| Talla(cm) | 169,84 (8,44) | 170,14 (8,12) | ns |
| Peso(kg) | 70,96 (13,96) | 70,09 (13,68) | ns |
| Peso ideal(kg) | 62,14 (6,85) | 59,91 (5,92) | < 0,01 |
| Pesodosificación (kg) | 65,66 (8,92) | 63,98 (8,10) | < 0,01 |
| Crs(mg/dl)* | 1,12 (0,78) | 1,10 (0,63) | ns |
| Clcrs (ml/min) | 61,01 (25,02) | 50,88 (22,05) | < 0,01 |
| *Expresado como mediana (amplitud intercuartil). | |||
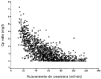
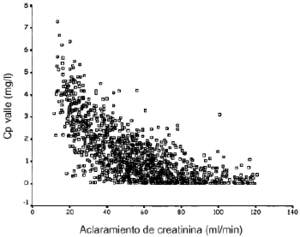
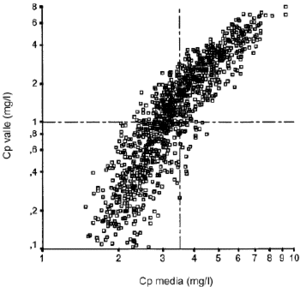
Laadministración de 240 mg de gentamicina por víaintravenosa originó las Cpvalle ensituación de estado estacionario que aparecen en la figura 1 en función delClCr del paciente. En la gráfica se aprecia laamplia variabilidad interindividual existente en el comportamientofarmacocinético de la gentamicina, donde incluso pacientescon ClCr similar presentan valores de Cpvallemuy distintos. De las 1.250 Cpvalle simuladas, 619 soninferiores a 1 mg/l y, por tanto, la prevalencia deCpvalle > 1 mg/l es de 50,48%. En la figura 2 se representa la relaciónexistente entre la concentración plasmática media enestado estacionario y la Cpvalle.
Figura 1.--Concentraciones plasmáticas valle de gentamicinasimuladas en situación de estado estacionario enfunción del aclaramiento de creatinina.
Figura 2.--Relación entre la concentraciónplasmática media de gentamicina y laconcentración plasmática valle.
En el desarrollodel modelo de regresión logística se realizóuna prueba de cribado mediante un análisis deregresión logística univariante de las variablesindependientes cuyos resultados, en forma de odds ratio(OR), se muestran en la tabla 4. Eneste análisis, excepto el peso y la talla, el resto de lasvariables analizadas presentaron una asociaciónestadísticamente significativa con la obtención deCpvalle > 1 mg/l. Esta asociación fue positivapara el sexo, el peso ideal y el ClCr, y negativa parala edad y la creatinina sérica. En cualquier caso, el valorde p alcanzado para cada variable es menor de 0,25 y, por tanto,según el criterio de Hosmer y Lemeshow todas ellas seincluyeron en el análisis multivariante.
Tabla 4. Análisis univariante de los posiblesfactorespronósticos de concentraciones plasmáticasvallede gentamicina inferiores a 1 mg/l | |||
| OR | IC 95% | p | |
| Edad (años) | 1,029 | 1,021-1,038 | < 0,0001 |
| Talla (cm) | 0,987 | 0,974-1,001 | 0,059 |
| Peso (kg) | 1,005 | 0,997-1,013 | 0,247 |
| Peso ideal (kg) | 0,983 | 0,966-1,000 | 0,046 |
| Sexo* | 0,571 | 0,457-0,715 | < 0,0001 |
| Crs (mg/dl) | 9,708 | 7,059-13,351 | < 0,0001 |
| Clcrs (ml/min) | 0,928 | 0,920-0,936 | < 0,0001 |
| *La referencia es el sexo masculino. | |||
Laexploración de los modelos multivariantes obtenidos por losmétodos de inclusión secuencial, exclusiónsecuencial y el método «paso a paso»evidenció al ClCr como la variable másimportante (modelo I). Esta variable se fijó en el modelo yla posterior adición jerárquica de variablessólo identificó al peso como variable capaz demejorar el ajuste de los datos al incluirla en el modelo (modeloII) (tabla 5). El resto de variablesno presentaban interacción con ClCr ni con elpeso, en ningún caso el cambio del logaritmo de laverosimilitud al introducir las posibles interacciones en el modelofue estadísticamente significativo. Además ninguna delas variables se mostró como factor de confusión,dado que la proporción de cambio de los coeficientes delmodelo fue inferior al 5% en todos los casos. En ambos modelos elanálisis gráfico del logit en funcióndel ClCr (modelos I y II) y del peso (modelo II) nomostró vulneraciones significativas en el supuesto delinealidad del modelo de regresiónlogística.
Tabla 5. Análisis multivariante de los posibles factorespronósticos de concentraciones plasmáticas valle degentamicina inferiores a 1 mg/l | |||||
| Coeficiente (EE)* | OR | IC95% | p | ||
| Modelo I | |||||
| --Constante | 4,047 (0,240) | < 0,0001 | |||
| --Clcrs (ml/min) | 0,075 (0,004) | 0,928 | 0,920-0,936 | < 0,0001 | |
| Modelo II | |||||
| --Constante | 2,629 (0,394) | < 0,0001 | |||
| --Clcrs (ml/min) | 0,078 (0,005) | 0,925 | 0,917-0,933 | < 0,0001 | |
| --Peso (kg) | 0,023 (0,005) | 1,023 | 1,013-1,033 | < 0,0001 | |
*Error estándar. | |||||
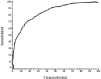
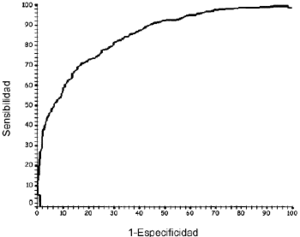
La capacidad declasificación, medida como el AUCROC, para elmodelo I es 84,86% (IC95%: 82,75% a 86,81%) (Fig. 3) y para el modelo II es 85,41 (IC95%: 83,33% a87,32%). Este incremento del AUCROC no mejora entérminos clínicos la capacidad declasificación obtenida con el modelo I. Por este motivo sedecidió seleccionar como prueba diagnóstica el modeloI, que incluía menor número deparámetros.
Figura 3.--Curva de rendimiento diagnóstico para lapredicción Cpvalle < 1 mg/l a partir delaclaramiento de creatinina (modelo I).
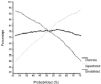
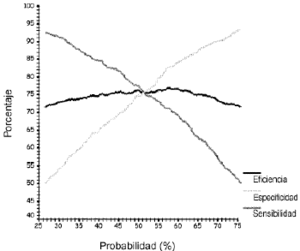
Los valores desensibilidad, especificidad y eficiencia en función de laprobabilidad obtenida con el modelo I se representa en la figura 4. El punto de corte óptimoseleccionado fue el valor de probabilidad igual a 0,5. Ahora bien,como la prueba diagnóstica es un modelo de regresiónlogística univariante, el valor de probabilidad establecidocomo punto de corte óptimo puede expresarse en unidades dela variable independiente, en este caso ClCr. De estaforma, el punto de corte equivale a un ClCr igual a 55ml/min, con un intervalo de confianza del 95% comprendido entre 48y 61 ml/min. Por mayor sensibilidad y simplicidad se decidióutilizar como punto de corte 60 ml/min.
Figura 4.--Valor de sensibilidad, especificidad y eficienciaen función del punto de corte seleccionado para lapredicción de Cpvalle > 1 mg/l, según el modeloI.
En la tabla 6 se resume, en forma de tabla2 * 2, la informaciónaportada por la prueba diagnóstica de Cpvalle> 1 mg/l. De esta tabla se desprende que la pruebadiagnóstica tiene una sensibilidad de 79,48% y unaespecificidad de 73,21%. El cociente de probabilidad de la pruebadiagnóstica para un resultado positivo es de 2,97 y para unresultado negativo de 0,28; y como la prevalencia deCpvalle < 1 mg/l en la muestra de 1.250 pacientes esde 0,50, la probabilidad postest es igual a 0,75.
| Tabla 6.Concentraciones plasmáticas valle de gentamicina enfunción del aclaramiento de creatinina | |||
| Clcr < 60 ml/min | Clcr > 60 ml/min | ||
| Cpvalle > 1 mg/l | 462 | 127 | 589 |
| Cpvalle < 1 mg/l | 169 | 492 | 661 |
| Total | 631 | 619 | 1.250 |
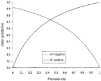
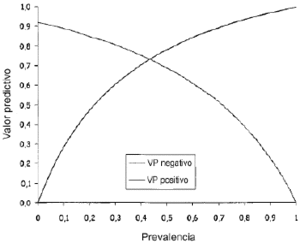
En la figura 5 se aprecian los valores predictivospositivos y negativos en función de la prevalencia deCpvalle > 1 mg/l. Así, para valores deprevalencia comprendidos entre 0,4 y 0,5 se obtienen,simultáneamente, valores predictivos positivos y negativossuperiores al 70%. A prevalencias mayores del 50% seríanecesario considerar el impacto de los falsos negativos, y aprevalencias menores a 40% el impacto de los falsos positivostendría repercusión clínica.
Figura 5.--Valores predictivos positivos y negativos enfunción de la prevalencia.
DISCUSION
Losaminoglucósidos son fármacos cuyo estrechoíndice terapéutico y amplia variabilidadinterindividual justifica la necesidad de la monitorizaciónde sus concentraciones plasmáticas, como parte delseguimiento de los pacientes en tratamiento. No obstante, en lassituaciones donde se administran en dosis única diaria elámbito terapéutico asociado a la pauta convencionalde tratamiento no puede aplicarse directamente, y es necesario elestablecimiento de una estrategia de monitorización de lasconcentraciones plasmáticas con el objetivo de garantizar lamáxima efectividad del tratamiento y evitar laacumulación excesiva del fármaco y laaparición de nefrotoxicidad y ototoxicidad.
En labibliografía aparecen distintas estrategias deindividualización posológica tras laadministración de los aminoglucósidos en dosisúnica diaria. Algunos autores piensan que lamonitorización de las concentraciones plasmáticasdebe realizarse antes de las veinticuatro horas, cuando latécnica analítica todavía es capaz de detectarel fármaco en la sangre (14, 20). Ahora bien, el tiempoexacto al cual debe realizarse la toma de muestra puede variar enrelación a la función renal del paciente. MacGowan yReeves proponen una única monitorizacióntranscurridas ocho horas desde la administración (32).Nicolau et al (14) proponen la administración de una dosisde 7 mg/kg seguida de la monitorización de laconcentración plasmática transcurridas entre seis ycatorce horas desde la administración. Estaconcentración se compara con el denominado nomograma deHartford, que permite seleccionar el intervalo posológicoentre veinticuatro, treinta y seis y cuarenta y ocho horas. Sinembargo, existe poca experiencia clínica en lautilización de intervalos posológicos superiores aveinticuatro horas y, además, 7 mg/kg puede ser una dosisexcesiva en muchas ocasiones, tal y como se ha evidenciadorecientemente (33).
De laspropuestas realizadas hasta el momento, la más robustaparece ser el método de Begg, desarrollado para pacientescon función renal normal, es decir, aclaramiento decreatinina superior a 60 ml/min (14). Este método, basada enla teoría del muestreo óptimo (34), consiste enmonitorizar la concentración pico treinta a sesenta minutostras finalizar la primera perfusión intravenosa de treintaminutos, y otra concentración transcurridas entre seis yveintidós horas desde la administración. A partir deestos datos se calcula el valor del área bajo la curvaconcentración-tiempo (AUC) y se ajustan las dosis enfunción del AUC deseado, que en cualquier caso deberáser inferior a 84 mg · h/l, valor que corresponde a unaconcentración plasmática media de 3,5 mg/l. Estevalor límite es coincidente con el propuesto por Aarons etal (35). Además, este método puede realizarseúnicamente con la segunda determinación mediante laestimación bayesiana del AUC (36), aunque la exactitud y laprecisión de la estimación es óptima cuando sedispone de dos valores de concentración plasmática(37).
Por otra parte,en los pacientes con aclaramiento de creatinina entre 20 y 60ml/min es necesario reducir la dosis inicial de 5-7 a 3-5 mg/kg conel fin de evitar AUC excesivos y realizar la segundamonitorización transcurridas entre ocho y veinticuatro horasdel final de la administración. No obstante, en estospacientes la mejor alternativa puede ser aumentar el intervaloposológico en lugar de diminuir la dosis, pero no existenensayos clínicos que avalen esta prácticaclínica (14).
En la figura 2se evidencia la relación existente entre laCpvalle y la concentración plasmáticamedia, propuesta como nuevo parámetro para laindividualización posológica de losaminoglucósidos. Esta relación permite justificarclínicamente la monitorización Cpvalle yla utilización del valor de 1 mg/l en sudicotomización. De hecho, los valores de Cpvalle< 1 mg/l presentan una elevada especificidad (93%) paradescartar concentraciones plasmáticas medias superiores a3,5 mg/l. Además, la monitorización clínica dela Cpvalle, comparada con cualquier concentraciónplasmática transcurridas al menos seis horas desde laadministración, presenta una mayor sencillez y practicidaddesde el punto de vista del personal de enfermería y puedeser de mayor utilidad en pacientes con insuficiencia renal, si bienpresenta una serie de inconvenientes derivados de lastécnicas analíticas habitualmenteempleadas.
En este estudiose intenta valorar la utilidad de la monitorización de lasCpvalle mediante la metodología empleada en eldesarrollo de las pruebas diagnósticas. Estametodología se ha utilizado para valorar la utilidad delmodelo de regresión logística, desarrollado a partirde variables independientes de tipo antropométrico ybioquímico, en la predicción de Cpvalle> 1 mg/l. En este caso, la validez del modelo deregresión logística, como prueba diagnóstica,está condicionada al punto de corte escogido. De tal formaque la sensibilidad y la especificidad debe ser evaluada en cadauno de los posibles puntos de corte mediante las curvas derendimiento diagnóstico, las cuales se han aplicado en elámbito de la farmacocinética clínica ennumerosas ocasiones (38).
En efecto, lascurvas de rendimiento diagnóstico permiten observar todoslos pares sensibilidad, especificidad resultantes de lavariación continua de los puntos de corte en todo elintervalo de resultados observados (39). Cuando los falsospositivos y los falsos negativos tienen el mismo coste, el punto decorte seleccionado mediante la aplicación del criterio deMcNeil et al (28) equivale al punto de la curva de rendimientodiagnóstico más próximo al vérticesuperior izquierdo de la misma curva, es decir, al punto máscercano a los valores óptimos de sensibilidad yespecificidad. Si los falsos positivos y los falsos negativos notienen el mismo coste, es necesario calcular el punto de corte queminimiza el coste de los resultados erróneos. En nuestrocaso se decidió asumir el mismo coste para los falsospositivos que para los falsos negativos.
Por otra parte,los niveles adecuados de sensibilidad y especificidad dependen delos objetivos que se pretenden conseguir con la pruebadiagnóstica. En este sentido, Galen y Gambino proponenvarios postulados relativos a la elección práctica delas características de una prueba diagnóstica. Sedebe seleccionar pruebas diagnósticas de elevadasensibilidad cuando la enfermedad sea grave, pero curable, y nopuede pasar inadvertida, o cuando los resultados falsos positivosno suponen para el paciente ningún traumatismopsicológico ni económico. Por el contrario, laselección de una prueba con elevada especificidaddebería realizarse cuando se trate de diagnosticarenfermedades graves, prácticamente incurables, y es de granimportancia descartar que se padece la enfermedad, o cuando unresultado falso positivo supone para el paciente un traumatismopsicológico o económico grave. Deberáutilizarse una prueba con alto valor predictivo positivo cuando eltratamiento de los falsos positivos pueda tener consecuenciasgraves (40). Por estos motivos se decidió elegir como puntode corte 60 ml/min, límite superior del intervalo deconfianza del 95% del ClCr, que en el modelo Icorresponde a un valor de probabilidad igual a 0,5. Este valorresultó de la aplicación del criterio de McNeil etal.
Además,las curvas de rendimiento diagnóstico permiten cuantificarde forma global la validez de la prueba diagnóstica paratodos los posibles puntos de corte mediante el AUCROC. Asu vez este parámetro puede ser utilizado en lacomparación de diferentes pruebas diagnósticas paraun mismo objetivo. En este trabajo se ha utilizado estatécnica para seleccionar como prueba diagnóstica elmodelo II en detrimento del modelo I. El AUCROCrepresenta la probabilidad de clasificar correctamente a un par desujetos a partir de los resultados de la prueba diagnóstica,uno con la condición estudiada y otro sin ella,seleccionados al azar de la población general. En nuestrocaso el modelo I presentaba un AUCROC de 85% y puedeinterpretarse de la siguiente forma: un paciente seleccionado alazar del grupo de pacientes que presentan un valor deCpvalle < 1 mg/l tendrá el 85% de las veces unClCr mayor que un paciente elegido al azar del grupo depacientes con Cpvalle > 1 mg/l.
El valor deAUCROC puede interpretarse según los criteriosestablecidos por Swets (41). Así, valores comprendidos entre0,5 y 0,7 indican una baja exactitud, entre 0,7 y 0,9 pueden serútiles para algunos propósitos y un valor mayor de0,9 indica una exactitud alta. En este sentido, el valor deAUCROC obtenido en base al ClCr puedeconsiderarse útil para la predicción deCpvalle > 1 mg/l, y aunque no puede considerarse comoun test altamente discriminante, sí se presenta como unavariable con un cociente de probabilidad (o razón deverosimilitud) para los resultados positivos y una probabilidadpostest aceptable (39).
Lamonitorización de las Cpvalle solicitadas a launidad de farmacocinética clínica deberánsometerse a este nuevo criterio con el fin de optimizar laeficiencia de la individualización posológica de losaminoglucósidos. Ahora bien, estos resultados debeninterpretarse con cautela por cuanto que la prevalencia deCpvalle > 1 mg/l en esta población es delorden del 50%. La aplicación de esta prueba en situacionesdonde la prevalencia pueda variar de forma notable puede ocasionarun incremento de resultados falsos (Fig. 3). En este sentido antesde implementar la prueba diagnóstica debe evaluarse suutilidad en base a la prevalencia existente y adaptar el punto decorte óptimo a la población de pacientes subsidiariosde tratamiento.
En definitiva,se puede concluir que la utilidad clínica de ladeterminación de la Cpvalle de gentamicina parasu individualización posológica es escasa cuando elpaciente recibe 240 mg en dosis única diaria y presenta unaclaramiento de creatinina superior a 60 ml/min.
BIBLIOGRAFIA
1.Barclay ML,Begg EJ. Ammoglycoside toxicity and relation to dose regimen.Adverse React Toxicol Rev 1994;13:207-34.
2.Moore RD,Smith CR, Lietman PS. The association of aminoglycoside plasmalevels with mortality in patients with gram-negative bacteriemia. JInfect Disease 1984;149:443-8.
3.Konrad F,Wagner R, Neumeister B, Rommel H, Georgieff M. Studies on drugmonitoring in thrice and once daily treatment with aminoglycosides.Intensive Care Med 1993;19:215-20.
4.Begg EJ,Barclay ML. Aminoglycosides - 50 years on. Br J Clin Pharmacol1995;39:597-603.
5.Crist KD,Nahata MC, Ety J. Positive impact of therapeutic drug monitoringprogram on total aminoglycoside dose and cost hospitalizations.Ther Drug Monit 1987;9:306-10.
6.Bertino JS,Rodvold KA, Destache CJ. Cost considerations in therapeutic drugmonitoring. Clin Pharmacokinetic 1994;26:71-81.
7.Hatala R,Dinh T, Cook D. Once-daily aminoglycosides dosing inimmunocompetent adults: a meta-analysis. Ann Intern Med1996;124:717-25.
8.Finell DL,Davis GA, Cropp CD, Ensom MHH. Validation of Hartford nomogram intrauma surgery patients. Ann Pharmacother1998;32:417-21.
9.Ali MZ, GoetzMB. A meta-analysis of the relative efficacy and toxicity of asingle daily dosing versus multiple daily dosing ofamimoglycosides. Clin Infect Dis 1997;24:796-809.
10.Bailey TC,Little JR, Littenberg B, Reichley RM, Dunagan WC. A meta-analysisof extended-interval dosing versus multiple daily dosing ofaminoglycosides. Clin Infect Dis 1997;24:786-95.
11.Barza M,Ioannidis JPA, Cappelleri JC, Lau J. Single or multiple daily dosesof aminoglycosides: a meta-analysis. Br Med J1996;312:338-45.
12.Nicolau DP,Wu AH, Finocchiaro S, Udeh E, Chow MS, Quintiliani R, et al.Once-daily aminoglycoside dosing: impact on request and cost fortherapeutic drug monitoring. Ther Drug Monit1996;18:263-6.
13.Barclay ML,Begg EJ, Hickling KG. Whats is the evidence for once dailyaminoglycoside therapy. Clin Pharmacokinet1994;27:32-48.
14.Nicolau DP,Freeman CD, Belliveau PP, Nithingale CH, Ross JW, Quintiliani R.Experience with once-daily aminoglycoside program administered to2,814 adult patients. Antimicrob Agents Chemother1995;39:650-5.
15.Schentag JJ,Nix DE, Forrest A, Adelman MH. AUIC - The universal parameterwithin the constraint of a reasonable dosing interval. AnnPharmacother 1996;30:1029-31.
16.Bates RD,Nahata MC. Once-daily administration of aminoglycosides. AnnPharmacother 1994;28:757-66.
17.Sanford JP,Gilbert DN, Moellering RC, Sande ME. The Sanford Guide toAntimicrobial Therapy. Viena: Ed. Antimicrobial Therapy, Inc;1997:62.
18.Kumana CR,Yuen KY. Parenteral aminoglycoside therapy: selection,administration and monitoring. Drugs 1994;47:902-13.
19.Marik PE,Lipman J, Kobilski S, Scribante J. A prospective randomized studycomparing once - versus twice daily amikacin dosing in criticallyill adult and pediatric patients. J Antimicrob Chemother1991;28:753-64.
20.Begg EJ,Barclay ML, Dufull SB. A suggested approach to once-dailyaminoglycoside dosing. Br J Clin Pharmacol1995;39:605-9.
21. MateuGarcía MT. Farmacocinética poblacional de gentamicinay tobramicina en pacientes críticos (tesis doctoral).Valencia; 1997.
22.Devine BJ.Gentamicin therapy. Drug Intell Clin Pharm 1974;8:650-5.
23.Bauer LA,Blouin RA, Griffen WO, Record KE, Bell RM. Amikacinpharmacokinetics in morbidly obese patients. Am J Hosp Pharm1980;34:5197-22.
24.Cockroft DW,Gault MH. Prediction of creatinine clearance from serum creatinine.Nephron 1976;16:31-41.
25.Abbottbase® Pharmacokinetics Systems OperationsManual. Version 1.00. Illinois: Abbott Laboratories;1991.
26.Hosmer DW,Lemeshow S. Applied logistic regression. New York: Wiley;1989.
27.Yamamoto N,Watanabe T, Katsumata N, Omuro Y, Ando M, et al. Construction andvalidation of a practical prognostic index for patients withmetastatic breast cancer. J Clin Oncol 1998;16:2401-8.
28.McNeil BJ,Keeler E, Adelstein SJ. Primer on certain elements of medicaldecision making. N Engl J Med 1975;293:211-5.
29.Jaeschke R,Guyatt GH, Sackett DL for the Evidence-Based Medicine WorkingGroup. Users' guides to medical literature. VI. How to use anerticle about a diagnostic test. A. Are the results of the studyvalid? JAMA 1994;271:703-7.
30.Burgueño MJ, García-Bastos JL,González-Buitrago JM. Las curvas ROC en la evaluaciónde pruebas diagnósticas. Med Clín1995;104:661-70.
31. SPSS.Statistical Package for Social Sciences, version 7.5 2S for Windows(programa informático).
32.MacGowan A,Reeves D. Serum aminoglycosides concentrations: the case forroutine monitoring. J Antimicrob Agents 1994;34:829-37.
33.El Bakri F,Pallet A, Smith AG, Duncombe AS. Ototoxicity induced by once-dailygentamicin. Lancet 1998;351:1407-8.
34.D'ArgenioDZ. Optimal sampling times for pharmacokinetic experiments. JPharmacokinet Biopharm 1981;9:739-56.
35.Aarons L,Vozeh S, Wenk M, Weiss P, Follath F. Population pharmacokinetics oftobramyicin. Br J Clin Pharmacol 1989;28:305-14.
36.Dufull SB,Kirkpatrick CMJ, Begg EJ. Comparison of two Bayesian approaches todose individualization for once daily dosing regimens. Br J ClinPharmacol 1997;43:125-35.
37.Kaufmann GR,Vozeh S, Wenk M, Haefeli W. Safety and efficacy of two-compartmentBayesian feedback program for therapeutic tobramycin monitoring indaily clinical use and comparison with a non-Bayesian onecompartment model. Ther Drug Monit 1997; 20:172-80.
38.SchumacherGE, Barr JT. Applying decision analysis in therapeutic drugmonitoring: using receiver-operating curves in comparativeevaluations. Clin Pharm 1986;5:239-46.
39. Sackett DL,Haynes RB, Tungwell P. Epidemiología clínica. Unaciencia básica para la medicina clínica. Madrid:Díaz Santos; 1989.
40.Galen RS,Gambino SR. Beyond normality: the predictive value and efficiencyof medical diagnoses. Nueva York: J Wiley and Sons, Inc;1975.
41. Swets JA.Measuring the accuracy of diagnostic systems. Science1988;240:1285-93.