En la actualidad los efectos adversos asociados al tratamiento antirretroviral es la principal causa de discontinuación de este tipo de terapia, tanto en ensayos clínicos como en la práctica clínica habitual.
Por otro lado, debido al cambio de orientación que nuestra profesión ha sufrido en los últimos años, nos enfrentamos a la necesidad de establecer una relación totalmente diferente con el paciente, realizando atención farmacéutica de manera directa y eficaz, en un marco asistencial de corresponsabilidad en los resultados terapéuticos.
Las intervenciones farmacéuticas deben estar dirigidas a mejorar la calidad de vida de los pacientes, lo que solo puede conseguirse con un abordaje multidisciplinar e individualizado y ajustada a los nuevos patrones de toxicidad de los fármacos actualmente utilizados.
El farmacéutico que realiza esta labor debe saber interpretar estos efectos adversos, dar una información precisa al paciente tanto del tratamiento farmacológico como no farmacológico del mismo y realizar un seguimiento farmacoterapéutico correcto donde se establezcan claramente los criterios de derivación a las consultas médicas.
El objetivo de este documento es establecer las líneas básicas para que el farmacéutico de hospital realice una labor uniforme y clara en la prevención, identificación y manejo de los principales efectos adversos: gastrointestinales, cardiovasculares, dermatológicos, a nivel del sistema nervioso central y renales, asociados al tratamiento antirretroviral.
At present, the side effects associated with antiretroviral treatment are the main reasons for discontinuation of this kind of therapy, both in clinical trials and in regular clinical practise.
On the other hand, due to the change of direction that our profession has suffered in recent years, we face the need to establish a different relationship with the patient, achieving direct and effective Pharmaceutical Care within a framework of shared responsibility for therapeutic results.
Pharmacist interventions should be aimed at improving the quality of life of patients, which can only be achieved with a multidisciplinary approach and individualised and adjusted to new patterns of toxicity of the drugs currently used.
The pharmacist who does this work must know how to interpret these side effects, giving accurate information to the patient about both pharmacological and non-pharmacological treatment and correct pharmaceutical follow-up which clearly sets forth the criteria for referral to medical appointments.
The aim of this paper is to establish baselines so that the hospital pharmacist can perform clearly and uniformly in the prevention, identification and management of major side effects: gastrointestinal, cardiovascular, dermatological, at the central nervous system and kidney level, associated with antiretroviral therapy.
La introducción del tratamiento antirretroviral de gran actividad (TARGA) ha conseguido disminuir significativamente la morbilidad y mortalidad asociadas a la infección por el VIH. Sin embargo, a día de hoy, para conseguir los objetivos terapéuticos marcados en este tipo de pacientes, supresión virológica mantenida y recuperación inmunológica, sigue siendo necesario un grado elevado de cumplimiento terapéutico. Por desgracia, la complejidad de estos tratamientos (número de formas farmacéuticas, requerimientos dietéticos, interacciones, etc.) hacen que, a menudo, sea difícil realizar correctamente la terapia prescrita. Los factores asociados con el incumplimiento terapéutico son complejos y generalmente se deben a la interacción entre variables relacionadas con el individuo, la enfermedad, el régimen terapéutico, el equipo asistencial y el sistema sanitario1.
En este sentido, la aparición de efectos adversos (EA) constituye un factor claramente relacionado con el cumplimiento. El TARGA está asociado con un elevado número de EA que tienen consecuencias tanto a corto como a largo plazo. En cualquier caso, todas tienen una gran relevancia por diferentes motivos: por un lado, los leves son frecuentes y disminuyen la calidad de vida del paciente (náuseas, cefalea, diarrea, etc.) y, por otro lado, los graves pueden provocar ingresos hospitalarios e incluso, en algunos casos, pueden hacer peligrar la vida del paciente (acidosis láctica, esteatosis hepática, pancreatitis, exantema grave, etc.).
Por tanto, en algunas ocasiones, las consecuencias clínicas de estos EA en términos de morbilidad y mortalidad son claras, provocando una acción por parte del clínico que depende del tipo y la gravedad de los síntomas. En otros muchos casos, la sintomatología descrita por el paciente se considera relativamente benigna en términos de efectos directos en la salud y se prefiere una actitud mucho mas reservada a la hora de introducir cambios en la terapia. Sin embargo, los síntomas benignos asociados al tratamiento antirretroviral pueden tener importantes consecuencias clínicas a largo plazo. Los resultados de varios estudios muestran que los pacientes pueden modificar o interrumpir el TARGA para minimizar estos EA y aumentar su calidad de vida2.
No obstante, aunque el tipo y la gravedad de los EA desempeñan un papel muy importante en la falta de cumplimiento terapéutico, la relación entre ambos factores es más significativa cuando se evalúan los síntomas percibidos por el paciente en vez de la relevancia clínica. En el estudio ADICONA3 los pacientes incumplidores refirieron una media de EA superior a la de los pacientes cumplidores.
Diferentes estudios4,5 han mostrado como la aparición de EA es la principal causa de discontinuación del TARGA, tanto en investigaciones realizadas en la práctica clínica habitual como en ensayos clínicos realizados para los últimos fármacos aprobados por las diferentes agencias reguladoras.
Por otro lado, debido al cambio de orientación que nuestra profesión ha sufrido en los últimos años nos enfrentamos a la necesidad de establecer una relación totalmente diferente, incluso nueva, con el paciente. Realizar atención farmacéutica de manera directa y eficaz sigue siendo, actualmente, uno de los mayores retos a los que nos enfrentamos y nos exige establecer en el marco asistencial una relación de corresponsabilidad6.
En los últimos años, han sido varios los trabajos publicados en los que se hacia hincapié en la importancia y el beneficio de la intervención farmacéutica en este tipo de pacientes tanto para la mejora de la adherencia y los resultados clínicos como en su marcado coste-efectividad7,8.
Entendiendo, pues, que las intervenciones farmacéuticas deben estar dirigidas a mejorar la calidad de vida de los pacientes, lo que solo puede conseguirse con un abordaje multidisciplinar e individualizado y ajustada a los nuevos patrones de toxicidad de los fármacos actualmente utilizados, este documento nace con la intención de establecer las líneas básicas para que el farmacéutico de hospital realice una labor uniforme y clara en la prevención, identificación y manejo de los EA asociados al tratamiento antirretroviral.
El documento, que se presenta como un resumen de un futuro documento que incluirá otros EA menos frecuentes, así como algoritmos de decisión y un desarrollo de la actividad más pormenorizado, se ha estructurado en diferentes capítulos de acuerdo con su interés práctico asistencial, en base a los conocimientos científicos actuales, a partir de unas normas precisas y homogéneas de cara a facilitar la consulta del mismo y la aplicación de las recomendaciones realizadas en la práctica diaria. A esto le ha seguido una revisión posterior por parte de todos los autores para perfilar aspectos menos claros, correlacionar la información de los capítulos entre sí y evitar posibles redundancias.
Parte II: efectos adversosEfectos adversos gastrointestinales: náuseas, vómitos y diarreasLas manifestaciones gastrointestinales (GI) son, probablemente, las más frecuentes en los pacientes con infección por el VIH. Son de origen multifactorial y no solo son incómodos y disminuyen la calidad de vida del paciente, sino que además pueden interferir en la absorción de fluidos, alimentos y otros medicamentos, incrementando el riesgo de deshidratación, alteraciones en los procesos bioquímicos del organismo, desnutrición, pérdida de peso y reducción de las concentraciones plasmáticas de los fármacos9,10.
La introducción del TARGA ha mejorado el estado inmunológico de los pacientes, reduciendo drásticamente la incidencia de infecciones oportunistas responsables de, entre otros, los cuadros de enteropatía. Sin embargo, el tratamiento prolongado con determinadas combinaciones de fármacos incrementa la incidencia de efectos GI, sobre todo diarrea de origen no infeccioso, estando presente en más de la cuarta parte de los pacientes en tratamiento11.
Las náuseas, vómitos y diarreas son los EA más habituales de los antirretrovirales al inicio del tratamiento y uno de los principales motivos de cambio del tratamiento antirretroviral e incluso de abandono del tratamiento. Aunque la toxicidad GI es inespecífica, puesto que puede ser producida por varios antirretrovirales independientemente del grupo al que pertenezcan, se asocia muy frecuentemente a la utilización de inhibidores de la proteasa (IP) y algunos inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) como zidovudina (AZT) o tenofovir (TDF).
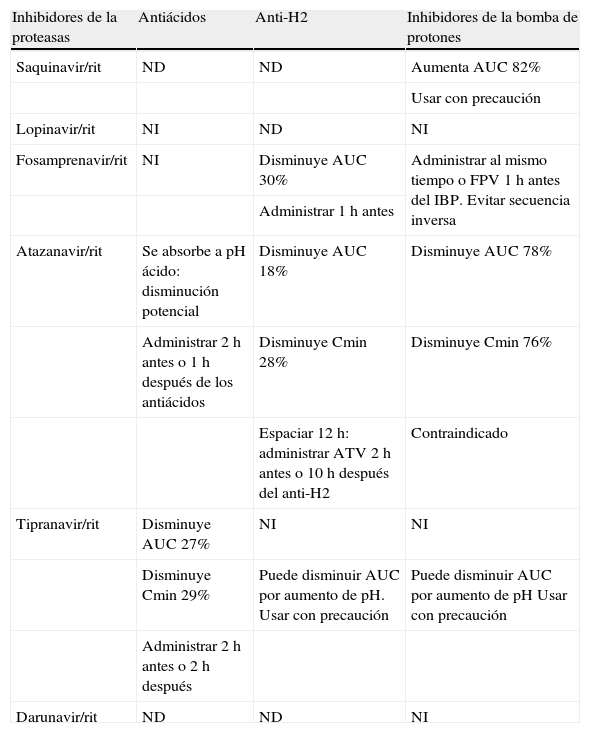
InterpretaciónEl farmacéutico debe conocer la incidencia o posibilidad de producir toxicidad GI de los diferentes fármacos antirretrovirales. También se debe asegurar que el paciente no esté recibiendo otra medicación que pueda provocar o agudizar estas reacciones, bien por efecto yatrogénico de la medicación concomitante o por la presencia de interacciones farmacocinéticas y/o farmacodinámicas que provoquen un aumento en las concentraciones plasmáticas de los antirretrovirales con mayor potencial de toxicidad GI. En caso de que el paciente esté recibiendo tratamiento para estos EA, hay que prestar especial atención a las interacciones que pueden presentarse con antiácidos, antiH2 e inhibidores de la bomba de protones (IBP) (tabla 1).
Interacciones de los inhibidores de la proteasa con antiácidos, anti-H2 e inhibidores de la bomba de protones
| Inhibidores de la proteasas | Antiácidos | Anti-H2 | Inhibidores de la bomba de protones |
| Saquinavir/rit | ND | ND | Aumenta AUC 82% |
| Usar con precaución | |||
| Lopinavir/rit | NI | ND | NI |
| Fosamprenavir/rit | NI | Disminuye AUC 30% | Administrar al mismo tiempo o FPV 1h antes del IBP. Evitar secuencia inversa |
| Administrar 1h antes | |||
| Atazanavir/rit | Se absorbe a pH ácido: disminución potencial | Disminuye AUC 18% | Disminuye AUC 78% |
| Administrar 2h antes o 1h después de los antiácidos | Disminuye Cmin 28% | Disminuye Cmin 76% | |
| Espaciar 12h: administrar ATV 2h antes o 10h después del anti-H2 | Contraindicado | ||
| Tipranavir/rit | Disminuye AUC 27% | NI | NI |
| Disminuye Cmin 29% | Puede disminuir AUC por aumento de pH. Usar con precaución | Puede disminuir AUC por aumento de pH Usar con precaución | |
| Administrar 2h antes o 2h después | |||
| Darunavir/rit | ND | ND | NI |
AUC: área bajo la curva; Cmin: concentración mínima; FPV: fosamprenavir; IBP: inhibidores de la bomba de protones; ND: no datos; NI: no interacciona; rit: ritonavir.
Es importante informar al paciente, antes de iniciar el TARGA, de los posibles EA, con la finalidad de que puedan participar en el reconocimiento precoz y en su manejo, evitando así incumplimientos terapéuticos, abandonos o cambios de fármacos innecesarios. Generalmente son efectos leves y transitorios que suelen desaparecer a las 3–5 semanas de iniciar el TARGA.
Varias medidas han resultado beneficiosas para el control de los efectos GI y, de modo general, se deben realizar recomendaciones de tipo higiénicas y dietéticas como administrar la medicación junto con alimentos, siempre que sea posible, mejorar los hábitos alimenticios y, si con estas medidas no se controlan, puede ser necesario administrar antieméticos y/o antidiarreicos12.
Tratamiento no farmacológico13,14Durante las primeras semanas tras del inicio del TARGA, una dieta adecuada puede ayudar a controlar estos efectos. En la mayoría de los casos, el organismo se habitúa al TARGA y las molestias desaparecen o se minimizan al cabo de unas semanas.
Tanto en los pacientes que presentan vómitos como en los que presentan diarrea, es importante evitar la deshidratación y los desequilibrios electrolíticos. En ambos casos debemos recomendar mantener una buena hidratación, beber líquidos como zumos de frutas, fuera de las comidas, frecuentemente y en pequeñas cantidades.
Las tablas 2–4 muestran las recomendaciones dietéticas e higiénicas para el tratamiento de las náuseas y vómitos y de las diarreas, respectivamente.
Recomendaciones dietéticas e higiénicas para el tratamiento de las náuseas y vómitos
| Recomendar | Evitar |
|
|
Recomendaciones dietéticas e higiénicas ante la aparición de diarreas por antirretrovirales
| Recomendar | Evitar |
|
|
Fases de iniciación de la dieta ante la aparición de efectos adversos gastrointestinales por antirretrovirales
| 1.a Fase |
| Después de un tiempo de ayuno, iniciar la ingesta de pequeñas cantidades con: agua de arroz, agua con limón o infusión de té clara con sacarina, suero oral |
| 2.a Fase |
| Además de los líquidos anteriores, introducir: consomé sin grasa, sopa de arroz, arroz hervido caldoso o harina de arroz (papillas infantiles), pescado blanco o pollo hervido, en pequeñas cantidades |
| 3.a Fase |
| Aumentar cantidades y seguir introduciendo nuevos alimentos según tolerancia: arroz blanco, patata o pasta fina cocida, zanahoria en puré o cocida, jamón cocido o pechuga de pavo (poco graso), yogur natural desnatado con sacarina, pan tostado, galletas tipo “María”, manzana o pera cocida, manzana rallada o en zumo, plátano muy maduro |
| 4.a Fase |
| Aumentar cantidades y seguir introduciendo nuevos alimentos según tolerancia: pollo, ternera o pescado blanco a la plancha, manzana asada, pera de agua muy madura, puré de verduras tamizado (pequeñas cantidades) |
| Observaciones |
| Una vez superada la fase crítica, probar tolerancia con los restantes alimentos, en muy pequeñas cantidades y en diferentes días |
Si la diarrea es muy intensa (4–6 deposiciones poco consistentes en 24h), se recomienda mantener en reposo el tubo digestivo entre 6 y 24h y utilizar fórmulas rehidratantes. Las bebidas ricas en minerales o la combinación de una cucharada de sal y 4 cucharadas de azúcar en un litro de agua puede ser muy útil para evitar la deshidratación y los desequilibrios electrolíticos. Tras este período, la ingesta de alimentos líquidos y sólidos debe realizarse en pequeñas cantidades y de forma frecuente, ampliando el horario y la cantidad según tolerancia.
Si con las medidas higiénico-dietéticas descritas no se consigue el control de los síntomas GI, podemos recurrir al tratamiento farmacológico.
Tratamiento farmacológicoLos antieméticos de uso más frecuente, como la metoclopramida, no presentan interacciones clínicamente significativas con ninguna de las clases de fármacos antirretrovirales y pueden recomendarse con seguridad para el tratamiento de las náuseas y/o vómitos. La dosis recomendada es de 15–60mg/24h, repartidos en 2–4 dosis, antes de las comidas.
Para el tratamiento de la diarrea, siempre y cuando no se haya podido controlar con medidas dietéticas, se puede recomendar la utilización de loperamida. Este fármaco no presenta interacciones documentadas con el TARGA, excepto con tipranavir (TPV) con el que se ha visto una reducción tanto en los niveles de loperamida como en la Cmin de TPV. La dosis recomendada es 4mg iniciales, seguidos de 2mg tras cada deposición (dosis máxima diaria: 16mg).
Seguimiento farmacoterapéutico:Se deben utilizar herramientas que permitan objetivar y clasificar la gravedad del efecto GI que se presenta en el paciente y evitar la derivación continua a consultas médicas no programadas por toxicidad GI leve-moderada. La escala de toxicidad utilizada más frecuentemente en los estudios realizados es la del AIDS Clinical Trials Group (ACTG)15, que categoriza los efectos GI en 4 grados en función de la gravedad.
Deben ser motivo de derivación a consulta médica:
- •
Toxicidad GI severa-grave (grado 3–4). Si los vómitos y diarreas son intensas o de larga duración, se debe prestar atención a los signos de deshidratación como son sed, fatiga, ansiedad o irritación, orina de color amarillo oscuro o poca cantidad, ojos hundidos, fiebre, piel seca, taquicardia.
- •
Paciente inmunocomprometido con diarreas prolongadas que no ceden con las recomendaciones no farmacológicas y farmacológicas propuestas. Probablemente estén causadas por una infección microbiana que deberá valorar el médico para pautar tratamiento antimicrobiano y/o retirar el TARGA.
- •
Si existe dolor abdominal agudo.
- •
Si a pesar de haber clasificado la toxicidad GI como leve-moderada (grado 1–2), se encuentra comprometida la calidad de vida del paciente o podemos sospechar un posible abandono del TARGA
La hiperbilirrubinemia normalmente ocurre como consecuencia de enfermedad hepática y obstrucción biliar, pero también aparece cuando existe una lisis masiva de hematíes16. Generalmente los niveles normales de bilirrubina son menores de 1mg/dl (18micromol/l), representando la bilirrubina conjugada menos del 20% del total.
La ictericia se manifiesta cuando la bilirrubina en sangre se incrementa de 2 a 3mg/dl el límite superior normal (grado 2–4). Habitualmente antes de producirse ictericia se produce coluria, coloración oscura de la orina por excreción de la bilirrubina a través de los riñones.
InterpretaciónCuando se determina una elevación de bilirrubina en sangre, el primer paso es verificar si se trata de una hiperbilirrubinemia de predominio conjugado («directa») o no conjugada («indirecta»). Habitualmente se habla de hiperbilirrubinemia de predominio directo cuando la bilirrubina directa representa más del 30% de la bilirrubina total17.
- •
Hiperbilirrubinemia directa:
Se asocia a enfermedades hepáticas debido a una insuficiente capacidad de excreción. Su elevación es uno de los hallazgos característicos de los cuadros colestásicos y se acompaña de elevación de fosfatasas alcalinas y GGT. Su aumento puede estar dado por varias causas como pueden ser obstrucción de la vía biliar, enfermedades hepáticas colestásicas, hepatitis agudas, cirrosis o algunas enfermedades genéticas poco frecuentes
- •
Hiperbilirrubinemia indirecta:
Se genera por una producción aumentada de bilirrubina, habitualmente por aumento del catabolismo de hemoglobina, por ejemplo, en anemias hemolíticas. Cuando existe hemólisis, otros parámetros sanguíneos se encuentran alterados como son VCM elevada, LDH elevada y haptoglobina disminuida. La hemólisis raramente produce elevaciones de bilirrubina mayores de 6mg/dl. Otras causas frecuentes de hiperbilirrubinemia indirecta son el síndrome de Gilbert, caracterizado por una disminución de la capacidad hepática de conjugación de la bilirrubina con parámetros hepáticos normales o el de Crigler-Najjar, aunque de forma más infrecuente.
El aumento de los niveles de bilirrubina en sangre está asociado también al tratamiento con atazanavir (ATZ), sobre todo bilirrubina indirecta o no conjugada y está directamente relacionado con las concentraciones en plasma del fármaco15.
La elevación de los niveles de bilirrubina total grado 3–4 ocurre en el 22–39% de los pacientes tratados con ATZ 400mg/d y aproximadamente en el 45% de los tratados con ATZ 300mg/d potenciado con ritonavir (ATZ/r). Estos incrementos de bilirrubina habitualmente no van acompañados de aumento de transaminasas y daño hepatocelular o complicaciones neurológicas, normalmente el efecto es reversible y no suelen causar problemas significativos, aunque alrededor de un 8% de los pacientes pueden desarrollar síntomas más graves de ictericia. No se recomienda reducción de dosis de ATZ porque puede provocar una disminución del efecto terapéutico o desarrollar resistencias. Incrementos de bilirrubina grado 4 ocurre en el 9% de los pacientes tratados con ATZ/r 300mg vs 4% de los que reciben ATZ 400mg18–22.
No hay datos a largo plazo disponibles sobre la repercusión de las elevaciones persistentes de la bilirrubina total >5 veces el límite superior normal (grado 4).
Información al pacienteSe debe advertir al paciente de la posible aparición de los EA asociados a ATZ, sobre todo en las 2–4 semanas siguientes al inicio del tratamiento. Aunque generalmente es bien tolerado y tiene poca relevancia clínica, se debe informar de los síntomas o signos que habitualmente van asociados a hiperbilirrubinemia como son coloración amarillenta de la piel, que generalmente comienza en la cara y se extiende hacia el resto del cuerpo, coloración marrón de orina y heces, falta de apetito o letargo. Se debe insistir en que, habitualmente, no es un EA por el cual se deba acudir a urgencias y si aparece de forma llamativa y por motivos estéticos es demasiado molesto para el paciente, puede acudir al médico para que valore un cambio de tratamiento.
Seguimiento farmacoterapéuticoLa herramienta que objetiviza y clasifica la gravedad de la hiperbilirrubinemia utilizada más frecuentemente en los estudios realizados es la del ACTG15, que categoriza los efectos GI en 4 grados en función de la gravedad.
En pacientes coinfectados en tratamiento con ATZ y ribavirina, se debe realizar una estrecha monitorización de los parámetros analíticos ya que los niveles de bilirrubina en sangre pueden verse seriamente incrementados.
En hiperbilirrubinemia grado 3–4 se debe recomendar la valoración médica así como en aquellos casos en los que va acompañado de un aumento de transaminasas, efecto asociado a daño hepático.
Efectos adversos cardiovasculares: dislipemias, lipodistrofia y alteraciones de la glucosaDislipemiasInterpretaciónEs la alteración metabólica más frecuente. Se caracteriza por aumento de niveles plasmáticos de colesterol total, colesterol- LDL y triglicéridos. En relación a la etiología de las dislipemias algunos autores postulan que se trata de un proceso multifactorial23 en el que podrían influir la propia infección por el VIH, la recuperación nutricional e inmunológica y la inhibición del metabolismo celular de los lípidos inducida por los antirretrovirales24.
La dislipemia se ha relacionado con la utilización de IP, pero también con otros antirretrovirales como los inhibidores de la transcriptasa inversa análogos de nucleosidos (ITIAN). Respecto a los IP no todos inducen dislipemias en igual medida: fosamprenavir (FPV) y ATZ, sobre todo no potenciados, tienen un mejor perfil lipídico. Saquinavir (SQV/r) (1.500/100 BID o QD) y darunavir (DRV/r) (600/100 BID o 800/100 QD) potenciados presentan perfiles intermedios. Por último, el perfil lipídico más desfavorable, especialmente en el aumento de triglicéridos, se corresponde con fosamprenavir (FPV/r) (1.400/100 QD o 700/100 BD), lopinavir (LPV/r) (400/100 BD) o tipranavir (TPV/r) (500/200 BID)25 potenciados.
El grado de alteración metabólica (lipídicas e hidrocarbonadas) inducida por distintos antirretrovirales se muestra en la tabla 526.
Grado de alteración metabólica (lipídicas e hidrocarbonadas) inducida por fármacos y por familias de fármacos antirretrovirales
| Menor | Mayor | ||
| ITINN | ITIAN | IP | |
| Menor | Nevirapina | Lamivudina | Atazanavir |
| Emtricitabina | Fosamprenavir | ||
| Abacavir | |||
| Tenofovir | |||
| Efavirenz | Zidovudina | Atazanavir/r | |
| Didanosina | Darunavir/r | ||
| Saquinavir/r | |||
| Lopinavir/r | |||
| Fosamprenavir/r | |||
| Estavudina | Indinavir/r | ||
| Tipranvir/r | |||
| Mayor | Ritonavir dosis plenas | ||
IP: inhibidores de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósidos; ITINN: inhibidores de la transcriptasa inversa no análogos de nucleósidos; rit: ritonavir.
Los datos disponibles de los inhibidores de la fusión (enfuvirtida), inhibidor de la integrasa (raltegravir) y antagonistas del correceptor CCR5 (maraviroc) sugieren que estos fármacos tienen escaso impacto metabólico.
La importancia de este EA radica en que las dislipemias y en general las alteraciones metabólicas, suponen, al igual que en el resto de población no VIH, un importante factor de riesgo de evento coronario y cardiovascular. Además de las dislipemias, otros factores de riesgo asociados a los eventos cardiovasculares y coronarios serían los mismos que para la población general: tabaquismo, hipertensión, edad superior a 55 años en hombres y a 65 años en mujeres y diabetes27.
Información al pacienteIndependientemente del nivel de riesgo cardiovascular, se debe insistir a los pacientes en llevar a cabo medidas generales de cambios en el estilo de vida, control de la hipertensión arterial y reducción de la grasa visceral. Entre las medidas higiénico-dietéticas generales y de cambios en el estilo de vida se encuentran26:
- •
Abandono del tabaco: es la medida que más reduce el riesgo cardiovascular (RCV), hasta en un 50% y es aditivo a los beneficios obtenidos con otras intervenciones28–30. Si el paciente no lo consigue tras un primer intento es conveniente remitirlo a la consulta antitabaco. Es posible utilizar sustitutos de nicotina (chicles, parches, etc.), vareniclina o bupropión. Considerar que este último puede interaccionar con IP e inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN).
- •
Dieta sana: las calorías ingeridas en la dieta deben ir acordes con el ejercicio realizado, siendo necesaria la reducción del aporte calórico si hay sobrepeso. Se recomienda reducir la ingesta de grasa por debajo del 30%, el colesterol por debajo de 300mg/día y la reducción de grasas saturadas por debajo del 7% del aporte calórico. Las dietas deben ser ricas en frutas, verduras y alimentos ricos en fibra así como pescado, aves (sin piel) y carnes magras.
- •
Ejercicio físico: el estilo de vida activo previene la obesidad, la hipertensión y la diabetes. Es conveniente realizar ejercicio físico moderado.
El control de los niveles plasmáticos de colesterol también es un factor decisivo para la reducción del riesgo cardiovascular, reduciéndose este en un 20–25% por cada 39mg/ml de colesterol total que se consiga disminuir.
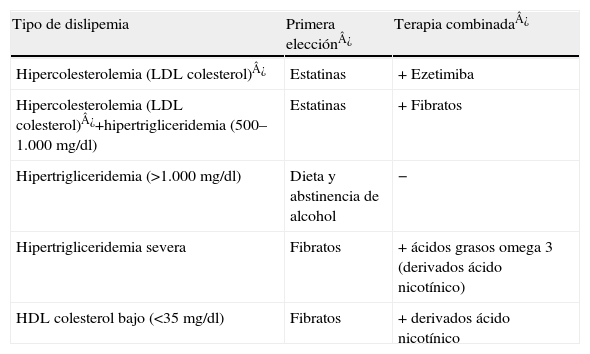
El tratamiento farmacológico empleado para el tratamiento de las dislipemias se muestra en la tabla 625,26:
Tratamiento recomendado en el manejo de las dislipemias
| Tipo de dislipemia | Primera elección¿ | Terapia combinada¿ |
| Hipercolesterolemia (LDL colesterol)¿ | Estatinas | + Ezetimiba |
| Hipercolesterolemia (LDL colesterol)¿+hipertrigliceridemia (500–1.000mg/dl) | Estatinas | + Fibratos |
| Hipertrigliceridemia (>1.000mg/dl) | Dieta y abstinencia de alcohol | − |
| Hipertrigliceridemia severa | Fibratos | + ácidos grasos omega 3 (derivados ácido nicotínico) |
| HDL colesterol bajo (<35mg/dl) | Fibratos | + derivados ácido nicotínico |
¿Por encima del punto de corte de LDL colesterol según el riesgo de evento CVC a 10 años.
Realizar seguimiento de niveles plasmáticos de colesterol antes de iniciar terapia, a las 4–12 semanas tras el inicio o modificación del tratamiento y anualmente si los niveles de colesterol se encuentran por debajo del punto de corte según el riesgo de evento cardiovascular a 10 años.
CVC: riesgo cardiovascular.
Si fuera necesario se puede combinar estatinas y fibratos, pero en este caso es imprescindible, sobretodo si el paciente está siendo tratado con IP vigilar la aparición de EA por estatinas (alteraciones musculares y/o hepáticas)31.
El ácido nicotínico y las resinas secuestradoras de ácidos biliares presentan una eficacia limitada y frecuentes EA (trastornos gastrointestinales, mialgias, cefaleas y fatiga), por lo que debe restringirse su uso en la medida de lo posible.
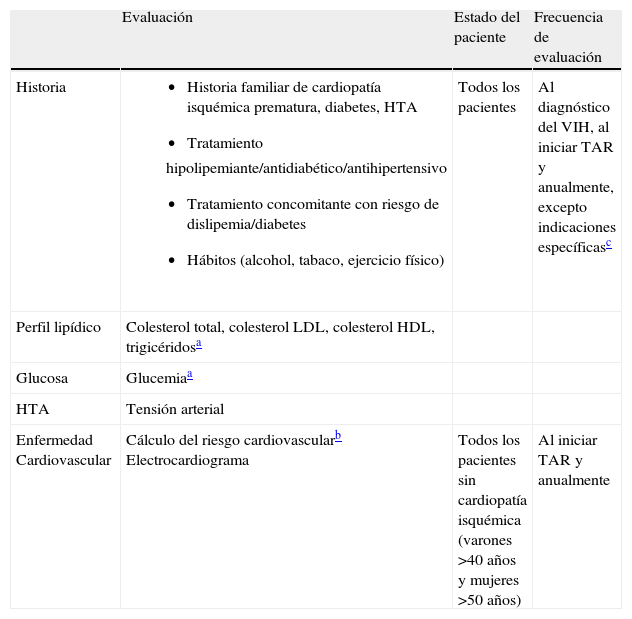
Seguimiento farmacoterapéuticoEs conveniente realizar un screening para detectar posibles alteraciones metabólicas y valorar el RCV en todos los pacientes. Para ello, es importante la elaboración de una correcta historia clínica que evalúe los antecedentes familiares de eventos cardiovasculares, diabetes y otros factores de riesgo. De igual manera se debe realizar determinaciones periódicas del perfil lipídico y glucemia, así como realizar el cálculo del riesgo de sufrir evento cardiovascular a diez años. Dicho screening se muestra en la tabla 727.
Evaluación de alteraciones metabólicas y RCV en pacientes VIH
| Evaluación | Estado del paciente | Frecuencia de evaluación | |
| Historia |
| Todos los pacientes | Al diagnóstico del VIH, al iniciar TAR y anualmente, excepto indicaciones específicasc |
| Perfil lipídico | Colesterol total, colesterol LDL, colesterol HDL, trigicéridosa | ||
| Glucosa | Glucemiaa | ||
| HTA | Tensión arterial | ||
| Enfermedad Cardiovascular | Cálculo del riesgo cardiovascularb Electrocardiograma | Todos los pacientes sin cardiopatía isquémica (varones >40 años y mujeres >50 años) | Al iniciar TAR y anualmente |
Cardiopatía isquémica (evento cardiovascular en familiar masculino de primer grado <55 años o femenino <65 años). HTA: hipertensión arterial; TAR: Tratamiento antirretroviral.
RCV: riesgo cardiovascular;
Tras la estimación del riesgo de evento cardiovascular a los diez años, los pacientes se clasifican en base a dicho riesgo (inferior al 10%, entre 10 y 20% o superior al 20%) y en cuanto a los objetivos buscados de niveles de colesterol y a la actitud a seguir para conseguir dicho objetivo28,29 (tabla 8).
Prevención de enfermedad cardiovascular en paciente VIH
| Factores de riesgo cardiovasculara | Cifras de LDL colesterol deseablesb (mg/dl) | Cifras de LDL colesterol a partirde las cuales se recomienda dieta y ejerciciob (mg/dl) | Cifras de colesterol a partir de las cuales se recomienda tratamiento farmacológicob (mg/dl) |
| Cardiopatía isquémica o equivalentesc: riesgo CVC a 10 años >20% | <100 | ≥100 | ≥130 |
| 2 o más factores de riesgo: riesgo CVC a 10 años 10–20% | <130 | ≥130 | ≥160 |
| 0–1 factor de riesgo: riesgo CVC a 10 años <10% | <160 | ≥160 | ≥190 |
Factores de riesgo cardiovascular: tabaquismo, hipertensión, cifras bajas de colesterol HDL (<40mg/dl), historia familiar de cardiopatía isquémica prematura (hombres <45 años y mujeres <55 años), y edad hombres >45 años y mujeres >55 años.
Se caracteriza por una pérdida del tejido adiposo subcutáneo en la cara, pared abdominal y extremidades (lipoatrofia) combinada o no con la acumulación de grasa en abdomen, cuello o columna dorsocervical (giba de búfalo) y en el tórax superior (lipohipertrofia)32. La prevalencia de lipodistrofia es muy variable (2–84%) dependiendo de los criterios diagnósticos y la duración del seguimiento33. En promedio, la prevalencia es del 42% y esta es proporcional a la duración del tratamiento (17% en aquellos tratados con IP durante menos de un año y frente al 43% en aquellos en más de un año de tratamiento). Por cada 6 meses de tratamiento el riesgo de lipodistrofia aumenta un 45%34.
Entre los factores de riesgo asociados al desarrollo de lipodistrofia se encuentra la edad (a mayor edad más riesgo), sexo femenino, raza blanca frente a otras razas, enfermedad avanzada, mejor respuesta al tratamiento TARGA, cambios en el índice de masa corporal, exposición a IP e ITIAN33. Las personas delgadas tienden a desarrollar lipoatrofia y las obesas lipohipertrofia. La lipohipertrofia está más relacionada con los IP y la lipoatrofia se relaciona con los ITIAN (básicamente y en orden decreciente didanosina [ddI], estavudina [d4T], AZT)35,36. Aunque los ITINN no parecían influir sobre estos trastornos37,38, los resultados del estudio ACTG 5142 mostraron, contrariamente a lo esperado, un empeoramiento de la lipodistrofia en la rama de pacientes tratados con efavirenz (EFV) frente a los tratados con lopinavir/ritonavir (LPV/r), especialmente cuando el regimen incluía análogos de la timidina. Son necesarios más estudios para poder confirmar estos resultados ya que no se había observado lipoatrofia en numerosos ensayos en los que EFV no estaba asociado a análogos de la timidina39.
Información al pacienteEn el tratamiento de la lipoatrofia se recomienda la sustitución de los ITIAN con alta capacidad de producir esta alteración (d4T, ddI, AZT) por otros con un riesgo menor (lamivudina [3TC], abacavir [ABC], TDF, emtricitabina [FTC])35. Este cambio se ha relacionado con mejoras en el perfil lipídico y en la resistencia a insulina40.
Otra alternativa terapéutica para el tratamiento de la lipoatrofia es la cirugía plástica. Puede realizarse mediante la incorporación de grasa subcutánea abdominal del propio paciente o mediante la inyección de materiales sintéticos como la silicona o el ácido poliláctico41 en la zona afectada. Se desconoce la eficacia de estos tratamientos a largo plazo42.
En el tratamiento de la lipohipertrofia se ha investigado el efecto del ejercicio físico y la dieta en el control de la acumulación de tejido adiposo visceral, pero los datos son limitados. Además en muchos pacientes el mantenimiento de un cambio en el estilo de vida, relacionado con el ejercicio físico y la dieta puede ser dificultoso35. La utilización de metformina (fuera de indicación) para el control de la lipoacumulación ha demostrado cierto beneficio, en combinación con el ejercicio físico en paciente con mínima lipoatrofia40.
La cirugía y la liposucción en las zonas afectadas se presentan como buenas alternativas, pero la duración de estos efectos es limitada43.
Alteraciones del metabolismo de la glucosaInterpretaciónA partir de la era TARGA los patrones de prevalencia de esta metabolopatía que comprende diabetes similar a tipo 2, resistencia a la insulina y alteración de la tolerancia a la glucosa, se han visto modificados. La prevalencia se estima en un 25% considerando cualquiera de las manifestaciones relacionadas con las alteraciones del metabolismo de la glucosa, pero esta cifra varía en función de los estudios44,45.
Las alteraciones en el metabolismo de la glucosa pueden coexistir junto con la lipodistrofia y dislipemia, no estando claro si son resultado de un mecanismo patogénico común42. Se sabe que la diabetes mellitus asociada a VIH, la alteración en la tolerancia a la glucosa y la resistencia a la insulina tienen una etiología multifactorial47. Los factores de riego asociados a padecer diabetes mellitas tipo 2 son la edad, obesidad, falta de ejercicio físico, hipertensión arterial, pariente de primer grado con diabetes tipo 2, HDL colesterol <35mg/dl, TGC >250mg/dl, historia de enfermedad cardiovascular y en el caso de mujeres diabetes gestacional45.
Solo los IP se han relacionado con alteraciones en el metabolismo de la glucosa, pero se ha visto que las demás clases de antirretrovirales son capaces de desarrollarla de una manera indirecta, por alteraciones de la grasa corporal. Este es el caso de los ITIAN, concretamente d4T cuya alteración en el metabolismo de la glucosa está relacionada con la lipoatrofia48.
Información al pacienteEl tratamiento de las alteraciones en el metabolismo de la glucosa se sustenta en cuatro pilares: tratamiento nutricional, ejercicio físico, antidiabéticos orales e insulina46.
Las recomendaciones encaminadas a los cambios en el estilo de vida incluyen el ejercicio físico regular y aeróbico y modificaciones en la dieta (restricción calórica, reducción de carbohidratos, colesterol y grasas saturadas), aunque la adherencia y mantenimiento de estas pautas es difícil de conseguir46–48 Con estas medidas cabe esperar una reducción de HbA1C de 1–2%.
Si las modificaciones en el estilo de vida resultan insuficientes para el control de la glucemia se recomienda introducir metformina, sobre todo en pacientes con obesidad. La dosis de 500mg 2 veces al día puede ir aumentando de manera gradual, si es necesario, hasta dosis máximas de 2–3g/día. Se debe realizar un control de los potenciales EA del fármaco (alteraciones gastrointestinales, acidosis metabólica) y se debe tener en cuenta que está contraindicado en caso de insuficiencia renal. Con esta medida cabe esperar una mejora del 1,5% en los valores de HbA1C26,48.
Las tiazolidindionas (rosiglitazona, pioglitazona) pueden utilizarse en primera línea para el control de las glucemias si se trata de pacientes que, además, han desarrollado lipodistrofia considerable. También pueden asociarse a la metformina para alcanzar el objetivo HbA1C deseado. Debido al mayor riesgo de infarto de miocardio derivado del uso de rosiglitazona, es preferible el uso de pioglitazona26. Es importante considerar otros EA de este grupo de fármacos como la retención hídrica, fallo cardíaco y el aumento de peso. El descenso esperado en HbA1C se encuentra alrededor del 0,5–1,4%26.
Si las medidas anteriores son insuficientes puede ser necesaria la introducción de insulina. En este caso es preferible la insulina de acción lenta antes de acostarse, aumentando las dosis en 2UI cada 3 días hasta alcanzar valores de glucemia basal <110mg/dl26.
Seguimiento farmacoterapéuticoEl objetivo del tratamiento se basa en mejorar los valores de glucemia, mantener niveles de hemoglobina glicosilada (HbA1C) <7%, además del mantenimiento de colesterol y trigicéridos como se ha explicado en los apartados anteriores26,48.
Efectos adversos dermatológicos: alergias, reacciones en el punto de inyecciónInterpretaciónLos pacientes infectados por el VIH presentan mayor susceptibilidad a sufrir EA cutáneas por fármacos que la población general49. La probabilidad de desarrollar este tipo de EA aumenta con el descenso en el recuento de CD4, la edad y con la infección aguda o recurrente de determinadas enfermedades víricas (Epstein-Barr y Citomegalovirus)50. Además muchos de los fármacos empleados para el tratamiento de infecciones oportunistas en la población VIH, como el cotrimoxazol, también producen EA cutáneos, por lo que determinar el fármaco causante puede resultar dificultoso51.
Las manifestaciones clínicas relacionadas son muy variables, pudiendo ir desde pequeñas erupciones hasta EA cutáneos más graves como el síndrome de Stevens-Johnson o la necrolisis tóxica epidérmica52.
El grupo de fármacos implicado con más frecuencia en la aparición de EA dermatológicos son los ITINN. Aproximadamente el 33% de los pacientes en tratamiento con nevirapina (NVP) desarrollan exantema maculopapular, que provoca la interrupción del tratamiento en el 3–10% de los casos. Este tipo de EA es menos frecuente en el caso de EFV (alrededor del 11%), siendo necesaria la interrupción del tratamiento en el 2% de los pacientes. Las erupciones cutáneas por este grupo de fármacos se manifiestan en las primeras seis semanas tras el inicio del tratamiento como erupciones pruríticas, maculopapulares, eritematosas que pueden acompañarse de fiebre, mialgia, fatiga y ulceración de mucosas. La NVP es responsable del 0,5% de las reacciones cutáneas severas (síndrome de Stevens-Johnson y necrolisis tóxica epidérmica). En el caso de etravirina, aunque los datos clínicos son más limitados debido a su reciente comercialización, el exantema ha sido la reacción adversa notificada con más frecuencia (17,0% en el grupo de etravirina y 9,4% en el de placebo), ocasionando el abandono en el 2% de los pacientes. Las reacciones cutáneas más frecuentes fueron de leves a moderadas y la mayoría ocurrieron en la segunda semana de tratamiento, siendo menos frecuentes a partir de la semana 4. Generalmente fueron autolimitadas y se resolvieron en 1 a 2 semanas de tratamiento ininterrumpido.
Dentro de los ITIAN24, ABC es el principal fármaco implicado. En el 5–8% de los pacientes en tratamiento con el fármaco, desarrollan una reacción de hipersensibilidad dentro de las primeras 6 semanas tras el inicio del tratamiento. Cursa con fiebre, mialgia, síntomas respiratorios (disnea) y gastrointestinales (náuseas, vómitos, diarrea), malestar general y exantema de intensidad creciente. La reintroducción del fármaco o la continuación del tratamiento pueden ser fatales.
Los principales IP53 causantes de EA cutáneos que van desde rash hasta erupciones cutáneas son FPV, TPV, DRV y ATZ52. El 20% de los pacientes en tratamiento con amprenavir (AMP), fármaco en desuso en nuestro entorno, desarrollan EA dermatológicos, pero solo el 5% de ellos han de interrumpir el tratamiento. En el caso del FPV el 7% de los pacientes desarrollan rash cutáneo en las primeras dos semanas tras el inicio del tratamiento.
Información al pacienteLas recomendaciones sobre el manejo de los EA dermatológicos producidos por diferentes antirretrovirales y el de los relacionados con el punto de inyección54 se muestran en las tablas 9 y 10.
Recomendaciones para el manejo de los efectos adversos dermatológicos producidos por antirretrovirales
| Efecto Adverso | Identificación, prevención y manejo |
| Reacción de hipersensibilidad | Principal causante: Abacavir |
| Realización de prueba cutánea HLA B*5701. Nunca iniciar el tratamiento si dicha prueba es positiva. En caso de resultado negativo no se descarta la producción de RHS. Educar a los pacientes para informar sobre aparición de los síntomas anteriores | |
| Suspensión del tratamiento en caso de aparecer los síntomas y descartar otras causas de los síntomas. Generalmente suelen remitir después de 48h de suspensión del tratamiento. Nunca volver a tratar a un paciente con abacavir tras sospecha de RHS | |
| Síndrome de Stevens-Johnson y necrosis tóxica epidémica | Principal causante: nevirapina>efavirenz. Otros son fosamprenavir, amprenavir, atazanavir, abacavir, didanosina, zidovudina |
| Escalada de dosis con nevirapina durante los primeros 15 días de tratamiento iniciando con 200mg/día para aumentar tras los primeros 15 días a 200mg/12h. No administrar corticoides o antihistamínicos durante los días de escalada de dosis, puede precipitar los efectos adversos cutáneos | |
| Es importante educar a los pacientes para informar sobre aparición de síntomas | |
| Como soporte sintomático pueden ser necesarios cuidados intensivos, tratamiento de sobreinfección, nutrición parenteral, tratamiento del dolor. Nunca volver a tratar a un paciente con el agente causante | |
| Rash cutáneo | Principal causante: nevirapina> efavirenz; amprenavir, fosamprenavir, atazanavir, abacavir |
| Escalada de dosis con nevirapina igual que anteriormente. No está claro la posibilidad de utilización de efavirenz en caso de rash por nevirapina | |
| El tratamiento se realizaría con antihistamínicos. Suspender la terapia ARV si el rash progresa o aparecen síntomas sistémicos. No reintroducir el FAR en caso de rash severo |
Recomendaciones para el manejo de los efectos adversos relacionados con el punto de inyección
| Efecto Adverso | Identificación, prevención y manejo |
| Reacción en el punto de inyección | Principal causante: enfuvirtide |
| Educación en cuanto a la técnica de aplicación, asegurar que la solución este a temperatura ambiente antes de la inyección, alternar el sitio de la inyección, evitar la inyección en sitios con poca grasa subcutánea o zonas donde existió reacciones anteriores | |
| Para reducir la incidencia del efecto adverso local se debe masajear el sitio de la inyección puede reducir el dolor. Usar ropa floja, principalmente en el sitio de la inyección o en sitios de reacciones previas | |
| Raramente es necesario el uso compresas calientes o analgésicos |
Las manifestaciones neurológicas en los pacientes con infección por VIH han recibido una atención creciente en los últimos años, ya que el aumento tanto de la calidad como de la esperanza de vida ha permitido disponer de periodos de observación más prolongados y, secundariamente, se han descrito numerosos trastornos mentales, ocasionados tanto por enfermedades orgánicas como por EA de los fármacos utilizados.
Entre todos los antirretrovirales, EFV es el fármaco principalmente implicado en la aparición de EA a nivel neurológico como: irritabilidad, mareos, somnolencia, sueños vívidos, etc., que pueden ser de gran intensidad en las primeras semanas pero generalmente van disminuyendo paulatinamente. Obligan a interrumpir la terapia en ocasiones y también, a veces, se mantienen tras muchos meses de tratamiento, a veces incluso requiriendo tratamiento farmacológico.
Otro de los grandes EA relacionados es la neuropatía periférica caracterizada porque puede aparecer hipestesia (sensibilidad anormalmente disminuida a la estimulación), parestesia (sensación o conjunto de sensaciones anormales, y especialmente hormigueo, adormecimiento o ardor que experimentan en la piel ciertos enfermos) o dolor en la zona distal de las extremidades (especialmente en los pies). Estos efectos secundarios se producen principalmente con ddI (13–34%) y d4T (15–20%), en el caso de d4T, este efecto es dosis–dependiente. El mecanismo por el que aparece neuropatía periférica se debe a la interacción entre citoquinas y factores de crecimiento neuronal, esta reacción puede verse favorecida por neuropatía previa y factores predisponentes (alcoholismo, desnutrición, diabetes, etc.)
Seguimiento farmacoterapéuticoSe recomienda utilizar en la consulta de atención farmacéutica algunas de las herramientas que facilitan la detección de depresión, como el «inventario de depresión de BECK»55.
Entre otras medidas en la consulta el farmacéutico deberá insistir: en
- •
Vigilar la administración de EFV en pacientes con trastornos psiquiátricos mayores.
- •
Realizar una valoración individual del estilo de vida y la actividad del paciente antes de iniciar tratamiento con EFV y dar información sobre el tratamiento.
- •
Recomendar la suspensión de EFV en caso de aparición de EA graves o invalidantes.
- •
Recomendar la administración de EFV por la noche, al menos 1–2h después de la cena, para no facilitar su absorción y evitar los efectos secundarios neurológicos.
- •
Recomendar la posible utilización de benzodiazepinas o neurolépticos si se mantienen las alteraciones del sueño.
- •
Si aparece cefalea, se debe recomendar no fumar ni beber alcohol, ni bebidas estimulantes o con gas (café, refrescos, etc.). También se debe recomendar la reducción de alimentos que contengan chocolate, los frutos secos y los quesos curados.
- •
Si aparece signos o síntomas de neuropatía valorar mantener fármacos potencialmente implicados si la clínica no es grave y no hay alternativas razonables.
- •
Si el dolor neuropático es leve, puede recomendarse la utilización de analgésicos habituales.
Las alteraciones renales constituyen una importante causa de morbilidad y mortalidad en los pacientes con infección por el VIH. La incidencia es variada, mientras el fracaso renal agudo en los pacientes hospitalizados se sitúa en torno al 6% anual y triplica la observada en población no infectada, la de enfermedad renal crónica se sitúa entre el 5 y el 15%56,57.
Los factores de riesgo asociados a alteraciones renales en el paciente con infección por VIH los podemos dividir en56:
- •
Factores demográficos: edad avanzada, raza negra y peso corporal bajo.
- •
Factores asociados con la infección por el VIH: carga viral, cifra nadir de linfocitos CD4+ <200 células/ìl y diagnóstico SIDA por eventos clínicos de categoría C.
- •
Enfermedades concomitantes: hipertensión arterial, diabetes mellitus y hepatitis crónica por VHC o VHB.
- •
Uso de fármacos potencialmente nefrotóxicos: antirretrovirales (TDF, indinavir, en desuso en nuestro medio) y otros como antiinflamatorios no esteroideos, aminoglucósidos, anfotericina B, cidofovir, cotrimoxazol, sulfadiazina, aciclovir y foscarnet.
En cuanto a las manifestaciones clínicas, entre las nefropatías derivadas de los EA del tratamiento antirretroviral destacan la nefropatía tubular asociada a TDF, incluyendo síndrome de Fanconi y diabetes insípida nefrogénica, y la nefropatía obstructiva intra o extrarrenal asociada a indinavir principalmente y en algunos casos aislados a ATZ58.
El TDF es el principal implicado en las alteraciones renales de tipo tubular y que pueden provocar insuficiencia renal. Provoca una disfunción tubular que se manifiesta como un síndrome de Fanconi acompañado de una disminución del filtrado glomerular. Es más frecuente cuando coincide con otros factores de riesgo y suele revertir al retirar el fármaco. El resto de ITIAN también se excretan principalmente por vía renal pero no se asocian con nefrotoxicidad.
El ajuste de dosis en caso de insuficiencia renal es especialmente importante en esta familia sobre todo en TDF, o en los que con más frecuencia producen toxicidad mitocondrial, sobre todo d4T y ddI59,60. El único fármaco de la clase que se diferencia del resto es ABC; su metabolismo principal es por vía hepática y no requiere ningún ajuste en insuficiencia renal61.
En cuanto a los coformulados a dosis fijas; todos ellos llevan 3TC o FTC para las que se necesitan ajustes de dosis que no siempre coinciden con las necesarias para el otro fármaco de la combinación, por lo que en general se desaconseja su uso. En estos casos deben emplearse los fármacos por separado, realizando los ajustes correspondientes de la dosis de cada fármaco56.
Información al pacienteTratamiento no farmacológicoPara prevenir o mejorar tanto la nefropatía tubular asociada a TDF, como la nefropatía obstructiva asociada a indinavir, es importante una hidratación adecuada asegurando una ingesta de 1.500 a 2.000ml de agua al día o más si el ambiente es caluroso. También es importante incidir en el estilo de vida del paciente orientado a los factores de riesgo del mismo. En cuanto a la dieta se aconseja la restricción de sal (< 6g/d) y el control del exceso de peso. Otras recomendaciones son el cese del hábito tabáquico, valorando si es preciso tratamiento sustitutivo y atención especializada antitabaco, y el ejercicio físico (al menos caminar a paso ligero 30–45min 4 días por semana).
Tratamiento farmacológicoEn el caso de alteraciones renales importantes es necesaria la suspensión del tratamiento causal, así como evitar el uso concomitante de fármacos nefrotóxicos. El tratamiento farmacológico una vez instaurada la nefropatía pasa por el control de la tensión arterial y alteraciones metabólicas como diabetes o dislipemias. En el caso de la tensión arterial se recomienda mantenerla en niveles inferiores a 130/80mmHg en enfermos sin proteinuria e inferiores a 120/75 si existe proteinuria significativa o diabetes. Farmacológicamente se utilizarán como primera línea los IECA o ARA-2.
En pacientes con diabetes se recomienda control estricto de la glucemia con HbA1C≤7% y utilizar insulina en estadios 4 y 5 de la enfermedad renal crónica y antidiabéticos orales en estadios 1–2. Es recomendable también el control estricto de la dislipemia con dieta adecuada y utilización si es necesario de estatinas y/o fibratos.
Seguimiento farmacoterapéuticoEs necesario primero identificar los pacientes de riesgo, en virtud a los factores que hemos indicado anteriormente, haciendo hincapié en aquellos que tengan TDF o indinavir en su esquema terapéutico. En general se recomienda hacer un seguimiento de la función renal en todas las revisiones a todos los pacientes que toman TARGA, pero muy especialmente si reciben TDF y a todos los pacientes con algún grado de insuficiencia renal. Es necesario llevar a cabo una anamnesis detallada del paciente identificando patologías adyacentes y medicación concomitante, estableciendo la causalidad con alteraciones renales.
Para evaluar la función renal del paciente es necesario calcular el filtrado glomerular a partir del aclaramiento de creatinina (Clcr). Las ecuaciones más usadas actualmente son la de Cockcroft-Gault (C-G) y la validada Modification of Diet in Renal Disease (MDRD). Junto al filtrado glomerular es necesaria también la determinación de fosfato en plasma y marcadores urinarios de daño renal, como la proteinuria y la glucosuria. En el caso de TDF si se observa un valor del fosfato sérico<1,5mg/dl (0,48mmol/l) o el Clcr disminuye a<50ml/min la evaluación de la función renal ha de repetirse tras una semana, incluyendo niveles de concentración de glucosa y potasio en sangre, y glucosa en orina ajustándose el intervalo de dosis. Además, debería considerarse la interrupción del tratamiento con TDF en pacientes con una disminución del CLcr a<50ml/min o disminución del fosfato sérico a<1,0mg/dl (0,32mmol/l)62. Cuando se considere imprescindible emplear FTC/TDF en pacientes con Clcr<50ml/min se debe aumentar el intervalo de dosificación de una vez al día a cada 48h en personas con Clcr de 30 a 49ml/min; debe evitarse en pacientes con Clcr <30ml/min, o en los que se sospeche toxicidad por TDF o tengan una función renal inestable63.
Si existen alteraciones en el estudio renal básico se debe ampliar el seguimiento a una determinación del equilibrio ácido base y del ácido úrico en plasma, un examen completo del sedimento urinario, una estimación cuantitativa de la proteinuria mediante los cocientes urinarios de proteínas/creatinina o albúmina/creatinina en una muestra de orina de la primera micción de la mañana, una ecografía renal y, en determinadas circunstancias, una biopsia renal.
Una vez detectados los pacientes con alteraciones renales es importante incidir, desde las consultas de atención farmacéutica, en el estilo de vida del paciente (ver tratamiento no farmacológico) y realizar el ajuste de dosis recomendado por las fichas técnicas de cada medicamento teniendo en cuenta las posibles interacciones entre los diferentes fármacos, más frecuentes y peligrosas en esta situación.
DiscusiónAunque en los últimos años se han hecho numerosos esfuerzos por simplificar el TARGA, en la actualidad, con el aumento en la esperanza de vida y el arsenal terapéutico disponible, los regímenes terapéuticos en los pacientes VIH siguen siendo altamente complejos.
En los últimos años, han sido varios los trabajos publicados en los que se hacia hincapié en la importancia y el beneficio de la intervención farmacéutica en este tipo de pacientes tanto para la mejora de la adherencia y los resultados clínicos, como en su marcado coste-efectividad7,8. Sin embargo, a pesar de que es conocido que la aparición de EA es el principal causante de discontinuación del tratamiento en este tipo de pacientes, se consideraban necesarias, unas recomendaciones sobre los puntos sobre los que es importante incidir para que el farmacéutico de hospital mejore y estandarice los cuidados sobre este apartado de la atención farmacéutica al paciente VIH.
Pese a la dificultad que supone incidir sobre la prevención, la identificación y el manejo de los EA asociados al tratamiento antirretroviral, el presente documento pretende ayudar a mejorar los resultados obtenidos tanto a nivel clínico como en calidad de vida.